Adsorption sker vid fasgränsen. Därför är det lämpligt att betrakta den termodynamiska beskrivningen av ytfenomen som ett särskilt fall av termodynamiken hos heterogena system.
Ris. 3.4. Gibbs adsorption: 1- tvåfas referenssystem, 2- verkligt tvåfassystem med inhomogen region
Termodynamiken i heterogena system använder additivitetsprincipen, vilket är följande: alla extensiva egenskaper hos ett heterogent system är lika med summan av motsvarande extensiva egenskaper som faserna skulle ha haft innan de kom i kontakt. Låt oss beteckna faserna med α och β (fig. 4). Sedan för ett idealiskt system, så att egenskaperna för faserna nära gränsytan sammanfaller med deras bulkegenskaper, för den interna energin U, volym V, massa (antal mol) n, entropi S efter jämvikt är etablerad i ett heterogent system, relationerna är giltiga:
U = U α + U β, V = V α + V β, n = n α + n β, S = S α + S β
Detta förutsätter att temperaturen och trycket i båda faserna är desamma.
För verkliga heterogena system ger övergångsregionen vid gränssnittet mellan två faser ett ytterligare bidrag till systemets omfattande egenskaper. Om ytfenomen uppstår bör man ta hänsyn till skillnaden mellan de omfattande egenskaperna hos ett verkligt heterogent system och de omfattande egenskaperna hos ett modellsystem där det inte finns några ytfenomen. Ett sådant system kallas ett jämförelsesystem. Jämförelsesystemet har samma intensiva parametrar (T, P, Ci ...) och samma volym V som det verkliga systemet (Fig. 4).
Ur termodynamisk synvinkel förstås adsorptionsvärdet G som överskottsmängden av ämne n s, uttryckt i mol eller gram, som ett riktigt heterogent system har i jämförelse med referenssystemet, relaterat till fasens ytarea separation eller till ytan av adsorbenten A. Det antas att jämförelsesystemet har samma intensiva parametrar (T, P, C i) och samma volym (V = V α + V β) som det verkliga systemet (Fig. 4).
G \u003d (n - n α - n β) / A \u003d n s / A 3.11
Överskott av termodynamiska funktioner för övergångsområdet för ett reellt system (betecknat med index s) kan skrivas som
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S β etc.
Experimentella mätningar av adsorption ger alltid adsorption exakt som ett överskott av en komponent i ett verkligt system jämfört med det valda referenssystemet. Till exempel, när man adsorberar en gas på en fast adsorbent eller när man adsorberar komponenter på en fast fas, för att hitta adsorptionsvärdena, bestäms förändringen i de initiala koncentrationerna av adsorbatet efter kontakten mellan faserna α och β
n i s = V(Ci o - C i),
Var C i o– initial koncentration av den i:te komponenten, C iär koncentrationen av den i:te komponenten efter upprättandet av jämvikt mellan de sammanhängande faserna. Det antas att volymen Vändras inte. Däremot koncentrationen i-te komponenten C i, erhållen experimentellt, bestäms i volymen V' ovanför gränsytan utan att ta hänsyn till volymen av den inhomogena regionen av övergångsskiktet Va vid gränssnittet där koncentrationen är Cia. På grund av förekomsten av en inhomogen region i ett verkligt system kan systemets totala volym representeras som V = V' + Va. Hela kvantiteten i-te komponenten C i o fördelade mellan dessa två volymer:
V Ci o = V' Ci + V α C i α ,
och antalet mol av komponenten i, adsorberad på gränssnittet, kommer att vara lika med
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (Ci α – C i) 3.12
De där. adsorption bestämd experimentellt är ett överskott av den i:te komponenten i volymen Va i jämförelse med mängden av denna komponent i samma volym långt från gränsytan. Denna typ av adsorption kallas Gibbs adsorption. .
V aCi a kallas fullständigt innehåll jag- komponenten i adsorptionsskiktet. I området med mycket låga koncentrationer C i i volym V'ändring V aCi ekvation (3.2) kan försummas och det uppmätta värdet kan beaktas V aCi a fullständigt innehåll jag- komponenten i adsorptionsskiktet, till exempel vid adsorption av gas på en fast adsorbent vid låga tryck.
Termodynamik för adsorptionsprocesser.
| Parameternamn | Menande |
| Artikelns ämne: | Termodynamik för adsorptionsprocesser. |
| Rubrik (tematisk kategori) | Utbildning |
Grundläggande definitioner och metoder för att klassificera adsorptionsprocesser.
Adsorption avser fenomen som uppstår som ett resultat av en spontan minskning av ytenergi.
Adsorption- Processen för spontan reversibel eller irreversibel omfördelning av komponenterna i ett heterogent system mellan ytskiktet och volymen av en homogen fas.
I flerkomponentsystem är den komponent som sänker gränsytspänningen att föredra framför ytskiktet. I enkomponentsystem, under bildandet av ett ytskikt, förändras dess struktur (en viss orientering av atomer och molekyler, polarisation), kallad autoadsorption.
Den tätare fasen på vilken adsorptionsinteraktioner är lokaliserade kallas adsorbent. Ämnet som omfördelas mellan volymen av den homogena fasen och ytskiktet betecknas med termen '' adsorbatʼʼ.
I vissa fall är adsorptionsprocessen reversibel. I detta fall, under vissa förhållanden, kan en del av de adsorberade molekylerna passera från ytskiktet till fasens volym som ett resultat av molekylära kinetiska fenomen. Den omvända processen för adsorption kallas desorption.
Metoder för att klassificera adsorptionsprocesser.
Klassificering av adsorptionsprocesser enligt aggregationstillståndet för de interagerande faserna. Med hänsyn till beroendet av det aggregerade tillståndet för intilliggande faser, särskiljs följande typer av adsorptionsprocesser:
Adsorption av gaser på fasta adsorbenter;
Adsorption av lösta ämnen vid gränssnitten ''fast-vätske'' och ''vätska-vätska';
Adsorption av ytaktiva ämnen vid gränssnittet ''vätskegas''.
Klassificering av adsorptionsprocesser enligt mekanismen för interaktion mellan adsorbenten och adsorbatet. Adsorption kan betraktas som interaktionen mellan adsorbatmolekyler och adsorbentens aktiva centra. Enligt mekanismen för deras interaktion är följande typer av adsorption uppdelade:
1) fysisk (molekylär) adsorption- interaktionen mellan adsorbatets molekyler och adsorbenten utförs på grund av van der Waals-krafterna, vätebindningar (utan förekomsten av kemiska reaktioner);
2) kemisk adsorption (kemisorption)– Adsorbatmolekylernas vidhäftning till adsorbentens aktiva platser sker som ett resultat av kemiska reaktioner av olika slag (med undantag för jonbytesreaktioner);
3) jonbytaradsorption (jonbyte) - omfördelningen av adsorbatsubstansen mellan lösningen och den fasta fasen (jonbytaren) enligt mekanismen för jonbytesreaktioner.
För en kvantitativ beskrivning av adsorptionsprocesser används två kvantiteter.
1) Absolut adsorptionär mängden (mol) eller massan (kg) av adsorbatet per ytenhet eller massa av adsorbenten. Beteckning - A; dimension: mol / m 2, mol / kg, kg / m 2, kg / kᴦ.
2) Gibbs (överskott) adsorptionär överskottet av adsorbatsubstansen i ytskiktet av en viss tjocklek jämfört med dess mängd i volymen av den homogena fasen, per enhet ytarea eller massa av adsorbenten. Beteckning - G; enhet: mol/m 2 , mol/kᴦ.
Förhållandet mellan absolut och överskottsadsorption kan illustreras med hjälp av ekvationen:
G \u003d A - c * h (3,1)
där c är jämviktskoncentrationen av ämnet i fasens volym, mol/m3;
h är tjockleken på ytskiktet, villkorligt taget lika med 10 -9 m.
I flerkomponents heterogena system, när en eller annan komponent omfördelas mellan volymen av en homogen fas och ytskiktet, är ekvationen för ytans överskott av inre energi giltig:
U = T * S + s * s + Sm i * n i (3,2)
Genom att föra alla termer i ekvationen till enhetsarean för gränssnittsytan får vi:
U s = T * S s + s + Sm i * Г i (3.3)
där Г i = n i/s är överskottet av den i:te komponenten i ytskiktet, det vill säga Gibbs adsorption.
För ett enkomponentsystem har ekvation (3.3) formen:
G s = s + m * Г (3,4)
där G s = U s - T * S s är Gibbs-energin på ytan eller arbetet med att skapa en enhetsarea av ytan;
m * G - komprimering av det adsorberade ämnets substans i ytskiktet.
Utifrån ekvation (3.4) kan vi dra slutsatsen att under adsorptionen består arbetet med att skapa en gränsyta av arbetet med att bilda en yta (bryta kohesiva bindningar i huvuddelen av adsorbatfasen) och komprimera ämnet i ytskiktet.
I tillståndet av dynamisk jämvikt mellan adsorbenten och adsorbatet, förändringen i Gibbs-energin för ett heterogent system ΔG = 0, beskrivs termodynamiken för adsorptionsprocessen med en ekvation som kallas Gibbs fundamentala adsorptionsekvation:
Ds = SГ i * dm i (3,5)
Denna ekvation är universell, eftersom den är giltig för alla typer av adsorptionsprocesser
Särskilda fall av Gibbs adsorptionsekvation.
1) Adsorption från lösningar.
För den kemiska potentialen för den i:te komponenten i systemet under adsorption vid gränssnitten "vätska - fast adsorbent" och "vätska - gas" är ekvationerna giltiga:
m i = m i 0 + R*T*ln a i (3,6)
dm i = R*T* d ln a i (3,7)
där m i 0 är den kemiska potentialen för den i:te komponenten i systemet under standardförhållanden;
a i – aktivitet för den i:te komponenten i systemet under standardförhållanden.
Baserat på detta kommer Gibbs adsorptionsekvation att ha formen:
Г i = - a i / R*T * (ds / da i) (3.8)
För icke-elektrolytlösningar tar vi en i \u003d c i, sedan:
Г i \u003d - s / R * T * (ds / ds) (3.9)
För elektrolytlösningar:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
där c ± är den genomsnittliga jonkoncentrationen av lösningen;
n är den stökiometriska koefficienten.
2) Adsorption av ämnen från gasfasen.
I enlighet med Mendeleev-Claiperons ekvation:
P \u003d c * R * T (3.11)
I detta avseende skrivs Gibbs ekvation för adsorption av gaser på fasta adsorbenter i följande form:
Г i = - Р / R*T * (ds / dР) (3.12)
I praktiken gör Gibbs adsorptionsekvation det möjligt att beräkna mängden adsorption av ämnen i gränsskiktet, för vilket ytspänningen bestäms, baserat på mätning av ytspänning vid olika värden av vätskekoncentration eller jämviktsgastryck .
Termodynamik för adsorptionsprocesser. - koncept och typer. Klassificering och funktioner i kategorin "Termodynamik för adsorptionsprocesser." 2017, 2018.
Adsorption som en spontan koncentration av molekyler på ytan åtföljs av en minskning av systemets entropi. Eftersom kriteriet för processens spontanitet är
∆N - T · ∆S = ∆G< 0,
då är adsorption endast möjlig vid ∆Н< 0 (экзотермический процесс). Равновесие определяется условием ∆Н = T· ∆S. Med en ökning av temperaturen skiftar jämvikten mot den endotermiska processen, d.v.s. desorption.
Adsorption på fast yta
1. monomolekylär adsorption.
Enligt Langmuirs teori interagerar adsorbatmolekyler med den adsorberande ytan och bildar så småningom ett monomolekylärt skikt. I detta fall, graden av fyllning () av ytan med det adsorberade ämnet under adsorption från gasfasen
från vätska
där K är jämviktskonstanten (adsorptionskonstanten);
p är partialtrycket för den adsorberade gasen;
c är koncentrationen av det adsorberade ämnet.
Beroendet av β på p (eller c) representeras av en graf (adsorptionsisoterm, Т = const) i fig. 1. 1.3.

Ris. 1.3. Fyllnadsgrad av ytan med adsorberat ämne
Vid låga koncentrationer och partialtryck är adsorptionen proportionell mot koncentrationen eller partialtrycket:
R<< 1, β ≈ К· r oris<< 1, β ≈ К· si e. den initiala delen av isotermen är ungefär linjär och tan α \u003d K (tg α bestäms av kurvans lutning vid p (eller c) → 0: eller ).
Om - antalet mol av det adsorberade ämnet per 1 g av adsorbenten; - det högsta möjliga antalet mol av det adsorberade ämnet per 1 g av adsorbenten ("monolagerkapacitet"), sedan
Ersätter β i ekvation (1.3) (för fallet med adsorption från gasfasen, koncentrationen Med i ekvationerna bör ersättas med tryck R), vi får:
 (1.6)
(1.6)
Eftersom och K i detta par av adsorbent-adsorbent är konstanter (vid T= const), då kan beroendet hittas och TILL(Fig. 1.4).

Ris. 1.4. Grafisk lösning av adsorptionsekvationen
erhålls genom att extrapolera det experimentella linjära beroendet till () = 0; och sedan , då .
Värdet kan användas för att bestämma adsorbentens specifika yta UD (i m 2 per 1 g adsorbent), om arean ω som upptas på ytan av en molekyl av adsorbenten är känd (bestäms utifrån molekylens storlek):
UD = · ω · Na, (1,7)
där Na är Avogadros tal (Na = 6,02 10 23).
I sin tur kan det kända värdet för SD användas för att beräkna eller ω av vilken substans som helst genom dess adsorption på en given adsorbent.
2. Polymolekylär adsorption.
Ekvation (1.5) beskriver en kurva med mättnad, d.v.s. på
p (eller c) → ∞ tenderar mot gränsvärdet lika med (Fig. 1.5, a).

Fig.1.5. Adsorptionsisotermer:
a – adsorption med mättnad; b – polymolekylär adsorption
Men i vissa fall ser adsorptionsisotermer ut som de som visas i fig. 1,5b, dvs. når inte gränsen ens vid hög p (eller c).
Beroenden av den typ som visas i fig. 1,5b motsvarar polymolekylär adsorption. Som regel är sådana isotermer karakteristiska för ämnen med starka intermolekylära interaktioner (till exempel vatten). När adsorptionscentra på ytan av adsorbenten är upptagna (det monomolekylära lagret är mättat) sker "landningen" av nästa adsorbatmolekyler på grund av intermolekylära interaktioner med redan adsorberade molekyler (Fig. 1.6). Värmen från sådan adsorption är nära i absoluta värden, men motsatt i tecken, till värmen från avdunstning av motsvarande vätska (tänk varför).

Fig.1.6. Adsorptionsschema:
a - monomolekylär adsorption; b - polymolekylär adsorption
När du kommer närmare R till det mättade ångtrycket hos det adsorberade ämnet börjar det kondensera på ytan av adsorbenten; som ett resultat ökar det snabbt med ökande R.
När det gäller växelverkan mellan två atomer:
U är interaktionsenergin;
U = U + U DRAG.
 - Lennard-Jones ekvation
, c, b, m = konst
- Lennard-Jones ekvation
, c, b, m = konst
I fall av interaktion av atomer med en fast yta är det nödvändigt att summera alla interaktioner.
x är avståndet till ytan
r - aktionsradien för attraktionskrafterna
dV - volym
n är antalet ytmolekyler
U ADS. är adsorptionsinteraktionsenergin



Vid adsorption förstärks attraktionen. Och i fallet med interaktion av den opolära-opolära typen är adsorptionen övervägande lokaliserad i fördjupningarna.
elektrostatisk interaktion.
Polär adsorbent - opolärt adsorbat
Icke-polär adsorbent - polärt adsorbat
En polär adsorbent är ett polärt adsorbat.
M  adsorbatmolekylen representeras som en dipol och adsorbenten som en ledare, i vilken adsorbatmolekylen inducerar en dipol spegelsymmetriskt med avseende på den givna.
adsorbatmolekylen representeras som en dipol och adsorbenten som en ledare, i vilken adsorbatmolekylen inducerar en dipol spegelsymmetriskt med avseende på den givna.
X - avstånd till mitten
När du interagerar uppstår potentialen:
 ,
,
 är dipolmomentet.
är dipolmomentet.
Potentialen tenderar att ta på maxvärdet, d.v.s. dipoler tenderar att orientera sig vinkelrätt mot ytan.
Eftersom en ökning av temperaturen främjar tillväxten av Brownsk rörelse, leder det till en retardation av adsorptionsprocessen.
Vid elektrostatisk interaktion är adsorbatet övervägande lokaliserat på utsprång.
Grundläggande adsorptionsekvation.
Vid adsorption omfördelas komponenten, vilket gör att den kemiska potentialen förändras. Adsorptionsprocessen kan betraktas som övergången av ytenergi till kemisk energi.
Skiktvolym = 0, sedan den generaliserade ekvationen I och II för termodynamikens lag:
T = const; (1) = (2) => 

För ett tvåkomponentsystem:
,
 ,
,
 =>
=>
=>
 - Gibbs adsorptionsekvation
.
- Gibbs adsorptionsekvation
.
För fallet med adsorption av TV. kropp - gas:, 
 ,
,

 - isoterm
- isoterm
 - isobar
- isobar
 - isopykne
- isopykne
 - isoster
- isoster
Isoterm, isopycne, isostere är släkt med varandra.
Därför att adsorptionsfunktion 



Henry isoterm Langmuir isoterm



Termodynamik. Adsorption.
För kondenserad media:
 ,
,
 ,
,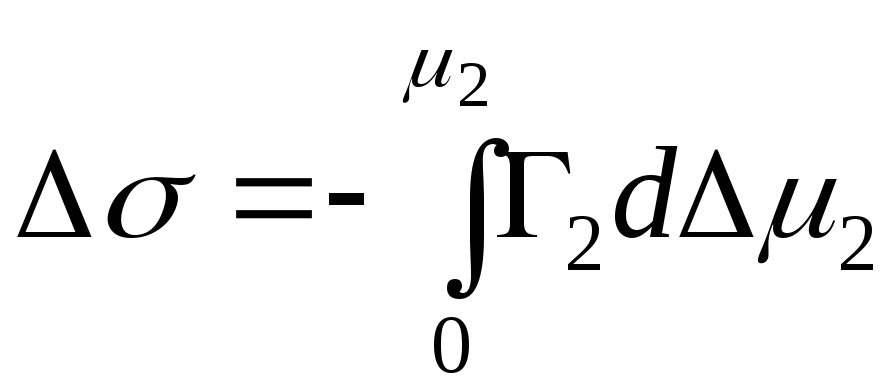
 - integrerad förändring i Gibbs energi
.
- integrerad förändring i Gibbs energi
.

P-tryck över en krökt yta, P S-tryck över en plan yta
 - adsorptionspotential
- adsorptionspotential
Differentiell förändring i entrapi 
 , Г = konst
, Г = konst
- differentiell entropiförändring
- differentiell entalpi för adsorption
 - isosterisk adsorptionsvärme
- isosterisk adsorptionsvärme
 - kondensationsvärme
- kondensationsvärme
 - nettoadsorptionsvärme
- nettoadsorptionsvärme

 ,
,




Qa är det integrerade adsorptionsvärmet, 
Qra är den integrerade nettovärmen för adsorption,

Henrys ekvation
Studiet av adsorption hämmas av ytans inhomogenitet, så de enklaste regelbundenheterna erhålls för homogena ytor.
Låt oss betrakta växelverkan mellan gaser och en fast yta, när en gas övergår från ett jämviktstillstånd i volymen till ett jämviktstillstånd på ytan. Detta fall är analogt med jämvikten mellan gaser i ett gravitationsfält.
 ,
,
 ,
=>
,
=> -Henrys ekvation
-Henrys ekvation
 - Fördelningskoefficient
- Fördelningskoefficient
I adsorptionsprocessen sker en förändring i kemiska potentialer.
För bulkfas: 
För ytgas: 
I ett tillstånd av jämvikt  , dvs.
, dvs.

I Henrys ekvation beror konstanten inte på koncentrationen
Henrys ekvation är giltig i området med låga tryck och koncentrationer. När koncentrationen ökar är två typer av avvikelser från Henrys lag möjliga:
1 - positiva avvikelser, D minskar, A minskar
2 - negativa avvikelser, D - ökar, A - ökar.
Typen av avvikelse bestäms av dominansen av en eller annan typ av adsorbent-adsorbatinteraktion.
Med en stark adhesiv interaktion ökar aktivitetskoefficienterna - en positiv avvikelse. Vid kohesiva interaktioner observeras negativa avvikelser.
monomolekylär adsorption.
Langmuir isoterm.
De enklaste regelbundenheterna erhölls i Henrys teori. Langmuir föreslog en teori enligt vilken adsorption betraktas som en kvasikemisk reaktion. Vart i:
Ytan är energimässigt enhetlig.
Adsorptionen är lokaliserad, varje adsorptionscentrum interagerar med en adsorbatmolekyl.
Adsorbatmolekyler interagerar inte med varandra.
Adsorption är monolager.

 - yta,
- yta,  - adsorbat,
- adsorbat,  - adsorptionskomplex.
- adsorptionskomplex.
 , sedan koncentrationen av adsorptionsställen:
, sedan koncentrationen av adsorptionsställen:  ,
, - begränsa adsorptionen.
- begränsa adsorptionen.
 , sedan reaktionskonstanten:
, sedan reaktionskonstanten: 

 - Langmuirs ekvation.
- Langmuirs ekvation.
Adsorption kontra koncentration
1 )
)
 ,
,

2) område med höga koncentrationer
 - begränsande adsorption, bildning av ett monomolekylärt skikt
- begränsande adsorption, bildning av ett monomolekylärt skikt
För Gibbs energi: .
g är entropifaktorn.
I fallet med Henry-isotermen karakteriserar Gibbs-energin övergången av adsorbatet från standardtillståndet i bulken till standardtillståndet på ytan. I fallet med Langmuir-isotermen  kännetecknar graden av affinitet för adsorbenten och adsorbatet.
kännetecknar graden av affinitet för adsorbenten och adsorbatet.
 hittat från van't Hoff isobar.
hittat från van't Hoff isobar.

 , Då
, Då  , därav
, därav  .
.

 - grad av ytfyllnad.
- grad av ytfyllnad.




 - antalet lediga platser,
- antalet lediga platser,  - antalet upptagna platser.
- antalet upptagna platser.
 ,
,

De där. i området med höga koncentrationer är antalet fria ställen omvänt proportionellt mot mängden adsorbat.
Adsorption av en blandning av gaser på en homogen yta.
I detta fall betraktas adsorptionsprocessen som två parallella reaktioner.
 (1)
(1)

 (2)
(2)


Adsorption av en blandning av gaser på en inhomogen yta.
Vid en icke-homogen yta bör man inte begränsa sig till medelstora fyllningar.
Som ett resultat av konkurrens är lokalisering av olika adsorbater möjlig på olika typer av platser.
I detta fall förhållandet  .
.
 ,
,
 är mättnadsångtrycket för adsorbatet.
är mättnadsångtrycket för adsorbatet.
 ,
,
 är adsorptionsvärmen.
är adsorptionsvärmen.
"+" - symbatiskt beroende, "-" - antibatiskt beroende, "H" - ingen korrelation.
"+" - adsorption fortskrider enligt samma mekanism. I de mest energimässigt gynnsamma områdena adsorberas en gas med hög affinitet till ytan övervägande.
"-" - adsorption fortskrider genom olika mekanismer och fram till en viss tidpunkt finns det ingen konkurrens om ytan.
Monomolekylär adsorption realiseras huvudsakligen under den fysiska adsorptionen av gaser vid låga värden sid, såväl som vid vätske/gas-gränsytan.
Polymolekylär adsorption.
BET teori(Brunauer, Emmet, Teller).
I det fall då bildandet av ett monoskikt är otillräckligt för att kompensera för ytenergin, är adsorption polymolekylär och kan betraktas som ett resultat av påtvingad kondensation under inverkan av ytkrafter.
Grundläggande bestämmelser:
När en adsorbatmolekyl träffar den ockuperade platsen bildas en multipel uppsättning.
När du kommer närmare sid Till sid s antalet fria adsorptionsplatser minskar. Inledningsvis ökar antalet platser som upptas av singel, dubbel etc. för att sedan minska. kit.
På sid =sid s adsorption övergår i kondensation.
Det finns inga horisontella interaktioner.
För det första lagret utförs Langmuir-isotermen.
Ytan betraktas som en uppsättning adsorptionsställen. Villkoret för dynamisk jämvikt är giltigt: kondensationshastigheten på fria platser är lika med avdunstningshastigheten från ockuperade.
a är kondensationskoefficienten (fraktionen av molekyler som kondenseras på ytan);
 ,
,
Zm är det maximala antalet lediga platser.
 - frekvens av vibrationer av atomer i riktning vinkelrät mot ytan.
- frekvens av vibrationer av atomer i riktning vinkelrät mot ytan.
För det första lagret är de dynamiska jämviktsförhållandena:



 , Då
, Då
 - Langmuirs ekvation.
- Langmuirs ekvation.
För det andra lagret kommer att vara sant: 
För det i-te lagret: 
För enkelhetens skull antas det att a och ν är lika för alla lager utom det första. För alla skikt utom det första är adsorptionsvärmen konstant. För det sista lagret är adsorptionsvärmet lika med kondensationsvärmet. Som ett resultat, ekvationen
 (*)
(*)
C- konstant,
När det gäller BET-teori, konstanten MED kännetecknar Gibbs energi av ren adsorption. Ekvationen innehåller bara en konstant, och denna ekvation är också mycket viktig för att bestämma adsorbentens specifika yta.
Eftersom värme frigörs som ett resultat av adsorption, utförs bestämningen av specifika ytor vid låga temperaturer.
 ????????????
????????????


Teorins huvudsakliga brist– Försummelse av horisontella interaktioner till förmån för vertikala.
Ekvationen ligger inom intervallet  från 0,05 till 0,3.
från 0,05 till 0,3.
Var  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0,3 - interaktionen av adsorbatet - adsorbat påverkar.
> 0,3 - interaktionen av adsorbatet - adsorbat påverkar.
Redovisning av adsorbat-adsorbat-interaktioner.
Interaktioner uppträder under adsorption på en opolär yta av grenade molekyler eller molekyler. kan bilda föreningar. I detta fall ändras formen på adsorptionsisotermerna.
A  sorbenten är inte polär.
sorbenten är inte polär.
Diagram 1 motsvarar svaga interaktioner adsorbat-adsorbat, starkt adsorbat-adsorbent.
Diagram 2 motsvarar en stark adsorbat-adsorbat-interaktion, en stark adsorbat-adsorbent-interaktion.
Diagram 3 motsvarar en stark adsorbat-adsorbat-interaktion, en svag adsorbat-adsorbent-interaktion.
 ,
,

Vid interaktion mellan adsorbatmolekyler är det nödvändigt att ta hänsyn till förändringar i aktivitetskoefficienterna. Och denna ekvation är skriven som:
 - Frunkins, Fowlers, Guggenheims ekvation.
- Frunkins, Fowlers, Guggenheims ekvation.
kär attraktionskonstanten.
Polans potentiella teori.
Denna teori härleder inte någon typ av adsorptionsisoterm, men gör det möjligt att beräkna isotermer vid en annan temperatur.
Adsorptionär resultatet av attraktionen av adsorbatet till ytan av adsorbenten på grund av adsorptionspotentialens verkan, som inte beror på närvaron av andra molekyler och beror på avståndet mellan ytan och adsorbatmolekylen.
 ,
,
 - adsorptionspotential.
- adsorptionspotential.
Eftersom ytan är inhomogen ersätts avståndet med adsorptionsvolymen  .adsorptionsvolymär volymen innesluten mellan ytan och den punkt som motsvarar det givna värdet
.adsorptionsvolymär volymen innesluten mellan ytan och den punkt som motsvarar det givna värdet  .
.
Adsorptionspotentialär arbetet med att överföra 1 mol av adsorbatet utanför den givna adsorptionsvolymen till en given punkt av adsorptionsvolymen (eller arbetet med att överföra 1 mol mättad ånga av adsorbatet, som är i jämvikt med det flytande adsorbatet i frånvaro av adsorbenten, in i ångfasen i jämvikt med adsorbenten).

Karakteristisk kurva
 - adsorptionspotential,
- adsorptionspotential, 
För en given adsorbent och olika adsorbater gäller följande: 
För olika typer av adsorbater  ,
,
Var  potentialer för adsorptionsisotermer vid relativa tryck
potentialer för adsorptionsisotermer vid relativa tryck  för adsorbat 1 och för adsorbat 2. Detta förhållande är ett konstant värde.
för adsorbat 1 och för adsorbat 2. Detta förhållande är ett konstant värde.
 - affinitetskoefficient
- affinitetskoefficient
Teori om kapillär kondensation.
Förloppet av adsorptionsprocessen beror till stor del på strukturen hos den porösa kroppen.
|
mikroporösa | |
|
Övergångs porös | |
|
Makroporös |
I fallet med mikroporösa sorbenter överlappar fälten av adsorptionskrafter. När det gäller makroporösa sorbenter fungerar porerna som transportkanaler. Kondensationsprocesserna är mest betydande i transienta porösa kroppar. Kapillärkondensering startar vid vissa värden sid Och  när en del av ytenergin redan har kompenserats. En nödvändig förutsättning är att ytan ska vara självbärande. Processen beskrivs Thompson-Kelvins ekvation.
när en del av ytenergin redan har kompenserats. En nödvändig förutsättning är att ytan ska vara självbärande. Processen beskrivs Thompson-Kelvins ekvation.

 - för vätning är krökningscentrum i gasfas.
- för vätning är krökningscentrum i gasfas.
Vid kapillärkondensation har adsorptionsisotermen en hysteresform. Den nedre grenen motsvarar adsorptionsprocessen och den övre grenen motsvarar desorptionsprocessen.
Alla typer av porer kan reduceras till tre typer:
|
konisk |
Cylindrisk med en sluten ände |
Cylindrisk med två öppna ändar |
|
Processfyllning utförs från botten av poren. Adsorptionsisotermen och desorptionsisotermen sammanfaller i detta fall, eftersom adsorptionsprocessen börjar med en sfär och desorptionsprocessen också börjar med att vissa sfärer försvinner.
↓ |
Det finns ingen hysteres. Slag framåt och bakåt beskrivs av ekvationen:
|
Det finns ingen botten någonstans, fyllningen av poren kommer att gå längs cylinderns väggar.
cylinder: Isoterm och kommer att ha en hysteresform.
↓ |
I  vätningsförhållanden uppstår kondens vid lägre tryck, vilket är energetiskt gynnsamt. Från desorptionsgrenen erhålls porstorleksfördelningskurvor.
vätningsförhållanden uppstår kondens vid lägre tryck, vilket är energetiskt gynnsamt. Från desorptionsgrenen erhålls porstorleksfördelningskurvor.
Differentialkurvans maximum förskjuts åt vänster i förhållande till integralens inflexionspunkt. Den totala volymen av små porer är liten, men har stora ytareor. När porstorleken ökar, ökar deras volym som  , och området som
, och området som  På grund av detta observeras en förskjutning av differentialkurvans maximum.
På grund av detta observeras en förskjutning av differentialkurvans maximum.
Adsorption vid gränssnittet mellan fast och vätska.
När det gäller adsorption vid fast-gas-gränssnittet försummade vi en komponent. I fallet med adsorption vid gränsytan mellan fast och vätska, tränger adsorbatet undan lösningsmedelsmolekyler från ytan av adsorbenten.
 ,
,
Den högra ekvationen är:

 ,
,
N 1, N 2 - molfraktioner av lösningsmedlet och komponenten, N 1 + N 2 \u003d 1, sedan
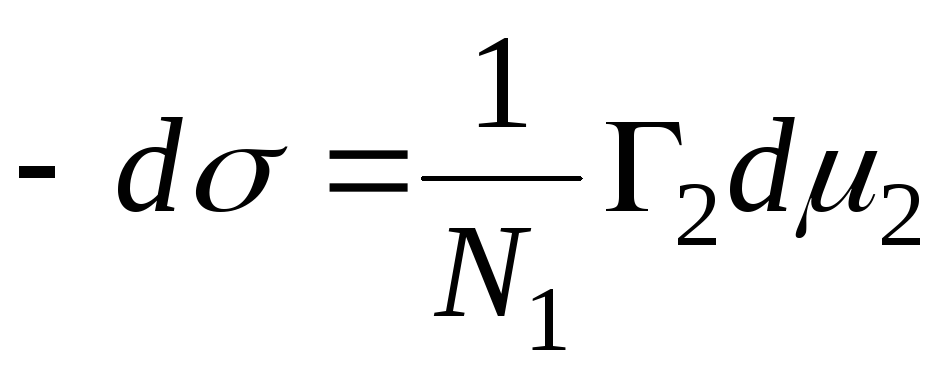 ,
=>
,
=>
 , sedan - adsorptionsekvationen för fasgränsen fast - vätska.
, sedan - adsorptionsekvationen för fasgränsen fast - vätska.
Adsorption (G) > 0 at  <
0
<
0
Om värdena  för komponenten och lösningsmedlet är mycket olika, i detta fall beroendet G från N har ett extremum vid värdet N
~ 0,5.
för komponenten och lösningsmedlet är mycket olika, i detta fall beroendet G från N har ett extremum vid värdet N
~ 0,5.
E  om
om  har liknande värden, i detta fall kan tecknet på adsorption ändras. Missbruk G från N korsar x-axeln
har liknande värden, i detta fall kan tecknet på adsorption ändras. Missbruk G från N korsar x-axeln
Funktion Korsning G(N) med abskissaxeln kallas adsorptionsazeotrop. Detta innebär att de två komponenterna inte kan separeras på denna adsorbent.
Adsorptionsisotermekvation med utbyteskonstant.
Under adsorption vid gränsytan mellan fast och vätska omfördelas komponenterna ständigt mellan ytan av adsorbenten och volymen av lösningen.
 - komponenter (- - hänvisar till ytan)
- komponenter (- - hänvisar till ytan)

 ,
,
 ,
, .
.
 ,
,


Adsorption vid vätske-gas-gränsytan
R  Låt oss betrakta förändringen i koncentrationsprofilen när vätske-gasgränsytan korsas. Låt komponent 2 vara flyktig.
Låt oss betrakta förändringen i koncentrationsprofilen när vätske-gasgränsytan korsas. Låt komponent 2 vara flyktig.
Cs är koncentrationen i ytskiktet.
Baserat på definitionen av överskottsadsorption

Om komponenten inte är flyktig, kommer adsorptionsvärdet att skrivas enligt följande:
P  ri
ri 

I ekvationen  materiens natur beskrivs av derivatan
materiens natur beskrivs av derivatan  .
.
Ytspänningsisotermen kan ha formen 1 eller 2:
1 - ytaktiva ämnen
2 - ytaktiva ämnen
Ytaktivitet g är ämnens förmåga att minska ytspänningen i systemet.

 - tjockleken på ytskiktet
- tjockleken på ytskiktet
C sär koncentrationen av komponenten i ytskiktet
MED– volymkoncentration
För en homolog serie finns en regel:
 - Traubeau Duclos härskar
- Traubeau Duclos härskar
För den homologa serien ser adsorptionsisotermen ut så här:
Vi skriver D istället för A, eftersom adsorptionen är för stor i ytskiktet.
Ytspänningsisoterm:

 är ytspänningen för det rena lösningsmedlet.
är ytspänningen för det rena lösningsmedlet.
 - fundamental adsorptionsekvation;
- fundamental adsorptionsekvation;
 - Langmuirs ekvation.
- Langmuirs ekvation.
Låt oss lösa dem tillsammans:

- Shishkovskys ekvation.
Bär en konstant för den homologa serien.
A- när man flyttar från en homolog till en annan ökar den med 3-3,5 gånger 
![]()
1 - område med låga koncentrationer
![]()
2 - medelkoncentration
3 - monomolekylärt skikt
Ytaktiva ämnen är amfifila molekyler, dvs. inkluderar en polär grupp och en opolär kolväteradikal.
o är den polära delen av molekylen.
| är den opolära delen av molekylen.
I ett polärt lösningsmedel är ytaktiva molekyler orienterade på ett sådant sätt att den polära delen av molekylen är vänd mot lösningsmedlet, medan den opolära delen trycks in i gasfasen.
I Shishkovskys ekvation  , är den konstant för den homologa serien.
, är den konstant för den homologa serien.
Ytaktiv handling börjar dyka upp med n>5. Vid koncentrationer högre än koncentrationen av det monomolekylära skiktet sker micellisering i ytaktiva lösningar.
Micelle- aggregatet av amfifila ytaktiva molekyler kallas, vars kolväteradikaler bildar kärnan, och de polära grupperna omvandlas till vattenfasen.
Micellmassa - micellmassa.
H  antalet molekyler är antalet aggregation.
antalet molekyler är antalet aggregation.
Sfäriska miceller
Vid micellisering upprättas en jämvikt i lösningen
CMC är den kritiska micellkoncentrationen.
Eftersom vi anser att micellen är en separat fas:
För den homologiska serien finns en empirisk ekvation:
aär den funktionella gruppens upplösningsenergi.
b är adsorptionspotentialökningen, arbetet med adsorption per metylenenhet.
är adsorptionspotentialökningen, arbetet med adsorption per metylenenhet.
Närvaron av en kolvätekärna i miceller gör det möjligt för föreningar som är olösliga i vatten att lösas i vattenlösningar av ytaktiva ämnen, detta fenomen kallas solubilisering (det som löser sig är ett solubilisat, ytaktivt ämne är ett solubiliseringsmedel).
Slammet kan vara helt opolärt, kan innehålla både polära och opolära delar och kommer att vara orienterat som en ytaktiv molekyl.
I vilket fall som helst, under solubilisering sker en ökning av micellmassan och aggregationstalet inte bara på grund av inkluderingen av solubilisatet, utan också på grund av en ökning av antalet ytaktiva molekyler som är nödvändiga för att upprätthålla jämviktstillståndet.
Solubilisering är desto effektivare desto lägre molekylvikt har solubilisatet.

 ~72 mN/m.
~72 mN/m.
 ~ 33 mN/m.
~ 33 mN/m.
Effektiviteten hos ytaktiva ämnen beror på storleken på CMC.
2D Ytskiktstryck

→ -krafter av ytspänning.
- tvådimensionellt tryck.
Ytskiktet är en kraft lika med skillnaden mellan ytspänningarna för en lösning av ytaktivt medel och ett rent lösningsmedel, riktad mot en ren yta.
En jämvikt upprättas mellan lösningen och ytskiktet



På  det finns ett område där
det finns ett område där  linjärt beroende av koncentration.
linjärt beroende av koncentration.
G [mol/m2].
 område som upptas av en mol av ett ämne
område som upptas av en mol av ett ämne
Då kommer den tvådimensionella tryckisotermen att ha formen 
 är den tvådimensionella tryckisotermen.
är den tvådimensionella tryckisotermen.
Missbruk  från S M:
från S M:

På  - det tvådimensionella trycket ökar kraftigt. På
- det tvådimensionella trycket ökar kraftigt. På  tvådimensionell är deformerad, vilket orsakar en kraftig tillväxt
tvådimensionell är deformerad, vilket orsakar en kraftig tillväxt  .
.
Filmen på båda sidor som begränsas av samma faser kallas dubbelsidig. I sådana filmer observeras en konstant rörelse av moderluten.
Filmer som är mindre än 5 nm tjocka kallas svarta filmer.

Adsorptionsskikt bör ha två egenskaper: viskositet och lätt rörlighet, flytbarhet och elasticitet.
Marangoni-effekten är självläkande.
Gibbs triangel,  - övertryck.
- övertryck.
Filmen sträcks och på grund av att en del av vätskan är borta rusar de ytaktiva medlen in i det fria utrymmet. Gibbs triangel.
Effekt av kroppars adsorptionsstyrka.
Det finns alltid ett adsorptionsskikt på filmytan, för vilket då
Langmuirs ekvation:


 till tvådimensionellt tryck
till tvådimensionellt tryck
 - analog av Shishkovsky-ekvationen
- analog av Shishkovsky-ekvationen
elektrokinetiska fenomen. Dubbelt elektriskt lager (DES).
Helemholtz modell. Gouy-Chapman teori.
1808 flygning

U – formade rör, nedsänkt i det 2 elektroder. Lagen om kommunicerande kärl överträds och det finns en förändring i vätskenivån i röret - elektrokinetiska fenomen.
Kinetiska fenomen:
elektrofores
Elektroosmos
Flöde (flöde) potential
Sedimentationspotential
1 och 2 uppstår när en potentialskillnad appliceras, 3 och 4 orsakar stansningen och sedimenteringen av kolloidala partiklar uppkomsten av en potentialskillnad.
Elektroosmos är rörelsen av ett dispersionsmedium i förhållande till en stationär dispergerad fas under inverkan av en elektrisk ström.
elektrofores är rörelsen av partiklar i den dispergerade fasen i förhållande till ett stationärt dispersionsmedium under inverkan av en elektrisk ström.
P  Anledningen till förekomsten av elektrokinetiska fenomen är den rumsliga separationen av laddningar och uppkomsten av ett dubbelt elektriskt lager.
Anledningen till förekomsten av elektrokinetiska fenomen är den rumsliga separationen av laddningar och uppkomsten av ett dubbelt elektriskt lager.
Det elektriska dubbelskiktet är en platt kondensator, en platta är bildad av potentialbestämmande joner, den andra av motinoer. Jonerna är också förorenade när potentialbestämmande samjoner trycks in i huvuddelen av lösningen. Avstånd mellan plattorna  . Potentialen faller linjärt, potentialskillnaden
. Potentialen faller linjärt, potentialskillnaden  .
.
En extern potentialskillnad orsakar uppkomsten av en skjuvmodul  är ett par krafter per ytenhet som verkar längs ytan av en fast kropp.
är ett par krafter per ytenhet som verkar längs ytan av en fast kropp.

Vid jämvikt är skjuvmodulen lika med den viskösa friktionsmodulen (  ).
).

I våra förhållanden  ,
,

 - Helemholtz-Smalukovsky ekvation
- Helemholtz-Smalukovsky ekvation
 - linjär hastighetsförskjutning i faser.
- linjär hastighetsförskjutning i faser.
Eär det elektriska fältets styrka.
 - potentialskillnad mellan plattorna
- potentialskillnad mellan plattorna
 - elektroforetisk rörlighet [m2/(V*s)].
- elektroforetisk rörlighet [m2/(V*s)].
Helemholtz-modellen tar inte hänsyn till molekylers termiska rörelse. I verkligheten är fördelningen av joner i dubbelskiktet mer komplex.
Gouy och Chapman identifierade följande orsaker till DES:
Övergången av en jon från en fas till en annan när jämvikt är etablerad.
Jonisering av fast fasmaterial.
Komplettering av ytan av joner som finns i dispersionsmediet.
Polarisering från en extern strömkälla.
Det elektriska dubbelskiktet har en suddig eller diffus struktur. Joner tenderar att vara jämnt fördelade i det diffusa skiktet.
Det diffusa skiktet består av motjoner, längden på skiktet bestäms av deras kinetiska energi. Vid en temperatur som tenderar till absoluta nollpunkten är kontrainoer så nära potentialbestämmande joner som möjligt.
Denna teori bygger på två ekvationer:
Boltzmanns ekvation

 - arbeta mot krafterna från elektrostatisk interaktion.
- arbeta mot krafterna från elektrostatisk interaktion.
 är bulkladdningstätheten.
är bulkladdningstätheten.

Poissons ekvation 
Eftersom DEL-tjockleken är mycket mindre än partikelstorleken, och för en platt DEL, är derivatan med avseende på koordinater  Och
Och  är avskaffad.
är avskaffad. 
För e y med y<<1 функцию можно разложить в ряд Маклорена:

Vi begränsar oss till två medlemmar i serien, då:


 - DEL-tjocklek är det avstånd från vilket DEL-potentialen minskar e en gång.
- DEL-tjocklek är det avstånd från vilket DEL-potentialen minskar e en gång.
Ju lägre temperatur, desto mindre  . Vid Т→0 – platt DES. Ju högre koncentration, desto mer jag, desto mindre
. Vid Т→0 – platt DES. Ju högre koncentration, desto mer jag, desto mindre  .
.





 "–" betyder att potentialen minskar med avståndet. =>
"–" betyder att potentialen minskar med avståndet. =>
=>

 ,
,
 - potentialen minskar exponentiellt.
- potentialen minskar exponentiellt.
Potential för ytladdningstäthet: 
Ytladdning är en rymdladdning med motsatt tecken, integrerad över avstånd.




=>


Där potentialen minskar med 2,7 gånger - 
Dubbla lagerkapacitet 
Nackdelen med teorin är att närvaron av Helemholtz-skiktet inte beaktas, d.v.s. tar inte hänsyn till  , därav felen vid bestämning av huvudparametrarna. Det förklarar inte heller effekten av joner av olika natur på tjockleken av det elektriska dubbelskiktet.
, därav felen vid bestämning av huvudparametrarna. Det förklarar inte heller effekten av joner av olika natur på tjockleken av det elektriska dubbelskiktet.
Sterns teori. Strukturen av en kolloidal micell.
Det elektriska dubbelskiktet består av två delar: tätt och diffust. Ett tätt skikt bildas som ett resultat av interaktionen av potentialbildande joner med specifikt adsorberade. Dessa joner är som regel delvis eller helt uttorkade och kan ha antingen samma eller motsatt laddning till de potentialbestämmande jonerna. Det beror på förhållandet mellan energin för elektrostatisk interaktion  och specifik adsorptionspotential
och specifik adsorptionspotential  . Jonerna i det täta lagret är fixerade. Den andra delen av jonerna ligger i det diffusa skiktet, dessa joner är fria och kan röra sig djupt in i lösningen, d.v.s. från ett område med högre koncentration till ett område med lägre koncentration. Den totala laddningstätheten består av två delar.
. Jonerna i det täta lagret är fixerade. Den andra delen av jonerna ligger i det diffusa skiktet, dessa joner är fria och kan röra sig djupt in i lösningen, d.v.s. från ett område med högre koncentration till ett område med lägre koncentration. Den totala laddningstätheten består av två delar.

 - Helmholtz lagerladdning
- Helmholtz lagerladdning
 -Diffus lagerladdning
-Diffus lagerladdning
Ytan har ett visst antal adsorptionscentra, som var och en interagerar med en motjon. Konstanten för en sådan kvasikemisk reaktion är:

 , Var
, Var  - molfraktion av motjoner i lösning
- molfraktion av motjoner i lösning
Helmholtz distribution
Potentialen minskar linjärt
Gouy potentialdistribution. Det finns inget tätt lager, potentialen minskar exponentiellt från värdet 
Sternfördelning.
Till en början är den potentiella minskningen linjär och sedan exponentiellt.
När ett elektriskt fält appliceras vid elektrofores är det inte partikeln i den fasta fasen som rör sig direkt, utan partikeln i den fasta fasen med ett lager av omgivande joner. DES upprepar formen av partikeln i den dispergerade fasen. När en potential appliceras rivs en del av det diffusa lagret av. Brytlinjen kallas glidande gräns.
Potentialen som uppstår vid glidgränsen till följd av att en del av det diffusa skiktet lossnar kallas elektrokinetisk potential(Zeta potential  ).
).
En partikel av en dispergerad fas, med ett lager av motjoner som omger den och ett dubbelt elektriskt lager, kallas micell.
Regler för att skriva kolloidala miceller:


1-1 laddningselektrolyt
T är en partikel av den dispergerade fasen.
AA är gränsen mellan de täta och diffusa delarna.
BB är glidgränsen.
Slirgränsen kan eller kanske inte sammanfaller med linje AA.
pH-värdet vid vilket zetapotentialen är noll kallas isoelektrisk punkt.
CaCl2 + Na2SO4 → CaSO4 ↓ + 2NaCl
1. I överskott av CaCl 2
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n-x)Cl-) 2 x + x Cl - - rekordmiceller.
CaSO 4 m - aggregat.
CaSO 4 m∙nCa 2+ är kärnan.
CaSO 4 m∙nCa 2+ 2( n-x)Cl - partikel.
2. I överskott av Na 2 SO 4
Na 2 SO 4 ↔2Na + + SO 4 2-
(CaSO4 m∙nSO4 2- 2(n-x)Na+) 2x- 2xNa+ - micell
CaSO 4 m - aggregat.
CaSO 4 m∙nSO 4 2 + är kärnan.
CaS04 m∙nSO4 2-2(n-x)Na+-partikel
Helemholtz-Smoluchowskis ekvation

 - linjär hastighet för förskjutning av gränser (vid elektroosmos).
- linjär hastighet för förskjutning av gränser (vid elektroosmos).
 - potentialskillnad på kondensatorplattorna (vid elektroosmos).
- potentialskillnad på kondensatorplattorna (vid elektroosmos).


 - lösningens volymetriska flödeshastighet, Sär cellens tvärsnittsarea.
- lösningens volymetriska flödeshastighet, Sär cellens tvärsnittsarea.

Eär det elektriska fältets styrka.


 (för elektroosmos).
(för elektroosmos).
För flödespotentialen:

 - potential
- potential
 - membrantryck
- membrantryck
Som regel är värdet av elektroforetiska rörligheter och elektroosmotiska rörligheter mindre än de beräknade. Detta beror på:
Avslappningseffekt (under rörelsen av en partikel av den dispergerade fasen, kränks symmetrin i den joniska atmosfären).
Elektroforetisk bromsning (förekomsten av ytterligare friktion som ett resultat av rörelsen av motjoner).
Förvrängning av strömlinjer vid elektriskt ledande partiklar.
Samband mellan ytspänning och potential. Lippmanns ekvation.
Bildandet av DEL sker spontant på grund av systemets önskan att minska sin ytenergi. I konstanssammanhang T Och sid den generaliserade ekvationen för termodynamikens första och andra lag ser ut så här:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1:a Lippmann-ekvationen.
- 1:a Lippmann-ekvationen.
 är ytladdningstätheten.
är ytladdningstätheten.
 - differentiell kapacitans.
- differentiell kapacitans.
 - 2:a Lippmann-ekvationen.
- 2:a Lippmann-ekvationen.
MED- kapacitet.
Vi löser den första Lippmann-ekvationen och den fundamentala adsorptionsekvationen:
 ,
,


 , Då
, Då
 - Nernsts ekvation
- Nernsts ekvation
 ,
,
 ,
,




 - ekvationen för den elektrokapillära kurvan (ECC).
- ekvationen för den elektrokapillära kurvan (ECC).
I  :
: , Men
, Men 
Katjoniska ytaktiva ämnen (CSAS) reducerar den katodiska grenen av ECC.
Anjoniska ytaktiva ämnen (ASS) reducerar den anodiska grenen av ECC.
Nonjoniska ytaktiva ämnen (NSA) reducerar den mellersta delen av ECC.
Stabilitet av dispergerade system. Kiltryck.
Dispergerade system kan delas in:
Termodynamiskt instabila system kan vara kinetiskt stabila på grund av övergången till ett metastabilt tillstånd.
Det finns två typer av stabilitet:
Sedimentationsstabilitet (med hänsyn till gravitationen).
Aggregativ stabilitet. (i förhållande till att sticka)
Koaguleringär processen där partiklar klibbar ihop, vilket leder till förlust av aggregativ stabilitet. Koagulering kan orsakas av förändringar i temperatur, pH, omrörning, ultraljud.
Särskilj koagulering:
Reversibel.
Irreversibel.
Koagulationen fortsätter med införandet av elektrolyter.
Koaguleringsregler:

Filma- detta är den del av systemet som ligger mellan två gränssnitt.
upplösande tryck uppstår med en kraftig minskning av filmtjockleken som ett resultat av interaktionen av närmande ytskikt.

«-» - när filmtjockleken minskar, ökar sönderdelningstrycket.
P 0 är trycket i bulkfasen, som är en fortsättning på mellanskiktet.
P 1 är trycket i filmen.
Teori om stabilitet. DLFO (Deryagin, Landau, Fairway, Overbeck).
Enligt DLVO-teorin särskiljs två komponenter i det sönderfallande trycket:
elektrostatisk PE (positiv, det beror på krafterna från elektrostatisk repulsion). Motsvarar en minskning av Gibbs-energin med ökande filmtjocklek.
Molekyl PM (negativ, på grund av attraherande krafters verkan). Det orsakas av komprimeringen av filmen på grund av kemiska ytkrafter, krafternas verkningsradie är tiondels nm med en energi i storleksordningen 400 kJ/mol.
Total interaktionsenergi:

 - systemet är aggregerat stabilt
- systemet är aggregerat stabilt
 - instabilt system
- instabilt system
P  positiv komponent.
positiv komponent.
Ökningen beror på ökningen av potentiell energi under komprimering av tunna filmer. För tjocka filmer kompenseras överskottet av jonenergin och är lika med energiinteraktionen i huvuddelen av dispersionsmediet.
Om  (
( - film tjocklek,
- film tjocklek,  - jonens radie) förtunning av filmen leder till att molekyler och joner med minimal ytenergi försvinner och reduceras i den. Antalet angränsande partiklar minskar, vilket resulterar i att den potentiella energin hos de partiklar som finns kvar i filmen ökar.
- jonens radie) förtunning av filmen leder till att molekyler och joner med minimal ytenergi försvinner och reduceras i den. Antalet angränsande partiklar minskar, vilket resulterar i att den potentiella energin hos de partiklar som finns kvar i filmen ökar.


DLVO-teorin betraktar interaktionen mellan partiklar som interaktionen mellan plattor.

Partiklar interagerar inte



 - Laplace ekvation,
- Laplace ekvation,  ,
,


För svagt laddade ytor
För mycket laddade ytor:

Den molekylära komponenten är interaktionen mellan två atomer:
 ~
~
Interaktion mellan en atom och en yta:

Låt oss ta två rekord:
D  För att erhålla den molekylära komponenten är det nödvändigt att summera alla interaktionsenergier för atomerna på den högra och vänstra plattan.
För att erhålla den molekylära komponenten är det nödvändigt att summera alla interaktionsenergier för atomerna på den högra och vänstra plattan.
Var  - Hamakers konstant (tar hänsyn till naturen hos interagerande kroppar).
- Hamakers konstant (tar hänsyn till naturen hos interagerande kroppar).
Den där. interaktionsenergin för partiklar i ett system kan uttryckas med hjälp av potentialkurvor.
I är det primära potentiella minimumet. Detta är en zon av irreversibel koagulering, attraktionskrafterna råder.
II - zon av aggregativ stabilitet, frånstötande krafter råder.
III - sekundär potentialminimum (eller flockningszon). Mellan partiklarna i den dispergerade fasen finns ett elektrolytskikt, och partiklarna kan separeras och överföras till zonen med aggregativ stabilitet.

Kurva 1 – systemet är aggregativt stabilt.
Kurva 2 är stabil i zon I, inte stabil i zon II.
Kurva 3 - koagulering inträffade i systemet.
Kurva 4 - vid punkt 4, den totala energin för interaktion U=0,  , motsvarar denna extrema punkt början av snabb koagulering.
, motsvarar denna extrema punkt början av snabb koagulering.
Det finns två fall:
1. Ytor är svagt laddade:
U \u003d U E + U M \u003d 0
 (1)
(1)
2)

 (2)
(2)



 - detta är tjockleken på skiktet som motsvarar början av koaguleringsprocessen.
- detta är tjockleken på skiktet som motsvarar början av koaguleringsprocessen.






 - för svagt laddade ytor
- för svagt laddade ytor
 Sedan
Sedan 
2. För mycket laddade ytor:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
Låt oss kvadrera (3)

Koagulering:
Vid specifik adsorption kan joner adsorberas i en superekvivalent mängd på ett sådant sätt att ytan kan ändra sin laddning. Ytan laddas om.
I fallet med specifik adsorption kan inte bara joner med motsatta tecken utan även av en jon adsorberas.
Om joner av samma tecken som ytan adsorberas, kommer det inte att finnas en droppe i potentialen i ytskiktet, utan dess tillväxt.

Neutraliseringskoagulering (uppstår med deltagande av svagt laddade partiklar och beror inte bara på laddningen av den koagulerande elektrolyten, utan också på potentialen vid gränsen för de täta och diffusa skikten).
Smoluchowskis teori om snabb koagulation.

Beroende av koagulationshastighet på elektrolytkoncentration.
I – koagulationshastigheten är låg,
II - koagulationshastigheten är praktiskt taget proportionell mot elektrolytkoncentrationen.
III - området för snabb koagulering, hastigheten är praktiskt taget oberoende av koncentrationen.
Nyckelord:
Den initiala solen är monodispers, liknande partiklar har en sfärisk form.
Alla partikelkollisioner är effektiva.
När två primära partiklar kolliderar bildas en sekundär partikel. Sekundär + primär = tertiär. Primär, sekundär, tertiär - mångfald.
När det gäller kemisk kinetik kan koaguleringsprocessen beskrivas med ekvationen:
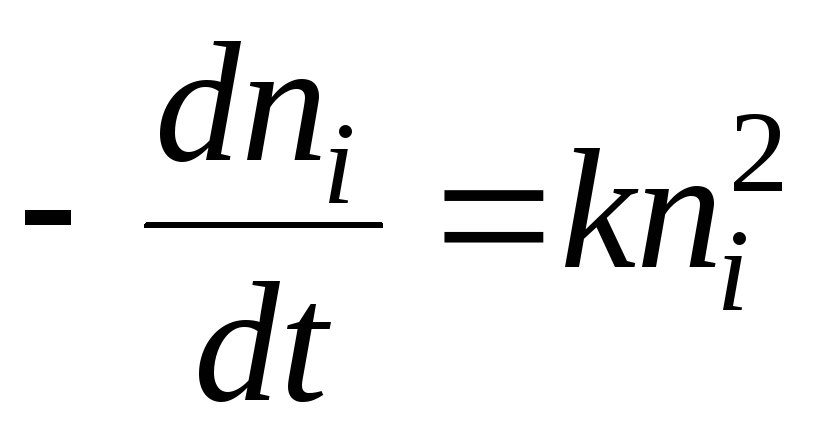
Lösningen blir ekvationen: 
 - tid för halvkoagulering. Detta är den tid under vilken antalet solpartiklar minskar med 2 gånger.
- tid för halvkoagulering. Detta är den tid under vilken antalet solpartiklar minskar med 2 gånger.

 ,
,
 ,
,
 ,
,


När multipliciteten ökar skiftar koagulationskurvornas maximum mot större värden  .
.
Brister:
Antagande om monodispersitet.
Antagandet om effektiviteten av alla kollisioner.




 - sfär,
- sfär, ,
,





