Alkener är kemiskt aktiva. Deras kemiska egenskaper bestäms till stor del av närvaron av en dubbelbindning. De vanligaste reaktionerna för alkener är elektrofila additionsreaktioner och radikaladditionsreaktioner. Nukleofila additionsreaktioner kräver vanligtvis närvaron av en stark nukleofil och är inte typiska för alkener. Alkener genomgår lätt oxidations- och additionsreaktioner och är också kapabla till alylradikalsubstitution.
Tilläggsreaktioner
Hydrogenering Tillsatsen av väte (hydreringsreaktion) till alkener utförs i närvaro av katalysatorer. Oftast används krossade metaller - platina, nickel, palladium etc. Som ett resultat bildas motsvarande alkaner (mättade kolväten).
$CH_2=CH_2 + H2 → CH_3–CH_3$
Tillsats av halogener. Alkener reagerar lätt, under vanliga förhållanden, med klor och brom för att bilda motsvarande dihaloalkaner, i vilka halogenatomer finns vid intilliggande kolatomer.
Anteckning 1
När alkener interagerar med brom, blir brom missfärgad till en gulbrun färg. Detta är en av de äldsta och enklaste kvalitativa reaktionerna för omättade kolväten, eftersom alkyner och alkadiener också reagerar på liknande sätt.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
Tillsats av vätehalogenider. När etenkolväten reagerar med vätehalogenider ($HCl$, $HBr$) bildas haloalkaner, reaktionsriktningen beror på alkenernas struktur.
När det gäller eten eller symmetriska alkener sker additionsreaktionen entydigt och leder till bildandet av endast en produkt:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
I fallet med osymmetriska alkener är bildningen av två olika additionsreaktionsprodukter möjlig:
Anteckning 2
Faktum är att huvudsakligen endast en reaktionsprodukt bildas. Mönstret i riktning mot sådana reaktioner fastställdes av den ryska kemisten V.V. Markovnikov 1869 Det kallas Markovnikovs styre. När vätehalogenider reagerar med osymmetriska alkener tillsätts en väteatom vid platsen för dubbelbindningsklyvningen på den mest hydrerade kolatomen, det vill säga innan den kopplas till ett stort antal väteatomer.
Markovnikov formulerade denna regel på basis av experimentella data, och först mycket senare fick den en teoretisk motivering. Betrakta reaktionen mellan propen och väteklorid.
En av egenskaperna hos $p$-bindningen är dess förmåga att lätt polariseras. Under påverkan av metylgruppen (positiv induktiv effekt + $I$) i propenmolekylen skiftar elektrontätheten för $p$-bindningen till en av kolatomerna (= $CH_2$). Som ett resultat visas en partiell negativ laddning ($\delta -$) på den. En partiell positiv laddning ($\delta +$) visas på den andra kolatomen i dubbelbindningen.
Denna fördelning av elektrondensitet i propenmolekylen bestämmer platsen för den framtida protonattacken. Detta är kolatomen i metylengruppen (= $CH_2$), som har en partiell negativ $\delta-$-laddning. Och klor angriper följaktligen en kolatom med en partiell positiv laddning $\delta+$.
Som en konsekvens är huvudprodukten av reaktionen mellan propen och väteklorid 2-klorpropan.
Hydrering
Hydrering av alkener sker i närvaro av mineralsyror och lyder Markovnikovs regel. Reaktionsprodukterna är alkoholer
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Alkylering
Tillsats av alkaner till alkener i närvaro av en sur katalysator ($HF$ eller $H_2SO_4$) vid låga temperaturer leder till bildning av kolväten med högre molekylvikt och används ofta inom industrin för att tillverka motorbränsle
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Oxidationsreaktioner
Oxidation av alkener kan förekomma, beroende på förhållanden och typer av oxiderande reagens, både med klyvningen av dubbelbindningen och med bevarandet av kolskelettet:
Polymerisationsreaktioner
Alkenmolekyler är kapabla att lägga till varandra under vissa förhållanden med öppning av $\pi$-bindningar och bildandet av dimerer, trimmers eller högmolekylära föreningar - polymerer. Polymerisation av alkener kan ske antingen genom en fri radikal eller en katjon-anjonmekanism. Som polymerisationsinitiatorer används syror, peroxider, metaller etc. Polymerisationsreaktionen utförs även under inverkan av temperatur, bestrålning och tryck. Ett typiskt exempel är polymerisationen av eten för att bilda polyeten
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Substitutionsreaktioner
Substitutionsreaktioner är inte typiska för alkener. Vid höga temperaturer (över 400 ° C) undertrycks emellertid radikaladditionsreaktioner, som är reversibla. I detta fall blir det möjligt att ersätta väteatomen i allylpositionen samtidigt som dubbelbindningen bibehålls
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Knowledge Hypermarket >>Kemi >>Kemi 10:e klass >> Kemi: Alkenes
Omättade inkluderar kolväten som innehåller flera bindningar mellan kolatomer i sina molekyler. Omättade är alkener, alkyner, alkadiener (polyener). Cykliska kolväten som innehåller en dubbelbindning i ringen (cykloalkener), samt cykloalkaner med ett litet antal kolatomer i ringen (tre eller fyra atomer) har också en omättad karaktär. Egenskapen för "omättnad" är förknippad med förmågan hos dessa ämnen att ingå additionsreaktioner, främst väte, med bildning av mättade eller mättade kolväten - alkaner.
Strukturera
Alkener är acykliska och innehåller i molekylen, förutom enkelbindningar, en dubbelbindning mellan kolatomer och motsvarar den allmänna formeln C n H 2n.
Alkener fick sitt andra namn - "olefiner" i analogi med omättade fettsyror (oljesyra, linolsyra), vars rester är en del av flytande fetter - oljor (från den engelska oljan - olja).
Kolatomer som har en dubbelbindning mellan sig är som du vet i ett tillstånd av sp 2 hybridisering. Detta innebär att en s och två p-orbitaler är involverade i hybridisering, och en p-orbital förblir ohybridiserad. Överlappningen av hybridorbitalerna leder till bildandet av en a-bindning, och på grund av de ohybridiserade -orbitalerna i de angränsande kolatomerna i etenmolekylen, bildas en andra, P-förbindelse. En dubbelbindning består alltså av en Þ-bindning och en p-bindning.
Hybridorbitalerna för atomerna som bildar en dubbelbindning är i samma plan, och orbitalerna som bildar en n-bindning är placerade vinkelrätt mot molekylens plan (se fig. 5).
Dubbelbindningen (0,132 nm) är kortare än enkelbindningen, och dess energi är högre, dvs den är starkare. Icke desto mindre leder närvaron av en mobil, lätt polariserbar 7g-bindning till det faktum att alkener är kemiskt mer aktiva än alkaner och kan genomgå additionsreaktioner.
Homolog serie av eten
Rakkedjiga alkener bildar den homologa serien av eten (eten).
C2H4 - eten, C3H6 - propen, C4H8 - buten, C5H10 - penten, C6H12 - hexen, etc.
Isomerism och nomenklatur
Alkener, liksom alkaner, kännetecknas av strukturell isomerism. Strukturella isomerer, som ni minns, skiljer sig från varandra i strukturen av kolskelettet. Den enklaste alkenen, kännetecknad av strukturella isomerer, är buten.
CH3-CH2-CH=CH2CH3-C=CH2
l
CH3
buten-1 metylpropen
En speciell typ av strukturell isomerism är isomerism av dubbelbindningens position:
CH3-CH2-CH=CH2CH3-CH=CH-CH3
buten-1 buten-2
Nästan fri rotation av kolatomer är möjlig runt en enda kol-kolbindning, så alkanmolekyler kan anta en mängd olika former. Rotation runt dubbelbindningen är omöjlig, vilket leder till uppkomsten av en annan typ av isomerism i alkener - geometrisk eller cis-trans-isomerism.
Cis-isomerer skiljer sig från thoraxisomerer i det rumsliga arrangemanget av molekylära fragment (i detta fall metylgrupper) i förhållande till planet P-förbindelser, och därmed fastigheter.
Alkener är isomera till cykloalkaner (interklassisomerism), till exempel:
CH2 = CH-CH2-CH2-CH2-CH3
hexen-1 cyklohexan
Nomenklatur alkener, utvecklad av IUPAC, liknar nomenklaturen för alkaner.
1. Val av huvudkrets
Bildandet av namnet på ett kolväte börjar med definitionen av huvudkedjan - den längsta kedjan av kolatomer i molekylen. När det gäller alkener måste huvudkedjan innehålla en dubbelbindning.
2. Numrering av atomer i huvudkedjan
Numreringen av atomerna i huvudkedjan börjar från den ände som dubbelbindningen är närmast. Till exempel är det korrekta anslutningsnamnet
dn3-dn-dn2-dn=dn-dn3 dn3
5-metylhexen-2, inte 2-metylhexen-4, som man kan förvänta sig.
Om dubbelbindningens position inte kan bestämma början av numreringen av atomer i kedjan, så bestäms den av substituenternas position på samma sätt som för mättade kolväten.
CH3-CH2-CH=CH-CH-CH3
l
CH3
2-metylhexen-3
3. Namnets bildande
Namnen på alkener bildas på samma sätt som namnen på alkaner. I slutet av namnet, ange numret på den kolatom vid vilken dubbelbindningen börjar, och suffixet som anger att föreningen tillhör klassen alkener, -en.
Mottagande
1. Krackning av petroleumprodukter. I processen för termisk krackning av mättade kolväten, tillsammans med bildningen av alkaner, uppstår bildningen av alkener.
2. Dehydrering av mättade kolväten. När alkaner passeras över en katalysator vid höga temperaturer (400-600 °C), elimineras en vätemolekyl och en alken bildas: 
3. Uttorkning av alkoholer (eliminering av vatten). Effekten av vattenavlägsnande medel (H2804, Al203) på envärda alkoholer vid höga temperaturer leder till eliminering av en vattenmolekyl och bildandet av en dubbelbindning:
Denna reaktion kallas intramolekylär dehydrering (i motsats till intermolekylär uttorkning, som leder till bildning av etrar och kommer att studeras i § 16 "Alkoholer").
4. Dehydrohalogenering (eliminering av vätehalogenid).
När en haloalkan reagerar med en alkali i en alkohollösning bildas en dubbelbindning som ett resultat av elimineringen av en vätehalogenidmolekyl.
Observera att denna reaktion producerar övervägande buten-2 i stället för buten-1, vilket motsvarar Zaitsevs regel:
När en vätehalogenid elimineras från sekundära och tertiära haloalkaner, elimineras en väteatom från den minst hydrerade kolatomen.
5. Dehalogenering. När zink verkar på ett dibromderivat av en alkan, elimineras halogenatomer belägna vid angränsande kolatomer och en dubbelbindning bildas: 
Fysikaliska egenskaper
De första tre representanterna för den homologa serien av alkener är gaser, ämnen med sammansättningen C5H10-C16H32 är vätskor och högre alkener är fasta ämnen.
Kok- och smältpunkter ökar naturligt med ökande molekylvikt hos föreningar.
Kemiska egenskaper
Tilläggsreaktioner
Låt oss komma ihåg att en utmärkande egenskap hos representanter för omättade kolväten - alkener är förmågan att ingå additionsreaktioner. De flesta av dessa reaktioner sker genom den elektrofila additionsmekanismen.
1. Hydrering av alkener. Alkener kan tillsätta väte i närvaro av hydreringskatalysatorer - metaller - platina, palladium, nickel:
CH3-CH2-CH=CH2 + H2-> CH3-CH2-CH2-CH3
Denna reaktion sker vid både atmosfärstryck och förhöjt tryck och kräver inte hög temperatur, eftersom den är exoterm. När temperaturen ökar kan samma katalysatorer orsaka en omvänd reaktion - dehydrering.
2. Halogenering (tillsats av halogener). Interaktionen av en alken med bromvatten eller en lösning av brom i ett organiskt lösningsmedel (CCl4) leder till snabb missfärgning av dessa lösningar som ett resultat av tillsatsen av en halogenmolekyl till alkenen och bildandet av dihaloalkaner.
Markovnikov Vladimir Vasilievich
(1837-1904)
Rysk organisk kemist. Formulerade (1869) regler om riktningen för substitution, eliminering, addition vid en dubbelbindning och isomeriseringsreaktioner beroende på den kemiska strukturen. Han studerade (sedan 1880) oljans sammansättning och lade grunden till petrokemin som en oberoende vetenskap. Upptäckte (1883) en ny klass av organiska ämnen - cykloparaffiner (naftener).
3. Hydrohalogenering (tillsats av vätehalogenid).
Vätehalogenidadditionsreaktionen kommer att diskuteras mer i detalj nedan. Denna reaktion lyder Markovnikovs regel:
När en vätehalogenid fäster till en alken, fäster vätet till den mer hydrerade kolatomen, d.v.s. den atom vid vilken det finns fler väteatomer, och halogenen till den mindre hydrerade.
4. Hydrering (tillsats av vatten). Hydrering av alkener leder till bildning av alkoholer. Till exempel ligger tillsatsen av vatten till eten bakom en av de industriella metoderna för att framställa etylalkohol:
CH2=CH2 + H2O -> CH3-CH2OH
eten etanol
Observera att en primär alkohol (med en hydroxigrupp på det primära kolet) bara bildas när eten hydratiseras. När propen eller andra alkener hydratiseras bildas sekundära alkoholer. 
Denna reaktion fortskrider också i enlighet med Markovnikovs regel - en vätekatjon fäster till en mer hydrerad kolatom och en hydroxigrupp fäster till en mindre hydrerad.
5. Polymerisation. Ett speciellt fall av addition är polymerisationsreaktionen av alkener:
Denna additionsreaktion sker via en friradikalmekanism.
Oxidationsreaktioner
Som alla organiska föreningar brinner alkener i syre för att bilda CO2 och H20.
Till skillnad från alkaner, som är resistenta mot oxidation i lösningar, oxideras alkener lätt genom inverkan av vattenhaltiga lösningar av kaliumpermanganat. I neutrala eller svagt alkaliska lösningar oxideras alkener till dioler (tvåvärda alkoholer), och hydroxylgrupper läggs till de atomer mellan vilka en dubbelbindning fanns före oxidation.
Som du redan vet är omättade kolväten - alkener kapabla att ingå additionsreaktioner. De flesta av dessa reaktioner sker genom den elektrofila additionsmekanismen.
Elektrofil koppling
Elektrofila reaktioner är reaktioner som sker under påverkan av elektrofiler - partiklar som har en brist på elektrondensitet, till exempel en ofylld orbital. Den enklaste elektrofila partikeln är vätekatjonen. Det är känt att väteatomen har en elektron i den 3:e orbitalen. En vätekatjon bildas när en atom förlorar denna elektron, så vätekatjonen har inga elektroner alls:
Н· - 1е - -> Н +
I detta fall har katjonen en ganska hög elektronaffinitet. Kombinationen av dessa faktorer gör vätekatjonen till en ganska stark elektrofil partikel.
Bildandet av en vätekatjon är möjlig under elektrolytisk dissociation av syror:
НВr -> Н + + Вr -
Det är av denna anledning som många elektrofila reaktioner inträffar i närvaro och deltagande av syror.
Elektrofila partiklar verkar, som tidigare nämnts, på system som innehåller områden med ökad elektrondensitet. Ett exempel på ett sådant system är en multipel (dubbel eller trippel) kol-kolbindning.
Du vet redan att kolatomer mellan vilka en dubbelbindning bildas befinner sig i ett tillstånd av sp 2-hybridisering. Ohybridiserade p-orbitaler av angränsande kolatomer belägna i samma plan överlappar varandra och bildar P-bindning, som är mindre stark än Þ-bindningen, och, viktigast av allt, lätt polariseras under påverkan av ett externt elektriskt fält. Det betyder att när en positivt laddad partikel närmar sig skiftar CS-bindningens elektroner mot den och den s.k. P- komplex.
Det visar sig P-komplex och vid tillsats av en vätekatjon till P- anslutningar. Vätekatjonen verkar stöta in i elektrontätheten som sticker ut från molekylens plan P-anslutning och förenar den. ![]()
I nästa steg sker en fullständig förskjutning av elektronparet P-binder till en av kolatomerna, vilket leder till uppkomsten av ett ensamt elektronpar på den. Orbitalen för kolatomen på vilken detta par är lokaliserat och den lediga orbitalen för vätekatjonen överlappar varandra, vilket leder till bildandet av en kovalent bindning genom donator-acceptormekanismen. Den andra kolatomen har fortfarande en ofylld orbital, dvs en positiv laddning.
Den resulterande partikeln kallas en karbokatjon eftersom den innehåller en positiv laddning på kolatomen. Denna partikel kan kombineras med vilken anjon som helst, en partikel som har ett ensamt elektronpar, d.v.s. en nukleofil.
Låt oss överväga mekanismen för den elektrofila additionsreaktionen med exemplet på hydrobromering (tillsats av vätebromid) av eten:
СН2= СН2 + НВг --> СНВr-СН3
Reaktionen börjar med bildandet av en elektrofil partikel - en vätekatjon, som uppstår som ett resultat av dissociationen av en vätebromidmolekyl.
Vätekatjonangrepp P- anslutning, bildande P- ett komplex som snabbt omvandlas till en kolsyra: 
Låt oss nu titta på ett mer komplext fall.
Reaktionen av tillsatsen av vätebromid till eten fortgår otvetydigt, och interaktionen av vätebromid med propen kan teoretiskt ge två produkter: 1-bromopropan och 2-bromopropan. Experimentella data visar att 2-bromopropan huvudsakligen produceras.
För att förklara detta måste vi överväga den mellanliggande partikeln - karbokatjonen.
Tillsatsen av en vätekatjon till propen kan leda till bildandet av två karbokatjoner: om en vätekatjon förenar den första kolatomen, atomen som ligger i slutet av kedjan, kommer den andra att ha en positiv laddning, dvs. molekylens centrum (1); om den förenar den andra, kommer den första atomen att ha en positiv laddning (2). 
Den föredragna riktningen för reaktionen kommer att bero på vilken karbokatjon som är rikligare i reaktionsmediet, vilket i sin tur bestäms av karbokatjonens stabilitet. Experimentet visar den dominerande bildningen av 2-bromopropan. Detta gör att bildningen av karbocation (1) med positiv laddning på centralatomen sker i större utsträckning.
Den större stabiliteten hos denna karbokat förklaras av det faktum att den positiva laddningen på den centrala kolatomen kompenseras av den positiva induktiva effekten av två metylgrupper, vars totala effekt är högre än +/- effekten av en etylgrupp:
Lagarna för reaktionerna för hydrohalogenering av alkener studerades av den berömda ryske kemisten V.V. Markovnikov, en student till A.M. Butlerov, som, som nämnts ovan, formulerade regeln som bär hans namn.
Denna regel etablerades empiriskt, det vill säga experimentellt. I dagsläget kan vi ge en helt övertygande förklaring till det.
Intressant nog följer andra elektrofila additionsreaktioner också Markovnikovs regel, så det skulle vara korrekt att formulera det i en mer allmän form.
I elektrofila additionsreaktioner lägger en elektrofil (en partikel med en ofylld orbital) till en mer hydrerad kolatom, och en nukleofil (en partikel med ett ensamt elektronpar) läggs till en mindre hydrerad.
Polymerisation
Ett specialfall av additionsreaktion är polymerisationsreaktionen av alkener och deras derivat. Denna reaktion fortskrider med mekanismen för tillsats av fria radikaler:
Polymerisation utförs i närvaro av initiatorer - peroxidföreningar, som är en källa till fria radikaler. Peroxidföreningar är ämnen vars molekyler inkluderar gruppen -O-O-. Den enklaste peroxidföreningen är väteperoxid HOOH.
Vid en temperatur på 100 °C och ett tryck på 100 MPa sker homolys av den instabila syre-syrebindningen och bildandet av radikaler - polymerisationsinitiatorer. Under påverkan av KO-radikaler initieras polymerisation, som utvecklas som en friradikaladditionsreaktion. Kedjetillväxten upphör när rekombination av radikaler sker i reaktionsblandningen - polymerkedjan och radikaler eller COCH2CH2-.
Genom att använda reaktionen av fri radikalpolymerisation av ämnen som innehåller en dubbelbindning erhålls ett stort antal föreningar med hög molekylvikt: 
Användningen av alkener med olika substituenter gör det möjligt att syntetisera ett brett spektrum av polymera material med ett brett spektrum av egenskaper. 
Alla dessa polymerföreningar används i stor utsträckning inom en mängd olika områden av mänsklig aktivitet - industri, medicin, används för tillverkning av utrustning för biokemiska laboratorier, några är mellanprodukter för syntes av andra högmolekylära föreningar.
Oxidation
Du vet redan att i neutrala eller svagt alkaliska lösningar sker oxidation av alkener till dioler (tvåvärda alkoholer). I en sur miljö (en lösning surgjord med svavelsyra) förstörs dubbelbindningen fullständigt och kolatomerna mellan vilka dubbelbindningen fanns omvandlas till kolatomer i karboxylgruppen: 
Destruktiv oxidation av alkener kan användas för att bestämma deras struktur. Så, till exempel, om ättiksyra och propionsyror erhålls under oxidationen av en viss alken, betyder detta att penten-2 har genomgått oxidation, och om smörsyra och koldioxid erhålls, då är det ursprungliga kolvätet penten-1 .
Ansökan
Alkener används i stor utsträckning inom den kemiska industrin som råmaterial för framställning av en mängd olika organiska ämnen och material.
Till exempel är eten utgångsmaterialet för framställning av etanol, etylenglykol, epoxider och dikloretan.
En stor mängd eten bearbetas till polyeten, som används för att tillverka förpackningsfilm, servis, rör och elektriska isoleringsmaterial.
Glycerin, aceton, isopropanol och lösningsmedel erhålls från propen. Genom att polymerisera propen erhålls polypropen, som är överlägsen polyeten i många avseenden: den har högre smältpunkt och kemisk beständighet.
För närvarande produceras fibrer med unika egenskaper av polymerer - analoger av polyeten. Till exempel är polypropenfiber starkare än alla kända syntetfibrer.
Material tillverkade av dessa fibrer är lovande och används i allt större utsträckning inom olika områden av mänsklig aktivitet.

1. Vilka typer av isomerism är karakteristiska för alkener? Skriv formlerna för möjliga isomerer av penten-1.
2. Från vilka föreningar kan erhållas: a) isobuten (2-metylpropen); b) buten-2; c) buten-1? Skriv ekvationerna för motsvarande reaktioner.
3. Dechiffrera följande kedja av transformationer. Nämn föreningarna A, B, C. 4. Föreslå en metod för att erhålla 2-klorpropan från 1-klorpropan. Skriv ekvationerna för motsvarande reaktioner.
5. Föreslå en metod för att rena etan från etenföroreningar. Skriv ekvationerna för motsvarande reaktioner.
6. Ge exempel på reaktioner som kan användas för att skilja mellan mättade och omättade kolväten.
7. För fullständig hydrering av 2,8 g alken förbrukades 0,896 liter väte (n.e.). Vad är molekylvikten och strukturformeln för denna förening, som har en normal kedja av kolatomer?
8. Vilken gas finns i cylindern (eten eller propen), om det är känt att den fullständiga förbränningen av 20 cm3 av denna gas krävde 90 cm3 (n.s.) syre?
9*. När en alken reagerar med klor i mörker bildas 25,4 g diklorid och när denna alken av samma massa reagerar med brom i koltetraklorid bildas 43,2 g dibromid. Bestäm alla möjliga strukturformler för startalkenen.
Upptäcktshistoria
Från ovanstående material har vi redan förstått att eten är förfadern till den homologa serien av omättade kolväten, som har en dubbelbindning. Deras formel är C n H 2n och de kallas alkener.
År 1669 var den tyske läkaren och kemisten Becher den första som fick etylen genom att reagera svavelsyra med etylalkohol. Becher fann att eten är mer kemiskt aktivt än metan. Men tyvärr kunde forskaren vid den tiden inte identifiera den resulterande gasen och gav den därför inget namn.
Lite senare använde holländska kemister samma metod för att framställa eten. Och eftersom det, när det interagerar med klor, tenderade att bilda en oljig vätska, fick det följaktligen namnet "oljegas". Senare blev det känt att denna vätska var dikloretan.
På franska är termen "olja" oléfiant. Och efter att andra kolväten av denna typ upptäckts, introducerade Antoine Fourcroix, en fransk kemist och vetenskapsman, en ny term som blev vanlig för hela klassen av olefiner eller alkener.
Men redan i början av artonhundratalet upptäckte den franske kemisten J. Gay-Lussac att etanol inte bara består av "olje"-gas, utan också av vatten. Dessutom upptäcktes samma gas i etylklorid.
Och även om kemister bestämde att eten består av väte och kol, och redan kände till ämnenas sammansättning, kunde de inte hitta dess riktiga formel på länge. Och först 1862 lyckades E. Erlenmeyer bevisa närvaron av en dubbelbindning i etenmolekylen. Detta erkändes också av den ryska forskaren A.M. Butlerov och bekräftade experimentellt riktigheten av denna synvinkel.
Förekomst i naturen och fysiologiska roll av alkener
Många människor är intresserade av frågan om var alkener kan hittas i naturen. Så det visar sig att de praktiskt taget inte förekommer i naturen, eftersom dess enklaste representant, eten, är ett hormon för växter och syntetiseras i dem endast i små mängder.
Det är sant att det i naturen finns en sådan alken som muskalur. Denna av de naturliga alkenerna är ett sexuellt lockande medel för husflugan.
Det är värt att uppmärksamma det faktum att lägre alkener med en hög koncentration har en narkotisk effekt som kan orsaka kramper och irritation av slemhinnorna.
Tillämpningar av alkener
Det är svårt att föreställa sig det moderna samhällets liv idag utan användning av polymermaterial. Eftersom polymerer till skillnad från naturmaterial har olika egenskaper är de lätta att bearbeta och ser man till priset är de relativt billiga. En annan viktig aspekt till förmån för polymerer är att många av dem kan återvinnas.
Alkener har funnit sin användning vid tillverkning av plast, gummi, filmer, teflon, etylalkohol, acetaldehyd och andra organiska föreningar.

Inom jordbruket används det som ett medel som påskyndar mognadsprocessen av frukter. Propylen och butylener används för att producera olika polymerer och alkoholer. Men vid tillverkning av syntetiskt gummi används isobuten. Därför kan vi dra slutsatsen att det är omöjligt att klara sig utan alkener, eftersom de är de viktigaste kemiska råvarorna.
Industriell användning av eten
I industriell skala används propen vanligtvis för syntes av polypropen och för framställning av isopropanol, glycerol, butyraldehyder etc. Varje år ökar efterfrågan på propen.

4.3.b. Tillsats av vätehalogenider (hydrohalogenering)
En annan viktig elektrofil additionsreaktion till alkener är den sedan länge kända hydrohalogeneringen av alkener.
Nedan är typiska exempel på tillsats av HCl, HBr och HI till olika alkener.


Effekten av alkylsubstituenter på dubbelbindningen på additionshastigheten beskrivs av följande sekvens:
R2C=CHR > RCH=CHR > RCH=CH2
Detta överensstämmer med en mekanism i vilken det hastighetsbestämmande steget i reaktionen involverar bildning av en karbokatjon när stabiliteten av alkylkatjoner minskar i ordningen tertiär > sekundär > primär. Sålunda måste tillsatsmekanismen involvera bildningen av antingen en fri karbokatjon-intermediär, som sällan observeras, eller en intermediär med en karbokatjonisk karaktär. Det sista fallet är det mest typiska.
Om tillsatsen skedde genom en "fri karbokatjon", skulle reaktionen vara helt icke-stereoselektiv, eftersom alkylkatjoner har en plan struktur. Hydrohalogeneringen fortskrider dock som regel stereoselektivt, och beroende på typen av alken, selektiv anti-anknytning, selektiv syn- eller blandat syn-anti- anslutning.
För alkener där dubbelbindningen inte är konjugerad till en aromatisk ring är den karakteristisk anti-tillsats av vätehalogenid. Anti-tillsats av väteklorid och bromid, deuteriumklorid och bromid observeras för cyklohexen, cyklopenten, 1,2-dimetylhexen, 1,2-dimetylpenten, cis- Och Trans-buten-2, hexen-3 och många andra enkla alkener och cykloalkener.

I additionsprodukten finns identiska substituenter (metylgrupper) på olika sidor av cyklohexanringens mittplan, därför tillhör den Trans-rad. Anti-addition är svårt att förena med en mekanism där bildandet av en diskret karbokatation antas. För en plan karbokation är nukleofil attack av halogenidjonen lika sannolikt på båda sidor av planet, vilket bör leda till bildandet av en blandning av produkter syn- Och anti- anslutningar. Kinetiken för alkenhydrohalogenering indikerar också en mer komplex additionsmekanism. För icke-konjugerade alkener beskrivs reaktionshastigheten av en tredje ordningens ekvation med en andra ordningen i vätehalogeniden, dvs den motsvarar Ad E3-mekanismen.
v = k [alken] 2
Antiadditionsreaktionen och andra ordningens reaktion på vätehalogeniden stämmer väl överens med Ad E 3-mekanismen, i vilken en alken reagerar med två vätehalogenidmolekyler, varav en fungerar som ett elektrofilt medel och den andra som ett nukleofilt medel.

Denna trimolekylära mekanism antar att ett komplex av en alken- och en vätehalogenidmolekyl initialt bildas, följt av attacken av en andra HX-molekyl på detta komplex med anti-sidor utan bildandet av en diskret karbokation. Det bör särskilt noteras att varje trimolekylär mekanism måste bestå av två på varandra följande steg, eftersom kollisionen av tre molekyler samtidigt är extremt osannolik.

Antiaddition indikerar en preferentiell nukleofil attack av vätehalogeniden från den motsatta sidan till där alkenen protoneras. Istället för en vätehalogenid kan funktionen av ett nukleofilt medel i slutsteget också utföras av en halogenidjon. Faktum är att reaktionshastigheten vanligtvis ökar i direkt proportion till koncentrationen av halidjonen som införs i reaktionsblandningen i form av tetraalkylammoniumhalogenider NR 4+ X - eller litium LiX. I det här fallet stereospecifik anti- anslutning.
För alkaner där dubbelbindningen är konjugerad till en aromatisk ring är den karakteristisk syn- anslutning eller blandad syn-anti-tillsats av vätehalogenid, till exempel:

Syn addition är den dominerande processen för cis- Och Trans-isomerer av 1-fenylpropen, 1-fenyl-4-alkylcyklohexener, acenaftylen, inden. När sådana alkener protoneras bildas karbokatjoner av bensyltyp, som är mer stabila än rena alkylkatjoner som uppstår under protoneringen av vanliga alkener och cykloalkener. Reaktionskinetiken i detta fall beskrivs vanligtvis av en enklare andra ordningens ekvation v = k[alken], dvs den motsvarar den bimolekylära Ad E 2 mekanismen. Ad E 2-Mechanism involverar bildandet av ett jonpar som involverar en karbokatjon och en halogenidjon.

Mekanismen för addition som involverar jonpar kan inte förväntas vara mycket stereoselektiv. Om ett jonpar omvandlas till slutprodukten snabbare än det kan rotera runt en enda kol-kolbindning, blir slutresultatet syn-addition, där en proton och en halogenidjon läggs till på samma sida av dubbelbindningen. Annars kan bildandet av produkter som t.ex syn- så anti- anslutning av NH. Detta fall inträffar under hydrohalogenering par-substituerad styren Z-C6H4-CH=CH2. Mönstret som observeras här är det syn-addition är typiskt endast för de olefiner som, när de protoneras, ger en relativt stabil karbokatjon, dvs i fallet med donator Z-substituenter.
Hydrohalogeneringsreaktioner som fortskrider med Ad E2-mekanismen kännetecknas av konkurrens mellan konjugatadditions- och omlagringsprocesser, eftersom ett karbokat- eller jonpar bildas som en mellanprodukt.

Som ett exempel på omarrangemang med 1,2-migrering av en alkylgrupp och en hydridjon presenterar vi hydrohalogeneringsreaktionerna av tert-butyletylen respektive isopropyleten.

När samma reaktion utförs utan lösningsmedel i kyla (-78°C) bildas en blandning av 33% normala och 67% onormala (omgrupperade) tillsatsprodukter.

4.3.c. Orientering. Markovnikovs styre
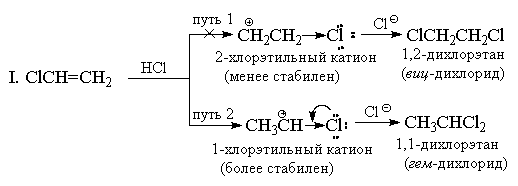
Till skillnad från symmetriska elektrofiler (Hal 2) är vätehalogenider osymmetriska elektrofila reagens. Tillsats av valfri osymmetrisk elektrofil (HBr, ICl, H2O, Hg(OAc)2, etc.) till en osymmetrisk alken skulle i princip kunna ge en blandning av två alternativa produkter, men i praktiken bildas vanligtvis bara en av dem. Som ett exempel, överväg tillsatsen av vätebromid till propen.

Tillbaka 1870 V.V. Markovnikov formulerade en empirisk regel enligt vilken osymmetriska alkener adderar HX på ett sådant sätt att en produkt företrädesvis bildas där väte tillsätts till den minst substituerade änden och X till den mest substituerade änden av dubbelbindningen.
Markovnikovs regel förklaras vanligtvis av skillnaden i stabilitet hos två alternativa karbokater. Till exempel, i exemplet ovan, normal n-propylkatjon är mycket mindre stabil än isopropylkatjon, och därför fortsätter reaktionen längs den andra vägen.
Markovnikovs regel användes ursprungligen endast för fall av tillsats av HX till kolvätesubstrat, men i princip kan den utvidgas till reaktioner av andra substituerade alkener. Således ger tillsatsen av HCl till CF3CH=CH2 " anti-Markovnikov" produkt CF 3 CH 2 CH 2 Cl. Detta var att vänta, eftersom CF 3 CH+ CH 3 katjonen är mindre stabil än CF 3 CH 2 CH 2+ katjonen på grund av den starka (-I) effekten av CF 3-gruppen Katjonen CF 3 CH 2 CH 2+ bildas övervägande, men den destabiliseras också, om än i mindre utsträckning, av den induktiva effekten av CF 3-gruppen, vilket resulterar i att tillsatsen av HCl till trifluormetyleten är mycket långsammare än tillsatsen till osubstituerad eten.
Av en liknande anledning tillsätter vinyltrialkylammoniumkatjoner HBr också mot Markovnikovs regel:
Tillsatsen av HX till alkener med starka (-I) och (-M) substituenter, till exempel till akrylnitril eller nitroetylen, bör också gå emot Markovnikovs regel. I detta fall är dock dubbelbindningen så kraftigt deaktiverad med avseende på elektrofila reagens att dessa reaktioner endast sker under mycket stringenta betingelser. Vinylklorid CH 2 =CHCl ger alltid uteslutande "Markovnikov-addukter". Till exempel, när den reagerar med HCl, bildas endast 1,1-dikloretan (geminal diklorid) CH3CHCl2. Klor, liknande CF 3-gruppen, har en stark (-I) effekt, och vid första anblicken verkar det som om tillsatsen av denna anledning bör ha en anti-Markovnikov-orientering, eftersom + CH 2 CH 2 Cl-katjonen bör vara mer stabil än katjon CH 3 CH + Cl. Men till skillnad från CF 3-gruppen har klor förutom (-I) effekten även en motverkande (+M) effekt (eftersom det har ensamma par). Erfarenhet visar att storleken på den mesomeriska effekten är ganska tillräcklig för att sänka energin hos 1-kloretylkatjonen under energinivån för 2-kloretylkatjonen, i vilken +M-effekten inte visar sig.
II. Ur resonansteoris synvinkel kan strukturen av 1-kloretylkatjonen representeras enligt följande:
Tillsatsen till vinylklorid sker dock långsammare än till eten under samma förhållanden, d.v.s. enligt den totala effekten (-I > +M), förblir klor en elektronbortdragande substituent jämfört med väte, och 1-kloretylkatjonen är mindre stabil än C2H5+. Andra vinylhalider reagerar på liknande sätt med HX.
Vinyletrar CH 2 =CHOR tillsätter HX (X=Hal) enligt Markovnikovs regel i en mycket högre hastighet än alla substituerade alkener som anges ovan. Detta beror på den betydande +M-effekten av RO-gruppen. Till skillnad från kloratomen är RO-gruppen, i termer av den totala elektroniska effekten (+M > -I), en stark elektrondonerande substituent som effektivt stabiliserar det närliggande karbokatationscentret. Karbokationens struktur kan i detta fall också representeras som en uppsättning av två resonansstrukturer
Angreppet av oxoniumkatjonen av en halidanjon leder till bildning av a-halogenetrar av typen CH3CH(Hal)OR.
4.3.g. Hydrering av alkener
Syrakatalyserad hydrering av alkener leder till bildning av alkoholer. Riktningen för hydratisering av alkener bestäms av Markovnikovs regel, så det antas att en karbokatjon bildas som en mellanliggande partikel i denna reaktion.
Tendensen hos sekundära alkylkarbokater att omarrangeras förhindrar användningen av hydratisering av alkener för att producera sekundära alkoholer.

Denna metod har funnit begränsad tillämpning i laboratoriet endast för framställning av tertiära alkoholer. Hydratiseringsreaktionen är i detta fall i stort sett reversibel och tertiära alkoholer bildas i låga utbyten (40-45%).


Hydratiseringen av de enklaste alkenerna - eten och propen - är en viktig industriell metod för framställning av etyl- och isopropylalkoholer.

I laboratoriepraxis har direkt hydratisering av alkener inte funnit någon utbredd användning, både på grund av svåra förhållanden och bildningen av en betydande mängd isomera alkoholer. För närvarande används den relaterade reaktionen av hydroxikvicksilering - avsvängning - vanligtvis för regioselektiv produktion av alkoholer från alkener.
4.3.d. Hydroxymercuration-demercuration
En elektrofil attack på dubbelbindningen av en alken kan utföras av metalljoner, bland vilka kvicksilver(II)katjonen intar en särställning. Kvicksilveracetat under mycket milda förhållanden vid 20 0 C adderas till alkener i vattenhaltig tetrahydrofuran (THF) eller vattenhaltig ättiksyra för att bilda organiska kvicksilverföreningar. Tillsatsen av kvicksilveracetat till dubbelbindningen sker regionspecifikt i strikt överensstämmelse med Markovnikovs regel, d.v.s. kvicksilverkatjonen fäster till den minst substituerade kolatomen.
C-Hg-bindningen i organiska kvicksilverföreningar kan lätt klyvas genom verkan av natriumborhydrid NaBH 4, vilket bildar kvicksilver och en ny C-H-bindning. Det antas att alkylkvicksilverhydrid erhålls som en instabil mellanprodukt, som ytterligare sönderdelas för att frigöra metalliskt kvicksilver genom en radikalmekanism.

Sammantaget representerar denna tvåstegsprocess av hydroxikvicksilering-avsvallning slutligen en regiospecifik hydratisering av en alken enligt Markovnikovs regel under extremt milda förhållanden, när bildningen av biprodukter reduceras till det yttersta möjliga minimum. Detta kan tydligt illustreras med hjälp av följande exempel, i vilka det totala utbytet av reaktionsprodukter är 90-98%. De givna digitala uppgifterna i detta fall indikerar inte utbytet av de resulterande föreningarna, utan deras förhållande i blandningen.




Såsom kan ses från exemplen ovan ger hydroxikvicksilering-avsvallning av alkener i de flesta fall regiospecifik hydratisering av alkener med bildning av nästan bara en av de två isomera alkoholerna. Det bör noteras att det inte finns något behov av att isolera den organiska kvicksilverföreningen, och båda processerna kan utföras direkt efter varandra.
Hydroxymercuration av osymmetriska alkener börjar tydligen med attacken av AcOHg+-katjonen och bildandet som en mellanprodukt av en osymmetrisk cyklisk kvicksilverkatjon (analog till den osymmetriska halogeniumjonen), som sedan öppnas som ett resultat av nukleofil attack av vatten som mest substituerad kolatom, som har en större positiv laddning.

Den överbryggande kvicksilverjonen kan fixeras i en icke-nukleofil starkt sur miljö även vid 20 0 C genom att tillsätta ett starkare elektrofilt medel - kvicksilvertrifluoracetat i en blandning av fluorsulfonsyra och antimonpentafluorid.

Kvicksilverkatjonen kan sönderdelas inte bara genom inverkan av vatten, utan också av andra elektrondonerande lösningsmedel: alkoholer, ättiksyra, acetonitril, etc. Den slutliga reaktionsprodukten i detta fall kommer att vara etrar, acetater eller N-substituerade amider av ättiksyra, respektive, till exempel:


När grenade sekundära eller tertiära alkoholer används i alkoxikvicksilver-avkvicksileringsreaktionen är trifluoracetat Hg(OCOCF 3) 2 eller kvicksilvertriflat Hg(OSO 2 CF 3) 2 mer effektiva än kvicksilveracetat.

Således är hydroxi- och alkoxikvicksilver-avsvallning en av de bästa förberedande metoderna för syntes av alkoholer och etrar med grenade alkylradikaler.
Tillsatsen av kvicksilversalter till alkener är det mest slående exemplet på en konjugatadditionsreaktion till en dubbelbindning, där rollen som ett externt nukleofilt medel spelas av ett lösningsmedel. Stereokemin av den dubbla hydroxikvicksilering-avsvickningsprocessen beror på det stereokemiska resultatet av varje enskilt steg. Hydroxymercuration kännetecknas av anti-addition, som för andra reaktioner som involverar en cyklisk katjon. Radikal deercuration är dock inte särskilt stereoselektiv. Därför är hela processen som helhet också icke-stereospecifik.
4.3.e. Tillsats av alkener (katjonisk dimerisering och polymerisation av alkener)
Det mest intressanta exemplet på denna typ av reaktion är dimerisering och polymerisation av isobuten i närvaro av svavelsyra.

Det tekniska namnet för denna blandning av alkener är "diisobutylen". Denna reaktion fortskrider med en katjonisk mekanism, liknande mekanismen för addition av mineralsyror till dubbelbindningen av alkener. I det första steget fäster en proton till en isobutylenmolekyl för att bilda en relativt stabil gnuggar-butylkatjon. Vidare bildad gnuggar-butylkatjon (Lewissyra) reagerar med en isobutylenmolekyl (Lewisbas) för att bilda en ny stabil tertiär oktylkatjon.

Under dessa förhållanden, under inverkan av baser (H 2 O, HSO 4 - joner), förlorar oktylkarbokaten snabbt en proton och förvandlas till en blandning av isomera pentener, eftersom protonabstraktion sker från två olika positioner:

Den föredragna bildningen av en termodynamiskt mindre stabil alken - 2,4,4-trimetylpenten-1 (80 % i reaktionsblandningen) är associerad med större rumslig tillgänglighet för attack av basen av väteatomerna i metylgrupper, jämfört med väte atomer i metylengruppen. Industriellt hydreras "diisobutylen" med Ni-Raney för att producera "isooktan" (det tekniska namnet för kolvätet 2,2,4-trimetylpentan), som används som ett högoktanigt bränsle för förbränningsmotorer.
Vid höga koncentrationer av svavelsyra (mer än 80%) sker katjonisk polymerisation av isobuten för att bilda en polymer som kallas polyisobutylen (-CH2C(CH3)2-)n. Denna gummiliknande polymer används för att producera korrosionsskyddande och vattentätande beläggningar, tätningsmedel etc.
Förutom isobuten polymeriseras 3-metylbuten-1, vinyletrar och vissa styrenderivat, som kan bilda relativt stabila karbokatjoner, genom den katjoniska mekanismen. Vätefluorid och Lewis-syror används också som katalysatorer för katjonisk polymerisation: BF 3, AlCl 3, AlBr 3, etc. i närvaro av mycket små mängder vatten.
4.3.g. Tillsats av alkaner (alkylering av alkener)
En annan industriell metod för syntes av "isooktan" är baserad på reaktionen av isobutylen med överskott av isobutan i närvaro av koncentrerad svavelsyra eller i vattenfri vätefluorid vid 0 10 0 C.

Denna reaktion fortskrider också genom en katjonisk mekanism och, vad som är särskilt intressant, är ett exempel på en kedjekatjonisk process. Först dimeriserar isobutylen under reaktionsbetingelserna för att bilda en tertiär oktylkatjon (CH 3) 3 CCH 2 C + (CH 3) 2. Mekanismen för dess bildande beskrivs i detalj i föregående avsnitt. Därefter sker en snabb överföring av väte (i form av en hydridjon) från isobutan till oktylkatjonen för att bilda en "isooktan"-molekyl och en ny tert-butylkatjon, som i sin tur snabbt reagerar med isobutylen för att bilda en ny oktylkatjon etc.

Förutom syntesen av "isooktan" används denna alkyleringsmetod inom den petrokemiska industrin för syntes av högkokande grenade kolväten från grenade alkener och lågkokande alkaner med användning av den termiska krackningsfraktionen.
ALKENES
Kolväten, i vilkas molekyl, förutom enkla kol-kol- och kol-väte-σ-bindningar, det finns kol-kol-π-bindningar, kallas obegränsat. Eftersom bildningen av en π-bindning formellt motsvarar förlusten av två väteatomer av molekylen, innehåller omättade kolväten 2p det finns färre väteatomer än de begränsande, där P - antal π-bindningar:
En serie vars medlemmar skiljer sig från varandra med (2H) n kallas isologisk serie. Således, i ovanstående schema, är isologerna hexaner, hexener, hexadiener, hexiner, hexatriener, etc.
Kolväten som innehåller en π-bindning (dvs dubbelbindning) kallas alkener (olefiner) eller, enligt den första medlemmen i serien - eten, etylenkolväten. Den allmänna formeln för deras homologa serie är C p H 2l.
1. Nomenklatur
I enlighet med IUPAC-reglerna, när man konstruerar namnen på alkener, får den längsta kolkedjan som innehåller en dubbelbindning namnet på motsvarande alkan där ändelsen -en ersatt av -sv. Denna kedja är numrerad på ett sådant sätt att kolatomerna som är involverade i bildandet av dubbelbindningen får lägsta möjliga antal:

Radikaler namnges och numreras som i fallet med alkaner.
För alkener med relativt enkel struktur är enklare namn tillåtna. Således namnges några av de vanligast förekommande alkenerna genom att lägga till suffixet -sv till namnet på en kolväteradikal med samma kolskelett:
Kolväteradikaler bildade av alkener får suffixet -enil. Numreringen i radikalen utgår från kolatomen som har en fri valens. Men för de enklaste alkenylradikalerna, istället för systematiska namn, är det tillåtet att använda triviala:

Väteatomer direkt bundna till omättade kolatomer som bildar en dubbelbindning kallas ofta vinylväteatomer,
2. Isomerism
Förutom isomerism av kolskelettet förekommer isomerism av dubbelbindningens position också i serien av alkener. I allmänhet är denna typ av isomerism isomerism av substituentposition (funktion)- observeras i alla fall när molekylen innehåller några funktionella grupper. För alkanen C4H10 är två strukturella isomerer möjliga:
För C4H8-alkenen (buten) är tre isomerer möjliga:

Buten-1 och buten-2 är isomerer av funktionens position (i detta fall spelas dess roll av en dubbelbindning).
Rumsliga isomerer skiljer sig åt i det rumsliga arrangemanget av substituenter i förhållande till varandra och kallas cis-isomerer, om substituenterna är belägna på samma sida av dubbelbindningen, och transisomerer, om på motsatta sidor:

3. Struktur av en dubbelbindning
Energin för klyvning av en molekyl vid C=C-dubbelbindningen är 611 kJ/mol; eftersom energin för C-C σ-bindningen är 339 kJ/mol, är energin för att bryta π-bindningen endast 611-339 = 272 kJ/mol. π -elektroner är mycket lättare än σ -elektroner och är känsliga för påverkan av till exempel polariserande lösningsmedel eller påverkan av eventuella attackerande reagens. Detta förklaras av skillnaden i symmetri för fördelningen av elektronmolnet av σ- och π-elektroner. Den maximala överlappningen av p-orbitaler och därför den minsta fria energin hos molekylen realiseras endast med en platt struktur av vinylfragmentet och med ett förkortat C-C-avstånd lika med 0,134 nm, dvs. betydligt mindre än avståndet mellan kolatomer anslutna med en enkelbindning (0,154 nm). När "halvorna" av molekylen roterar i förhållande till varandra längs dubbelbindningsaxeln, minskar graden av orbital överlappning, vilket är förknippat med energiförbrukningen. Konsekvensen av detta är frånvaron av fri rotation längs dubbelbindningsaxeln och förekomsten av geometriska isomerer med lämplig substitution vid kolatomerna.
Alkenes- omättade kolväten, som innehåller en dubbelbindning. Exempel på alkener:

Metoder för att erhålla alkener.
1. Krackning av alkaner vid 400-700°C. Reaktionen sker via en mekanism för fria radikaler:

2. Dehydrering av alkaner:
3. Elimineringsreaktion (eliminering): 2 atomer eller 2 grupper av atomer elimineras från angränsande kolatomer, och en dubbelbindning bildas. Sådana reaktioner inkluderar:
A) Dehydrering av alkoholer (uppvärmning över 150°C, med deltagande av svavelsyra som vattenavlägsnande reagens):
B) Eliminering av vätehalogenider när de utsätts för en alkoholhaltig alkalilösning:

Väteatomen delas av företrädesvis från kolatomen som är bunden till färre väteatomer (den minst hydrerade atomen) - Zaitsevs styre.
B) Dehalogenering:

Kemiska egenskaper hos alkener.
Egenskaperna hos alkener bestäms av närvaron av en multipelbindning, därför går alkener in i elektrofila additionsreaktioner, som sker i flera steg (H-X - reagens):
1:a etappen:

2:a etappen:
 .
.
Vätejonen i denna typ av reaktion tillhör kolatomen som har en mer negativ laddning. Densitetsfördelningen är:

Om substituenten är en donator, vilket manifesterar +I-effekten, så skiftar elektrontätheten mot den mest hydrerade kolatomen, vilket skapar en delvis negativ laddning på den. Reaktioner går enligt Markovnikovs styre: när man förenar polära molekyler som NH (HCl, HCN, HOH etc.) till osymmetriska alkener, fäster väte företrädesvis till den mer hydrerade kolatomen vid dubbelbindningen.
A) Tilläggsreaktioner:
1) Hydrohalogenering:
Reaktionen följer Markovnikovs regel. Men om peroxid är närvarande i reaktionen, beaktas inte regeln:
2) Hydrering. Reaktionen följer Markovnikovs regel i närvaro av fosfor- eller svavelsyra:

3) Halogenering. Som ett resultat blir bromvatten missfärgat - detta är en kvalitativ reaktion på en multipelbindning:
4) Hydrering. Reaktionen sker i närvaro av katalysatorer.



