Alkeny są chemicznie aktywne. O ich właściwościach chemicznych w dużej mierze decyduje obecność wiązania podwójnego. Najczęstszymi reakcjami alkenów są reakcje addycji elektrofilowej i reakcji addycji rodnikowej. Reakcje addycji nukleofilowej zwykle wymagają obecności silnego nukleofila i nie są typowe dla alkenów. Alkeny łatwo ulegają reakcjom utleniania i addycji, a także są zdolne do podstawienia rodników alilowych.
Reakcje addycji
Uwodornienie Dodawanie wodoru (reakcja uwodornienia) do alkenów przeprowadza się w obecności katalizatorów. Najczęściej stosuje się pokruszone metale - platynę, nikiel, pallad itp. W rezultacie powstają odpowiednie alkany (węglowodory nasycone).
$CH_2=CH_2 + H2 → CH_3–CH_3$
Dodatek halogenów. Alkeny łatwo w normalnych warunkach reagują z chlorem i bromem, tworząc odpowiednie dihaloalkany, w których atomy halogenu są umiejscowione przy sąsiednich atomach węgla.
Notatka 1
Kiedy alkeny oddziałują z bromem, brom zmienia kolor na żółto-brązowy. Jest to jedna z najstarszych i najprostszych jakościowych reakcji nienasyconych węglowodorów, ponieważ alkiny i alkadieny również reagują podobnie.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
Dodatek halogenowodorów. Kiedy węglowodory etylenowe reagują z halogenowodorami ($HCl$, $HBr$), tworzą się haloalkany, których kierunek reakcji zależy od budowy alkenów.
W przypadku etylenu lub symetrycznych alkenów reakcja addycji zachodzi jednoznacznie i prowadzi do powstania tylko jednego produktu:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
W przypadku niesymetrycznych alkenów możliwe jest utworzenie dwóch różnych produktów reakcji addycji:
Uwaga 2
W rzeczywistości powstaje głównie tylko jeden produkt reakcji. Wzór w kierunku takich reakcji ustalił rosyjski chemik V.V. Markownikowa w 1869 r. Nazywa się to regułą Markownikowa. Kiedy halogenowodory reagują z niesymetrycznymi alkenami, atom wodoru dodaje się w miejscu rozerwania wiązania podwójnego na najbardziej uwodornionym atomie węgla, to znaczy przed połączeniem go z dużą liczbą atomów wodoru.
Markownikow sformułował tę regułę na podstawie danych eksperymentalnych i dopiero znacznie później otrzymała teoretyczne uzasadnienie. Rozważ reakcję propylenu z chlorowodorem.
Jedną z cech obligacji $p$ jest jej zdolność do łatwej polaryzacji. Pod wpływem grupy metylowej (dodatni efekt indukcyjny + $I$) w cząsteczce propenu gęstość elektronowa wiązania $p$ przesuwa się w stronę jednego z atomów węgla (= $CH_2$). W rezultacie pojawia się na nim częściowy ładunek ujemny ($\delta -$). Częściowy ładunek dodatni ($\delta +$) pojawia się na drugim atomie węgla wiązania podwójnego.
Ten rozkład gęstości elektronów w cząsteczce propylenu określa miejsce przyszłego ataku protonów. Jest to atom węgla grupy metylenowej (= $CH_2$), który niesie częściowy ładunek ujemny $\delta-$. Odpowiednio chlor atakuje atom węgla częściowym ładunkiem dodatnim $\delta+$.
W konsekwencji głównym produktem reakcji propylenu z chlorowodorem jest 2-chloropropan.
Uwodnienie
Hydratacja alkenów zachodzi w obecności kwasów mineralnych i podlega regule Markownikowa. Produktami reakcji są alkohole
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Alkilowanie
Dodatek alkanów do alkenów w obecności katalizatora kwasowego ($HF$ lub $H_2SO_4$) w niskich temperaturach prowadzi do powstania węglowodorów o większej masie cząsteczkowej i jest często stosowany w przemyśle do produkcji paliw silnikowych
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Reakcje utleniania
Utlenianie alkenów może nastąpić, w zależności od warunków i rodzaju odczynników utleniających, zarówno przy rozszczepieniu wiązania podwójnego, jak i przy zachowaniu szkieletu węglowego:
reakcje polimeryzacji
Cząsteczki alkenów potrafią w określonych warunkach dodawać się do siebie, otwierając wiązania $\pi$ i tworząc dimery, trimery lub związki o dużej masie cząsteczkowej – polimery. Polimeryzacja alkenów może zachodzić albo poprzez mechanizm wolnorodnikowy, albo kationowo-anionowy. Jako inicjatory polimeryzacji stosuje się kwasy, nadtlenki, metale itp. Reakcję polimeryzacji prowadzi się także pod wpływem temperatury, napromieniowania i ciśnienia. Typowym przykładem jest polimeryzacja etylenu z wytworzeniem polietylenu
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Reakcje podstawienia
Reakcje podstawienia nie są typowe dla alkenów. Jednak w wysokich temperaturach (ponad 400 ° C) reakcje addycji rodnikowej, które są odwracalne, są tłumione. W takim przypadku możliwa staje się wymiana atomu wodoru znajdującego się w pozycji allilowej przy zachowaniu wiązania podwójnego
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Hipermarket Wiedzy >>Chemia >>Chemia 10. klasa >> Chemia: Alkeny
Do nienasyconych zaliczają się węglowodory zawierające w swoich cząsteczkach wiązania wielokrotne pomiędzy atomami węgla. Nienasycone to alkeny, alkiny, alkadieny (polieny). Węglowodory cykliczne zawierające w pierścieniu wiązanie podwójne (cykloalkeny), a także cykloalkany z małą liczbą atomów węgla w pierścieniu (trzy lub cztery atomy) również mają charakter nienasycony. Właściwość „nienasycenia” wiąże się ze zdolnością tych substancji do wchodzenia w reakcje addycji, przede wszystkim wodoru, z tworzeniem nasyconych lub nasyconych węglowodorów - alkanów.
Struktura
Alkeny są acykliczne, zawierające w cząsteczce oprócz wiązań pojedynczych jedno podwójne wiązanie między atomami węgla i odpowiadające ogólnemu wzorowi C n H 2n.
Alkeny otrzymały swoją drugą nazwę - „olefiny” przez analogię do nienasyconych kwasów tłuszczowych (oleinowy, linolowy), których pozostałości stanowią część płynnych tłuszczów - olejów (od angielskiego oleju - oleju).
Atomy węgla, które mają między sobą wiązanie podwójne, jak wiadomo, znajdują się w stanie hybrydyzacji sp 2. Oznacza to, że w hybrydyzacji biorą udział jeden orbital s i dwa p, a jeden orbital p pozostaje niezhybrydyzowany. Nakładanie się orbitali hybrydowych prowadzi do powstania wiązania a, a w wyniku niezhybrydyzowanych -orbitali sąsiednich atomów węgla cząsteczki etylenu powstaje drugie, P-połączenie. Zatem wiązanie podwójne składa się z jednego wiązania Þ i jednego wiązania p.
Orbitale hybrydowe atomów tworzących wiązanie podwójne znajdują się w tej samej płaszczyźnie, a orbitale tworzące wiązanie n są usytuowane prostopadle do płaszczyzny cząsteczki (patrz ryc. 5).
Wiązanie podwójne (0,132 nm) jest krótsze od wiązania pojedynczego, a jego energia jest większa, czyli mocniejsza. Niemniej jednak obecność mobilnego, łatwo polaryzowalnego wiązania 7g powoduje, że alkeny są chemicznie bardziej aktywne niż alkany i mogą ulegać reakcjom addycji.
Szereg homologiczny etenu
Alkeny o prostym łańcuchu tworzą homologiczną serię etenu (etylenu).
C2H4 - eten, C3H6 - propen, C4H8 - buten, C5H10 - penten, C6H12 - heksen itp.
Izomeria i nazewnictwo
Alkeny, podobnie jak alkany, charakteryzują się izomerią strukturalną. Jak pamiętacie, izomery strukturalne różnią się między sobą budową szkieletu węglowego. Najprostszym alkenem, charakteryzującym się izomerami strukturalnymi, jest buten.
CH3-CH2-CH=CH2 CH3-C=CH2
l
CH3
buten-1-metylopropen
Szczególnym rodzajem izomerii strukturalnej jest izomeria położenia wiązania podwójnego:
CH3-CH2-CH=CH2 CH3-CH=CH-CH3
buten-1 buten-2
Możliwa jest prawie swobodna rotacja atomów węgla wokół pojedynczego wiązania węgiel-węgiel, zatem cząsteczki alkanów mogą przybierać najróżniejsze kształty. Rotacja wokół wiązania podwójnego jest niemożliwa, co prowadzi do pojawienia się w alkenach innego rodzaju izomerii - geometrycznej lub Izomeria cis-trans.
Izomery cis różnią się od izomerów tułowia przestrzennym rozmieszczeniem fragmentów molekularnych (w tym przypadku grup metylowych) względem płaszczyzny P-połączenia, a zatem i właściwości.
Alkeny są izomeryczne z cykloalkanami (izomeria międzyklasowa), na przykład:
CH2 = CH-CH2-CH2-CH2-CH3
heksen-1 cykloheksan
Nomenklatura alkeny, opracowany przez IUPAC, jest podobny do nazewnictwa alkanów.
1. Wybór obwodu głównego
Tworzenie nazwy węglowodoru rozpoczyna się od zdefiniowania głównego łańcucha - najdłuższego łańcucha atomów węgla w cząsteczce. W przypadku alkenów łańcuch główny musi zawierać wiązanie podwójne.
2. Numeracja atomów łańcucha głównego
Numeracja atomów łańcucha głównego rozpoczyna się od końca, do którego najbliżej znajduje się wiązanie podwójne. Na przykład poprawna nazwa połączenia to
dn3-dn-dn2-dn=dn-dn3 dn3
5-metyloheksen-2, a nie 2-metyloheksen-4, jak można by się spodziewać.
Jeżeli pozycja wiązania podwójnego nie może określić początku numeracji atomów w łańcuchu, wówczas wyznacza się ją na podstawie położenia podstawników w taki sam sposób, jak w przypadku węglowodorów nasyconych.
CH3-CH2-CH=CH-CH-CH3
l
CH3
2-metyloheksen-3
3. Tworzenie nazwy
Nazwy alkenów tworzy się w taki sam sposób, jak nazwy alkanów. Na końcu nazwy należy podać numer atomu węgla, od którego zaczyna się wiązanie podwójne, oraz przyrostek wskazujący, że związek należy do klasy alkenów –en.
Paragon
1. Kraking produktów naftowych. W procesie krakingu termicznego węglowodorów nasyconych wraz z powstawaniem alkanów dochodzi do powstawania alkenów.
2. Odwodornienie węglowodorów nasyconych. Gdy alkany przepuszcza się przez katalizator w wysokich temperaturach (400-600°C), cząsteczka wodoru zostaje wyeliminowana i powstaje alken: 
3. Odwodnienie alkoholi (eliminacja wody). Działanie środków odwadniających (H2804, Al203) na alkohole jednowodorotlenowe w wysokich temperaturach prowadzi do eliminacji cząsteczki wody i powstania wiązania podwójnego:
Reakcja ta nazywana jest odwodnieniem wewnątrzcząsteczkowym (w przeciwieństwie do odwodnienia międzycząsteczkowego, które prowadzi do powstania eterów i zostanie omówione w § 16 „Alkohole”).
4. Dehydrohalogenacja (eliminacja halogenowodoru).
Kiedy haloalkan reaguje z zasadą w roztworze alkoholu, w wyniku eliminacji cząsteczki halogenowodoru powstaje podwójne wiązanie.
Należy zauważyć, że w tej reakcji powstaje głównie buten-2, a nie buten-1, co odpowiada Reguła Zajcewa:
Kiedy halogenowodór jest eliminowany z drugorzędowych i trzeciorzędowych haloalkanów, atom wodoru jest eliminowany z najmniej uwodornionego atomu węgla.
5. Dehalogenacja. Kiedy cynk działa na dibromową pochodną alkanu, atomy halogenu znajdujące się przy sąsiednich atomach węgla są eliminowane i powstaje podwójne wiązanie: 
Właściwości fizyczne
Pierwsi trzej przedstawiciele homologicznej serii alkenów to gazy, substancje o składzie C5H10-C16H32 to ciecze, a wyższe alkeny to ciała stałe.
Temperatury wrzenia i topnienia naturalnie rosną wraz ze wzrostem masy cząsteczkowej związków.
Właściwości chemiczne
Reakcje addycji
Przypomnijmy, że charakterystyczną cechą przedstawicieli węglowodorów nienasyconych - alkenów jest zdolność do wchodzenia w reakcje addycji. Większość tych reakcji przebiega na zasadzie addycji elektrofilowej.
1. Uwodornienie alkenów. Alkeny mają zdolność dodawania wodoru w obecności katalizatorów uwodornienia - metali - platyny, palladu, niklu:
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
Reakcja ta zachodzi zarówno pod ciśnieniem atmosferycznym, jak i podwyższonym i nie wymaga wysokiej temperatury, ponieważ jest egzotermiczna. Gdy temperatura wzrasta, te same katalizatory mogą spowodować reakcję odwrotną - odwodornienie.
2. Halogenowanie (dodatek halogenów). Oddziaływanie alkenu z wodą bromową lub roztworem bromu w rozpuszczalniku organicznym (CCl4) prowadzi do szybkiego odbarwienia tych roztworów na skutek dodania cząsteczki halogenu do alkenu i powstania dihaloalkanów.
Markownikow Władimir Wasiljewicz
(1837-1904)
Rosyjski chemik organiczny. Sformułowane (1869) zasady dotyczące kierunku reakcji podstawienia, eliminacji, addycji przy wiązaniu podwójnym i reakcji izomeryzacji w zależności od budowy chemicznej. Studiował (od 1880 r.) skład ropy naftowej i położył podwaliny pod petrochemię jako samodzielną naukę. Odkrył (1883) nową klasę substancji organicznych - cykloparafiny (nafteny).
3. Hydrohalogenacja (dodatek halogenowodoru).
Reakcja addycji halogenowodoru zostanie omówiona bardziej szczegółowo poniżej. Ta reakcja jest zgodna z regułą Markownikowa:
Gdy halogenowodór przyłącza się do alkenu, wodór przyłącza się do bardziej uwodornionego atomu węgla, tj. atomu, przy którym jest więcej atomów wodoru, a halogen do mniej uwodornionego.
4. Hydratacja (dodanie wody). Uwodnienie alkenów prowadzi do powstania alkoholi. Na przykład dodanie wody do etenu leży u podstaw jednej z przemysłowych metod produkcji alkoholu etylowego:
CH2=CH2 + H2O -> CH3-CH2OH
eten, etanol
Należy zauważyć, że alkohol pierwszorzędowy (z grupą hydroksylową na węglu pierwszorzędowym) powstaje tylko wtedy, gdy eten jest uwodniony. Podczas uwodnienia propenu lub innych alkenów powstają alkohole drugorzędowe. 
Reakcja ta również przebiega zgodnie z zasadą Markownikowa – kation wodoru przyłącza się do bardziej uwodornionego atomu węgla, a grupa hydroksylowa do mniej uwodornionego.
5. Polimeryzacja. Szczególnym przypadkiem dodatku jest reakcja polimeryzacji alkenów:
Ta reakcja addycji zachodzi poprzez mechanizm wolnorodnikowy.
Reakcje utleniania
Jak wszystkie związki organiczne, alkeny spalają się w tlenie, tworząc CO2 i H2O.
W przeciwieństwie do alkanów, które są odporne na utlenianie w roztworach, alkeny łatwo utleniają się pod wpływem wodnych roztworów nadmanganianu potasu. W obojętnych lub lekko zasadowych roztworach alkeny utleniają się do dioli (alkoholi diwodorotlenowych), a grupy hydroksylowe dodaje się do tych atomów, między którymi przed utlenianiem istniało podwójne wiązanie.
Jak już wiesz, nienasycone węglowodory - alkeny mogą wchodzić w reakcje addycji. Większość tych reakcji przebiega na zasadzie addycji elektrofilowej.
dodatek elektrofilowy
Reakcje elektrofilowe to reakcje zachodzące pod wpływem elektrofilów – cząstek, którym brakuje gęstości elektronowej, np. niewypełnionego orbitalu. Najprostszą cząstką elektrofilową jest kation wodoru. Wiadomo, że atom wodoru ma jeden elektron na 3. orbicie. Kation wodorowy powstaje, gdy atom traci ten elektron, zatem kation wodorowy w ogóle nie ma elektronów:
Н· - 1е - -> Н +
W tym przypadku kation ma dość wysokie powinowactwo elektronowe. Połączenie tych czynników sprawia, że kation wodorowy jest dość silną cząstką elektrofilową.
Tworzenie kationu wodorowego jest możliwe podczas elektrolitycznej dysocjacji kwasów:
НВr -> Н + + Вr -
Z tego powodu wiele reakcji elektrofilowych zachodzi w obecności i udziale kwasów.
Jak wspomniano wcześniej, cząstki elektrofilowe działają na układy zawierające obszary o zwiększonej gęstości elektronowej. Przykładem takiego układu jest wiązanie wielokrotne (podwójne lub potrójne) węgiel-węgiel.
Wiadomo już, że atomy węgla, pomiędzy którymi tworzy się wiązanie podwójne, znajdują się w stanie hybrydyzacji sp2. Niehybrydyzowane orbitale p sąsiadujących atomów węgla znajdujących się w tej samej płaszczyźnie nakładają się, tworząc P-wiązanie, które jest słabsze od wiązania Þ i, co najważniejsze, łatwo ulega polaryzacji pod wpływem zewnętrznego pola elektrycznego. Oznacza to, że gdy zbliża się cząstka naładowana dodatnio, elektrony wiązania CS przesuwają się w jej stronę i następuje tzw P- złożony.
Okazało się P-kompleksowy i po dodaniu kationu wodoru P- połączenia. Kation wodoru wydaje się zderzać z gęstością elektronową wystającą z płaszczyzny cząsteczki P-połączenie i przyłącza się do niego. ![]()
W kolejnym etapie następuje całkowite przemieszczenie pary elektronów P-wiązanie z jednym z atomów węgla, co prowadzi do pojawienia się na nim wolnej pary elektronów. Orbital atomu węgla, na którym znajduje się ta para, i niezajęty orbital kationu wodorowego nakładają się, co prowadzi do powstania wiązania kowalencyjnego poprzez mechanizm donor-akceptor. Drugi atom węgla nadal ma niewypełniony orbital, tj. ładunek dodatni.
Powstała cząstka nazywana jest karbokationem, ponieważ zawiera ładunek dodatni na atomie węgla. Cząstka ta może łączyć się z dowolnym anionem, cząstką mającą niewspółdzieloną parę elektronów, czyli nukleofilem.
Rozważmy mechanizm reakcji addycji elektrofilowej na przykładzie bromowodorowania (dodawania bromowodoru) etenu:
СН2= СН2 + НВг --> СНВr-СН3
Reakcja rozpoczyna się od powstania cząstki elektrofilowej – kationu wodoru, która powstaje w wyniku dysocjacji cząsteczki bromowodoru.
Ataki kationów wodorowych P- połączenie, formowanie P- kompleks szybko przekształcający się w karbokation: 
Teraz spójrzmy na bardziej złożony przypadek.
Reakcja addycji bromowodoru do etenu przebiega jednoznacznie, a oddziaływanie bromowodoru z propenem teoretycznie może dać dwa produkty: 1-bromopropan i 2-bromopropan. Dane eksperymentalne pokazują, że wytwarzany jest głównie 2-bromopropan.
Aby to wyjaśnić, będziemy musieli wziąć pod uwagę cząstkę pośrednią - karbokation.
Dodanie kationu wodoru do propenu może prowadzić do powstania dwóch karbokationów: jeśli kation wodoru połączy się z pierwszym atomem węgla, atomem znajdującym się na końcu łańcucha, to drugi będzie miał ładunek dodatni, tj. środek cząsteczki (1); jeśli dołączy do drugiego, wówczas pierwszy atom będzie miał ładunek dodatni (2). 
Preferowany kierunek reakcji będzie zależał od tego, którego karbokationu jest więcej w środowisku reakcji, co z kolei zależy od stabilności karbokationu. Doświadczenie pokazuje, że przeważa tworzenie się 2-bromopropanu. Oznacza to, że w większym stopniu dochodzi do powstawania karbokationu (1) z ładunkiem dodatnim na atomie centralnym.
Większą stabilność tego karbokationu tłumaczy się faktem, że dodatni ładunek na centralnym atomie węgla jest kompensowany przez dodatnie działanie indukcyjne dwóch grup metylowych, których łączny efekt jest większy niż efekt +/- jednej grupy etylowej:
Prawa reakcji hydrohalogenowania alkenów badał słynny rosyjski chemik V.V. Markownikow, uczeń A.M. Butlerowa, który, jak wspomniano powyżej, sformułował regułę noszącą jego imię.
Zasada ta została ustalona empirycznie, to znaczy eksperymentalnie. Obecnie możemy podać całkowicie przekonujące wyjaśnienie tego zjawiska.
Co ciekawe, inne reakcje addycji elektrofilowej również podlegają prawu Markownikowa, dlatego słuszne byłoby sformułowanie go w bardziej ogólnej formie.
W reakcjach addycji elektrofilowej elektrofil (cząstka z niewypełnionym orbitalem) dodaje się do bardziej uwodornionego atomu węgla, a nukleofil (cząstka z wolną parą elektronów) dodaje się do mniej uwodornionego.
Polimeryzacja
Szczególnym przypadkiem reakcji addycji jest reakcja polimeryzacji alkenów i ich pochodnych. Reakcja ta przebiega poprzez mechanizm addycji wolnych rodników:
Polimeryzację prowadzi się w obecności inicjatorów – związków nadtlenkowych, które są źródłem wolnych rodników. Związki nadtlenkowe to substancje, których cząsteczki zawierają grupę -O-O-. Najprostszym związkiem nadtlenkowym jest nadtlenek wodoru HOOH.
W temperaturze 100°C i ciśnieniu 100 MPa następuje homoliza niestabilnego wiązania tlen-tlen i powstawanie rodników – inicjatorów polimeryzacji. Pod wpływem rodników KO inicjowana jest polimeryzacja, która przebiega jako reakcja addycji wolnorodnikowej. Wzrost łańcucha zatrzymuje się, gdy w mieszaninie reakcyjnej następuje rekombinacja rodników - łańcucha polimeru i rodników czyli COCH2CH2-.
Stosując reakcję polimeryzacji wolnorodnikowej substancji zawierających podwójne wiązanie, otrzymuje się dużą liczbę związków o dużej masie cząsteczkowej: 
Zastosowanie alkenów z różnymi podstawnikami umożliwia syntezę szerokiej gamy materiałów polimerowych o szerokim zakresie właściwości. 
Wszystkie te związki polimerowe są szeroko stosowane w różnych obszarach działalności człowieka - przemyśle, medycynie, wykorzystywane do produkcji sprzętu do laboratoriów biochemicznych, niektóre są półproduktami do syntezy innych związków wielkocząsteczkowych.
Utlenianie
Wiadomo już, że w roztworach obojętnych lub lekko zasadowych następuje utlenianie alkenów do dioli (alkoholi dwuwodorotlenowych). W środowisku kwaśnym (roztwór zakwaszony kwasem siarkowym) wiązanie podwójne ulega całkowitemu zniszczeniu, a atomy węgla, pomiędzy którymi istniało wiązanie podwójne, przekształcają się w atomy węgla grupy karboksylowej: 
Do określenia ich struktury można zastosować destrukcyjne utlenianie alkenów. Tak więc, na przykład, jeśli podczas utleniania pewnego alkenu otrzyma się kwas octowy i propionowy, oznacza to, że penten-2 uległ utlenieniu, a jeśli otrzyma się kwas masłowy i dwutlenek węgla, wówczas pierwotnym węglowodorem jest penten-1 .
Aplikacja
Alkeny są szeroko stosowane w przemyśle chemicznym jako surowce do produkcji różnorodnych substancji i materiałów organicznych.
Na przykład eten jest materiałem wyjściowym do produkcji etanolu, glikolu etylenowego, epoksydów i dichloroetanu.
Duża ilość etenu jest przetwarzana na polietylen, z którego wytwarza się folie opakowaniowe, zastawę stołową, rury i materiały elektroizolacyjne.
Z propenu otrzymuje się glicerynę, aceton, izopropanol i rozpuszczalniki. W wyniku polimeryzacji propenu otrzymuje się polipropylen, który pod wieloma względami przewyższa polietylen: ma wyższą temperaturę topnienia i odporność chemiczną.
Obecnie włókna o unikalnych właściwościach produkowane są z polimerów - analogów polietylenu. Na przykład włókno polipropylenowe jest mocniejsze niż wszystkie znane włókna syntetyczne.
Materiały wykonane z tych włókien są obiecujące i są coraz częściej stosowane w różnych obszarach działalności człowieka.

1. Jakie rodzaje izomerii są charakterystyczne dla alkenów? Zapisz wzory możliwych izomerów pentenu-1.
2. Z jakich związków można otrzymać: a) izobuten (2-metylopropen); b) buten-2; c) buten-1? Zapisz równania odpowiednich reakcji.
3. Rozszyfruj następujący łańcuch transformacji. Nazwij związki A, B, C. 4. Zaproponuj metodę otrzymywania 2-chloropropanu z 1-chloropropanu. Zapisz równania odpowiednich reakcji.
5. Zaproponować metodę oczyszczania etanu z zanieczyszczeń etylenowych. Zapisz równania odpowiednich reakcji.
6. Podaj przykłady reakcji, dzięki którym można rozróżnić węglowodory nasycone i nienasycone.
7. Do całkowitego uwodornienia 2,8 g alkenu zużyto 0,896 litra wodoru (niewymienionego). Jaka jest masa cząsteczkowa i wzór strukturalny tego związku, który ma normalny łańcuch atomów węgla?
8. Jaki gaz znajduje się w butli (eten czy propen), jeśli wiadomo, że do całkowitego spalenia 20 cm3 tego gazu potrzebne jest 90 cm3 (n.s.) tlenu?
9*. Gdy alken reaguje z chlorem w ciemności, powstaje 25,4 g dichlorku, a gdy ten alken o tej samej masie reaguje z bromem w czterochlorku węgla, powstaje 43,2 g dibromku. Określ wszystkie możliwe wzory strukturalne wyjściowego alkenu.
Historia odkryć
Z powyższego materiału zrozumieliśmy już, że etylen jest przodkiem homologicznej serii nienasyconych węglowodorów, który ma jedno wiązanie podwójne. Ich wzór to C n H 2n i nazywane są alkenami.
W 1669 roku niemiecki lekarz i chemik Becher jako pierwszy otrzymał etylen w reakcji kwasu siarkowego z alkoholem etylowym. Becher odkrył, że etylen jest bardziej aktywny chemicznie niż metan. Ale niestety w tym czasie naukowiec nie był w stanie zidentyfikować powstałego gazu i dlatego nie nadał mu żadnej nazwy.
Nieco później holenderscy chemicy zastosowali tę samą metodę produkcji etylenu. A ponieważ podczas interakcji z chlorem miał tendencję do tworzenia oleistej cieczy, dlatego otrzymał nazwę „gaz naftowy”. Później okazało się, że tą cieczą był dichloroetan.
W języku francuskim termin „olej” to oléfiant. A po odkryciu innych węglowodorów tego typu Antoine Fourcroix, francuski chemik i naukowiec, wprowadził nowy termin, który stał się powszechny dla całej klasy olefin, czyli alkenów.
Ale już na początku XIX wieku francuski chemik J. Gay-Lussac odkrył, że etanol składa się nie tylko z „ropy” naftowej, ale także z wody. Ponadto ten sam gaz odkryto w chlorku etylu.
I chociaż chemicy ustalili, że etylen składa się z wodoru i węgla i znali już skład tych substancji, długo nie mogli znaleźć jego prawdziwej formuły. I dopiero w 1862 roku E. Erlenmeyerowi udało się udowodnić obecność podwójnego wiązania w cząsteczce etylenu. Zostało to również dostrzeżone przez rosyjskiego naukowca A.M. Butlerowa i potwierdziło eksperymentalnie słuszność tego punktu widzenia.
Występowanie w przyrodzie i fizjologiczna rola alkenów
Wiele osób interesuje się pytaniem, gdzie można znaleźć alkeny w przyrodzie. Okazuje się więc, że praktycznie nie występują one w przyrodzie, gdyż jego najprostszy przedstawiciel, etylen, jest hormonem dla roślin i jest w nich syntetyzowany jedynie w niewielkich ilościach.
Prawdą jest, że w naturze istnieje taki alken jak muskaur. Ten jeden z naturalnych alkenów jest wabikiem seksualnym samic muchy domowej.
Warto zwrócić uwagę na fakt, że przy wysokim stężeniu niższe alkeny mają działanie narkotyczne, które może powodować drgawki i podrażnienie błon śluzowych.
Zastosowania alkenów
Trudno wyobrazić sobie dziś życie współczesnego społeczeństwa bez użycia materiałów polimerowych. Ponieważ w przeciwieństwie do materiałów naturalnych, polimery mają różne właściwości, są łatwe w obróbce, a jeśli spojrzeć na cenę, są stosunkowo tanie. Kolejnym ważnym aspektem przemawiającym na korzyść polimerów jest to, że wiele z nich można poddać recyklingowi.
Alkeny znalazły zastosowanie w produkcji tworzyw sztucznych, gumy, folii, teflonu, alkoholu etylowego, aldehydu octowego i innych związków organicznych.

W rolnictwie stosowany jest jako środek przyspieszający proces dojrzewania owoców. Propylen i butyleny wykorzystuje się do produkcji różnych polimerów i alkoholi. Ale do produkcji kauczuku syntetycznego stosuje się izobutylen. Dlatego możemy stwierdzić, że nie da się obejść bez alkenów, ponieważ są one najważniejszymi surowcami chemicznymi.
Przemysłowe zastosowania etylenu
Na skalę przemysłową propylen wykorzystuje się najczęściej do syntezy polipropylenu oraz do produkcji izopropanolu, gliceryny, aldehydów masłowych itp. Z roku na rok wzrasta zapotrzebowanie na propylen.

4.3.b. Dodatek halogenowodorów (hydrohalogenacja)
Inną ważną reakcją addycji elektrofilowej do alkenów jest od dawna znane hydrohalogenowanie alkenów.
Poniżej znajdują się typowe przykłady dodawania HCl, HBr i HI do różnych alkenów.


Wpływ podstawników alkilowych przy wiązaniu podwójnym na szybkość dodawania opisuje następująca sekwencja:
R2C=CHR > RCH=CHR > RCH=CH2
Jest to zgodne z mechanizmem, w którym etap decydujący o szybkości reakcji obejmuje tworzenie karbokationu w miarę zmniejszania się stabilności kationów alkilowych w kolejności trzeciorzędowej > drugorzędowej > pierwszorzędowej. Zatem mechanizm dodawania musi obejmować utworzenie albo wolnego półproduktu karbokationowego, co jest rzadko obserwowane, albo półproduktu o charakterze karbokationowym. Ostatni przypadek jest najbardziej typowy.
Gdyby dodatek nastąpił poprzez „wolne karbokation”, wówczas reakcja byłaby całkowicie niestereoselektywna, ponieważ kationy alkilowe mają płaską strukturę. Jednakże hydrohalogenowanie z reguły przebiega stereoselektywnie, a w zależności od rodzaju alkenu selektywnie anty-przywiązanie, selektywne syn- lub mieszane syn-anty- przystąpienie.
Jest to charakterystyczne dla alkenów, w których wiązanie podwójne nie jest sprzężone z pierścieniem aromatycznym anty- dodatek halogenowodoru. Anty- dodatek chlorowodoru i bromku, chlorku i bromku deuteru obserwuje się dla cykloheksenu, cyklopentenu, 1,2-dimetyloheksenu, 1,2-dimetylopentenu, cis- I trans-buten-2, heksen-3 i wiele innych prostych alkenów i cykloalkenów.

W produkcie addycji identyczne podstawniki (grupy metylowe) znajdują się po różnych stronach środkowej płaszczyzny pierścienia cykloheksanowego, dlatego należy on do trans-wiersz. Anty-addycja jest trudna do pogodzenia z mechanizmem, w którym zakłada się tworzenie dyskretnego karbokationu. W przypadku płaskiego karbokationu atak nukleofilowy jonu halogenkowego jest równie prawdopodobny po obu stronach płaszczyzny, co powinno prowadzić do powstania mieszaniny produktów syn- I anty- przystąpienia. Kinetyka hydrohalogenacji alkenu wskazuje również na bardziej złożony mechanizm dodawania. Dla niesprzężonych alkenów szybkość reakcji opisuje równanie trzeciego rzędu z drugim rzędem w halogenowodorze, tj. odpowiada mechanizmowi Ad E 3.
v = k [alken] 2
Reakcja antyaddycji i reakcji drugiego rzędu na halogenowodorze dobrze zgadza się z mechanizmem Ad E 3, w którym alken reaguje z dwiema cząsteczkami halogenowodoru, z których jedna działa jako środek elektrofilowy, a druga jako środek nukleofilowy.

Ten mechanizm trójcząsteczkowy zakłada, że początkowo tworzy się kompleks alkenu i jednej cząsteczki halogenowodoru, po czym następuje atak drugiej cząsteczki HX na ten kompleks za pomocą anty-boki bez tworzenia dyskretnego karbokationu. Należy szczególnie zauważyć, że każdy mechanizm trójcząsteczkowy musi składać się z dwóch kolejnych etapów, ponieważ zderzenie trzech cząsteczek jednocześnie jest niezwykle mało prawdopodobne.

Przeciwdziałanie addycji wskazuje na preferencyjny atak nukleofilowy halogenowodoru ze strony przeciwnej do miejsca, w którym alken jest protonowany. Zamiast halogenowodoru funkcję środka nukleofilowego w końcowym etapie może pełnić także jon halogenkowy. Rzeczywiście, szybkość reakcji zwykle wzrasta wprost proporcjonalnie do stężenia jonu halogenkowego wprowadzonego do mieszaniny reakcyjnej w postaci halogenków tetraalkiloamoniowych NR 4+ X - lub lit LiX. W tym przypadku stereospecyficzny anty- przystąpienie.
Jest to charakterystyczne dla alkanów, w których wiązanie podwójne jest sprzężone z pierścieniem aromatycznym syn- akcesyjne lub mieszane syn-anty- dodatek halogenowodoru, na przykład:

Dodawanie Syn jest dominującym procesem cis- I trans-izomery 1-fenylopropenu, 1-fenylo-4-alkilocykloheksenów, acenaftylenu, indenu. Kiedy takie alkeny są protonowane, tworzą się karbokationy typu benzylowego, które są bardziej stabilne niż kationy czysto alkilowe, które powstają podczas protonowania zwykłych alkenów i cykloalkenów. Kinetykę reakcji w tym przypadku opisuje się zwykle prostszym równaniem drugiego rzędu v = k[alken], czyli odpowiada to dwumolekularnemu mechanizmowi Ad E 2. Mechanizm Ad E 2 polega na tworzeniu pary jonowej obejmującej karbokation i jon halogenkowy.

Nie można oczekiwać, że mechanizm dodawania z udziałem par jonowych będzie wysoce stereoselektywny. Jeśli para jonowa zostanie przekształcona w produkt końcowy szybciej, niż jest w stanie obrócić się wokół pojedynczego wiązania węgiel-węgiel, efektem końcowym będzie syn-addycja, w której proton i jon halogenkowy są dodawane po tej samej stronie wiązania podwójnego. W przeciwnym razie powstawanie produktów takich jak syn- Więc anty- podłączenie NH. Przypadek ten ma miejsce podczas hydrohalogenacji para-podstawiony styren Z-C 6H 4 -CH=CH2. Zaobserwowany tutaj wzór jest taki syn-addycja jest typowa tylko dla tych olefin, które po protonowaniu dają stosunkowo trwałe karbokation, tj. w przypadku podstawników Z-donora.
Reakcje hydrohalogenacji przebiegające według mechanizmu Ad E 2 charakteryzują się współzawodnictwem pomiędzy procesami dodawania koniugatu i przegrupowania, ponieważ jako związek pośredni tworzy się karbokation lub para jonowa.

Jako przykład przegrupowań z 1,2-migracją grupy alkilowej i jonu wodorkowego przedstawiamy reakcje hydrohalogenowania odpowiednio tert-butyloetylenu i izopropyloetylenu.

Gdy tę samą reakcję prowadzi się bez rozpuszczalnika na zimno (-78 0 C), tworzy się mieszanina 33% normalnych i 67% nieprawidłowych (przegrupowanych) produktów addycji.

4.3.c. Orientacja. Reguła Markownikowa
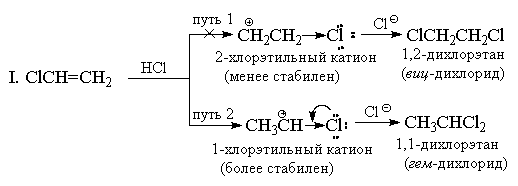
W przeciwieństwie do symetrycznych elektrofilów (Hal 2), halogenowodory są niesymetrycznymi odczynnikami elektrofilowymi. Dodanie dowolnego niesymetrycznego elektrofila (HBr, ICl, H2O, Hg(OAc)2 itp.) do niesymetrycznego alkenu mogłoby w zasadzie spowodować powstanie mieszaniny dwóch alternatywnych produktów, ale w praktyce zwykle tworzy się tylko jeden z nich. Jako przykład rozważmy dodanie bromowodoru do propylenu.

Już w 1870 r. V.V. Markovnikov sformułował empiryczną regułę, zgodnie z którą niesymetryczne alkeny dodają HX w taki sposób, że preferencyjnie powstaje produkt, w którym wodór dodaje się do najmniej podstawionego końca, a X do najbardziej podstawionego końca wiązania podwójnego.
Regułę Markownikowa zwykle wyjaśnia się różnicą w stabilności dwóch alternatywnych karbokationów. Na przykład w powyższym przykładzie normalne N Kation -propylowy jest znacznie mniej stabilny niż kation izopropylowy, dlatego reakcja przebiega drugą drogą.
Reguła Markownikowa była pierwotnie stosowana tylko w przypadkach dodawania HX do substratów węglowodorowych, ale w zasadzie można ją rozszerzyć na reakcje innych podstawionych alkenów. Zatem dodanie HCl do CF3CH=CH2 daje „ anty-Markovnikov” produkt CF 3 CH 2 CH 2 Cl. Tego można było się spodziewać, ponieważ kation CF 3 CH+ CH 3 jest mniej stabilny niż kation CF 3 CH 2 CH 2+ ze względu na silny efekt (-I) Grupa CF 3 W przeważającej mierze powstaje kation CF 3 CH 2 CH 2+, ale ulega on także, choć w mniejszym stopniu, destabilizacji przez indukcyjne działanie grupy CF 3, w wyniku czego dodatek HCl do trifluorometyloetylenu znacznie wolniejszy niż dodatek do niepodstawionego etylenu.
Z podobnego powodu kationy winylotrialkiloamoniowe dodają HBr również wbrew zasadzie Markownikowa:
Dodanie HX do alkenów posiadających mocne (-I) i (-M) podstawniki, np. do akrylonitrylu lub nitroetylenu, również powinno być sprzeczne z regułą Markownikowa. Jednak w tym przypadku wiązanie podwójne jest tak silnie dezaktywowane w stosunku do odczynników elektrofilowych, że reakcje te zachodzą tylko w bardzo rygorystycznych warunkach. Chlorek winylu CH 2 = CHCl zawsze daje wyłącznie „addukty Markownikowa”. Na przykład, gdy reaguje z HCl, powstaje tylko 1,1-dichloroetan (dichlorek geminalu) CH3CHCl2. Chlor, podobnie jak grupa CF 3, ma silny efekt (-I) i na pierwszy rzut oka wydaje się, że z tego powodu dodatek powinien mieć orientację antyMarkownikowową, ponieważ kation + CH 2 CH 2 Cl powinien być bardziej stabilny niż kation CH 3 CH + Cl. Jednak w przeciwieństwie do grupy CF 3, chlor oprócz efektu (-I) ma również działanie przeciwdziałające (+M) (ponieważ ma wolne pary). Doświadczenie pokazuje, że wielkość efektu mezomerycznego jest wystarczająca, aby obniżyć energię kationu 1-chloroetylowego poniżej poziomu energetycznego kationu 2-chloroetylowego, w którym efekt +M nie objawia się.
II. Z punktu widzenia teorii rezonansu strukturę kationu 1-chloroetylowego można przedstawić w następujący sposób:
Jednakże addycja do chlorku winylu zachodzi wolniej niż do etylenu w tych samych warunkach, tj. zgodnie z efektem ogólnym (-I > +M) chlor pozostaje podstawnikiem odciągającym elektrony w porównaniu z wodorem, a kation 1-chloroetylowy jest mniej stabilny niż C2H5+. Inne halogenki winylu reagują w podobny sposób z HX.
Etery winylowe CH 2 = CHOR dodają HX (X = Hal) zgodnie z regułą Markownikowa w znacznie większym stopniu niż wszystkie wymienione powyżej podstawione alkeny. Wynika to ze znacznego efektu +M grupy RO. W przeciwieństwie do atomu chloru, grupa RO pod względem całkowitego efektu elektronowego (+M > -I) jest silnym podstawnikiem oddającym elektrony, który skutecznie stabilizuje sąsiednie centrum karbokationu. Strukturę karbokationu w tym przypadku można również przedstawić jako zbiór dwóch struktur rezonansowych
Atak kationu oksoniowego przez anion halogenkowy prowadzi do powstania eterów α-halogenowych typu CH3CH(Hal)OR.
4.3.g. Hydratacja alkenów
Katalizowana kwasem hydratacja alkenów prowadzi do powstania alkoholi. Kierunek hydratacji alkenów określa reguła Markownikowa, dlatego przyjmuje się, że w tej reakcji powstaje karbokation jako cząstka pośrednia.
Tendencja drugorzędowych karbokationów alkilowych do zmiany układu uniemożliwia zastosowanie hydratacji alkenów do wytworzenia drugorzędowych alkoholi.

Metoda ta znalazła ograniczone zastosowanie w laboratorium jedynie do wytwarzania alkoholi trzeciorzędowych. Reakcja hydratacji jest w tym przypadku w dużej mierze odwracalna i trzeciorzędowe alkohole powstają z niską wydajnością (40-45%).


Hydratacja najprostszych alkenów – etylenu i propylenu – jest ważną metodą przemysłową produkcji alkoholi etylowych i izopropylowych.

W praktyce laboratoryjnej bezpośrednie uwodnienie alkenów nie znalazło szerokiego zastosowania, zarówno ze względu na trudne warunki, jak i powstawanie znacznej ilości alkoholi izomerycznych. Obecnie pokrewną reakcję hydroksymerkuracji – demerkurację – wykorzystuje się zwykle do regioselektywnego wytwarzania alkoholi z alkenów.
4.3.d. Hydroksymerkuracja-demerkuracja
Atak elektrofilowy na wiązanie podwójne alkenu może zostać przeprowadzony przez jony metali, wśród których kation rtęci(II) zajmuje szczególne miejsce. Octan rtęci w bardzo łagodnych warunkach w temperaturze 20°C dodaje się do alkenów w wodnym roztworze tetrahydrofuranu (THF) lub wodnym roztworze kwasu octowego, tworząc organiczne związki rtęci. Dodanie octanu rtęci do wiązania podwójnego przebiega regiospecyficznie, ściśle według reguły Markownikowa, tj. kation rtęci przyłącza się do najmniej podstawionego atomu węgla.
Wiązanie C-Hg w związkach rtęci organicznych można łatwo rozerwać pod wpływem borowodorku sodu NaBH4, tworząc rtęć i nowe wiązanie C-H. Zakłada się, że wodorek alkilortęciowy otrzymuje się jako niestabilny półprodukt, który ulega dalszemu rozkładowi z uwolnieniem rtęci metalicznej na drodze mechanizmu rodnikowego.

W sumie ten dwuetapowy proces hydroksymerkuracji-demerkuracji ostatecznie reprezentuje regiospecyficzną hydratację alkenu zgodnie z regułą Markownikowa w wyjątkowo łagodnych warunkach, gdy tworzenie się produktów ubocznych jest zredukowane do możliwie największego minimum. Można to jasno zilustrować na podstawie poniższych przykładów, w których całkowita wydajność produktów reakcji wynosi 90-98%. Podane dane cyfrowe w tym przypadku nie wskazują wydajności otrzymanych związków, ale ich stosunek w mieszaninie.




Jak widać z powyższych przykładów, hydroksymerkuracja-demerkuracja alkenów w większości przypadków zapewnia regiospecyficzne uwodnienie alkenów z utworzeniem prawie tylko jednego z dwóch izomerycznych alkoholi. Należy zaznaczyć, że nie ma potrzeby izolowania związku rtęci organicznej i oba procesy można prowadzić bezpośrednio jeden po drugim.
Hydroksymerkuracja niesymetrycznych alkenów najwyraźniej zaczyna się od ataku kationu AcOHg + i utworzenia jako półproduktu niesymetrycznego cyklicznego kationu rtęci (analog niesymetrycznego jonu halogenowego), który następnie zostaje otwarty co najwyżej w wyniku nukleofilowego ataku wody podstawiony atom węgla, który niesie większy ładunek dodatni.

Mostkujący jon rtęci można utrwalić w nienukleofilowym, silnie kwaśnym środowisku nawet w temperaturze 20 0 C, dodając silniejszy środek elektrofilowy – trifluorooctan rtęci w mieszaninie kwasu fluorosulfonowego i pięciofluorku antymonu.

Kation rtęciowy może zostać rozłożony nie tylko pod działaniem wody, ale także innych rozpuszczalników oddających elektrony: alkoholi, kwasu octowego, acetonitrylu itp. Końcowym produktem reakcji będą w tym przypadku etery, octany lub N-podstawione amidy odpowiednio kwas octowy, na przykład:


Gdy w reakcji alkoksymerkuracji-odbarwiania stosuje się rozgałęzione drugorzędowe lub trzeciorzędowe alkohole, trifluorooctan Hg(OCOCF 3) 2 lub trifluorometanu rtęci Hg(OSO 2 CF 3) 2 są bardziej skuteczne niż octan rtęci.

Zatem odmerkurowanie hydroksy- i alkoksymerkuracji jest jedną z najlepszych metod preparatywnych w syntezie alkoholi i eterów z rozgałęzionymi rodnikami alkilowymi.
Dodatek soli rtęci do alkenów jest najbardziej uderzającym przykładem reakcji addycji koniugatu do wiązania podwójnego, gdzie rolę zewnętrznego czynnika nukleofilowego pełni rozpuszczalnik. Stereochemia procesu podwójnej hydroksymerkuracji i demerkuracji zależy od stereochemicznego wyniku każdego pojedynczego etapu. Hydroksymerkuracja charakteryzuje się anty-addycja, jak w przypadku innych reakcji z udziałem cyklicznego kationu. Jednakże radykalna demerkuracja nie jest wysoce stereoselektywna. Dlatego cały proces jako całość jest również niestereospecyficzny.
4.3.e. Dodatek alkenów (dimeryzacja kationowa i polimeryzacja alkenów)
Najciekawszym przykładem tego typu reakcji jest dimeryzacja i polimeryzacja izobutylenu w obecności kwasu siarkowego.

Techniczna nazwa tej mieszaniny alkenów to „diizobutylen”. Reakcja ta przebiega według mechanizmu kationowego, podobnego do mechanizmu dodawania kwasów mineralnych do podwójnego wiązania alkenów. W pierwszym etapie proton przyłącza się do cząsteczki izobutylenu, tworząc stosunkowo stabilną substancję tert-kation butylowy. Dalsze formowanie tert kation -butylowy (kwas Lewisa) reaguje z cząsteczką izobutylenu (zasada Lewisa), tworząc nowy stabilny trzeciorzędowy kation oktylowy.

W tych warunkach pod działaniem zasad (jonów H 2 O, HSO 4) karbokation oktylowy szybko traci proton i zamienia się w mieszaninę izomerycznych pentenów, ponieważ abstrakcja protonów zachodzi z dwóch różnych pozycji:

Preferencyjne powstawanie mniej stabilnego termodynamicznie alkenu – 2,4,4-trimetylopentenu-1 (80% w mieszaninie reakcyjnej) wiąże się z większą przestrzenną dostępnością ataku zasadowych atomów wodoru grup metylowych w porównaniu do wodoru atomy grupy metylenowej. Na skalę przemysłową „diizobutylen” uwodornia się za pomocą Ni-Raneya w celu wytworzenia „izooktanu” (techniczna nazwa węglowodoru 2,2,4-trimetylopentanu), stosowanego jako wysokooktanowe paliwo do silników spalinowych.
Przy wysokich stężeniach kwasu siarkowego (ponad 80%) zachodzi kationowa polimeryzacja izobutylenu, tworząc polimer zwany poliizobutylenem (-CH 2 C(CH 3) 2 -) n. Ten gumopodobny polimer służy do wytwarzania powłok antykorozyjnych i wodoodpornych, uszczelniaczy itp.
Oprócz izobutylenu, w procesie kationowym polimeryzacji ulegają 3-metylobuten-1, etery winylowe i niektóre pochodne styrenu, zdolne do tworzenia stosunkowo stabilnych karbokationów. Fluorowodór i kwasy Lewisa stosuje się także jako katalizatory polimeryzacji kationowej: BF 3, AlCl 3, AlBr 3 itp. w obecności bardzo małych ilości wody.
4.3.g. Dodatek alkanów (alkilowanie alkenów)
Inna przemysłowa metoda syntezy „izooktanu” opiera się na reakcji izobutylenu z nadmiarem izobutanu w obecności stężonego kwasu siarkowego lub w bezwodnym fluorowodorze w temperaturze 0,10 0 C.

Reakcja ta również przebiega według mechanizmu kationowego i, co szczególnie interesujące, jest przykładem łańcuchowego procesu kationowego. Po pierwsze, izobutylen dimeryzuje w warunkach reakcji, tworząc trzeciorzędowy kation oktylowy (CH 3) 3 CCH 2 C + (CH 3) 2. Mechanizm jego powstawania opisano szczegółowo w poprzednim rozdziale. Następnie następuje szybkie przeniesienie wodoru (w postaci jonu wodorkowego) z izobutanu do kationu oktylowego z wytworzeniem cząsteczki „izooktanu” i nowego kationu tert-butylowego, który z kolei szybko reaguje z izobutylenem tworząc nowy kation oktylowy itp.

Oprócz syntezy „izooktanu” tę metodę alkilowania wykorzystuje się w przemyśle petrochemicznym do syntezy wysokowrzących rozgałęzionych węglowodorów z rozgałęzionych alkenów i niskowrzących alkanów z wykorzystaniem frakcji krakingu termicznego.
ALKENY
Nazywa się węglowodory, w których cząsteczce oprócz prostych wiązań węgiel-węgiel i węgiel-wodór występują wiązania węgiel-węgiel π Nieograniczony. Ponieważ utworzenie wiązania π jest formalnie równoznaczne z utratą dwóch atomów wodoru przez cząsteczkę, węglowodory nienasycone zawierają 14:00 jest mniej atomów wodoru niż te ograniczające, gdzie P - liczba wiązań π:
Szereg, którego elementy różnią się od siebie o (2H) n, nazywa się szereg izoologiczny. Zatem na powyższym schemacie izologami są heksany, hekseny, heksadieny, heksyny, heksatrieny itp.
Nazywa się węglowodory zawierające jedno wiązanie π (tj. wiązanie podwójne). alkeny (olefiny) lub według pierwszego członka serii - etylen, węglowodory etylenowe. Ogólny wzór ich szeregu homologicznego to CpH2l.
1. Nazewnictwo
Zgodnie z zasadami IUPAC przy konstruowaniu nazw alkenów najdłuższemu łańcuchowi węglowemu zawierającemu wiązanie podwójne podaje się nazwę odpowiedniego alkanu, w którym kończy się -jakiś zastąpione przez -en.Łańcuch ten numeruje się w taki sposób, aby atomy węgla biorące udział w tworzeniu wiązania podwójnego otrzymały najniższe możliwe numery:

Rodniki są nazywane i numerowane jak w przypadku alkanów.
W przypadku alkenów o stosunkowo prostej budowie dopuszczalne są prostsze nazwy. Dlatego niektóre z najczęściej występujących alkenów nazywane są przez dodanie przyrostka -en do nazwy rodnika węglowodorowego o tym samym szkielecie węglowym:
Rodniki węglowodorowe powstałe z alkenów otrzymują przyrostek -enil. Numeracja rodnika zaczyna się od atomu węgla mającego wolną wartościowość. Jednak w przypadku najprostszych rodników alkenylowych zamiast nazw systematycznych można używać nazw trywialnych:

Często nazywane są atomami wodoru bezpośrednio związanymi z nienasyconymi atomami węgla, tworzącymi wiązanie podwójne atomy wodoru winylu,
2. Izomeria
Oprócz izomerii szkieletu węglowego w szeregu alkenów pojawia się także izomeria położenia wiązania podwójnego. Ogólnie rzecz biorąc, ten typ izomerii jest izomeria pozycji podstawnika (funkcja)- obserwowane we wszystkich przypadkach, gdy cząsteczka zawiera jakiekolwiek grupy funkcyjne. W przypadku alkanu C4H10 możliwe są dwa izomery strukturalne:
W przypadku alkenu C4H8 (butenu) możliwe są trzy izomery:

Buten-1 i buten-2 są izomerami pozycji funkcji (w tym przypadku jej rolę pełni wiązanie podwójne).
Izomery przestrzenne różnią się przestrzennym rozmieszczeniem podstawników względem siebie i nazywane są izomery cis, jeśli podstawniki znajdują się po tej samej stronie wiązania podwójnego, oraz izomery trans, jeśli po przeciwnych stronach:

3. Struktura wiązania podwójnego
Energia rozszczepienia cząsteczki przy wiązaniu podwójnym C=C wynosi 611 kJ/mol; ponieważ energia wiązania CC σ wynosi 339 kJ/mol, energia rozerwania wiązania π wynosi tylko 611-339 = 272 kJ/mol. π -elektrony są znacznie lżejsze od σ -elektronów i są podatne na działanie np. rozpuszczalników polaryzujących czy działanie jakichkolwiek atakujących odczynników. Wyjaśnia to różnica w symetrii rozkładu chmury elektronowej elektronów σ i π. Maksymalne nakładanie się orbitali p, a co za tym idzie, minimalna energia swobodna cząsteczki są realizowane tylko przy płaskiej strukturze fragmentu winylowego i przy skróconej odległości C-C równej 0,134 nm, tj. znacznie mniejsza niż odległość między atomami węgla połączonymi pojedynczym wiązaniem (0,154 nm). W miarę jak „połówki” cząsteczki obracają się względem siebie wzdłuż osi wiązań podwójnych, stopień nakładania się orbit maleje, co wiąże się ze zużyciem energii. Konsekwencją tego jest brak swobodnej rotacji wzdłuż osi wiązania podwójnego i istnienie izomerów geometrycznych z odpowiednim podstawieniem przy atomach węgla.
Alkeny- węglowodory nienasycone, które zawierają jedno wiązanie podwójne. Przykłady alkenów:

Metody otrzymywania alkenów.
1. Kraking alkanów w temperaturze 400-700°C. Reakcja zachodzi poprzez mechanizm wolnorodnikowy:

2. Odwodornienie alkanów:
3. Reakcja eliminacji (eliminacja): 2 atomy lub 2 grupy atomów są eliminowane z sąsiednich atomów węgla i powstaje wiązanie podwójne. Takie reakcje obejmują:
A) Odwadnianie alkoholi (ogrzewanie powyżej 150°C, z udziałem kwasu siarkowego jako odwadniacza):
B) Eliminacja halogenowodorów pod wpływem alkoholowego roztworu alkalicznego:

Atom wodoru jest oddzielany preferencyjnie od atomu węgla, który jest związany z mniejszą liczbą atomów wodoru (atom najmniej uwodorniony) - Reguła Zajcewa.
B) Dehalogenacja:

Właściwości chemiczne alkenów.
O właściwościach alkenów decyduje obecność wiązania wielokrotnego, dlatego alkeny wchodzą w reakcje addycji elektrofilowej, które zachodzą w kilku etapach (H-X - odczynnik):
I etap:

II etap:
 .
.
Jon wodoru w tego typu reakcji należy do atomu węgla, który ma bardziej ładunek ujemny. Rozkład gęstości to:

Jeśli podstawnikiem jest donor, co objawia się efektem +I-, wówczas gęstość elektronów przesuwa się w stronę najbardziej uwodornionego atomu węgla, tworząc na nim częściowo ujemny ładunek. Reakcje przebiegają zgodnie Reguła Markownikowa: podczas łączenia cząsteczek polarnych, takich jak NH (HCl, HCN, HOH itp.) do niesymetrycznych alkenów, wodór przyłącza się preferencyjnie do bardziej uwodornionego atomu węgla przy podwójnym wiązaniu.
A) Reakcje addycji:
1) Hydrohalogenacja:
Reakcja jest zgodna z regułą Markownikowa. Ale jeśli w reakcji obecny jest nadtlenek, zasada nie jest brana pod uwagę:
2) Nawodnienie. Reakcja przebiega zgodnie z regułą Markownikowa w obecności kwasu fosforowego lub siarkowego:

3) Halogenowanie. W rezultacie woda bromowa ulega odbarwieniu - jest to jakościowa reakcja na wiązanie wielokrotne:
4) Uwodornienie. Reakcja zachodzi w obecności katalizatorów.



