Alkene sind chemisch aktiv. Ihre chemischen Eigenschaften werden maßgeblich durch das Vorhandensein einer Doppelbindung bestimmt. Die häufigsten Reaktionen für Alkene sind elektrophile Additionen und radikalische Additionsreaktionen. Nukleophile Additionsreaktionen erfordern normalerweise die Anwesenheit eines starken Nukleophils und sind für Alkene nicht typisch. Alkene gehen leicht Oxidations- und Additionsreaktionen ein und sind auch zur Substitution durch Arylradikale fähig.
Additionsreaktionen
Hydrierung Die Addition von Wasserstoff (Hydrierungsreaktion) an Alkene erfolgt in Gegenwart von Katalysatoren. Am häufigsten werden zerkleinerte Metalle verwendet – Platin, Nickel, Palladium usw. Dadurch entstehen die entsprechenden Alkane (gesättigte Kohlenwasserstoffe).
$CH_2=CH_2 + H2 → CH_3–CH_3$
Zusatz von Halogenen. Alkene reagieren unter normalen Bedingungen leicht mit Chlor und Brom und bilden die entsprechenden Dihalogenalkane, in denen sich Halogenatome an benachbarten Kohlenstoffatomen befinden.
Anmerkung 1
Wenn Alkene mit Brom interagieren, verfärbt sich Brom gelbbraun. Dies ist eine der ältesten und qualitativ einfachsten Reaktionen für ungesättigte Kohlenwasserstoffe, da auch Alkine und Alkadiene ähnlich reagieren.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
Zugabe von Halogenwasserstoffen. Bei der Wechselwirkung von Ethylenkohlenwasserstoffen mit Halogenwasserstoffen ($HCl$, $HBr$) entstehen Halogenalkane; die Richtung der Reaktion hängt von der Struktur der Alkene ab.
Bei Ethylen oder symmetrischen Alkenen verläuft die Additionsreaktion eindeutig und führt zur Bildung nur eines Produkts:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
Bei unsymmetrischen Alkenen ist die Bildung zweier unterschiedlicher Additionsprodukte möglich:
Anmerkung 2
Tatsächlich entsteht hauptsächlich nur ein Reaktionsprodukt. Das Muster in der Richtung solcher Reaktionen wurde vom russischen Chemiker V.V. Markownikow im Jahr 1869 Es wird Markownikows Herrschaft genannt. Bei der Reaktion von Halogenwasserstoffen mit unsymmetrischen Alkenen wird ein Wasserstoffatom an der Stelle der Doppelbindungsspaltung am am stärksten hydrierten Kohlenstoffatom angefügt, also bevor es mit einer großen Anzahl von Wasserstoffatomen verbunden wird.
Markownikow formulierte diese Regel auf der Grundlage experimenteller Daten und erhielt erst viel später eine theoretische Begründung. Betrachten Sie die Reaktion von Propylen mit Chlorwasserstoff.
Eines der Merkmale der $p$-Anleihe ist ihre Fähigkeit, leicht polarisiert zu werden. Unter dem Einfluss der Methylgruppe (positiver induktiver Effekt + $I$) im Propenmolekül verschiebt sich die Elektronendichte der $p$-Bindung zu einem der Kohlenstoffatome (= $CH_2$). Dadurch entsteht darauf eine teilweise negative Ladung ($\delta -$). Am anderen Kohlenstoffatom der Doppelbindung erscheint eine teilweise positive Ladung ($\delta +$).
Diese Verteilung der Elektronendichte im Propylenmolekül bestimmt den Ort des zukünftigen Protonenangriffs. Dies ist das Kohlenstoffatom der Methylengruppe (= $CH_2$), das eine teilweise negative $\delta-$-Ladung trägt. Und Chlor greift dementsprechend ein Kohlenstoffatom mit einer teilweise positiven Ladung $\delta+$ an.
Infolgedessen ist das Hauptprodukt der Reaktion von Propylen mit Chlorwasserstoff 2-Chlorpropan.
Flüssigkeitszufuhr
Die Hydratation von Alkenen erfolgt in Gegenwart von Mineralsäuren und gehorcht der Markownikow-Regel. Die Reaktionsprodukte sind Alkohole
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Alkylierung
Die Addition von Alkanen an Alkene in Gegenwart eines Säurekatalysators ($HF$ oder $H_2SO_4$) bei niedrigen Temperaturen führt zur Bildung von Kohlenwasserstoffen mit höherem Molekulargewicht und wird in der Industrie häufig zur Herstellung von Kraftstoffen verwendet
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Oxidationsreaktionen
Die Oxidation von Alkenen kann je nach Bedingungen und Art der Oxidationsreagenzien sowohl unter Spaltung der Doppelbindung als auch unter Erhalt des Kohlenstoffgerüsts erfolgen:
Polymerisationsreaktionen
Alkenmoleküle sind unter bestimmten Bedingungen in der Lage, sich unter der Öffnung von $\pi$-Bindungen und der Bildung von Dimeren, Trimeren oder hochmolekularen Verbindungen – Polymeren – zu addieren. Die Polymerisation von Alkenen kann entweder über ein freies Radikal oder über einen Kation-Anion-Mechanismus erfolgen. Als Polymerisationsinitiatoren dienen Säuren, Peroxide, Metalle etc. Die Polymerisationsreaktion erfolgt auch unter Einfluss von Temperatur, Strahlung und Druck. Ein typisches Beispiel ist die Polymerisation von Ethylen zu Polyethylen
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Substitutionsreaktionen
Substitutionsreaktionen sind für Alkene nicht typisch. Allerdings werden bei hohen Temperaturen (über 400 °C) radikalische Additionsreaktionen, die reversibel sind, unterdrückt. In diesem Fall wird es möglich, das in Allylstellung befindliche Wasserstoffatom unter Beibehaltung der Doppelbindung zu ersetzen
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Wissens-Hypermarkt >>Chemie >>Chemie 10. Klasse >> Chemie: Alkene
Ungesättigt sind Kohlenwasserstoffe, die in ihren Molekülen mehrere Bindungen zwischen Kohlenstoffatomen enthalten. Ungesättigt sind Alkene, Alkine, Alkadiene (Polyene). Auch zyklische Kohlenwasserstoffe mit einer Doppelbindung im Ring (Cycloalkene) sowie Cycloalkane mit wenigen Kohlenstoffatomen im Ring (drei oder vier Atome) haben einen ungesättigten Charakter. Die Eigenschaft der „Unsättigung“ ist mit der Fähigkeit dieser Stoffe verbunden, Additionsreaktionen, vor allem Wasserstoff, unter Bildung gesättigter oder gesättigter Kohlenwasserstoffe – Alkane – einzugehen.
Struktur
Alkene sind azyklisch, enthalten im Molekül neben Einfachbindungen eine Doppelbindung zwischen Kohlenstoffatomen und entsprechen der allgemeinen Formel C n H 2n.
Alkene erhielten ihren zweiten Namen – „Olefine“ in Analogie zu ungesättigten Fettsäuren (Ölsäure, Linolsäure), deren Reste Teil flüssiger Fette – Öle (vom englischen Öl – Öl) sind.
Wie Sie wissen, befinden sich Kohlenstoffatome, zwischen denen sich eine Doppelbindung befindet, in einem Zustand der sp 2 -Hybridisierung. Dies bedeutet, dass ein s- und zwei p-Orbitale an der Hybridisierung beteiligt sind und ein p-Orbital unhybridisiert bleibt. Die Überlappung der Hybridorbitale führt zur Bildung einer a-Bindung und aufgrund der unhybridisierten -Orbitale der benachbarten Kohlenstoffatome des Ethylenmoleküls entsteht eine zweite, P-Verbindung. Somit besteht eine Doppelbindung aus einer Þ-Bindung und einer p-Bindung.
Die Hybridorbitale der Atome, die eine Doppelbindung bilden, liegen in derselben Ebene, und die Orbitale, die eine n-Bindung bilden, stehen senkrecht zur Ebene des Moleküls (siehe Abb. 5).
Die Doppelbindung (0,132 nm) ist kürzer als die Einfachbindung und ihre Energie ist höher, also stärker. Dennoch führt das Vorhandensein einer beweglichen, leicht polarisierbaren 7g-Bindung dazu, dass Alkene chemisch aktiver sind als Alkane und zu Additionsreaktionen fähig sind.
Homologe Reihe von Ethen
Geradkettige Alkene bilden die homologe Reihe des Ethens (Ethylen).
C2H4 – Ethen, C3H6 – Propen, C4H8 – Buten, C5H10 – Penten, C6H12 – Hexen usw.
Isomerie und Nomenklatur
Alkene zeichnen sich wie Alkane durch Strukturisomerie aus. Strukturisomere unterscheiden sich, wie Sie sich erinnern, in der Struktur des Kohlenstoffgerüsts. Das einfachste Alken, das durch Strukturisomere gekennzeichnet ist, ist Buten.
CH3-CH2-CH=CH2 CH3-C=CH2
l
CH3
Buten-1-methylpropen
Eine Sonderform der Strukturisomerie ist die Positionsisomerie der Doppelbindung:
CH3-CH2-CH=CH2 CH3-CH=CH-CH3
Buten-1 Buten-2
Um eine einzelne Kohlenstoff-Kohlenstoff-Bindung ist eine nahezu freie Rotation der Kohlenstoffatome möglich, sodass Alkanmoleküle eine große Vielfalt an Formen annehmen können. Eine Drehung um die Doppelbindung ist unmöglich, was zum Auftreten einer anderen Art von Isomerie bei Alkenen führt – geometrisch oder cis-trans-Isomerie.
Cis-Isomere unterscheiden sich von Thorax-Isomeren durch die räumliche Anordnung der Molekülfragmente (in diesem Fall Methylgruppen) relativ zur Ebene P-Verbindungen und damit Eigenschaften.
Alkene sind isomer zu Cycloalkanen (Interklassenisomerie), zum Beispiel:
CH2 = CH-CH2-CH2-CH2-CH3
Hexen-1-Cyclohexan
Nomenklatur Alkene Die von der IUPAC entwickelte Nomenklatur ähnelt der Nomenklatur der Alkane.
1. Auswahl des Hauptstromkreises
Die Bildung des Namens eines Kohlenwasserstoffs beginnt mit der Definition der Hauptkette – der längsten Kette von Kohlenstoffatomen im Molekül. Bei Alkenen muss die Hauptkette eine Doppelbindung enthalten.
2. Nummerierung der Atome der Hauptkette
Die Nummerierung der Atome der Hauptkette beginnt an dem Ende, dem die Doppelbindung am nächsten liegt. Der korrekte Verbindungsname lautet beispielsweise
dn3-dn-dn2-dn=dn-dn3 dn3
5-Methylhexen-2, nicht 2-Methylhexen-4, wie man erwarten könnte.
Wenn die Position der Doppelbindung den Beginn der Nummerierung der Atome in der Kette nicht bestimmen kann, wird sie wie bei gesättigten Kohlenwasserstoffen durch die Position der Substituenten bestimmt.
CH3-CH2-CH=CH-CH-CH3
l
CH3
2-Methylhexen-3
3. Bildung des Namens
Die Namen von Alkenen werden auf die gleiche Weise gebildet wie die Namen von Alkanen. Geben Sie am Ende des Namens die Nummer des Kohlenstoffatoms an, an dem die Doppelbindung beginnt, und das Suffix, das angibt, dass die Verbindung zur Klasse der Alkene gehört, nämlich -en.
Quittung
1. Cracken von Erdölprodukten. Beim thermischen Cracken gesättigter Kohlenwasserstoffe kommt es neben der Bildung von Alkanen auch zur Bildung von Alkenen.
2. Dehydrierung gesättigter Kohlenwasserstoffe. Wenn Alkane bei hohen Temperaturen (400–600 °C) über einen Katalysator geleitet werden, wird ein Wasserstoffmolekül abgespalten und ein Alken gebildet: 
3. Dehydrierung von Alkoholen (Wasserabspaltung). Die Einwirkung wasserentfernender Mittel (H2804, Al203) auf einwertige Alkohole bei hohen Temperaturen führt zur Abspaltung eines Wassermoleküls und zur Bildung einer Doppelbindung:
Diese Reaktion wird als intramolekulare Dehydratisierung bezeichnet (im Gegensatz zur intermolekularen Dehydratisierung, die zur Bildung von Ethern führt und in § 16 „Alkohole“ untersucht wird).
4. Dehydrohalogenierung (Abspaltung von Halogenwasserstoff).
Wenn ein Halogenalkan mit einem Alkali in einer Alkohollösung reagiert, entsteht durch die Abspaltung eines Halogenwasserstoffmoleküls eine Doppelbindung.
Beachten Sie, dass bei dieser Reaktion überwiegend Buten-2 und nicht Buten-1 entsteht, was entspricht Zaitsevs Regel:
Wenn ein Halogenwasserstoff aus sekundären und tertiären Halogenalkanen abgespalten wird, wird ein Wasserstoffatom aus dem am wenigsten hydrierten Kohlenstoffatom abgespalten.
5. Dehalogenierung. Wenn Zink auf ein Dibromderivat eines Alkans einwirkt, werden an benachbarten Kohlenstoffatomen befindliche Halogenatome abgespalten und eine Doppelbindung gebildet: 
Physikalische Eigenschaften
Die ersten drei Vertreter der homologen Reihe der Alkene sind Gase, Stoffe der Zusammensetzung C5H10-C16H32 sind Flüssigkeiten und höhere Alkene sind Feststoffe.
Siede- und Schmelzpunkte steigen natürlicherweise mit steigendem Molekulargewicht der Verbindungen.
Chemische Eigenschaften
Additionsreaktionen
Erinnern wir uns daran, dass ein charakteristisches Merkmal von Vertretern ungesättigter Kohlenwasserstoffe – Alkene – die Fähigkeit ist, Additionsreaktionen einzugehen. Die meisten dieser Reaktionen laufen über den elektrophilen Additionsmechanismus ab.
1. Hydrierung von Alkenen. Alkene sind in der Lage, in Gegenwart von Hydrierungskatalysatoren Wasserstoff zu addieren – Metalle – Platin, Palladium, Nickel:
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
Diese Reaktion findet sowohl bei Atmosphärendruck als auch bei erhöhtem Druck statt und erfordert keine hohe Temperatur, da sie exotherm ist. Wenn die Temperatur steigt, können dieselben Katalysatoren eine Rückreaktion auslösen – die Dehydrierung.
2. Halogenierung (Anlagerung von Halogenen). Die Wechselwirkung eines Alkens mit Bromwasser oder einer Lösung von Brom in einem organischen Lösungsmittel (CCl4) führt zu einer schnellen Verfärbung dieser Lösungen infolge der Addition eines Halogenmoleküls an das Alken und der Bildung von Dihalogenalkanen.
Markownikow Wladimir Wassiljewitsch
(1837-1904)
Russischer organischer Chemiker. Formulierte (1869) Regeln zur Richtung von Substitution, Eliminierung, Addition an einer Doppelbindung und Isomerisierungsreaktionen in Abhängigkeit von der chemischen Struktur. Er untersuchte (seit 1880) die Zusammensetzung von Öl und legte den Grundstein für die Petrochemie als eigenständige Wissenschaft. Entdeckte (1883) eine neue Klasse organischer Substanzen – Cycloparaffine (Naphthene).
3. Hydrohalogenierung (Zugabe von Halogenwasserstoff).
Die Halogenwasserstoff-Additionsreaktion wird weiter unten ausführlicher besprochen. Diese Reaktion gehorcht Markownikows Regel:
Wenn ein Halogenwasserstoff an ein Alken bindet, bindet sich der Wasserstoff an das stärker hydrierte Kohlenstoffatom, also das Atom, an dem sich mehr Wasserstoffatome befinden, und das Halogen an das weniger hydrierte.
4. Hydratation (Zugabe von Wasser). Die Hydratisierung von Alkenen führt zur Bildung von Alkoholen. Die Zugabe von Wasser zu Ethen liegt beispielsweise einer der industriellen Methoden zur Herstellung von Ethylalkohol zugrunde:
CH2=CH2 + H2O -> CH3-CH2OH
Ethen-Ethanol
Beachten Sie, dass ein primärer Alkohol (mit einer Hydroxygruppe am primären Kohlenstoff) nur gebildet wird, wenn Ethen hydratisiert wird. Bei der Hydratisierung von Propen oder anderen Alkenen entstehen sekundäre Alkohole. 
Auch diese Reaktion verläuft nach der Regel von Markownikow: Ein Wasserstoffkation bindet an ein stärker hydriertes Kohlenstoffatom und eine Hydroxygruppe an ein weniger hydriertes Kohlenstoffatom.
5. Polymerisation. Ein Sonderfall der Addition ist die Polymerisationsreaktion von Alkenen:
Diese Additionsreaktion erfolgt über einen radikalischen Mechanismus.
Oxidationsreaktionen
Wie alle organischen Verbindungen verbrennen Alkene in Sauerstoff zu CO2 und H20.
Im Gegensatz zu Alkanen, die in Lösungen resistent gegen Oxidation sind, werden Alkene durch die Einwirkung wässriger Kaliumpermanganatlösungen leicht oxidiert. In neutralen oder leicht alkalischen Lösungen werden Alkene zu Diolen (zweiwertigen Alkoholen) oxidiert und an die Atome, zwischen denen vor der Oxidation eine Doppelbindung bestand, werden Hydroxylgruppen angehängt.
Wie Sie bereits wissen, können ungesättigte Kohlenwasserstoffe – Alkene – Additionsreaktionen eingehen. Die meisten dieser Reaktionen laufen über den elektrophilen Additionsmechanismus ab.
Elektrophile Verbindung
Elektrophile Reaktionen sind Reaktionen, die unter dem Einfluss von Elektrophilen ablaufen – Teilchen, denen es an Elektronendichte mangelt, beispielsweise einem ungefüllten Orbital. Das einfachste elektrophile Teilchen ist das Wasserstoffkation. Es ist bekannt, dass das Wasserstoffatom ein Elektron im 3. Orbital hat. Ein Wasserstoffkation entsteht, wenn ein Atom dieses Elektron verliert, das Wasserstoffkation hat also überhaupt keine Elektronen:
Н· - 1е - -> Н +
In diesem Fall hat das Kation eine ziemlich hohe Elektronenaffinität. Die Kombination dieser Faktoren macht das Wasserstoffkation zu einem ziemlich starken elektrophilen Teilchen.
Bei der elektrolytischen Dissoziation von Säuren ist die Bildung eines Wasserstoffkations möglich:
НВr -> Н + + Вr -
Aus diesem Grund laufen viele elektrophile Reaktionen in Gegenwart und Beteiligung von Säuren ab.
Elektrophile Partikel wirken, wie bereits erwähnt, auf Systeme, die Bereiche mit erhöhter Elektronendichte enthalten. Ein Beispiel für ein solches System ist eine mehrfache (doppelte oder dreifache) Kohlenstoff-Kohlenstoff-Bindung.
Sie wissen bereits, dass sich Kohlenstoffatome, zwischen denen eine Doppelbindung gebildet wird, im Zustand der sp 2 -Hybridisierung befinden. Unhybridisierte p-Orbitale benachbarter Kohlenstoffatome, die in derselben Ebene liegen, überlappen sich und bilden sich P-Bindung, die weniger stark ist als die Þ-Bindung und vor allem unter dem Einfluss eines externen elektrischen Feldes leicht polarisiert. Das heißt, wenn sich ein positiv geladenes Teilchen nähert, verschieben sich die Elektronen der CS-Bindung zu diesem und dem sogenannten P- Komplex.
Es stellt sich heraus P-Komplex und bei Zugabe eines Wasserstoffkations zu P- Verbindungen. Das Wasserstoffkation scheint gegen die Elektronendichte zu stoßen, die aus der Molekülebene herausragt P-Verbindung und schließt sich dieser an. ![]()
Im nächsten Schritt kommt es zu einer vollständigen Verschiebung des Elektronenpaares P-Bindung an eines der Kohlenstoffatome, was dazu führt, dass darauf ein einzelnes Elektronenpaar entsteht. Das Orbital des Kohlenstoffatoms, auf dem sich dieses Paar befindet, und das unbesetzte Orbital des Wasserstoffkations überlappen sich, was zur Bildung einer kovalenten Bindung über den Donor-Akzeptor-Mechanismus führt. Das zweite Kohlenstoffatom hat noch ein unbesetztes Orbital, also eine positive Ladung.
Das resultierende Teilchen wird Carbokation genannt, weil es eine positive Ladung am Kohlenstoffatom enthält. Dieses Teilchen kann sich mit jedem Anion verbinden, einem Teilchen, das ein einzelnes Elektronenpaar hat, also einem Nukleophil.
Betrachten wir den Mechanismus der elektrophilen Additionsreaktion am Beispiel der Hydrobromierung (Addition von Bromwasserstoff) von Ethen:
СН2= СН2 + НВг --> СНВr-СН3
Die Reaktion beginnt mit der Bildung eines elektrophilen Teilchens – eines Wasserstoffkations, das durch die Dissoziation eines Bromwasserstoffmoleküls entsteht.
Angriffe von Wasserstoffkationen P- Verbindung, Bildung P- ein Komplex, der schnell in ein Carbokation umgewandelt wird: 
Schauen wir uns nun einen komplexeren Fall an.
Die Reaktion der Addition von Bromwasserstoff an Ethen verläuft eindeutig, und die Wechselwirkung von Bromwasserstoff mit Propen kann theoretisch zu zwei Produkten führen: 1-Brompropan und 2-Brompropan. Experimentelle Daten zeigen, dass hauptsächlich 2-Brompropan produziert wird.
Um dies zu erklären, müssen wir das Zwischenteilchen betrachten – das Carbokation.
Die Zugabe eines Wasserstoffkations zu Propen kann zur Bildung von zwei Carbokationen führen: Wenn sich ein Wasserstoffkation an das erste Kohlenstoffatom, das Atom am Ende der Kette, anschließt, dann hat das zweite eine positive Ladung, d. h das Zentrum des Moleküls (1); Wenn es sich mit dem zweiten verbindet, hat das erste Atom eine positive Ladung (2). 
Die Vorzugsrichtung der Reaktion hängt davon ab, welches Carbokation im Reaktionsmedium häufiger vorkommt, was wiederum von der Stabilität des Carbokations abhängt. Der Versuch zeigt die überwiegende Bildung von 2-Brompropan. Dies bedeutet, dass die Bildung von Carbokation (1) mit positiver Ladung am Zentralatom in größerem Umfang erfolgt.
Die größere Stabilität dieses Carbokations erklärt sich aus der Tatsache, dass die positive Ladung am zentralen Kohlenstoffatom durch die positive induktive Wirkung zweier Methylgruppen kompensiert wird, deren Gesamtwirkung höher ist als die +/- Wirkung einer Ethylgruppe:
Die Gesetze der Reaktionen der Hydrohalogenierung von Alkenen wurden vom berühmten russischen Chemiker V. V. Markovnikov, einem Schüler von A. M. Butlerov, untersucht, der, wie oben erwähnt, die nach ihm benannte Regel formulierte.
Diese Regel wurde empirisch, also experimentell, ermittelt. Derzeit können wir eine völlig überzeugende Erklärung dafür liefern.
Interessanterweise gehorchen auch andere elektrophile Additionsreaktionen der Markownikow-Regel, daher wäre es richtig, sie in einer allgemeineren Form zu formulieren.
Bei elektrophilen Additionsreaktionen addiert sich ein Elektrophil (ein Teilchen mit einem unbesetzten Orbital) an ein stärker hydriertes Kohlenstoffatom und ein Nukleophil (ein Teilchen mit einem freien Elektronenpaar) an ein weniger hydriertes Kohlenstoffatom.
Polymerisation
Ein Sonderfall der Additionsreaktion ist die Polymerisationsreaktion von Alkenen und ihren Derivaten. Diese Reaktion läuft über den Mechanismus der Addition freier Radikale ab:
Die Polymerisation wird in Gegenwart von Initiatoren durchgeführt – Peroxidverbindungen, die eine Quelle freier Radikale darstellen. Peroxidverbindungen sind Stoffe, deren Moleküle die -O-O-Gruppe enthalten. Die einfachste Peroxidverbindung ist Wasserstoffperoxid HOOH.
Bei einer Temperatur von 100 °C und einem Druck von 100 MPa kommt es zur Homolyse der instabilen Sauerstoff-Sauerstoff-Bindung und zur Bildung von Radikalen – Polymerisationsinitiatoren. Unter dem Einfluss von KO-Radikalen wird eine Polymerisation initiiert, die sich als radikalische Additionsreaktion entwickelt. Das Kettenwachstum stoppt, wenn es zu einer Rekombination von Radikalen in der Reaktionsmischung kommt – der Polymerkette und den Radikalen oder COCH2CH2-.
Durch die Reaktion der radikalischen Polymerisation von Substanzen, die eine Doppelbindung enthalten, wird eine große Anzahl hochmolekularer Verbindungen erhalten: 
Der Einsatz von Alkenen mit unterschiedlichen Substituenten ermöglicht die Synthese verschiedenster Polymermaterialien mit unterschiedlichsten Eigenschaften. 
Alle diese Polymerverbindungen werden häufig in einer Vielzahl von Bereichen der menschlichen Tätigkeit eingesetzt – Industrie, Medizin, zur Herstellung von Geräten für biochemische Labore, einige sind Zwischenprodukte für die Synthese anderer hochmolekularer Verbindungen.
Oxidation
Sie wissen bereits, dass in neutralen oder leicht alkalischen Lösungen eine Oxidation von Alkenen zu Diolen (zweiwertigen Alkoholen) stattfindet. In einer sauren Umgebung (einer mit Schwefelsäure angesäuerten Lösung) wird die Doppelbindung vollständig zerstört und die Kohlenstoffatome, zwischen denen die Doppelbindung bestand, werden in Kohlenstoffatome der Carboxylgruppe umgewandelt: 
Durch destruktive Oxidation von Alkenen lässt sich deren Struktur bestimmen. Wenn beispielsweise bei der Oxidation eines bestimmten Alkens Essigsäure und Propionsäure anfallen, bedeutet dies, dass Penten-2 oxidiert wurde, und wenn Buttersäure und Kohlendioxid erhalten werden, ist der ursprüngliche Kohlenwasserstoff Penten-1 .
Anwendung
Alkene werden in der chemischen Industrie häufig als Rohstoffe für die Herstellung einer Vielzahl organischer Substanzen und Materialien verwendet.
Ethen ist beispielsweise der Ausgangsstoff für die Herstellung von Ethanol, Ethylenglykol, Epoxiden und Dichlorethan.
Eine große Menge Ethen wird zu Polyethylen verarbeitet, das zur Herstellung von Verpackungsfolien, Geschirr, Rohren und elektrischen Isoliermaterialien verwendet wird.
Aus Propen werden Glycerin, Aceton, Isopropanol und Lösungsmittel gewonnen. Durch die Polymerisation von Propen entsteht Polypropylen, das Polyethylen in vielerlei Hinsicht überlegen ist: Es verfügt über einen höheren Schmelzpunkt und eine höhere chemische Beständigkeit.
Derzeit werden Fasern mit einzigartigen Eigenschaften aus Polymeren hergestellt – Analoga von Polyethylen. Beispielsweise ist Polypropylenfaser stärker als alle bekannten synthetischen Fasern.
Materialien aus diesen Fasern sind vielversprechend und werden zunehmend in verschiedenen Bereichen der menschlichen Tätigkeit eingesetzt.

1. Welche Arten der Isomerie sind charakteristisch für Alkene? Schreiben Sie die Formeln für mögliche Isomere von Penten-1.
2. Aus welchen Verbindungen kann gewonnen werden: a) Isobuten (2-Methylpropen); b) Buten-2; c) Buten-1? Schreiben Sie die Gleichungen für die entsprechenden Reaktionen.
3. Entschlüsseln Sie die folgende Transformationskette. Nennen Sie die Verbindungen A, B, C. 4. Schlagen Sie eine Methode zur Gewinnung von 2-Chlorpropan aus 1-Chlorpropan vor. Schreiben Sie die Gleichungen für die entsprechenden Reaktionen.
5. Schlagen Sie eine Methode zur Reinigung von Ethan von Ethylenverunreinigungen vor. Schreiben Sie die Gleichungen für die entsprechenden Reaktionen.
6. Nennen Sie Beispiele für Reaktionen, mit denen zwischen gesättigten und ungesättigten Kohlenwasserstoffen unterschieden werden kann.
7. Zur vollständigen Hydrierung von 2,8 g Alken wurden 0,896 Liter Wasserstoff (n.e.) verbraucht. Wie lautet das Molekulargewicht und die Strukturformel dieser Verbindung, die eine normale Kette von Kohlenstoffatomen aufweist?
8. Welches Gas befindet sich in der Flasche (Ethen oder Propen), wenn bekannt ist, dass für die vollständige Verbrennung von 20 cm3 dieses Gases 90 cm3 (n.s.) Sauerstoff erforderlich sind?
9*. Wenn ein Alken im Dunkeln mit Chlor reagiert, entstehen 25,4 g Dichlorid, und wenn dieses Alken mit der gleichen Masse mit Brom in Tetrachlorkohlenstoff reagiert, entstehen 43,2 g Dibromid. Bestimmen Sie alle möglichen Strukturformeln des Ausgangsalkens.
Geschichte der Entdeckung
Aus dem obigen Material haben wir bereits verstanden, dass Ethylen der Vorfahre der homologen Reihe ungesättigter Kohlenwasserstoffe ist, die über eine Doppelbindung verfügen. Ihre Formel lautet C n H 2n und sie werden Alkene genannt.
Im Jahr 1669 gelang es dem deutschen Arzt und Chemiker Becher als erster, Ethylen durch Reaktion von Schwefelsäure mit Ethylalkohol zu gewinnen. Becher fand heraus, dass Ethylen chemisch aktiver ist als Methan. Doch leider konnte der Wissenschaftler damals das entstehende Gas nicht identifizieren und gab ihm daher keinen Namen.
Wenig später nutzten niederländische Chemiker die gleiche Methode zur Herstellung von Ethylen. Und da es bei der Wechselwirkung mit Chlor dazu neigte, eine ölige Flüssigkeit zu bilden, erhielt es daher den Namen „Ölgas“. Später wurde bekannt, dass es sich bei dieser Flüssigkeit um Dichlorethan handelte.
Im Französischen ist der Begriff „Öl“ oléfiant. Und nachdem andere Kohlenwasserstoffe dieser Art entdeckt wurden, führte Antoine Fourcroix, ein französischer Chemiker und Wissenschaftler, einen neuen Begriff ein, der für die gesamte Klasse der Olefine oder Alkene allgemein wurde.
Doch bereits zu Beginn des 19. Jahrhunderts entdeckte der französische Chemiker J. Gay-Lussac, dass Ethanol nicht nur aus „Öl“-Gas, sondern auch aus Wasser besteht. Darüber hinaus wurde das gleiche Gas in Ethylchlorid entdeckt.
Und obwohl Chemiker feststellten, dass Ethylen aus Wasserstoff und Kohlenstoff besteht, und die Zusammensetzung der Stoffe bereits kannten, konnten sie die wahre Formel lange Zeit nicht finden. Und erst 1862 gelang es E. Erlenmeyer, das Vorhandensein einer Doppelbindung im Ethylenmolekül nachzuweisen. Dies erkannte auch der russische Wissenschaftler A.M. Butlerov und bestätigte experimentell die Richtigkeit dieser Sichtweise.
Vorkommen in der Natur und physiologische Rolle von Alkenen
Viele Menschen interessieren sich für die Frage, wo Alkene in der Natur vorkommen. Es stellt sich also heraus, dass sie in der Natur praktisch nicht vorkommen, da ihr einfachster Vertreter, Ethylen, ein Hormon für Pflanzen ist und in ihnen nur in geringen Mengen synthetisiert wird.
Es stimmt, dass es in der Natur ein Alken wie Muskalur gibt. Dieses natürliche Alken ist ein sexueller Lockstoff für die weibliche Stubenfliege.
Es ist zu beachten, dass niedere Alkene in hoher Konzentration eine narkotische Wirkung haben, die zu Krämpfen und Reizungen der Schleimhäute führen kann.
Anwendungen von Alkenen
Der Einsatz von Polymermaterialien ist aus dem heutigen Leben der modernen Gesellschaft kaum noch wegzudenken. Da Polymere im Gegensatz zu Naturmaterialien andere Eigenschaften haben, sind sie einfach zu verarbeiten und preislich relativ günstig. Ein weiterer wichtiger Aspekt, der für Polymere spricht, ist, dass viele davon recycelt werden können.
Alkene finden Verwendung bei der Herstellung von Kunststoffen, Gummi, Folien, Teflon, Ethylalkohol, Acetaldehyd und anderen organischen Verbindungen.

In der Landwirtschaft wird es als Mittel zur Beschleunigung des Reifeprozesses von Früchten eingesetzt. Propylen und Butylen werden zur Herstellung verschiedener Polymere und Alkohole verwendet. Bei der Herstellung von synthetischem Kautschuk wird jedoch Isobutylen verwendet. Wir können daher den Schluss ziehen, dass auf Alkene nicht verzichtet werden kann, da sie die wichtigsten chemischen Rohstoffe sind.
Industrielle Verwendung von Ethylen
Im industriellen Maßstab wird Propylen üblicherweise zur Synthese von Polypropylen und zur Herstellung von Isopropanol, Glycerin, Butyraldehyden usw. verwendet. Jedes Jahr steigt die Nachfrage nach Propylen.

4.3.b. Addition von Halogenwasserstoffen (Hydrohalogenierung)
Eine weitere wichtige elektrophile Additionsreaktion an Alkene ist die seit langem bekannte Hydrohalogenierung von Alkenen.
Nachfolgend finden Sie typische Beispiele für die Addition von HCl, HBr und HI an verschiedene Alkene.


Der Einfluss von Alkylsubstituenten an der Doppelbindung auf die Additionsgeschwindigkeit wird durch die folgende Reihenfolge beschrieben:
R 2 C=CHR > RCH=CHR > RCH=CH 2
Dies steht im Einklang mit einem Mechanismus, bei dem der geschwindigkeitsbestimmende Schritt der Reaktion die Bildung eines Carbokations beinhaltet, da die Stabilität der Alkylkationen in der Reihenfolge tertiär > sekundär > primär abnimmt. Daher muss der Additionsmechanismus entweder die Bildung eines freien Carbokation-Zwischenprodukts beinhalten, was selten beobachtet wird, oder eines Zwischenprodukts mit carbokationischem Charakter. Der letzte Fall ist der typischste.
Würde die Addition über ein „freies Carbokation“ erfolgen, wäre die Reaktion völlig nicht-stereoselektiv, da Alkylkationen eine planare Struktur haben. Allerdings verläuft die Hydrohalogenierung in der Regel stereoselektiv und je nach Alkentyp selektiv Anti-Anhaftung, selektiv syn- oder gemischt syn-Anti- Beitritt.
Für Alkene, bei denen die Doppelbindung nicht an einen aromatischen Ring konjugiert ist, ist es charakteristisch Anti-Zugabe von Halogenwasserstoff. Anti-die Zugabe von Chlorwasserstoff und Bromid, Deuteriumchlorid und Bromid wird bei Cyclohexen, Cyclopenten, 1,2-Dimethylhexen, 1,2-Dimethylpenten beobachtet, cis- Und Trance-Buten-2, Hexen-3 und viele andere einfache Alkene und Cycloalkene.

Im Additionsprodukt befinden sich identische Substituenten (Methylgruppen) auf verschiedenen Seiten der Mittelebene des Cyclohexanrings, daher gehört es dazu Trance-Reihe. Anti-Addition lässt sich nur schwer mit einem Mechanismus vereinbaren, bei dem die Bildung eines diskreten Carbokations angenommen wird. Bei einem planaren Carbokation ist ein nukleophiler Angriff des Halogenidions auf beiden Seiten der Ebene gleichermaßen wahrscheinlich, was zur Bildung einer Produktmischung führen sollte syn- Und Anti- Beitritte. Die Kinetik der Alkenhydrohalogenierung weist auch auf einen komplexeren Additionsmechanismus hin. Für nicht konjugierte Alkene wird die Reaktionsgeschwindigkeit durch eine Gleichung dritter Ordnung mit einer zweiten Ordnung im Halogenwasserstoff beschrieben, d. h. sie entspricht dem Ad E 3 -Mechanismus.
v = k [Alken] 2
Die Anti-Addition und die Reaktion zweiter Ordnung am Halogenwasserstoff stimmen gut mit dem Ad E 3 -Mechanismus überein, bei dem ein Alken mit zwei Halogenwasserstoffmolekülen reagiert, von denen eines als elektrophiles und das andere als nukleophiles Agens fungiert.

Dieser trimolekulare Mechanismus geht davon aus, dass zunächst ein Komplex aus einem Alken und einem Halogenwasserstoffmolekül gebildet wird, gefolgt vom Angriff eines zweiten HX-Moleküls auf diesen Komplex mit Anti-Seiten ohne Bildung einer diskreten Carbokation. Es ist besonders zu beachten, dass jeder trimolekulare Mechanismus aus zwei aufeinanderfolgenden Stufen bestehen muss, da die gleichzeitige Kollision von drei Molekülen äußerst unwahrscheinlich ist.

Anti-Addition weist auf einen bevorzugten nukleophilen Angriff des Halogenwasserstoffs von der Seite hin, die der Protonierung des Alkens gegenüberliegt. Anstelle eines Halogenwasserstoffs kann die Funktion eines nukleophilen Agens im Endstadium auch von einem Halogenidion übernommen werden. Tatsächlich steigt die Reaktionsgeschwindigkeit normalerweise direkt proportional zur Konzentration des Halogenidions, das in Form von Tetraalkylammoniumhalogeniden NR 4+ X in die Reaktionsmischung eingeführt wird - oder Lithium LiX. In diesem Fall stereospezifisch Anti- Beitritt.
Für Alkane, bei denen die Doppelbindung an einen aromatischen Ring konjugiert ist, ist es charakteristisch syn- Beitritt oder gemischt syn-Anti-Zugabe von Halogenwasserstoff, zum Beispiel:

Syn-Addition ist der dominierende Prozess für cis- Und Trance-Isomere von 1-Phenylpropen, 1-Phenyl-4-alkylcyclohexenen, Acenaphthylen, Inden. Bei der Protonierung solcher Alkene entstehen Carbokationen vom Benzyltyp, die stabiler sind als reine Alkylkationen, die bei der Protonierung gewöhnlicher Alkene und Cycloalkene entstehen. Die Reaktionskinetik wird in diesem Fall üblicherweise durch eine einfachere Gleichung zweiter Ordnung v = k[Alken] beschrieben, d. h. sie entspricht dem bimolekularen Ad E 2 -Mechanismus. Der Ad E 2-Mechanismus beinhaltet die Bildung eines Ionenpaars aus einem Carbokation und einem Halogenidion.

Es ist nicht zu erwarten, dass der Additionsmechanismus unter Beteiligung von Ionenpaaren hoch stereoselektiv ist. Wenn ein Ionenpaar schneller in das Endprodukt umgewandelt wird, als es sich um eine einzelne Kohlenstoff-Kohlenstoff-Bindung drehen kann, ist das Endergebnis syn-Addition, bei der ein Proton und ein Halogenidion auf derselben Seite der Doppelbindung hinzugefügt werden. Andernfalls kann es zur Bildung von Produkten wie z syn- so und Anti- Anschluss von NH. Dieser Fall tritt bei der Hydrohalogenierung auf Paar-substituiertes Styrol Z-C 6 H 4 -CH=CH 2. Das hier beobachtete Muster ist das syn-Addition ist nur für solche Olefine typisch, die bei Protonierung ein relativ stabiles Carbokation ergeben, also im Fall von Donorsubstituenten Z.
Hydrohalogenierungsreaktionen, die nach dem Ad E 2 -Mechanismus ablaufen, sind durch Konkurrenz zwischen konjugierten Additions- und Umlagerungsprozessen gekennzeichnet, da als Zwischenprodukt ein Carbokation oder Ionenpaar gebildet wird.

Als Beispiel für Umlagerungen mit 1,2-Wanderung einer Alkylgruppe und eines Hydridions stellen wir die Hydrohalogenierungsreaktionen von tert-Butylethylen bzw. Isopropylethylen vor.

Wenn die gleiche Reaktion ohne Lösungsmittel in der Kälte (-78 °C) durchgeführt wird, entsteht eine Mischung aus 33 % normalen und 67 % abnormalen (umgruppierten) Additionsprodukten.

4.3.c. Orientierung. Markownikows Regel
Im Gegensatz zu symmetrischen Elektrophilen (Hal 2) sind Halogenwasserstoffe unsymmetrische elektrophile Reagenzien. Die Addition eines beliebigen unsymmetrischen Elektrophils (HBr, ICl, H2O, Hg(OAc)2 usw.) an ein unsymmetrisches Alken könnte im Prinzip eine Mischung aus zwei alternativen Produkten erzeugen, in der Praxis wird jedoch normalerweise nur eines davon gebildet. Betrachten Sie als Beispiel die Zugabe von Bromwasserstoff zu Propylen.

Im Jahr 1870 v.v. Markownikow formulierte eine empirische Regel, nach der unsymmetrische Alkene HX so addieren, dass bevorzugt ein Produkt entsteht, bei dem Wasserstoff an das am wenigsten substituierte Ende und X an das am stärksten substituierte Ende der Doppelbindung addiert wird.
Markownikows Regel wird normalerweise durch den Stabilitätsunterschied zweier alternativer Carbokationen erklärt. Im obigen Beispiel beispielsweise normal N Das -Propyl-Kation ist viel weniger stabil als das Isopropyl-Kation und daher verläuft die Reaktion auf dem zweiten Weg.
Die Markownikow-Regel wurde ursprünglich nur für Fälle der Addition von HX an Kohlenwasserstoffsubstrate verwendet, kann aber prinzipiell auf Reaktionen anderer substituierter Alkene ausgeweitet werden. Somit ergibt die Zugabe von HCl zu CF 3 CH=CH 2 „ Anti-Markovnikov"-Produkt CF 3 CH 2 CH 2 Cl. Dies war zu erwarten, da das CF 3 CH+ CH 3-Kation aufgrund des starken (-I)-Effekts weniger stabil ist als das CF 3 CH 2 CH 2+-Kation CF 3 -Gruppe Überwiegend wird das Kation CF 3 CH 2 CH 2+ gebildet, aber auch, wenn auch in geringerem Maße, durch die induktive Wirkung der CF 3 -Gruppe destabilisiert, wodurch die Addition von HCl an Trifluormethylethylen erfolgt viel langsamer als die Addition an unsubstituiertes Ethylen.
Aus einem ähnlichen Grund fügen Vinyltrialkylammonium-Kationen HBr auch entgegen der Markownikow-Regel hinzu:
Die Addition von HX an Alkene mit starken (-I)- und (-M)-Substituenten, beispielsweise an Acrylnitril oder Nitroethylen, sollte ebenfalls gegen Markownikows Regel verstoßen. Allerdings ist in diesem Fall die Doppelbindung gegenüber elektrophilen Reagenzien so stark desaktiviert, dass diese Reaktionen nur unter sehr stringenten Bedingungen ablaufen. Vinylchlorid CH 2 =CHCl liefert immer ausschließlich „Markownikow-Addukte“. Wenn es beispielsweise mit HCl reagiert, entsteht nur 1,1-Dichlorethan (geminales Dichlorid) CH 3 CHCl 2. Chlor hat ähnlich wie die CF 3 -Gruppe eine starke (-I)-Wirkung, und auf den ersten Blick scheint es, dass die Addition aus diesem Grund eine Anti-Markownikow-Orientierung haben sollte, da das Kation + CH 2 CH 2 Cl eine sein sollte stabiler als das Kation CH 3 CH + Cl. Allerdings hat Chlor im Gegensatz zur CF 3 -Gruppe neben der (-I)-Wirkung auch eine gegenläufige (+M)-Wirkung (da es über freie Elektronenpaare verfügt). Die Erfahrung zeigt, dass das Ausmaß des mesomeren Effekts völlig ausreicht, um die Energie des 1-Chlorethyl-Kations unter das Energieniveau des 2-Chlorethyl-Kations zu senken, bei dem sich der +M-Effekt nicht manifestiert.
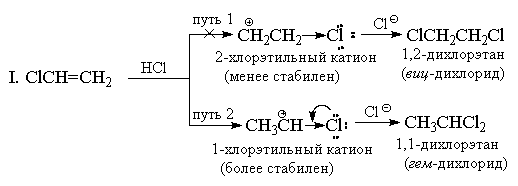
II. Aus resonanztheoretischer Sicht lässt sich die Struktur des 1-Chlorethyl-Kations wie folgt darstellen:
Allerdings erfolgt die Addition an Vinylchlorid unter gleichen Bedingungen langsamer als an Ethylen, d. h. entsprechend dem Gesamteffekt (-I > +M) bleibt Chlor im Vergleich zu Wasserstoff und dem 1-Chlorethyl-Kation ein elektronenziehender Substituent ist weniger stabil als C 2 H 5 + . Andere Vinylhalogenide reagieren mit HX auf ähnliche Weise.
Vinylether CH 2 =CHOR addieren HX (X=Hal) gemäß der Markownikow-Regel mit einer viel höheren Geschwindigkeit als alle oben aufgeführten substituierten Alkene. Dies ist auf den signifikanten +M-Effekt der RO-Gruppe zurückzuführen. Im Gegensatz zum Chloratom ist die RO-Gruppe im Hinblick auf den gesamten elektronischen Effekt (+M > -I) ein stark elektronenschiebender Substituent, der das benachbarte Carbokation-Zentrum effektiv stabilisiert. Die Struktur des Carbokations kann in diesem Fall auch als Satz zweier Resonanzstrukturen dargestellt werden
Der Angriff des Oxoniumkations durch ein Halogenidanion führt zur Bildung von α-Halogenethern vom Typ CH 3 CH(Hal)OR.
4.3.g. Hydratisierung von Alkenen
Die säurekatalysierte Hydratisierung von Alkenen führt zur Bildung von Alkoholen. Die Hydratationsrichtung von Alkenen wird durch die Markownikow-Regel bestimmt, daher wird angenommen, dass bei dieser Reaktion ein Carbokation als Zwischenteilchen entsteht.
Die Tendenz sekundärer Alkylcarbokationen zur Umlagerung verhindert die Verwendung der Hydratation von Alkenen zur Herstellung sekundärer Alkohole.

Diese Methode hat im Labor nur begrenzte Anwendung für die Herstellung tertiärer Alkohole gefunden. Die Hydratationsreaktion ist in diesem Fall weitgehend reversibel und tertiäre Alkohole werden in geringen Ausbeuten (40–45 %) gebildet.


Die Hydratisierung der einfachsten Alkene – Ethylen und Propylen – ist eine wichtige industrielle Methode zur Herstellung von Ethyl- und Isopropylalkoholen.

In der Laborpraxis hat die direkte Hydratation von Alkenen aufgrund der rauen Bedingungen und der Bildung einer erheblichen Menge isomerer Alkohole keine weit verbreitete Anwendung gefunden. Derzeit wird die verwandte Reaktion der Hydroxymercurierung – Demercurierung – üblicherweise zur regioselektiven Herstellung von Alkoholen aus Alkenen genutzt.
4.3.d. Hydroxymercuration-Demercuration
Ein elektrophiler Angriff auf die Doppelbindung eines Alkens kann durch Metallionen erfolgen, unter denen das Quecksilber(II)-Kation eine Sonderstellung einnimmt. Quecksilberacetat addiert sich unter sehr milden Bedingungen bei 20 °C an Alkene in wässrigem Tetrahydrofuran (THF) oder wässriger Essigsäure und bildet Organoquecksilberverbindungen. Die Addition von Quecksilberacetat an die Doppelbindung verläuft regiospezifisch streng nach der Markownikow-Regel, d. h. das Quecksilberkation bindet an das am wenigsten substituierte Kohlenstoffatom.
Die C-Hg-Bindung in Organoquecksilberverbindungen kann durch die Einwirkung von Natriumborhydrid NaBH 4 leicht gespalten werden, wodurch Quecksilber und eine neue C-H-Bindung entstehen. Es wird angenommen, dass Alkylquecksilberhydrid als instabiles Zwischenprodukt entsteht, das sich weiter zersetzt und über einen Radikalmechanismus metallisches Quecksilber freisetzt.

Insgesamt stellt dieser zweistufige Prozess der Hydroxymercurierung-Demercurierung letztlich eine regiospezifische Hydratisierung eines Alkens nach der Markownikow-Regel unter äußerst milden Bedingungen dar, bei der die Bildung von Nebenprodukten auf das größtmögliche Minimum reduziert wird. Dies lässt sich anhand der folgenden Beispiele deutlich veranschaulichen, bei denen die Gesamtausbeute an Reaktionsprodukten 90–98 % beträgt. Die angegebenen digitalen Daten geben in diesem Fall nicht die Ausbeuten der resultierenden Verbindungen an, sondern deren Verhältnis in der Mischung.




Wie aus den obigen Beispielen hervorgeht, führt die Hydroxymercurierung-Demercurierung von Alkenen in den meisten Fällen zu einer regiospezifischen Hydratisierung von Alkenen unter Bildung fast nur eines der beiden isomeren Alkohole. Es ist zu beachten, dass keine Isolierung der quecksilberorganischen Verbindung erforderlich ist und beide Prozesse direkt nacheinander durchgeführt werden können.
Die Hydroxymercurierung unsymmetrischer Alkene beginnt offenbar mit dem Angriff des AcOHg + -Kations und der intermediären Bildung eines unsymmetrischen cyclischen Mercurinium-Kations (Analogon des unsymmetrischen Halogenium-Ions), das dann höchstens durch nukleophilen Angriff von Wasser geöffnet wird substituiertes Kohlenstoffatom, das eine größere positive Ladung trägt.

Das verbrückende Quecksilberion kann in einer nicht nukleophilen, stark sauren Umgebung sogar bei 20 °C fixiert werden, indem ein stärkeres elektrophiles Mittel hinzugefügt wird – Quecksilbertrifluoracetat in einer Mischung aus Fluorsulfonsäure und Antimonpentafluorid.

Das Mercuriniumkation kann nicht nur durch die Einwirkung von Wasser, sondern auch durch andere elektronenspendende Lösungsmittel zersetzt werden: Alkohole, Essigsäure, Acetonitril usw. Das Endprodukt der Reaktion sind in diesem Fall Ether, Acetate oder N-substituierte Amide von Essigsäure, zum Beispiel:


Wenn verzweigte sekundäre oder tertiäre Alkohole in der Alkoxymercurierungs-Demercurierungsreaktion verwendet werden, sind Trifluoracetat Hg(OCOCF 3) 2 oder Quecksilbertriflat Hg(OSO 2 CF 3) 2 wirksamer als Quecksilberacetat.

Somit ist die Hydroxy- und Alkoxymercurierung-Demercurierung eine der besten präparativen Methoden zur Synthese von Alkoholen und Ethern mit verzweigten Alkylresten.
Die Addition von Quecksilbersalzen an Alkene ist das auffälligste Beispiel einer konjugierten Additionsreaktion an eine Doppelbindung, bei der ein Lösungsmittel die Rolle eines externen nukleophilen Mittels spielt. Die Stereochemie des dualen Hydroxymercuration-Demercuration-Prozesses hängt vom stereochemischen Ergebnis jedes einzelnen Schritts ab. Hydroxymercuration ist gekennzeichnet durch Anti-Addition, wie bei anderen Reaktionen mit einem zyklischen Kation. Allerdings ist die radikale Demercurierung nicht hoch stereoselektiv. Daher ist der gesamte Prozess als Ganzes auch nicht stereospezifisch.
4.3.e. Addition von Alkenen (kationische Dimerisierung und Polymerisation von Alkenen)
Das interessanteste Beispiel für diese Art von Reaktion ist die Dimerisierung und Polymerisation von Isobutylen in Gegenwart von Schwefelsäure.

Der technische Name für dieses Alkengemisch ist „Diisobutylen“. Diese Reaktion verläuft nach einem kationischen Mechanismus, ähnlich dem Mechanismus der Addition von Mineralsäuren an die Doppelbindung von Alkenen. Im ersten Schritt bindet ein Proton an ein Isobutylenmolekül und bildet so ein relativ stabiles reibt-Butylkation. Weiter geformt reibt-Butyl-Kation (Lewis-Säure) reagiert mit einem Isobutylen-Molekül (Lewis-Base) unter Bildung eines neuen stabilen tertiären Octyl-Kations.

Unter diesen Bedingungen verliert das Octylcarbokation unter Einwirkung von Basen (H 2 O, HSO 4 - Ionen) schnell ein Proton und verwandelt sich in eine Mischung isomerer Pentene, da die Protonenabstraktion an zwei verschiedenen Positionen erfolgt:

Die bevorzugte Bildung eines thermodynamisch weniger stabilen Alkens – 2,4,4-Trimethylpenten-1 (80 % im Reaktionsgemisch) ist mit einer größeren räumlichen Zugänglichkeit für den Angriff der Wasserstoffatome von Methylgruppen durch die Base im Vergleich zu Wasserstoff verbunden Atome der Methylengruppe. Industriell wird „Diisobutylen“ mit Ni-Raney hydriert, um „Isooctan“ (die technische Bezeichnung für den Kohlenwasserstoff 2,2,4-Trimethylpentan) zu erzeugen, der als Kraftstoff mit hoher Oktanzahl für Verbrennungsmotoren verwendet wird.
Bei hohen Schwefelsäurekonzentrationen (mehr als 80 %) kommt es zur kationischen Polymerisation von Isobutylen unter Bildung eines Polymers namens Polyisobutylen (-CH 2 C(CH 3) 2 -) n. Dieses gummiartige Polymer wird zur Herstellung von Korrosionsschutz- und wasserabweisenden Beschichtungen, Dichtungsmitteln usw. verwendet.
Neben Isobutylen werden auch 3-Methylbuten-1, Vinylether und einige Styrolderivate, die relativ stabile Carbokationen bilden können, durch den kationischen Mechanismus polymerisiert. Als Katalysatoren für die kationische Polymerisation werden auch Fluorwasserstoff und Lewis-Säuren verwendet: BF 3, AlCl 3, AlBr 3 usw. in Gegenwart sehr geringer Mengen Wasser.
4.3.g. Addition von Alkanen (Alkylierung von Alkenen)
Eine weitere industrielle Methode zur Synthese von „Isooctan“ basiert auf der Reaktion von Isobutylen mit überschüssigem Isobutan in Gegenwart von konzentrierter Schwefelsäure oder in wasserfreiem Fluorwasserstoff bei 0 10 0 C.

Diese Reaktion verläuft ebenfalls über einen kationischen Mechanismus und ist, was besonders interessant ist, ein Beispiel für einen kationischen Kettenprozess. Zunächst dimerisiert Isobutylen unter den Reaktionsbedingungen unter Bildung eines tertiären Octylkations (CH 3) 3 CCH 2 C + (CH 3) 2. Der Mechanismus seiner Entstehung wird im vorherigen Abschnitt ausführlich beschrieben. Als nächstes findet eine schnelle Übertragung von Wasserstoff (in Form eines Hydridions) von Isobutan auf das Octylkation statt, um ein „Isooctan“-Molekül und ein neues tert-Butylkation zu bilden, das wiederum schnell mit Isobutylen reagiert und ein neues bildet Octylkation usw.

Neben der Synthese von „Isooctan“ wird dieses Alkylierungsverfahren in der petrochemischen Industrie zur Synthese hochsiedender verzweigter Kohlenwasserstoffe aus verzweigten Alkenen und niedrigsiedenden Alkanen unter Verwendung der thermischen Crackfraktion eingesetzt.
ALKENE
Man bezeichnet Kohlenwasserstoffe, in deren Molekül neben einfachen Kohlenstoff-Kohlenstoff- und Kohlenstoff-Wasserstoff-σ-Bindungen auch Kohlenstoff-Kohlenstoff-π-Bindungen vorhanden sind unbegrenzt. Da die Bildung einer π-Bindung formal dem Verlust von zwei Wasserstoffatomen durch das Molekül entspricht, enthalten ungesättigte Kohlenwasserstoffe 14 Uhr es gibt weniger Wasserstoffatome als die begrenzenden, wo P - Anzahl der π-Bindungen:
Eine Reihe, deren Mitglieder sich um (2H) n voneinander unterscheiden, heißt isologische Reihe. Im obigen Schema sind die Isologen also Hexane, Hexene, Hexadiene, Hexine, Hexatriene usw.
Kohlenwasserstoffe, die eine π-Bindung (d. h. Doppelbindung) enthalten, werden genannt Alkene (Olefine) oder, entsprechend dem ersten Mitglied der Reihe - Ethylen, Ethylenkohlenwasserstoffe. Die allgemeine Formel ihrer homologen Reihe lautet C p H 2l.
1. Nomenklatur
Gemäß den IUPAC-Regeln erhält bei der Namensbildung von Alkenen die längste Kohlenstoffkette, die eine Doppelbindung enthält, den Namen des entsprechenden Alkans, in dem die Endung steht -ein ersetzt durch -en. Diese Kette wird so nummeriert, dass die an der Bildung der Doppelbindung beteiligten Kohlenstoffatome möglichst niedrige Nummern erhalten:

Radikale werden wie Alkane benannt und nummeriert.
Für Alkene relativ einfacher Struktur sind einfachere Namen zulässig. Daher werden einige der am häufigsten vorkommenden Alkene durch Anhängen des Suffixes benannt -en zum Namen eines Kohlenwasserstoffrestes mit demselben Kohlenstoffgerüst:
Aus Alkenen gebildete Kohlenwasserstoffradikale erhalten das Suffix -enil. Die Nummerierung im Rest beginnt mit dem Kohlenstoffatom, das eine freie Valenz aufweist. Für die einfachsten Alkenylreste dürfen jedoch anstelle systematischer Namen triviale Namen verwendet werden:

Häufig werden Wasserstoffatome genannt, die direkt an ungesättigte Kohlenstoffatome gebunden sind und eine Doppelbindung bilden Vinyl-Wasserstoffatome,
2. Isomerie
Neben der Isomerie des Kohlenstoffgerüsts kommt es in der Reihe der Alkene auch zu einer Isomerie der Position der Doppelbindung. Im Allgemeinen ist diese Art der Isomerie Isomerie der Substituentenposition (Funktion)- wird in allen Fällen beobachtet, wenn das Molekül funktionelle Gruppen enthält. Für das Alkan C4H10 sind zwei Strukturisomere möglich:
Für das C4H8-Alken (Buten) sind drei Isomere möglich:

Buten-1 und Buten-2 sind Isomere der Position der Funktion (in diesem Fall spielt eine Doppelbindung ihre Rolle).
Raumisomere unterscheiden sich in der räumlichen Anordnung der Substituenten zueinander und werden aufgerufen cis-Isomere, wenn sich die Substituenten auf der gleichen Seite der Doppelbindung befinden, und trans-Isomere, wenn auf gegenüberliegenden Seiten:

3. Struktur einer Doppelbindung
Die Spaltungsenergie eines Moleküls an der C=C-Doppelbindung beträgt 611 kJ/mol; Da die Energie der C-C-σ-Bindung 339 kJ/mol beträgt, beträgt die Energie zum Aufbrechen der π-Bindung nur 611-339 = 272 kJ/mol. π-Elektronen sind viel leichter als σ-Elektronen und anfällig für den Einfluss beispielsweise polarisierender Lösungsmittel oder den Einfluss angreifender Reagenzien. Dies wird durch den Unterschied in der Symmetrie der Verteilung der Elektronenwolke von σ- und π-Elektronen erklärt. Die maximale Überlappung der p-Orbitale und damit die minimale freie Energie des Moleküls wird nur bei einer flachen Struktur des Vinylfragments und bei einem verkürzten C-C-Abstand von 0,134 nm realisiert, d.h. deutlich kleiner als der Abstand zwischen Kohlenstoffatomen, die durch eine Einfachbindung verbunden sind (0,154 nm). Wenn sich die „Hälften“ des Moleküls entlang der Doppelbindungsachse relativ zueinander drehen, nimmt der Grad der Orbitalüberlappung ab, was mit dem Energieverbrauch verbunden ist. Die Folge davon ist das Fehlen einer freien Rotation entlang der Doppelbindungsachse und die Existenz geometrischer Isomere mit entsprechender Substitution an den Kohlenstoffatomen.
Alkene- ungesättigte Kohlenwasserstoffe, die eine Doppelbindung enthalten. Beispiele für Alkene:

Methoden zur Gewinnung von Alkenen.
1. Cracken von Alkanen bei 400-700°C. Die Reaktion erfolgt über einen Mechanismus freier Radikale:

2. Dehydrierung von Alkanen:
3. Eliminierungsreaktion (Eliminierung): 2 Atome oder 2 Atomgruppen werden von benachbarten Kohlenstoffatomen abgespalten und es entsteht eine Doppelbindung. Zu diesen Reaktionen gehören:
A) Dehydratisierung von Alkoholen (Erhitzen über 150 °C unter Beteiligung von Schwefelsäure als wasserentfernendes Reagenz):
B) Eliminierung von Halogenwasserstoffen bei Einwirkung einer alkoholischen Alkalilösung:

Das Wasserstoffatom wird bevorzugt von dem Kohlenstoffatom abgespalten, das an weniger Wasserstoffatome gebunden ist (das am wenigsten hydrierte Atom) – Zaitsevs Herrschaft.
B) Dehalogenierung:

Chemische Eigenschaften von Alkenen.
Die Eigenschaften von Alkenen werden durch das Vorhandensein einer Mehrfachbindung bestimmt, daher gehen Alkene elektrophile Additionsreaktionen ein, die in mehreren Stufen ablaufen (H-X – Reagenz):
1. Stufe:

2. Stufe:
 .
.
Das Wasserstoffion gehört bei dieser Art von Reaktion zu dem Kohlenstoffatom, das eine negativere Ladung hat. Die Dichteverteilung ist:

Wenn der Substituent ein Donor ist, der den +I-Effekt zeigt, verschiebt sich die Elektronendichte in Richtung des am stärksten hydrierten Kohlenstoffatoms, wodurch eine teilweise negative Ladung darauf entsteht. Die Reaktionen verlaufen entsprechend Markownikows Regel: beim Verbinden polarer Moleküle wie NH (HCl, HCN, HOH usw.) an unsymmetrische Alkene bindet Wasserstoff bevorzugt an das stärker hydrierte Kohlenstoffatom an der Doppelbindung.
A) Additionsreaktionen:
1) Hydrohalogenierung:
Die Reaktion folgt Markownikows Regel. Wenn bei der Reaktion jedoch Peroxid vorhanden ist, wird die Regel nicht berücksichtigt:
2) Flüssigkeitszufuhr. Die Reaktion folgt der Markownikowschen Regel in Gegenwart von Phosphor- oder Schwefelsäure:

3) Halogenierung. Dadurch kommt es zu einer Verfärbung des Bromwassers – hierbei handelt es sich um eine qualitative Reaktion auf eine Mehrfachbindung:
4) Hydrierung. Die Reaktion findet in Gegenwart von Katalysatoren statt.



