Alkeni su hemijski aktivni. Njihova hemijska svojstva su uglavnom određena prisustvom dvostruke veze. Za alkene su najkarakterističnije reakcije elektrofilne adicije i reakcije adicije radikala. Reakcije nukleofilne adicije obično zahtijevaju jak nukleofil i nisu tipične za alkene. Alkeni lako ulaze u reakcije oksidacije, adicije, a također su sposobni za supstituciju alil radikala.
Reakcije sabiranja
Hidrogenacija Dodatak vodika (reakcija hidrogenacije) u alkene se izvodi u prisustvu katalizatora. Najčešće se koriste drobljeni metali - platina, nikal, paladijum itd. Kao rezultat toga nastaju odgovarajući alkani (zasićeni ugljovodonici).
$CH_2=CH_2 + H2 → CH_3–CH_3$
dodatak halogena. Alkeni lako reaguju sa hlorom i bromom pod normalnim uslovima i formiraju odgovarajuće dihaloalkane, u kojima se atomi halogena nalaze na susednim atomima ugljenika.
Napomena 1
Kada alkeni stupe u interakciju sa bromom, žuto-smeđa boja broma se mijenja. Ovo je jedna od najstarijih i najjednostavnijih kvalitativnih reakcija za nezasićene ugljikovodike, jer alkini i alkadieni također reagiraju slično.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
dodavanje halogenovodonika. Kada etilen ugljovodonici reaguju sa halogenovodonicima ($HCl$, $HBr$), nastaju haloalkani, smer reakcije zavisi od strukture alkena.
U slučaju etilena ili simetričnih alkena, reakcija adicije se odvija nedvosmisleno i dovodi do stvaranja samo jednog proizvoda:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
U slučaju nesimetričnih alkena moguće je formiranje dva različita produkta reakcije adicije:
Napomena 2
Zapravo, u osnovi nastaje samo jedan produkt reakcije. Pravilnost pravca prolaska takvih reakcija ustanovio je ruski hemičar V.V. Markovnikov 1869. Zove se Markovnikova vladavina. U interakciji halogenovodonika sa nesimetričnim alkenima, atom vodika se spaja na mjestu gdje se prekida dvostruka veza u najhidrogenizovanijem atomu ugljika, odnosno prije nego što se poveže sa velikim brojem atoma vodika.
Markovnikov je ovo pravilo formulisao na osnovu eksperimentalnih podataka, a tek mnogo kasnije je dobilo teorijsko opravdanje. Razmotrite reakciju propilena sa klorovodikom.
Jedna od karakteristika $p$ veze je njena sposobnost da se lako polarizira. Pod uticajem metil grupe (pozitivni induktivni efekat + $I$) u molekulu propena, elektronska gustina $p$ veze se pomera na jedan od atoma ugljenika (= $CH_2$). Kao rezultat, na njemu se pojavljuje djelomični negativni naboj ($\delta -$). Na drugom atomu ugljika dvostruke veze javlja se parcijalni pozitivni naboj ($\delta +$).
Ova distribucija elektronske gustine u molekulu propilena određuje lokaciju budućeg napada protona. Ovo je atom ugljika metilenske grupe (= $CH_2$), koji nosi djelomični negativni naboj $\delta-$. I hlor, shodno tome, napada atom ugljika djelomičnim pozitivnim nabojem $\delta+$.
Kao posljedica toga, glavni produkt reakcije propilena sa klorovodikom je 2-kloropropan.
Hidratacija
Hidratacija alkena se dešava u prisustvu mineralnih kiselina i pridržava se Markovnikovog pravila. Produkti reakcije su alkoholi
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Alkilacija
Dodavanje alkana alkenima u prisustvu kiselog katalizatora ($HF$ ili $H_2SO_4$) na niskim temperaturama dovodi do stvaranja ugljovodonika veće molekularne težine i često se koristi u industriji za proizvodnju motornog goriva
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Reakcije oksidacije
Do oksidacije alkena može doći, u zavisnosti od uslova i vrste oksidacionih reagensa, kako sa prekidom dvostruke veze tako i sa očuvanjem ugljeničnog skeleta:
reakcije polimerizacije
Molekule alkena su sposobne da se pridružuju jedni drugima pod određenim uslovima uz otvaranje $\pi$-veza i formiranje dimera, trimera ili visokomolekularnih jedinjenja - polimera. Polimerizacija alkena može se odvijati i slobodnim radikalima i mehanizmom kation-anion. Kao inicijatori polimerizacije koriste se kiseline, peroksidi, metali itd. Reakcija polimerizacije se odvija i pod uticajem temperature, zračenja i pritiska. Tipičan primjer je polimerizacija etilena u polietilen
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Reakcije supstitucije
Reakcije supstitucije za alkene nisu tipične. Međutim, na visokim temperaturama (iznad 400 °C), reakcije radikalne adicije, koje su reverzibilne, su potisnute. U ovom slučaju postaje moguće izvršiti supstituciju atoma vodika u alilnom položaju uz održavanje dvostruke veze
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Hipermarket znanja >>Hemija >>Hemija 10. razred >> Hemija: alkeni
Nezasićeni ugljikovodici uključuju ugljikovodike koji sadrže višestruke veze između atoma ugljika u molekulima. Nezasićeni su alkeni, alkini, alkadieni (polieni). Ciklični ugljovodonici koji sadrže dvostruku vezu u ciklusu (cikloalkeni), kao i cikloalkani sa malim brojem ugljikovih atoma u ciklusu (tri ili četiri atoma) također imaju nezasićeni karakter. Svojstvo "nezasićenosti" povezano je sa sposobnošću ovih supstanci da uđu u reakcije adicije, prvenstveno vodika, sa stvaranjem zasićenih, ili zasićenih, ugljikovodika - alkana.
Struktura
Alkeni su aciklični, sadrže u molekuli, pored jednostrukih veza, jednu dvostruku vezu između atoma ugljika i odgovaraju općoj formuli C n H 2n.
Alkeni su dobili svoje drugo ime - "olefini" po analogiji sa nezasićenim masnim kiselinama (oleinska, linolna), čiji su ostaci dio tekućih masti - ulja (od engleskog ulja - ulje).
Atomi ugljika između kojih postoji dvostruka veza, kao što znate, su u stanju sp 2 hibridizacije. To znači da jedna s- i dvije p-orbitale učestvuju u hibridizaciji, dok jedna p-orbitala ostaje nehibridizirana. Preklapanje hibridnih orbitala dovodi do stvaranja α-veze, a zbog nehibridiziranih α-orbitala susjednih molekula etilena, atomi ugljika formiraju drugi, P-veza. Dakle, dvostruka veza se sastoji od jedne z- i jedne p-veze.
Hibridne orbitale atoma koji formiraju dvostruku vezu su u istoj ravni, dok su orbitale koje formiraju n-vezu okomite na ravan molekula (vidi sliku 5).
Dvostruka veza (0,132 nm) je kraća od jednostruke veze, a njena energija je veća, odnosno trajnija. Ipak, prisustvo mobilne, lako polarizabilne 7r veze dovodi do činjenice da su alkeni hemijski aktivniji od alkana i da su u stanju da uđu u reakcije adicije.
Homologni niz etena
Nerazgranati alkeni čine homologni niz etena (etilena).
C2H4 - eten, C3H6 - propen, C4H8 - buten, C5H10 - penten, C6H12 - heksen, itd.
Izomerizam i nomenklatura
Za alkene, kao i za alkane, karakterističan je strukturni izomerizam. Strukturni izomeri, kao što se sjećate, razlikuju se jedni od drugih po strukturi ugljičnog skeleta. Najjednostavniji alken, koji karakteriziraju strukturni izomeri, je buten.
CH3-CH2-CH=CH2 CH3-C=CH2
l
CH3
buten-1 metilpropen
Posebna vrsta strukturne izomerizma je izomerija položaja dvostruke veze:
CH3-CH2-CH=CH2 CH3-CH=CH-CH3
buten-1 buten-2
Gotovo slobodna rotacija atoma ugljika moguća je oko jedne veze ugljik-ugljik, tako da molekule alkana mogu poprimiti različite oblike. Rotacija oko dvostruke veze je nemoguća, što dovodi do pojave druge vrste izomerizma u alkenima – geometrijske ili cis-trans izomerizam.
Cis-izomeri se razlikuju od izomera toraksa po prostornom rasporedu molekularnih fragmenata (u ovom slučaju, metilnih grupa) u odnosu na ravan P odnosima, a time i svojstvima.
Alkeni su izomerni prema cikloalkanima (međuklasni izomerizam), na primjer:
ch2=ch-ch2-ch2-ch2-ch3
heksen-1 cikloheksan
Nomenklatura alkeni, koji je razvio IUPAC, sličan je nomenklaturi alkana.
1. Izbor glavnog kola
Formiranje imena ugljikovodika počinje definicijom glavnog lanca - najdužeg lanca atoma ugljika u molekuli. U slučaju alkena, glavni lanac mora sadržavati dvostruku vezu.
2. Numeracija atoma glavnog lanca
Numeracija atoma glavnog lanca počinje od kraja kojem je dvostruka veza najbliža. Na primjer, ispravan naziv veze je
ch3-chn-ch2-ch=ch-ch3 ch3
5-metilheksen-2, a ne 2-metilheksen-4 kako bi se moglo očekivati.
Ako je nemoguće odrediti početak numeracije atoma u lancu po lokaciji dvostruke veze, onda se to određuje položajem supstituenata na isti način kao i za zasićene ugljikovodike.
CH3-CH2-CH=CH-CH-CH3
l
CH3
2-metilheksen-3
3. Formiranje imena
Imena alkena nastaju na isti način kao i imena alkana. Na kraju naziva naveden je broj atoma ugljika na kojem počinje dvostruka veza i sufiks koji ukazuje da spoj pripada klasi alkena, -ena.
Potvrda
1. Krekiranje naftnih derivata. U procesu termičkog krekiranja zasićenih ugljovodonika, uz nastanak alkana, dolazi do stvaranja alkena.
2. Dehidrogenacija zasićenih ugljovodonika. Kada se alkani prođu preko katalizatora na visokoj temperaturi (400-600 °C), molekula vodika se odvaja i formira se alken: 
3. Dehidracija alkohola (cijepanje vode). Učinak sredstava za uklanjanje vode (H2804, Al203) na monohidrične alkohole na visokim temperaturama dovodi do eliminacije molekule vode i stvaranja dvostruke veze:
Ova reakcija se naziva intramolekularna dehidratacija (za razliku od intermolekularne dehidracije, koja dovodi do stvaranja etera i biće proučavana u § 16 "Alkoholi").
4. Dehidrohalogenacija (eliminacija halogenovodonika).
Kada haloalkan reaguje sa alkalijom u alkoholnom rastvoru, nastaje dvostruka veza kao rezultat eliminacije molekula halogen vodika.
Imajte na umu da ova reakcija proizvodi pretežno buten-2, a ne buten-1, što odgovara Zajcevovo pravilo:
Kada se halogenvodik odcijepi od sekundarnih i tercijalnih haloalkana, atom vodika se odcijepi od najmanje hidrogeniranog atoma ugljika.
5. Dehalogenacija. Pod djelovanjem cinka na dibromo derivat alkana, atomi halogena se odvajaju od susjednih atoma ugljika i nastaje dvostruka veza: 
Fizička svojstva
Prva tri predstavnika homolognog niza alkena su gasovi, supstance sastava C5H10-C16H32 su tečnosti, viši alkeni su čvrste materije.
Tačke ključanja i topljenja se prirodno povećavaju s povećanjem molekularne težine spojeva.
Hemijska svojstva
Reakcije sabiranja
Podsjetimo da je karakteristična karakteristika predstavnika nezasićenih ugljikovodika - alkena sposobnost ulaska u reakcije adicije. Većina ovih reakcija odvija se mehanizmom elektrofilnog dodavanja.
1. Hidrogenacija alkena. Alkeni su u stanju da dodaju vodonik u prisustvu katalizatora hidrogenacije - metala - platine, paladija, nikla:
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
Ova reakcija se odvija i pri atmosferskom i pri povišenom pritisku i ne zahteva visoku temperaturu, jer je egzotermna. Sa povećanjem temperature na istim katalizatorima može doći do obrnute reakcije, dehidrogenacije.
2. Halogenacija (dodatak halogena). Interakcija alkena sa bromnom vodom ili rastvorom broma u organskom rastvaraču (SCl4) dovodi do brze promene boje ovih rastvora kao rezultat dodavanja molekula halogena alkenu i formiranja dihaloalkana.
Markovnikov Vladimir Vasiljevič
(1837-1904)
Ruski organski hemičar. Formulirana (1869) pravila o smjeru reakcija supstitucije, eliminacije, dodavanja dvostruke veze i izomerizacije, ovisno o kemijskoj strukturi. Istraživao (od 1880.) sastav nafte, postavio temelje petrohemije kao samostalne nauke. Otvorio (1883) novu klasu organskih supstanci - cikloparafina (naftena).
3. Hidrohalogenizacija (dodatak halogenovodonika).
Reakcija dodavanja halogen vodika bit će detaljnije razmotrena u nastavku. Ova reakcija je podređena Markovnikovom pravilu:
Kada se halogen vodika doda alkenu, vodik je vezan za više hidrogenizirani atom ugljika, odnosno atom na kojem ima više atoma vodika, a halogen za manje hidrogenirani.
4. Hidratacija (dodavanje vode). Hidratacija alkena dovodi do stvaranja alkohola. Na primjer, dodavanje vode etenu je u osnovi jedne od industrijskih metoda za proizvodnju etil alkohola:
CH2=CH2 + H2O -> CH3-CH2OH
eten etanol
Imajte na umu da se primarni alkohol (sa hidroksilnom grupom na primarnom ugljiku) formira samo kada je eten hidratiziran. Kada se propen ili drugi alkeni hidriraju, nastaju sekundarni alkoholi. 
Ova reakcija se također odvija u skladu s Markovnikovovim pravilom - hidrogeniziranom atomu ugljika dodaje se vodikov kation, a manje hidrogeniranom hidroksi grupa.
5. Polimerizacija. Poseban slučaj adicije je reakcija polimerizacije alkena:
Ova reakcija adicije odvija se mehanizmom slobodnih radikala.
Reakcije oksidacije
Kao i svaka organska jedinjenja, alkeni sagorevaju u kiseoniku dajući CO2 i H20.
Za razliku od alkana, koji su otporni na oksidaciju u rastvorima, alkeni se lako oksidiraju vodenim rastvorima kalijum permanganata. U neutralnim ili blago alkalnim otopinama alkeni se oksidiraju u diole (dihidrične alkohole), a hidroksilne grupe su vezane za one atome između kojih je prije oksidacije postojala dvostruka veza.
Kao što već znate, nezasićeni ugljikovodici - alkeni mogu ući u reakcije adicije. Većina ovih reakcija odvija se mehanizmom elektrofilnog dodavanja.
elektrofilni dodatak
Elektrofilne reakcije su reakcije koje nastaju pod djelovanjem elektrofila - čestica koje nemaju elektronsku gustoću, kao što je neispunjena orbitala. Najjednostavnija elektrofilna čestica je vodikov kation. Poznato je da atom vodika ima jedan elektron na 3-in-orbitali. Vodikov kation nastaje kada atom izgubi taj elektron, tako da vodikov kation uopće nema elektrona:
H - 1e - -> H +
U ovom slučaju kation ima prilično visok afinitet prema elektronu. Kombinacija ovih faktora čini katjon vodika prilično jakom elektrofilnom česticom.
Formiranje vodikovog kationa moguće je tokom elektrolitičke disocijacije kiselina:
HBr -> H + + Br -
Iz tog razloga se mnoge elektrofilne reakcije javljaju u prisustvu i uz učešće kiselina.
Elektrofilne čestice, kao što je ranije spomenuto, djeluju na sisteme koji sadrže područja povećane elektronske gustine. Primjer takvog sistema može biti višestruka (dvostruka ili trostruka) veza ugljik-ugljik.
Već znate da su atomi ugljika između kojih se formira dvostruka veza u stanju sp 2 hibridizacije. Nehibridizirane p-orbitale susjednih atoma ugljika, koji se nalaze u istoj ravni, preklapaju se, formirajući P-veza, koja je manje jaka od z-veze i, što je najvažnije, lako se polarizira pod djelovanjem vanjskog električnog polja. To znači da se pri približavanju pozitivno nabijene čestice elektroni TC veze pomiču u njenom smjeru i dolazi do tzv. P- kompleks.
Ispostavilo se P-kompleks i nakon dodavanja vodikovog katjona u P-veze. Kation vodonika, takoreći, naiđe na gustinu elektrona koja strši iz ravni molekula P-vezuje i pridružuje mu se. ![]()
U sledećoj fazi dolazi do potpunog pomeranja elektronskog para. P-vezuje se za jedan od atoma ugljika, što dovodi do pojave usamljenog para elektrona na njemu. Orbitala atoma ugljika na kojoj se nalazi ovaj par i neispunjena orbitala vodikovog kationa se preklapaju, što dovodi do stvaranja kovalentne veze mehanizmom donor-akceptor. U isto vrijeme, drugi atom ugljika ostaje nepopunjena orbitala, odnosno pozitivan naboj.
Rezultirajuća čestica naziva se karbokation jer sadrži pozitivan naboj na atomu ugljika. Ova čestica se može kombinirati sa bilo kojim anjonom, česticom koja ima nepodijeljeni elektronski par, tj. nukleofilom.
Razmotrite mehanizam reakcije elektrofilne adicije na primjeru hidrobromiranja (adicija bromovodonika) etena:
CH2= CH2 + HBr --> CHBr-CH3
Reakcija počinje stvaranjem elektrofilne čestice - vodikovog kationa, koji nastaje kao rezultat disocijacije molekule bromovodika.
Napadi vodikovih katjona P-povezivanje, formiranje P-kompleks koji se brzo pretvara u karbokation: 
Sada razmotrite jedan komplikovaniji slučaj.
Reakcija dodavanja bromovodonika u eten teče nedvosmisleno, a interakcija bromovodonika sa propenom teoretski može dati dva proizvoda: 1-bromopropan i 2-bromopropan. Eksperimentalni podaci pokazuju da se uglavnom dobija 2-bromopropan.
Da bismo ovo objasnili, morat ćemo razmotriti međučesticu - karbokation.
Dodatak vodikovog kationa propenu može dovesti do stvaranja dva karbokationa: ako je vodikov kation vezan za prvi atom ugljika, za atom koji se nalazi na kraju lanca, onda drugi, tj. centar molekula (1), imat će pozitivan naboj; ako se pridruži drugom, tada će prvi atom (2) imati pozitivan naboj. 
Preferirani smjer reakcije ovisit će o tome koji će karbokation biti više u reakcionom mediju, što je, zauzvrat, određeno stabilnošću karbokationa. Eksperiment pokazuje dominantno stvaranje 2-bromopropana. To znači da se formiranje karbokatationa (1) s pozitivnim nabojem na centralnom atomu događa u većoj mjeri.
Veća stabilnost ovog karbokationa objašnjava se činjenicom da je pozitivan naboj na centralnom atomu ugljika kompenziran pozitivnim induktivnim efektom dvije metilne grupe čiji je ukupni učinak veći od +/- efekta jedne etilne grupe:
Obrasce reakcija hidrohalogeniranja alkena proučavao je poznati ruski hemičar V. V. Markovnikov, učenik A. M. Butlerova, koji je, kao što je već spomenuto, formulirao pravilo koje nosi njegovo ime.
Ovo pravilo je ustanovljeno empirijski, odnosno empirijski. Za sada to možemo dati potpuno uvjerljivo objašnjenje.
Zanimljivo je da se i druge reakcije elektrofilne adicije pridržavaju Markovnikovog pravila, pa bi bilo ispravno formulisati ga u opštijem obliku.
U reakcijama elektrofilne adicije, elektrofil (čestica s neispunjenom orbitalom) je vezan za hidrogenirani atom ugljika, a nukleofil (čestica sa usamljenim parom elektrona) je vezan za manje hidrogenirani.
Polimerizacija
Poseban slučaj reakcije adicije je polimerizacija alkena i njihovih derivata. Ova reakcija se odvija mehanizmom dodavanja slobodnih radikala:
Polimerizacija se provodi u prisustvu inicijatora - peroksidnih spojeva, koji su izvor slobodnih radikala. Jedinjenja peroksida nazivaju se tvarima čije molekule uključuju -O-O- grupu. Najjednostavniji peroksidni spoj je vodikov peroksid HOOH.
Na temperaturi od 100 °C i pritisku od 100 MPa dolazi do homolize nestabilne veze kiseonik-kiseonik i stvaranja radikala - inicijatora polimerizacije. Pod dejstvom KO-radikala pokreće se polimerizacija koja se razvija kao reakcija adicije slobodnih radikala. Rast lanca prestaje kada se u reakcijskoj smjesi rekombinuju radikali - polimerni lanac i radikali ili KOCH2CH2-.
Reakcijom polimerizacije slobodnih radikala tvari koje sadrže dvostruku vezu, dobiva se veliki broj makromolekularnih spojeva: 
Upotreba alkena sa različitim supstituentima omogućava sintezu širokog spektra polimernih materijala sa širokim spektrom svojstava. 
Sva ova polimerna jedinjenja imaju široku primenu u različitim oblastima ljudske delatnosti - industriji, medicini, koriste se za proizvodnju opreme za biohemijske laboratorije, neka su međuprodukti za sintezu drugih makromolekularnih jedinjenja.
Oksidacija
Već znate da se u neutralnim ili blago alkalnim otopinama alkeni oksidiraju u diole (dihidrične alkohole). U kiseloj sredini (otopina zakiseljena sumpornom kiselinom) dvostruka veza je potpuno uništena i atomi ugljika između kojih je postojala dvostruka veza pretvaraju se u atome ugljika karboksilne grupe: 
Destruktivna oksidacija alkena može se koristiti za određivanje njihove strukture. Tako, na primjer, ako se octena i propionska kiselina dobiju tijekom oksidacije nekog alkena, to znači da je penten-2 prošao oksidaciju, a ako se dobiju maslačna (butanoična) kiselina i ugljični dioksid, tada je početni ugljikovodik penten -1.
Aplikacija
Alkeni se široko koriste u hemijskoj industriji kao sirovina za proizvodnju raznih organskih supstanci i materijala.
Tako je, na primjer, eten polazni materijal za proizvodnju etanola, etilen glikola, epoksida, dikloroetana.
Velika količina etena se prerađuje u polietilen koji se koristi za proizvodnju ambalažnih folija, posuđa, cijevi i električnih izolacijskih materijala.
Iz propena se dobijaju glicerin, aceton, izopropanol, rastvarači. Polimerizacijom propena nastaje polipropilen, koji je superiorniji od polietilena u mnogim aspektima: ima višu tačku topljenja i hemijsku otpornost.
Trenutno se od polimera - analoga polietilena proizvode vlakna s jedinstvenim svojstvima. Na primjer, polipropilensko vlakno je jače od svih poznatih sintetičkih vlakana.
Materijali napravljeni od ovih vlakana obećavaju i sve se više koriste u različitim područjima ljudske djelatnosti.

1. Koje vrste izomerizma su karakteristične za alkene? Napišite formule za moguće izomere pentena-1.
2. Koja se jedinjenja mogu dobiti iz: a) izobutena (2-metilpropena); b) buten-2; c) buten-1? Napišite jednadžbe za odgovarajuće reakcije.
3. Dešifrirajte sljedeći lanac transformacija. Imenujte jedinjenja A, B, C. 4. Predložite metodu za dobijanje 2-hloropropana iz 1-hloropropana. Napišite jednadžbe za odgovarajuće reakcije.
5. Predložite metodu za prečišćavanje etana od nečistoća etilena. Napišite jednadžbe za odgovarajuće reakcije.
6. Navedite primjere reakcija koje se mogu koristiti za razlikovanje zasićenih i nezasićenih ugljikovodika.
7. Za kompletnu hidrogenizaciju 2,8 g alkena utrošeno je 0,896 l vodonika (n.a.). Koja je molekulska težina i strukturna formula ovog spoja, koji ima normalan lanac atoma ugljika?
8. Koji se gas nalazi u cilindru (eten ili propen), ako se zna da je bilo potrebno 90 cm3 (n.a.) kiseonika da potpuno sagori 20 cm3 ovog gasa?
9*. Kada alken reaguje sa hlorom u mraku, nastaje 25,4 g dihlorida, a kada ovaj alken iste mase reaguje sa bromom u tetrahloridu nastaje 43,2 g dibromida. Postavite sve moguće strukturne formule početnog alkena.
Istorija otkrića
Iz gornjeg materijala već smo shvatili da je etilen predak homolognog niza nezasićenih ugljikovodika, koji ima jednu dvostruku vezu. Njihova formula je C n H 2n i zovu se alkeni.
Njemački liječnik i hemičar Becher je 1669. godine prvi dobio etilen djelovanjem sumporne kiseline na etil alkohol. Becher je otkrio da je etilen reaktivniji od metana. Ali, nažalost, u to vrijeme naučnik nije mogao identificirati primljeni plin, pa mu nije dodijelio nikakvo ime.
Nešto kasnije, holandski hemičari su takođe koristili istu metodu za dobijanje etilena. A budući da je u interakciji s hlorom imao sposobnost formiranja uljne tekućine, prema tome je dobio naziv "gas kisika". Kasnije se saznalo da je ova tečnost dihloretan.
Na francuskom, izraz "uljano" zvuči kao oléfiant. A nakon što su otkriveni drugi ugljovodonici ove vrste, Antoine Fourcroix, francuski hemičar i naučnik, uveo je novi termin koji je postao uobičajen za čitavu klasu olefina ili alkena.
Ali već početkom devetnaestog veka, francuski hemičar J. Gay-Lussac pokazao je da se etanol sastoji ne samo od "uljnog" gasa, već i od vode. Osim toga, isti plin je pronađen u etil hloridu.
I iako su kemičari utvrdili da se etilen sastoji od vodika i ugljika, i već su znali sastav tvari, dugo nisu mogli pronaći njegovu pravu formulu. I tek 1862. godine E. Erlenmeyer je uspio dokazati prisustvo dvostruke veze u molekulu etilena. To je prepoznao i ruski naučnik A. M. Butlerov i eksperimentalno potvrdio ispravnost ovog gledišta.
Nalaz u prirodi i fiziološka uloga alkena
Mnogi su zainteresirani za pitanje gdje se alkeni mogu naći u prirodi. Dakle, ispada da se praktički ne pojavljuju u prirodi, jer je njegov najjednostavniji predstavnik, etilen, hormon za biljke i sintetizira se u njima samo u malim količinama.
Istina, u prirodi postoji takav alken kao muskalur. Ovaj jedan od prirodnih alkena je seksualni atraktant ženki kućne muhe.
Vrijedno je obratiti pažnju na činjenicu da, s visokom koncentracijom, niži alkeni imaju narkotički učinak koji može uzrokovati konvulzije i iritaciju sluznice.
Primena alkena
Život modernog društva danas je teško zamisliti bez upotrebe polimernih materijala. Pošto, za razliku od prirodnih materijala, polimeri imaju drugačija svojstva, lako se obrađuju, a ako se pogleda cijena, relativno su jeftini. Još jedan važan aspekt u korist polimera je da se mnogi od njih mogu reciklirati.
Alkeni su našli svoju primenu u proizvodnji plastike, gume, filmova, teflona, etil alkohola, acetaldehida i drugih organskih jedinjenja.

U poljoprivredi se koristi kao sredstvo koje ubrzava proces zrenja voća. Propilen i butileni se koriste za proizvodnju raznih polimera i alkohola. Ali u proizvodnji sintetičke gume koristi se izobutilen. Stoga možemo zaključiti da se alkeni ne mogu izostaviti, jer su oni najvažnije hemijske sirovine.
Industrijska upotreba etilena
U industrijskim razmjerima, propilen se obično koristi za sintezu polipropilena i za proizvodnju izopropanola, glicerola, butirnih aldehida itd. Svake godine se povećava potreba za propilenom.

4.3.b. Dodatak halogenovodonika (hidrohalogenacija)
Druga važna reakcija elektrofilnog dodavanja alkenima je dugo poznata hidrohalogenacija alkena.
Slijede tipični primjeri dodavanja HCl, HBr i HI raznim alkenima.


Učinak alkil supstituenata na dvostruku vezu na brzinu dodavanja opisan je sljedećim nizom:
R 2 C=CHR > RCH=CHR > RCH=CH 2
Ovo je u skladu s mehanizmom u kojem je korak reakcije koji određuje brzinu formiranje karbokatjona, budući da se stabilnost alkil katjona smanjuje u nizu tercijarni > sekundarni > primarni. Dakle, mehanizam adicije mora uključivati srednje formiranje ili slobodnog karbokatjona, što je rijetko, ili intermedijara sa karbokationskim karakterom. Poslednji slučaj je najtipičniji.
Ako bi se adicija dogodila kroz "slobodni karbokation", tada bi reakcija bila potpuno nestereoselektivna, budući da alkil kationi imaju planarnu strukturu. Međutim, hidrohalogenacija se po pravilu odvija stereoselektivno, a ovisno o vrsti alkena, selektivno anti- veza, selektivna sin- ili mješoviti sin-anti- pristupanje.
Za alkene, kod kojih dvostruka veza nije konjugirana s aromatičnim prstenom, karakteristično je anti- dodavanje halogenovodonika. Anti- za cikloheksen, ciklopenten, 1,2-dimetilheksen, 1,2-dimetilpenten primećeno je dodavanje hlorovodonika i bromovodonika, deuterijum hlorida i bromida, cis- I trans-buten-2, heksen-3 i mnogi drugi jednostavni alkeni i cikloalkeni.

U adicijskom proizvodu isti supstituenti (metilne grupe) nalaze se na suprotnim stranama srednje ravni cikloheksanskog prstena, pa pripada trans-red. Anti-adicija je teško kompatibilna sa mehanizmom u kojem se pretpostavlja formiranje diskretnog karbokationa. Za planarni karbokation, nukleofilni napad halidnog jona je jednako vjerojatan s obje strane ravnine, što bi trebalo dovesti do stvaranja mješavine proizvoda sin- I anti- veze. Kinetika hidrohalogenacije alkena također ukazuje na složeniji mehanizam adicije. Za nekonjugirane alkene, brzina reakcije je opisana jednačinom trećeg reda sa drugim redom u smislu halogenovodonika, odnosno odgovara Ad E 3 mehanizmu.
v = k [alken] 2
Reakcija protiv adicije i reakcija drugog reda u odnosu na halogen vodonik je u dobroj saglasnosti s Ad E 3 mehanizmom u kojem alken reagira s dvije molekule halogenovodonika, od kojih jedna djeluje kao elektrofilna, a druga kao nukleofilna.

Takav trimolekularni mehanizam sugerira da se u početku formira kompleks alkena i jedne molekule halogenovodonika, nakon čega slijedi napad drugog HX molekula na ovaj kompleks sa anti-strane bez formiranja diskretne karbokacije. Posebno treba napomenuti da se svaki trimolekularni mehanizam mora sastojati od dva uzastopna stupnja, budući da je istovremeni sudar tri molekula krajnje malo vjerojatan.

Anti-adicija ukazuje na preferencijalni nukleofilni napad halogenovodonika sa strane suprotne onoj sa koje je alken protoniran. Umjesto halogenovodonika, funkciju nukleofilnog agensa u završnoj fazi može obavljati i halogenidni jon. Zaista, brzina reakcije obično raste u direktnoj proporciji s koncentracijom halidnog jona unesenog u reakcijsku smjesu u obliku tetraalkilamonijum halida NR 4+ X - ili litijum LiX. U ovom slučaju, stereospecifičan anti- pristupanje.
Za alkane, kod kojih je dvostruka veza konjugirana sa aromatičnim prstenom, karakteristično je sin- vezni ili mješoviti sin-anti-dodatak halogen vodika, na primjer:

Sin-vezanost je dominantan proces za cis- I trans-izomeri 1-fenilpropena, 1-fenil-4-alkilcikloheksena, acenaftilena, indena. Protoniranje takvih alkena rezultira stvaranjem karbokationa benzilnog tipa, koji su stabilniji od čistih alkil katjona koji nastaju protonacijom običnih alkena i cikloalkena. Kinetika reakcije u ovom slučaju obično se opisuje jednostavnijom jednačinom drugog reda v = k[alken], odnosno odgovara bimolekularnom Ad E 2 mehanizmu. Mehanizam Ad E 2 uključuje formiranje jonskog para uključujući karbokation i halid ion.

Ne može se očekivati da će mehanizam adicije koji uključuje parove jona biti visoko stereoselektivan. Ako se ionski par pretvori u konačni proizvod brže od rotacije oko jednostavne veze ugljik-ugljik, krajnji rezultat će biti sin-adicija, gdje su proton i halogenid ion vezani na istoj strani dvostruke veze. Inače, formiranje proizvoda se posmatra kao sin- tako i anti- HX konekcije. Takav slučaj se ostvaruje tokom hidrohalogenacije par-supstituisani stireni Z-C 6 H 4 -CH=CH 2 . Obrazac koji je ovdje uočen je takav sin-adicija je tipična samo za one olefine koji pri protoniranju daju relativno stabilan karbokation, odnosno u slučaju donorskih supstituenata Z.
Reakcije hidrohalogenacije koje se odvijaju prema Ad E 2 mehanizmu karakteriziraju nadmetanje između procesa konjugovanog dodavanja i rearanžiranja, jer se kao intermedijer formira karbokation ili jonski par.

Kao primjer rearanžiranja sa 1,2-migracijom alkil grupe i hidridnog jona, predstavljamo reakcije hidrohalogenacije terc-butiletilena i izopropiletilena.

Prilikom izvođenja iste reakcije bez rastvarača na hladnom (-78 0 C), nastaje mješavina 33% normalnih i 67% anomalnih (preuređenih) adicijskih produkata.

4.3.c. Orijentacija. Markovnikovo pravilo
Za razliku od simetričnih elektrofila (Hal 2), vodonik halogenidi su nesimetrični elektrofilni reagensi. Dodatak bilo kojeg nesimetričnog elektrofila (HBr, ICl, H2O, Hg (OAc)2, itd.) nesimetričnom alkenu bi u principu mogao dati mješavinu dva alternativna proizvoda, ali u praksi obično nastaje samo jedan od njih. Kao primjer, uzmite u obzir dodavanje bromovodika u propilen.

Davne 1870. godine V.V. Markovnikov je formulirao empirijsko pravilo prema kojem nesimetrični alkeni dodaju HX na način da se pretežno formira proizvod u kojem se vodik dodaje na najmanje supstituirani, a X na najsupstituiraniji kraj dvostruke veze.
Obično se Markovnikovo pravilo objašnjava razlikom u stabilnosti dva alternativna karbokationa. Na primjer, u gornjem primjeru, normalno n-propil kation je mnogo manje stabilan od izopropil kationa, pa se reakcija odvija drugim putem.
Markovnikovo pravilo se prvobitno koristilo samo za dodavanje HX ugljovodoničnim supstratima, ali se u principu može proširiti na reakcije drugih supstituisanih alkena. Dakle, dodavanje HCl u CF 3 CH=CH 2 daje " anti-Markovnikov "proizvod CF 3 CH 2 CH 2 Cl. Ovo je bilo i za očekivati, budući da je katjon CF 3 CH+ CH 3 manje stabilan od katjona CF 3 CH 2 CH 2+ zbog jakog (-I)-efekta CF 3 -grupa Kation CF 3 CH 2 CH 2+ se pretežno formira, ali je također, iako u manjoj mjeri, destabiliziran induktivnim djelovanjem CF 3 grupe, uslijed čega se dodavanjem HCl u trifluorometiletilen je mnogo sporiji od dodavanja nesupstituisanom etilenu.
Iz sličnog razloga, viniltrialkilamonijum kationi dodaju HBr i protiv Markovnikovovog pravila:
Dodavanje HX alkenima sa jakim (-I) i (-M) supstituentima, na primer, akrilonitrilu ili nitroetilenu, takođe mora biti protiv Markovnikovovog pravila. Međutim, u ovom slučaju dvostruka veza je tako snažno deaktivirana u odnosu na elektrofilne reagense da se ove reakcije odvijaju samo u vrlo teškim uvjetima. Vinil hlorid CH 2 =CHCl uvijek daje isključivo "Markovnikove adukte". Na primjer, kada reaguje sa HCl, nastaje samo 1,1-dihloretan (geminalni dihlorid) CH 3 CHCl 2. Klor, slično kao i CF 3 grupa, ima snažno (-I) dejstvo, pa se na prvi pogled čini da bi iz tog razloga dodatak trebalo da ima anti-Markovnikovu orijentaciju, jer kation + CH 2 CH 2 Cl treba da bude stabilniji od kationa CH 3 CH + Cl. Međutim, za razliku od CF 3 grupe, hlor, pored (-I) efekta, ima i (+ M) efekat koji mu se suprotstavlja (jer ima usamljene parove). Iskustvo pokazuje da je veličina mezomernog efekta sasvim dovoljna da se energija 1-hloretil kationa spusti ispod energetskog nivoa 2-hloretil kationa, u kojem se efekat +M ne manifestuje.
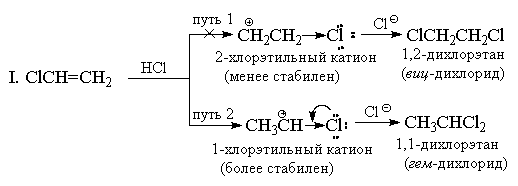
II. Sa stanovišta teorije rezonancije, struktura 1-kloroetil kationa može se predstaviti na sljedeći način:
Međutim, dodavanje vinil hlorida se odvija sporije nego etilenu pod istim uslovima, tj. prema ukupnom efektu (-I> +M), hlor ostaje supstituent koji povlači elektrone u odnosu na vodonik, a 1-hloretil kation je manje stabilan od C 2 H 5 + . Drugi vinil halogenidi reaguju slično sa HX.
Vinil eteri CH 2 =CHOR dodaju HX (X=Hal) prema Markovnikovom pravilu mnogo većom brzinom od svih gore navedenih supstituisanih alkena. Ovo je zbog značajnog +M efekta RO grupe. Za razliku od atoma hlora, RO grupa u smislu ukupnog elektronskog efekta (+M > -I) je jak supstituent koji donira elektrone, koji efikasno stabilizuje susedni karbokationski centar. Struktura karbokatjona u ovom slučaju se takođe može predstaviti kao skup dve rezonantne strukture
Napad oksonijum kationa halogenim anjonom dovodi do stvaranja α-haloestera tipa CH 3 CH(Hal)OR.
4.3.d. Hidratacija alkena
Hidratacija alkena katalizirana kiselinom dovodi do stvaranja alkohola. Smjer hidratacije alkena određen je Markovnikovim pravilom, pa se pretpostavlja da u ovoj reakciji nastaje karbokation kao međučestica.
Tendencija sekundarnih alkil karbokationa da se preuređuju sprečavaju upotrebu hidratacije alkena za dobijanje sekundarnih alkohola.

Ova metoda u laboratoriji našla je ograničen opseg samo za pripremu tercijalnih alkohola. Reakcija hidratacije u ovom slučaju je uglavnom reverzibilna i tercijarni alkoholi nastaju u niskim prinosima (40-45%).


Hidratacija najjednostavnijih alkena - etilena i propilena - važna je industrijska metoda za dobijanje etil i izopropil alkohola.

U laboratorijskoj praksi direktna hidratacija alkena nije našla široku primjenu kako zbog otežanih uvjeta tako i zbog stvaranja značajne količine izomernih alkohola. Trenutno se srodna reakcija hidroksimerkuracije i demerkuracije obično koristi za regioselektivnu proizvodnju alkohola iz alkena.
4.3.d. Hidroksimerkuracija-demerkuracija
Elektrofilni napad na dvostruku vezu alkena mogu izvršiti ioni metala, među kojima posebnu poziciju zauzima kation žive (II). Živin acetat pod veoma blagim uslovima na 20°C dodaje se alkenima u vodenom rastvoru tetrahidrofurana (THF) ili u vodenom rastvoru sirćetne kiseline da bi se formirala organoživa jedinjenja. Dodavanje živinog acetata na dvostruku vezu odvija se regiospecifično u strogom skladu s Markovnikovovim pravilom, tj. živin kation se vezuje za najmanje supstituirani atom ugljika.
C-Hg veza u organoživim jedinjenjima može se lako odcijepiti natrijum borohidridom NaBH 4 da bi se formirala živa i nova C-H veza. Pretpostavlja se da se alkil živin hidrid dobije kao nestabilan intermedijer, koji se dalje razgrađuje uz oslobađanje metalne žive radikalnim mehanizmom.

Ukratko, ovaj dvostepeni proces hidroksimerkuracije-demerkuracije na kraju predstavlja regiospecifičnu hidrataciju alkena prema Markovnikovovom pravilu pod izuzetno blagim uslovima, kada je stvaranje nusproizvoda svedeno na maksimalno mogući minimum. To se može jasno ilustrirati sljedećim primjerima, u kojima je ukupan prinos produkta reakcije 90-98%. Navedeni brojčani podaci u ovom slučaju ne ukazuju na prinose nastalih jedinjenja, već na njihov odnos u smeši.




Kao što se može vidjeti iz gornjih primjera, hidroksimerkuracija-demerkuracija alkena u većini slučajeva obezbjeđuje regiospecifičnu hidrataciju alkena sa stvaranjem praktično samo jednog od dva izomerna alkohola. Treba napomenuti da nema potrebe za izolacijom organskog jedinjenja žive, te se oba procesa mogu izvoditi direktno jedan za drugim.
Hidroksimerkuracija nesimetričnih alkena očito počinje napadom AcOHg + kationa i stvaranjem nesimetričnog cikličkog kationa živine (analogno nesimetričnom halonijevom jonu) kao međuprodukta, koji se zatim otvara kao rezultat najviše nukleofilnog napada vode. supstituirani atom ugljika koji nosi veći pozitivni naboj.

Premosni živin jon može se fiksirati u nenukleofilnoj jako kiseloj sredini čak i na 20 0 C dodavanjem jačeg elektrofilnog sredstva - živinog trifluoracetata u mješavini fluorosulfonske kiseline i antimon pentafluorida.

Kation žive može se razdvojiti ne samo djelovanjem vode, već i drugim otapalima koji doniraju elektrone: alkoholima, octenom kiselinom, acetonitrilom, itd. Konačni proizvod reakcije u ovom slučaju će biti eteri, acetati ili N-supstituirani amidi octena kiselina, na primjer:


Kada se koriste razgranati sekundarni ili tercijarni alkoholi u reakciji alkoksimerkuracije-demerkuracije, Hg(OCOCF 3) 2 trifluoroacetat ili Hg(OSO 2 CF 3) 2 trifluoracetat su efikasniji od živinog acetata.

Dakle, hidroksi- i alkoksimerkuracija-demerkuracija je jedna od najboljih preparativnih metoda za sintezu alkohola i etera sa razgranatim alkil radikalima.
Dodatak živinih soli alkenima je najupečatljiviji primjer konjugirane reakcije adicije na dvostruku vezu, gdje ulogu vanjskog nukleofilnog agensa igra otapalo. Stereohemija dualnog procesa hidroksimerkuracije-demerkuracije zavisi od stereohemijskog ishoda svakog pojedinačnog koraka. Hidroksimerkuraciju karakteriše anti-adicija, kao i za druge reakcije koje uključuju ciklički kation. Međutim, radikalnu demerkuraciju ne karakteriše visoka stereoselektivnost. Stoga je cijeli proces u cjelini također nestereospecifičan.
4.3.f. Dodatak alkena (kationska dimerizacija i polimerizacija alkena)
Najzanimljiviji primjer ove vrste reakcije je dimerizacija i polimerizacija izobutilena u prisustvu sumporne kiseline.

Tehnički naziv za ovu mješavinu alkena je "diizobutilen". Ova reakcija se odvija prema kationskom mehanizmu sličnom mehanizmu dodavanja mineralnih kiselina na dvostruku vezu alkena. U prvom koraku, proton je vezan za molekulu izobutilena kako bi se formirao relativno stabilan tert-butilacija. Dalje formiran tert-butilacija (Lewisova kiselina) reaguje sa molekulom izobutilena (Lewisova baza) da bi se formirao novi stabilni tercijarni oktil kation.

U tim uslovima, pod dejstvom baza (H 2 O, HSO 4 - joni), oktil karbokation brzo gubi proton i pretvara se u mešavinu izomernih pentena, jer se odvajanje protona dešava sa dva različita položaja:

Preferencijalno formiranje termodinamički manje stabilnog alkena - 2,4,4-trimetilpentena-1 (80% u reakcijskoj smjesi) povezano je s većom prostornom dostupnošću za napad bazama atoma vodika metilnih grupa u odnosu na atome vodika metilenske grupe. U industriji, "diizobutilen" se hidrogenira na Ni-Raneyju da bi se dobio "izooktan" (tehnički naziv za ugljovodonik 2,2,4-trimetilpentan), koji se koristi kao visokooktansko gorivo za motore sa unutrašnjim sagorevanjem.
Pri visokim koncentracijama sumporne kiseline (više od 80%) dolazi do kationske polimerizacije izobutilena da bi se formirao polimer koji se zove poliizobutilen (-CH2C(CH3)2-)n. Ovaj polimer sličan gumi koristi se za dobijanje antikorozivnih i hidroizolacionih premaza, zaptivača itd.
Pored izobutilena, prema kationskom mehanizmu polimeriziraju se 3-metilbuten-1, vinil eteri i neki derivati stirena koji su sposobni da formiraju relativno stabilne karbokatione. Kao katalizatori katjonske polimerizacije koriste se i fluorovodonik i Lewisove kiseline: BF 3 , AlCl 3 , AlBr 3 i druge u prisustvu vrlo malih količina vode.
4.3.g. Dodatak alkana (alkilacija alkena)
Druga industrijska metoda za sintezu "izooktana" temelji se na interakciji izobutilena s viškom izobutana u prisustvu koncentrirane sumporne kiseline ili u bezvodnom fluorovodiku na 0 10 0 C.

Ova reakcija se također odvija putem kationskog mehanizma i, što je od posebnog interesa, primjer je kationskog lančanog procesa. Prvo, izobutilen dimerizuje pod uslovima reakcije da bi formirao tercijarni oktilkatjon (CH 3) 3 CCH 2 C + (CH 3) 2 . Mehanizam njegovog formiranja detaljno je opisan u prethodnom odeljku. Zatim dolazi do brzog prijenosa vodika (u obliku hidridnog jona) iz izobutana u oktil kation uz formiranje "izooktanske" molekule i novog terc-butil kationa, koji zauzvrat brzo reagira s izobutilenom i nastaje novi oktil kation, itd.

Pored sinteze "izooktana", ova metoda alkilacije se koristi u petrohemijskoj industriji za sintezu razgranatih ugljovodonika visokog ključanja iz razgranatih alkena i alkana niskog ključanja sa frakcijom termičkog krekiranja.
ALKENI
Ugljovodonici, u čijoj molekuli, pored prostih ugljik-ugljenik i ugljik-vodik σ-veze, postoje π-veze ugljik-ugljenik, nazivaju se neograničeno. Budući da je formiranje π veze formalno ekvivalentno gubitku dva atoma vodika od strane molekule, nezasićeni ugljovodonici sadrže 2p manje atoma vodika od granice, gdje P - broj π-veza:
Zove se niz čiji se članovi međusobno razlikuju za (2H) n izološka strana. Dakle, u gornjoj shemi, izolozi su heksani, hekseni, heksadieni, heksini, heksatrieni, itd.
Ugljovodonici koji sadrže jednu π-vezu (tj. dvostruku vezu) nazivaju se alkeni (olefini) ili, prema prvom članu serije - etilen, etilenski ugljovodonici. Opšta formula za njihov homologni niz C p H 2l.
1. Nomenklatura
U skladu sa pravilima IUPAC-a, prilikom konstruisanja imena alkena, najduži ugljikov lanac koji sadrži dvostruku vezu dobiva naziv odgovarajućeg alkana, u kojem je završetak -en promijenio u -en. Ovaj lanac je numerisan na takav način da atomi ugljika uključeni u formiranje dvostruke veze dobiju najmanji mogući broj:

Radikali su imenovani i numerisani kao u slučaju alkana.
Za alkene relativno jednostavne strukture dozvoljena su jednostavnija imena. Dakle, neki od najčešćih alkena se nazivaju dodavanjem sufiksa -en na ime ugljikovodičnih radikala s istim ugljikovim kosturom:
Ugljovodonični radikali formirani od alkena dobijaju sufiks -enil. Numeracija u radikalu počinje od atoma ugljika koji ima slobodnu valenciju. Međutim, za najjednostavnije alkenil radikale, umjesto sistematskih naziva, dopušteno je koristiti trivijalne:

Atomi vodika koji su direktno vezani za nezasićene atome ugljika koji formiraju dvostruku vezu često se nazivaju vinil vodikovi atomi,
2. Izomerizam
Pored izomerizma ugljeničnog skeleta, u nizu alkena postoji i izomerija položaja dvostruke veze. Općenito, izomerizam ovog tipa - supstituent položaj izomerizam (funkcije)- primećuje se u svim slučajevima kada u molekuli postoje funkcionalne grupe. Za alkan C 4 H 10 moguća su dva strukturna izomera:
Za alken C 4 H 8 (buten) moguća su tri izomera:

Buten-1 i buten-2 su izomeri položaja funkcije (u ovom slučaju njegovu ulogu igra dvostruka veza).
Prostorni izomeri se razlikuju po prostornom rasporedu supstituenata jedan u odnosu na drugi i nazivaju se cis izomeri, ako su supstituenti na istoj strani dvostruke veze, i trans izomeri, ako na suprotnim stranama:

3. Struktura dvostruke veze
Energija kidanja molekula na C=C dvostrukoj vezi je 611 kJ/mol; pošto je energija σ-veze C-C 339 kJ/mol, energija prekida π veze je samo 611-339 = 272 kJ/mol. Na π-elektrone je mnogo lakše nego na σ-elektrone utjecati, na primjer, polarizirajućim rastvaračima ili bilo kojim napadačkim reagensima. Ovo se objašnjava razlikom u simetriji distribucije elektronskog oblaka σ- i π-elektrona. Maksimalno preklapanje p-orbitala i, posljedično, minimalna slobodna energija molekula ostvaruje se samo s planarnom strukturom vinilnog fragmenta i sa skraćenom C-C razmakom od 0,134 nm, tj. mnogo manja od udaljenosti između atoma ugljika povezanih jednom vezom (0,154 nm). S rotacijom "polovina" molekula jedna u odnosu na drugu duž osi dvostruke veze, smanjuje se stupanj preklapanja orbitala, što je povezano s utroškom energije. Posljedica ovoga je odsustvo slobodne rotacije duž ose dvostruke veze i postojanje geometrijskih izomera sa odgovarajućom supstitucijom na atomima ugljika.
Alkenes- nezasićeni ugljovodonici, koji sadrže jednu dvostruku vezu. Primjeri alkena:

Metode za dobijanje alkena.
1. Krekiranje alkana na 400-700°C. Reakcija se odvija prema mehanizmu slobodnih radikala:

2. Dehidrogenacija alkana:
3. Reakcija eliminacije (cijepanje): 2 atoma ili 2 grupe atoma se odcjepljuju od susjednih atoma ugljika i formira se dvostruka veza. Ove reakcije uključuju:
A) Dehidracija alkohola (zagrijavanje iznad 150°C, uz učešće sumporne kiseline kao reagensa za uklanjanje vode):
B) Cepanje halogenovodonika kada su izloženi alkoholnom rastvoru alkalija:

Atom vodika se odvaja uglavnom od atoma ugljika koji je povezan s manjim brojem atoma vodika (najmanje hidrogenirani atom) - Zajcevovo pravilo.
B) Dehalogenacija:

Hemijska svojstva alkena.
Svojstva alkena određena su prisustvom višestruke veze, pa alkeni ulaze u elektrofilne reakcije adicije, koje se odvijaju u nekoliko faza (H-X - reagens):
1. faza:

2. faza:
 .
.
Ion vodika u ovoj vrsti reakcije pripada atomu ugljika koji ima negativniji naboj. Distribucija gustine je:

Ako kao supstituent postoji donor, koji se manifestuje kao +I- efekat, tada se elektronska gustina pomera prema najhidrogenizovanijem atomu ugljenika, stvarajući na njemu delimično negativan naboj. Reakcije idu dalje Markovnikovo pravilo: kada se vežu polarni molekuli ovog tipa HX (HCl, HCN, HOH itd.) za nesimetrične alkene, vodonik se dodaje prvenstveno hidrogenizovanijem atomu ugljenika na dvostrukoj vezi.
A) Reakcije sabiranja:
1) Hidrohalogenacija:
Reakcija se odvija prema Markovnikovom pravilu. Ali ako je peroksid prisutan u reakciji, onda se pravilo ne uzima u obzir:
2) Hidratacija. Reakcija se odvija prema Markovnikovovom pravilu u prisustvu fosforne ili sumporne kiseline:

3) Halogenacija. Kao rezultat toga, bromna voda postaje obezbojena - ovo je kvalitativna reakcija na višestruku vezu:
4) Hidrogenacija. Reakcija se odvija u prisustvu katalizatora.



