Алкени хімічно активні. Їхні хімічні властивості багато в чому визначаються наявністю подвійного зв'язку. Для алкенів найбільш характерні реакції електрофільного приєднання та реакції радикального приєднання. Реакції нуклеофільного приєднання зазвичай вимагають наявність сильного нуклеофілу та для алкенів не типові. Алкени легко вступають у реакції окислення, приєднання і здатні до алільного радикального заміщення.
Реакції приєднання
Гідрування Приєднання водню (реакція гідрування) до алкенів проводять у присутності каталізаторів. Найчастіше використовують подрібнені метали - платину, нікель, паладій та ін. У результаті утворюються відповідні алкани (насичені вуглеводні).
$CH_2=CH_2 + H2 → CH_3–CH_3$
Приєднання галогенів. Алкени легко за звичайних умов вступають у реакції з хлором та бромом з утворенням відповідних дигалогеналканів, у яких атоми галогену знаходяться у сусідніх атомів вуглецю.
Зауваження 1
При взаємодії алкенів із бромом спостерігається знебарвлення жовто-бурого забарвлення брому. Це одна із найстаріших і найпростіших якісних реакцій на ненасичені вуглеводні, оскільки аналогічно реагують також алкіни та алкадієни.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
Приєднання галогеноводородів. При взаємодії етиленових вуглеводнів з галогеноводородами ($HCl$, $HBr$) утворюються галогеналкани, напрямок реакції залежить від будови алкенів.
У разі етилену або симетричних алкенів реакція приєднання відбувається однозначно і веде до утворення лише одного продукту:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
У разі несиметричних алкенів можливе утворення двох різних продуктів реакції приєднання:
Зауваження 2
Насправді в основному утворюється лише один продукт реакції. Закономірність в напрямку проходження таких реакцій встановив російський хімік В.В. Марковникова в 1869 р. Вона називається правилом Марковникова. При взаємодії галогеноводородів з несиметричними алкенами атом водню приєднується за місцем розриву подвійного зв'язку найбільш гидрированного атома вуглецю, тобто до того, що з'єднаний з великою кількістю атомів водню.
Це правило Марковников сформулював з урахуванням експериментальних даних, і лише значно пізніше воно отримало теоретичне обгрунтування. Розглянемо реакцію пропілену з хлористим воднем.
Однією з особливостей $p$-зв'язку є його здатність легко поляризуватися. Під впливом метильної групи (позитивний індуктивний ефект + $I$) у молекулі пропіна електронна щільність $p$-зв'язку зміщується до одного з атомів вуглецю (= $CH_2$). Внаслідок цього у ньому виникає частковий негативний заряд ($\delta -$). На іншому атомі вуглецю подвійного зв'язку відповідно виникає частковий заряд позитивний ($\delta +$).
Такий розподіл електронної густини в молекулі пропілену визначає місце майбутньої атаки протоном. Це атом вуглецю метиленової групи (= $CH_2$), який несе частковий негативний заряд $delta-$. А хлор відповідно атакує атом вуглецю з частковим позитивним зарядом $delta+$.
Як наслідок, основним продуктом реакції пропілену з хлористим воднем є 2-хлорпропан.
Гідратація
Гідратація алкенів відбувається у присутності мінеральних кислот і підпорядковується правилу Марковникова. Продуктами реакції є спирти
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Алкілювання
Приєднання алканів до алкенів у присутності кислотного каталізатора ($HF$ або $H_2SO_4$) за низьких температур призводить до утворення вуглеводнів з більшою молекулярною масою і часто використовується в промисловості для отримання моторного палива
$R–CH_2=CH_2 + R'–H → R–CH_2–CH_2–R’$
Реакції окиснення
Окислення алкенів може відбуватися залежно від умов та видів окисних реагентів як з розривом подвійного зв'язку, так і зі збереженням вуглецевого скелета:
Реакції полімеризації
Молекули алкенів здатні приєднуватися за певних умов один до одного з розкриттям $\pi$-зв'язків та утворення димерів, тримерів або високомолекулярних сполук - полімерів. Полімеризація алкенів може протікати як за вільнорадикальним, так і катіонно-аніонним механізмом. Як ініціатори полімеризації застосовують кислоти, перекиси, метали та ін Реакцію полімеризації здійснюють також під дією температури, опромінення, тиску. Типовим прикладом є полімеризація етилену з утворенням поліетилену
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Реакції заміщення
Реакції заміщення для алкенів є характерними. Однак при високих температурах (понад 400°C) реакції радикального приєднання, що мають оборотний характер, і пригнічуються. У цьому випадку стає можливим провести заміщення атома водню, що знаходиться в аллільному положенні при збереженні подвійного зв'язку.
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Гіпермаркет знань >>Хімія >>Хімія 10 клас >> Хімія: Алкени
До ненасичених відносять вуглеводні, що містять в молекулах кратні зв'язки між атомами вуглецю. Ненасиченими є алкени, алкіни, алкадієни (полієни). Ненасиченим характером мають також циклічні вуглеводні, що містять подвійний зв'язок у циклі (циклоалке-ни), а також циклоалкани з невеликим числом атомів вуглецю в циклі (три або чотири атоми). Властивість «ненасиченості» пов'язане зі здатністю цих речовин вступати в реакції приєднання, насамперед водню, з утворенням граничних, або насичених, вуглеводнів - алканів.
Будова
Алкени - ациклічні , що містять у молекулі, крім одинарних зв'язків, один подвійний зв'язок між атомами вуглецю та відповідні загальній формулі С n Н 2n .
Свою другу назву – «олефіни» – алкени отримали за аналогією з жирними ненасиченими кислотами (олеїнова, лінолева), залишки яких входять до складу рідких жирів – олій (від англ. oil – олія).
Атоми вуглецю, між якими є подвійний зв'язок, як ви знаєте, перебувають у стані sp 2 -гібридизації. Це означає, що в гібридизації беруть участь одна s- та дві р-орбіталі, а одна р-орбіталь залишається негібридизованою. Перекриття гібридних орбіталей призводить до утворення а-зв'язку, а за рахунок негібридизованих -орбіталей сусідніх молекули етилену атомів вуглецю утворюється друга, п-зв'язок. Таким чином, подвійний зв'язок складається з одного Þ-і одного п-зв'язку.
Гібридні орбіталі атомів, що утворюють подвійний зв'язок, знаходяться в одній площині, а орбіталі, що утворюють л-зв'язок, розташовуються перпендикулярно до площини молекули (див. рис. 5).
Подвійний зв'язок (0,132 нм) коротший за одинарний, а його енергія більша, тобто вона є більш міцною. Проте наявність рухомого, легко поляризованого 7г-зв'язку призводить до того, що алкени хімічно активніші, ніж алкани, і здатні вступати в реакції приєднання.
Гомологічний ряд етену
Нерозгалужені алкени становлять гомологічний ряд етену (етилену).
С2Н4 – етен, С3Н6 – пропен, С4Н8 – бутен, С5Н10 – пентен, С6Н12 – гексен і т.д.
Ізомерія та номенклатура
Для алкенів, як і алканів, характерна структурна ізомерія. Структурні ізомери, як пам'ятаєте, відрізняються друг від друга будовою вуглецевого скелета. Найпростіший алкен, котрим характерні структурні ізомери , - це бутен.
СН3-СН2-СН=СН2 СН3-С=СН2
l
СН3
бутен-1 метилпропен
Особливим видом структурної ізомерії є ізомерія положення подвійного зв'язку:
СН3-СН2-СН=СН2 СН3-СН=СН-СН3
бутен-1 бутен-2
Навколо одинарного вуглець-вуглецевого зв'язку можливе практично вільне обертання атомів вуглецю, тому молекули алканів можуть набувати найрізноманітнішої форми. Обертання навколо подвійного зв'язку неможливо, що призводить до появи у алкенів ще одного виду ізомерії - геометричної, або цис-транс-ізомерії.
Цис-ізомери відрізняються від торакс-ізомерів просторовим розташуванням фрагментів молекули (у даному випадку мітильних груп) щодо площини. п-зв'язку, отже, і властивостями.
Алкени ізомерні циклоалканам (міжкласова ізомерія), наприклад:
сн2=сн-сн2-сн2-сн2-сн3
гексен-1 циклогексан
Номенклатура алкенів, Розроблена ІЮПАК, схожа з номенклатурою алканів.
1. Вибір головного ланцюга
Утворення назви вуглеводню починається з визначення головного ланцюга - найдовшого ланцюжка атомів вуглецю в молекулі. У разі алкенів головний ланцюг повинен містити подвійний зв'язок.
2. Нумерація атомів головного ланцюга
Нумерація атомів головного ланцюга починається з того кінця, до якого ближче перебуває подвійний зв'язок. Наприклад, правильна назва з'єднання
сн3-сн-сн2-сн=сн-сн3 сн3
5-метилгексен-2, а не 2-метилгексен-4, як можна було б припустити.
Якщо за розташуванням подвійного зв'язку не можна визначити початок нумерації атомів у ланцюзі, його визначає положення заступників як і, як граничних вуглеводнів.
CH3- CH2-CH=CH-СН-СН3
l
СН3
2-метилгексен-З
3. Формування назви
Назви алкенів формуються так само, як і назви ал-канів. Наприкінці назви вказують номер атома вуглецю, у якого починається подвійний зв'язок, і суфікс , що означає належність з'єднання до класу алкенів -ен.
Отримання
1. Крекінг нафтопродуктів. У процесі термічного крекінгу граничних вуглеводнів поряд з утворенням алканів відбувається утворення алкенів.
2. Дегідрування граничних вуглеводнів. При пропущенні алканів над каталізатором при високій температурі (400-600 °С) відбувається відщеплення молекули водню та утворення алкену: 
3. Дегідратація спиртів (відщеплення води). Вплив водовіднімних засобів (Н2804, Аl203) на одноатомні спирти при високій температурі призводить до відщеплення молекули води та утворення подвійного зв'язку:
Цю реакцію називають внутрішньомолекулярною дегідратацією (на відміну від міжмолекулярної дегідратації, яка призводить до утворення простих ефірів та буде вивчена у § 16 «Спирти»).
4. Дегідрогалогенування (відщеплення галогеноводороду).
При взаємодії галогеналкану з лугом у спиртовому розчині утворюється подвійний зв'язок внаслідок відщеплення галогеноводородної молекули.
Зверніть увагу, що в результаті цієї реакції утворюється переважно бутен-2, а не бутен-1, що відповідає правилу Зайцева:
При відщепленні галогеноводороду від вторинних та третинних галогеналканів атом водню відщеплюється від найменш гідрованого атома вуглецю.
5. Дегалогенування. При дії цинку на дибромпроізводное алкану відбувається відщеплення атомів галогенів, що знаходяться при сусідніх атомах вуглецю, і утворення подвійного зв'язку: 
Фізичні властивості
Перші три представники гомологічного ряду алкенів – гази, речовини складу С5Н10-С16Н32 – рідини, вищі алкени – тверді речовини.
Температури кипіння та плавлення закономірно підвищуються зі збільшенням молекулярної маси сполук.
Хімічні властивості
Реакції приєднання
Нагадаємо, що відмінною рисою представників ненасичених вуглеводнів - алкенів є здатність вступати в реакції приєднання. Більшість цих реакцій протікає механізмом електрофільного приєднання.
1. Гідрування алкенів. Алкени здатні приєднувати водень у присутності каталізаторів гідрування - металів - платини, паладію, нікелю:
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
Ця реакція протікає і при атмосферному і при підвищеному тиску і не вимагає високої температури, оскільки є екзотермічною. При підвищенні температури на тих же каталізаторах може бути зворотна реакція - дегідрування.
2. Галогенування (приєднання галогенів). Взаємодія алкену з бромною водою або розчином брому в органічному розчиннику (ССl4) призводить до швидкого знебарвлення цих розчинів у результаті приєднання молекули галогену до алкену та утворення дигалогеналканів.
Марковніков Володимир Васильович
(1837-1904)
Російський хімік-органік. Сформулював (1869) правила про направлення реакцій заміщення, відщеплення, приєднання подвійного зв'язку та ізомеризації залежно від хімічної будови. Досліджував (з 1880 р.) склад нафти, заклав основи нафтохімії як самостійної науки. Відкрив (1883) новий клас органічних речовин – цикло-парафіни (нафтени).
3. Гідрогалогенування (приєднання галогеноводороду).
Реакцію приєднання галогеноводороду більш детально буде розглянуто нижче. Ця реакція підпорядковується правилу Марковникова:
При приєднанні галогеноводороду до алкену водень приєднується до більш гидрированному атому вуглецю, т. е. атому, у якому перебуває більше атомів водню, а галоген - менш гидрированному.
4. Гідратація (приєднання води). Гідратація алкенів призводить до утворення спиртів. Наприклад, приєднання води до етену лежить в основі одного з промислових способів одержання етилового спирту:
CH2=CH2 + H2O -> СН3-СН2ОН
етен етанол
Зверніть увагу на те, що первинний спирт (з гідроксигрупою при первинному вуглеці) утворюється тільки при гідратації етену. При гідратації пропену чи інших алкенів утворюються вторинні спирти. 
Ця реакція також протікає відповідно до правила Марковникова - катіон водню приєднується до більш гідрованого атома вуглецю, а гідроксигрупа - до менш гідрованого.
5. Полімеризація. Особливим випадком приєднання є реакція полімеризації алкенів:
Ця реакція приєднання протікає за вільнорадикальним механізмом.
Реакції окиснення
Як і будь-які органічні сполуки, алкени горять у кисні з утворенням С02 та Н20.
На відміну від алканів, які є стійкими до окислення в розчинах, алкени легко окислюються під дією водних розчинів перманганату калію. У нейтральних або слаболужних розчинах відбувається окислення алкенів до діолів (двохатомних спиртів), причому гідроксильні групи приєднуються до тих атомів, між якими до окислення існував подвійний зв'язок.
Як ви вже знаєте, ненасичені вуглеводні - алкени здатні вступати в реакції приєднання. Більшість цих реакцій протікає механізмом електрофільного приєднання.
Електрофільне приєднання
Електрофільні реакції - це реакції, що протікають під дією електрофілів - частинок, що мають нестачу електронної щільності, наприклад, незаповнену орбіталь. Найпростішою електрофільною частинкою є катіон водню. Відомо, що атом водню має один електрон З-в-орбіталі. Катіон водню утворюється, коли атом втрачає цей електрон, таким чином, у катіону водню взагалі відсутні електрони:
Н· - 1е - -> Н +
При цьому катіон має досить високу спорідненість до електрона. Поєднання цих факторів робить катіон водню досить сильною електрофільною частинкою.
Утворення катіону водню можливе при електролітичній дисоціації кислот:
НВr -> Н + + Вr -
Саме з цієї причини багато електрофільних реакцій йдуть у присутності і за участю кислот.
Електрофільні частинки, як говорилося раніше, діють на системи, що містять області підвищеної електронної щільності. Прикладом такої системи може бути кратна (подвійна або потрійна) вуглець-вуглецевий зв'язок.
Ви вже знаєте, що атоми вуглецю, між якими утворено подвійний зв'язок, перебувають у стані sр 2 -гібридизації. Негібри-дизовані р-орбіталі сусідніх атомів вуглецю, що знаходяться в одній площині, перекриваються, утворюючи п-зв'язок, який менш міцний, ніж ?-зв'язок, і, що найбільш істотно, легко поляризується під дією зовнішнього електричного поля. Це означає, що при наближенні позитивно зарядженої частинки електрони транспортного засобу зміщуються в її бік і утворюється так званий п-комплекс.
Виходить п-комплекс та при приєднанні катіону водню до п-зв'язку. Катіон водню хіба що натикається на виступає з поверхні молекули електронну щільність п-зв'язку та приєднується до неї. ![]()
На наступній стадії відбувається повне усунення електронної пари п-зв'язку до одного з атомів вуглецю, що призводить до появи на ньому неподіленої пари електронів Орбіталь атома вуглецю, на якій знаходиться ця пара, і незаповнена орбіталь катіону водню перекриваються, що призводить до утворення ковалентного зв'язку донорно-акцепторного механізму. У другого атома вуглецю у своїй залишається незаповнена орбіталь, т. е. позитивний заряд.
Частка, що утворилася, називається карбокатіоном, так як вона містить позитивний заряд на атомі вуглецю. Ця частка може з'єднатися з будь-яким аніоном, частинкою, що має неподілену електронну пару, тобто нуклеофіл.
Розглянемо механізм реакції електрофільного приєднання на прикладі гідробромування (приєднання бромоводню) етену:
СН2 = СН2 + НВг -> СНr-СН3
Реакція починається з утворення електрофільної частки – катіону водню, що відбувається внаслідок дисоціації молекули бромоводню.
Катіон водню атакує п-зв'язок, утворюючи п-комплекс, який швидко перетворюється на карбокатіон: 
Тепер розглянемо складніший випадок.
Реакція приєднання бромоводню до етену протікає однозначно, а взаємодія бромоводню з пропеном теоретично може дати два продукти: 1-бромпропан та 2-бромпропан. Дані експерименту показують, що в основному виходить 2-бромпропан.
Для того, щоб пояснити це, нам доведеться розглянути проміжну частинку – карбокатіон.
Приєднання катіону водню до пропену може призвести до утворення двох карбокатіонів: якщо катіон водню приєднається до першого атома вуглецю, атома, який знаходиться на кінці ланцюга, то позитивний заряд виявиться у другого, тобто в центрі молекули (1); якщо приєднається до другого, позитивний заряд виявиться у першого атома (2). 
Переважний напрямок реакції залежатиме від того, якого карбокатіону виявиться більше в реакційному середовищі, що, у свою чергу, визначається стійкістю карбокатіону. Експеримент показує переважне утворення 2-бромпропану. Це означає, що переважно відбувається утворення карбокатіону (1) з позитивним зарядом на центральному атомі.
Велика стійкість цього карбокатіону пояснюється тим, що позитивний заряд на центральному атомі вуглецю компенсується позитивним індуктивним ефектом двох метильних груп, сумарний ефект яких вищий, ніж +/-ефект однієї етильної групи:
Закономірності реакцій гідрогалогенування алкенів були вивчені відомим російським хіміком В. В. Марковниковим, учнем А. М. Бутлерова, який, як це вже було сказано вище, сформулював правило, що носить його ім'я.
Це було встановлено емпірично, т. е. досвідченим шляхом. Нині ми можемо навести цілком переконливе його пояснення.
Цікаво, що правилу Марковникова підпорядковуються й інші реакції електрофільного приєднання, тому правильно сформулювати його у загальному вигляді.
У реакціях електрофільного приєднання електрофіл (частка із незаповненою орбіталлю) приєднується до більш гідрованого атома вуглецю, а нуклеофіл (частка з неподіленою парою електронів) – до менш гідрованого.
Полімеризація
Особливим випадком реакції приєднання є реакція полімеризації алкенів та їх похідних. Ця реакція протікає механізмом вільнорадикального приєднання:
Полімеризацію проводять у присутності ініціаторів – перекисних сполук, які є джерелом вільних радикалів. Перекисними сполуками називають речовини, молекули яких включають групу О-О-. Найпростішим перекисним з'єднанням є перекис водню НООН.
При температурі 100 ° С і тиску 100 МПа відбувається гомоліз нестійкої кисень-кисневого зв'язку і утворення радикалів - ініціаторів полімеризації. Під дією радикалів КО відбувається ініціювання полімеризації, яка розвивається як реакція вільнорадикального приєднання. Зростання ланцюга припиняється, коли в реакційній суміші відбувається рекомбінація радикалів - полімерного ланцюга та радикалів або КОСН2СН2-.
За допомогою реакції вільнорадикальної полімеризації речовин, що містять подвійний зв'язок, отримують велику кількість високомолекулярних сполук: 
Застосування алкенів з різними замісниками дає можливість синтезувати багатий асортимент полімерних матеріалів із широким набором властивостей. 
Всі ці полімерні сполуки знаходять широке застосування в різних галузях людської діяльності - промисловості, медицині, використовуються для виготовлення обладнання біохімічних лабораторій, деякі є напівпродуктами для синтезу інших високомолекулярних сполук.
Окислення
Ви вже знаєте, що в нейтральних або слаболужних розчинах відбувається окислення алкенів до діолів (двохтомних спиртів). У кислому середовищі (підкислений сірчаною кислотою розчин) відбувається повне руйнування подвійного зв'язку і перетворення атомів вуглецю, між якими існував подвійний зв'язок, атоми вуглецю карбоксильної групи: 
Деструктивне окислення алкенів можна застосовувати визначення їх структури. Так, наприклад, якщо при окисленні деякого алкену отримані оцтова та пропіонова кислоти, це означає, що окислення зазнав пентен-2, а якщо отримані масляна (бутанова) кислота та вуглекислий газ, то вихідний вуглеводень - пентен-1.
Застосування
Алкени широко використовуються в хімічній промисловості як сировина для отримання різноманітних органічних речовин та матеріалів.
Так, наприклад, етен є вихідною речовиною для виробництва етанолу, етиленгліколю, епоксидів, дихлоретан.
Велика кількість етену переробляється на поліетилен, який використовується для виготовлення пакувальної плівки, посуду, труб, електроізоляційних матеріалів.
З пропену одержують гліцерин, ацетон, ізопропанол, розчинники. Полімеризацією пропену одержують поліпропілен, який за багатьма показниками перевершує поліетилен: має більш високу температуру плавлення, хімічну стійкість.
В даний час з полімерів - аналогів поліетилену виробляють волокна, що мають унікальні властивості. Так, наприклад, волокно з поліпропілену міцніше від усіх відомих синтетичних волокон.
Матеріали, виготовлені з цих волокон, є перспективними і знаходять все більшого застосування у різних галузях людської діяльності.

1. Які види ізомерії характерні для алкенів? Напишіть формули можливих ізомерів пентена-1.
2. З яких сполук може бути отриманий: а) ізобутен (2-метилпропен); б) бутен-2; в) бутен-1? Напишіть рівняння відповідних реакцій.
3. Розшифруйте наступний ланцюжок перетворень. Назвіть сполуки А, Б, В. 4. Запропонуйте спосіб отримання 2-хлорпропану з 1-хлорпропану. Напишіть рівняння відповідних реакцій.
5. Запропонуйте спосіб очищення етану від домішок етилену. Напишіть рівняння відповідних реакцій.
6. Наведіть приклади реакцій, за допомогою яких можна розрізнити граничні та ненасичені вуглеводні.
7. На повне гідрування 2,8 г алкену витрачено 0,896 л водню (н. у.). Якою є молекулярна маса і структурна формула цієї сполуки, яка має нормальний ланцюг вуглецевих атомів?
8. Який газ знаходиться в циліндрі (етен або пропен), якщо відомо, що на повне згоряння 20 см3 цього газу знадобилося 90 см3 (н. у.) кисню?
9*. При реакції алкену з хлором у темряві утворюється 25,4 г дихлориду, а за реакції цього алкену тієї ж маси з бромом у тетрахлорметані - 43,2 г диброміду. Встановіть усі можливі структурні формули вихідного алкену.
Історія відкриття
З вищевикладеного матеріалу ми з вами вже зрозуміли, що етилен є родоначальником гомологічного ряду ненасичених вуглеводнів, що має один подвійний зв'язок. Їх формула C n H 2n і звуться вони алкенів.
Німецькому лікарю та хіміку Бехеру в 1669 році вперше вдалося отримати етилен шляхом впливу сірчаної кислоти на етиловий спирт. Бехер встановив, що етилен є більш хімічно активним, ніж метан. Але, на жаль, на той час отриманий газ учений ідентифікувати не зміг, тому й назви йому ніякого не привласнив.
Трохи згодом таким же способом отримання етилену скористався і голландські хіміки. Оскільки при взаємодії з хлором він мав властивість утворювати маслянисту рідину, то і отримав назву «маслородного газу». Пізніше стало відомо, що ця рідина є дихлоретан.
У французькій мові термін «олійний» звучить, як oléfiant. А після того, як були виявлені й інші вуглеводні подібного типу, Антуан Фуркруа, французький хімік і вчений, ввів новий термін, який став загальним для всього класу олефінів або алкенів.
Але вже на початку дев'ятнадцятого століття французьким хіміком Ж. Гей-Люссаком було доведено, що етанол складається не лише з «олійного» газу, а й з води. Крім того, такий самий газ був виявлений і в хлористому етилі.
І хоча хіміки і визначили, що етилен складається з водню та вуглецю, і вже знали склад речовин, але знайти його справжню формулу ще довго не могли. І лише 1862 року Е.Эрленмейеру вдалося довести наявність у молекулі етилену подвійного зв'язку. Це визнав і російський учений А. М. Бутлеров та підтвердив правильність такої точки зору експериментально.
Знаходження в природі та фізіологічна роль алкенів
Багатьох цікавить питання, де у природі можна зустріти алкени. Так от, виявляється, що в природі вони практично не зустрічаються, тому що найпростіший його представник етилен є гормоном для рослин і лише в незначній кількості синтезується в них.
Щоправда у природі існує такий алкен, як мускалур. Цей один із природних алкенів є статевим атрактантом самки домашньої мухи.
Варто звернути увагу на те, що маючи високу концентрацію нижчі алкени мають наркотичний ефект, який здатний викликати судоми і подразнення слизових оболонок.
Застосування алкенів
Життя сучасного суспільства на сьогоднішній день важко уявити без застосування полімерних матеріалів. Так як на відміну від природних матеріалів, полімери мають різні властивості, вони легкі в обробці, та й якщо дивитися за ціною, то вони порівняно дешеві. Ще важливим аспектом на користь полімерів є те, що багато з них можна повторно переробляти.
Алкени своє застосування знайшли під час виробництва пластмас, каучуків, плівок, тефлону, етилового спирту, оцтового альдегіду та інших органічних сполук.

У сільському господарстві його застосовують як засіб, який прискорює процес дозрівання фруктів. Для отримання різних полімерів та спиртів використовують пропілен та бутилени. А ось у виробництві синтетичного каучуку використовують ізобутилен. Тому можна дійти невтішного висновку, що без алкенів не обійтися, оскільки є найважливішим хімічним сировиною.
Промислове використання етилену
У промислових масштабах пропілен зазвичай використовують для синтезу поліпропілену і для отримання ізопропанолу, гліцерину, масляних альдегідів і т.д. З кожним роком потреба у пропілені зростає.

4.3.б. Приєднання галогеноводородів (гідрогалогенування)
Іншою важливою реакцією електрофільного приєднання до алкенів є давно відоме гадрогалогенування алкенів.
Нижче наведено типові приклади приєднання HCl, HBr та HI до різних алкенів.


Вплив алкільних заступників у подвійного зв'язку на швидкість приєднання описується такою послідовністю:
R 2 C=CHR > RCH=CHR > RCH=CH 2
Це узгоджується з таким механізмом, в якому в визначальній швидкості стадії реакції відбувається утворення карбокатіону, оскільки стабільність алкільних катіонів зменшується в ряду третинний вторинний первинний. Таким чином, механізм приєднання повинен включати проміжне утворення або вільного карбокатіону, що спостерігається рідко, або інтермедіату з карбокатіонним характером. Останній випадок найбільш типовий.
Якби приєднання відбувалося через "вільний карбокатіон", то реакція була б абсолютно нестереоселективною, так як алкільні катіони мають плоску будову. Однак, гідрогалогенування, як правило, протікає стереоселективно, причому залежно від типу алкену може спостерігатися селективне анти-приєднання, селективне син- або змішане син-анти-Приєднання.
Для алкенів, у яких подвійний зв'язок не пов'язаний з ароматичним кільцем, характерно анти-Приєднання галогеноводороду. Анті-приєднання хлористого та бромистого водню, хлористого та бромистого дейтерію спостерігається для циклогексену, циклопентену, 1,2-диметилгексену, 1,2-диметилпентену, цис- І транс-бутена-2, гексена-3 та багатьох інших простих алкенів та циклоалкенів.

У продукті приєднання однакові замісники (метильні групи) розташовані по різні боки середньої площини циклогексанового кільця, отже він відноситься до транс-Ряд. Анті-приєднання важко сумісне з механізмом, в якому передбачається утворення дискретного карбокатіону. Для плоского карбокатіону нуклеофільна атака галогенід-іона рівноймовірна з обох боків площини, що повинно призвести до утворення суміші продуктів. син- І анти-Приєднання. Кінетика гідрогалогенування алкенів також свідчить про складніший механізм приєднання. Для несопряженных алкенів швидкість реакції описується рівнянням третього порядку з другим порядком галогеноводороду, тобто відповідає Ad E 3-механізму.
v = k [алкен] 2
Анти-приєднання і другий порядок реакції галогеноводороду добре узгоджується з Ad E 3-механізмом, в якому алкен взаємодіє з двома молекулами галогеноводороду, одна з яких виконує функцію електрофільного, а інша - нуклеофільного агента.

Такий тримолекулярний механізм передбачає, що спочатку утворюється комплекс алкену і однією молекулою галогеноводороду з наступною атакою другої молекули НХ на цей комплекс анти-Буки без утворення дискретного карбокатіону. Слід особливо відзначити, що будь-який тримолекулярний механізм повинен складатися із двох послідовних стадій, оскільки одночасно зіткнення трьох молекул є вкрай малоймовірним.

Анти-приєднання свідчить про кращу нуклеофільну атаку галогеноводороду з протилежної сторони тієї, звідки відбувається протонування алкену. Замість галогеноводороду функцію нуклеофільного агента на кінцевій стадії може виконати і галогенид-ион. Справді, швидкість реакції зазвичай зростає прямо пропорційно концентрації галогенід-іону, введеного в реакційну суміш у вигляді галогенідів тетраалкіламонію NR 4+ X - або літію LiX. У цьому випадку спостерігається стереоспецифічне анти-Приєднання.
Для алканів, у яких подвійний зв'язок пов'язаний з ароматичним кільцем, характерно син-приєднання або змішане син-анти-приєднання галогеноводороду, наприклад:

Син-приєднання є домінуючим процесом для цис- І транс-ізомерів 1-фенілпропену, 1-феніл-4-алкілциклогексенів, аценафтилену, індену. При протонуванні таких алкенів утворюються карбокатіони бензильного типу, які стабільніші за чисто алкільні катіони, що виникають при протонуванні звичайних алкенів і циклоалкенів. Кінетика реакції в цьому випадку зазвичай описується більш простим рівнянням другого порядку v = k [алкен], тобто відповідає бімолекулярному Ad E 2-механізму. Ad E 2-Механізм передбачає утворення іонної пари, що включає карбокатіон і галогенід-іон.

Не можна очікувати, що механізм приєднання за участю іонних пар відрізнятиметься високою стереоселективністю. Якщо іонна пара перетворюється на кінцевий продукт швидше, ніж відбувається обертання навколо простий вуглець-вуглецевий зв'язок, кінцевим результатом буде син-приєднання, де протон і галогенід-іон приєднується з однієї і тієї ж сторони подвійного зв'язку. В іншому випадку спостерігається утворення продуктів як син- так і анти-Приєднання НХ. Такий випадок реалізується при гідрогалогенуванні пара-заміщених стиролів Z-C6H4-CH=CH2. Спостережувана тут закономірність у тому, що син-приєднання характерно лише для тих олефінів, які при протонуванні дають відносно стабільний карбокатіон, тобто у разі донорних заступників Z.
Для реакцій гідрогалогенування, що протікають Ad E 2-механізму характерна конкуренція процесів сполученого приєднання і перегрупувань, оскільки в якості інтермедіату утворюється карбокатіон або іонна пара.

Як приклад перегрупувань з 1,2-міграцією алкільної групи та гідрид-іону наведемо реакції гідрогалогенування відповідно трет-бутилетилену та ізопропілетилену.

При проведенні цієї реакції без розчинника на холоду (-78 0 С) утворюється суміш 33% нормального і 67% аномального (перегрупованого) продуктів приєднання.

4.3.в. орієнтація. Правило Марковнікова
На відміну від симетричних електрофілів (Hal 2), галогеноводи є несиметричні електрофільні реагенти. Приєднання будь-якого несиметричного електрофіла (HBr, ICl, H 2 O, Hg(OAc) 2 і т. д.) до несиметричного алкену в принципі могло б дати суміш двох альтернативних продуктів, проте на практиці зазвичай утворюється тільки один з них. Як приклад розглянемо приєднання бромистого водню до пропілену.

Ще 1870 р. В.В. Марковников сформулював емпіричне правило, згідно з яким несиметричні алкени приєднують НХ таким шляхом, що переважно утворюється продукт, в якому водень приєднується до найменш заміщеного, а Х - до найбільш заміщеного кінця подвійного зв'язку.
Зазвичай правило Марковникова пояснюють різницею у стабільності двох альтернативних карбокатіонів. Наприклад, у наведеному вище прикладі нормальний н-пропильний катіон значно менш стабільний, ніж ізопропільний катіон, і тому реакція йде другим шляхом.
Правило Марковникова спочатку використовувалося лише випадків приєднання НХ до вуглеводневих субстратів, але у принципі його можна поширити і реакції інших заміщених алкенів. Так, приєднання НCl до CF 3 CH=CH 2 дає " анти-марковниковський" продукт CF 3 CH 2 CH 2 Cl. Цього і слід очікувати, оскільки катіон CF 3 CH+ CH 3 менш стабільний, ніж катіон CF 3 CH 2 CH 2+ через сильний (-I)-ефект CF 3 -групи Переважно утворюється катіон CF 3 CH 2 CH 2+ , але він теж, хоча і меншою мірою дестабілізований індуктивним ефектом CF 3 -групи, внаслідок чого приєднання HCl до трифторметилетилену йде значно повільніше, ніж приєднання до незаміщеного етилену.
З аналогічної причини катіони вінілтріалкіламонію приєднують HBr також проти правила Марковнікова:
Приєднання НХ до алкенів, що мають сильні (-I) та (-M)-заступники, наприклад, до акрилонітрилу або нітроетилену, також має йти проти правила Марковникова. Однак у цьому випадку подвійний зв'язок настільки сильно дезактивований по відношенню до електрофільних реагентів, що ці реакції йдуть лише за дуже жорстких умов. Хлористий вініл СН 2 = СНСl завжди дає винятково "марковникові аддукти". Наприклад, при його реакції з HCl утворюється лише 1,1-дихлоретан (гемінальний дихлорид) CH 3 CHCl 2 . Хлор, аналогічно CF 3 -групі має сильний (-I)-ефект, і на перший погляд, здається, що з цієї причини приєднання повинно мати антимарковникову орієнтацію, тому що катіон + CH 2 CH 2 Cl повинен бути більш стабільним, ніж катіон СН 3 СН + Cl. Однак, на відміну від CF 3 -групи, хлор крім (-I)-ефекту має також протидіє йому (+М)-ефект (т. до. має неподілені пари). Досвід показує, що величина мезомерного ефекту є достатньою, щоб знизити енергію 1-хлоретильного катіону нижче рівня енергії 2-хлоретильного катіону, в якому +М-ефект не проявляється.
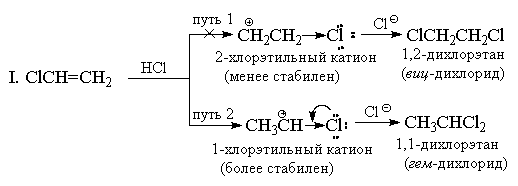
ІІ. З позицій теорії резонансу будова 1-хлоретильного катіону може бути представлена таким чином:
Тим не менш, приєднання до хлористого вінілу відбувається повільніше, ніж до етилену в тих же умовах, тобто за сумарним ефектом (-I > + M) хлор залишається електроноакцепторним замісником порівняно з воднем, а 1-хлоретильний катіон менш стабільний, ніж З 2 Н 5 +. Аналогічним чином реагують з НХ та інші вінілгалогеніди.
Вінілові ефіри CH 2 =CHOR приєднують НХ (X=Hal) за правилом Марковникова з набагато більшою швидкістю, ніж усі перераховані вище заміщені алкени. Це з значним +М-эффектом RО-группы. На відміну від атома хлору, RО-група за сумарним електронним ефектом (+М > -I) є сильним електронодонорним заступником, що ефективно стабілізує сусідній карбокатіонний центр. Будова карбокатіону в цьому випадку також може бути представлена у вигляді набору двох резонансних структур
Атака оксонієвого катіону галогенід-аніоном призводить до утворення галогенефірів типу СН 3 СН(Hal)OR.
4.3.г. Гідратація алкенів
Кислотно-каталізується гідратація алкенів призводить до утворення спиртів. Напрямок гідратації алкенів визначається правилом Марковникова, тому передбачається, що як проміжна частка в цій реакції утворюється карбокатіон.
Схильність вторинних алкільних карбокатіонів до перегрупування заважає використанню гідратації алкенів для отримання вторинних спиртів.

Цей метод у лабораторії знайшов обмежену сферу застосування тільки для отримання третинних спиртів. Реакція гідратації у разі значною мірою оборотна і третинні спирти утворюються з низькими виходами (40-45%).


Гідратація найпростіших алкенів - етилену та пропілену - є важливим промисловим методом отримання етилового та ізопропілового спиртів.

У лабораторній практиці пряма гідратація алкенів не знайшла широкого застосування як внаслідок жорстких умов, так і завдяки значній кількості ізомерних спиртів. В даний час для регіоселективного одержання спиртів з алкенів зазвичай використовується споріднена реакція гідроксимеркурювання - демеркурування.
4.3.д. Гідроксимеркурування-демеркурування
Електрофільна атака на подвійний зв'язок алкену може здійснюватися іонами металів, серед яких особливе положення займає катіон ртуті (II). Ацетат ртуті у дуже м'яких умовах при 20 0 С приєднується до алкенів у водному тетрагідрофурані (ТГФ) або у водній оцтовій кислоті з утворенням ртутьорганічних сполук. Приєднання ацетату ртуті по подвійному зв'язку протікає регіоспецифічно у суворій відповідності до правила Марковникова, тобто катіон ртуті приєднується до найменш заміщеного атома вуглецю.
Зв'язок С-Hg в ртутьорганічних сполуках може бути легко розщеплена під дією боргідриду натрію NaBH 4 з утворенням ртуті і нового зв'язку С-Н. Передбачається, що як нестабільний інтермедіат при цьому виходить алкілмеркургідрид, який далі розкладається з виділенням металевої ртуті за радикальним механізмом.

Сумарно цей двостадійний процес гідроксимеркурування-демеркурування в кінцевому підсумку є регіоспецифічною гідратацією алкену за правилом Марковникова у виключно м'яких умовах, коли утворення побічних продуктів зведено до гранично можливого мінімуму. Це можна наочно проілюструвати з допомогою таких прикладів, у яких сумарний вихід продуктів реакції становить 90-98%. Наведені цифрові дані в цьому випадку позначають не виходи сполук, що утворюються, а їх співвідношення в суміші.




Як видно з наведених вище прикладів гідроксимеркурування-демеркурування алкенів у більшості випадків забезпечує регіоспецифічну гідратацію алкенів з утворенням практично одного з двох ізомерних спиртів. Слід зазначити, що немає потреби у виділенні ртутьорганічної сполуки, і обидва процеси можуть бути проведені безпосередньо один за одним.
Гідроксимеркурування несиметричних алкенів, мабуть, починається з атаки катіону AcOHg + і утворення в якості інтермедіату несиметричного циклічного меркурінієвого катіону (аналогу несиметричного галогенонієвого іону), який потім розкривається в результаті нуклеофільної атаки водою по найбільш заміщений атом.

Містковий меркурінієвий іон можна зафіксувати в ненуклеофільному сильнокислому середовищі навіть при 20 0 С при приєднанні сильнішого електрофільного агента - трифторацетату ртуті в суміші фторсульфонової кислоти та п'ятифтористої сурми.

Меркурінієвий катіон може розщеплюватися не тільки при дії води, але й інших електронодонорних розчинників: спиртів, оцтової кислоти, ацетонітрилу та ін.


При використанні в реакції алкоксимеркурування-демеркурування розгалужених вторинних або третинних спиртів ефективнішими, ніж ацетат ртуті, є трифторацетат Hg(OCOCF 3) 2 або трифлат ртуті Hg(OSO 2 CF 3) 2 .

Таким чином, гідрокси- та алкоксимеркурування-демеркурування - це один із кращих препаративних методів синтезу спиртів та простих ефірів з розгалуженими алкільними радикалами.
Приєднання солей ртуті до алкенів є найбільш яскравим прикладом реакції сполученого приєднання до подвійного зв'язку, де роль зовнішнього нуклеофільного агента виконує розчинник. Стереохімія подвійного процесу гідроксимеркурювання-демеркурування залежить від стереохімічного результату кожної окремої стадії. Для гідроксимеркурування характерно анти-приєднання, як і інших реакцій з участю циклічного катіона. Однак радикальне демеркурування не відрізняється високою стереоселективністю. Тому весь процес загалом також нестереоспецифічний.
4.3.е. Приєднання алкенів (катіонна димеризація та полімеризація алкенів)
Найбільш цікавим прикладом такого типу реакцій є димеризація та полімеризація ізобутилену в присутності сірчаної кислоти.

Технічна назва цієї суміші алкенів – "діізобутилен". Ця реакція протікає за катіонним механізмом, подібним до механізму приєднання мінеральних кислот до подвійного зв'язку алкенів. На першій стадії протон приєднується до молекули ізобутилену з утворенням щодо стабільного трет-бутилкатіону. Далі утворений трет-бутилкатіон (кислота Льюїса) реагує з молекулою ізобутилену (основа Льюїса) з утворенням нового стабільного третинного октильного катіону.

У цих умовах під дією основ (H 2 O, HSO 4 - -іони) октильний карбокатіон швидко втрачає протон і перетворюється на суміш ізомерних пентенів, тому що відрив протону відбувається з двох різних положень:

Переважне утворення термодинамічно менш стабільного алкену - 2,4,4-триметилпентена-1 (80% у реакційній суміші) пов'язане з більшою просторовою доступністю для атаки основою атомів водню метильних груп порівняно з атомами водню метиленової групи. У промисловості "діізобутилен" гідрують на Ni-Ренею і отримують "ізооктан" (технічна назва вуглеводню 2,2,4-триметилпентану), що використовується як високооктанове паливо для двигунів внутрішнього згоряння.
При високих концентраціях сірчаної кислоти (понад 80%) відбувається катіонна полімеризація ізобутилену з утворенням полімеру, званого поліізобутиленом (-CH 2 C(CH 3) 2 -) n . Цей каучукоподібний полімер використовують для отримання антикорозійних та гідроізоляційних покриттів, герметиків та ін.
Крім ізобутилену, за катіонним механізмом полімеризуються 3-метилбутен-1, вінілові ефіри і деякі похідні стиролу, здатні утворювати порівняно стійкі карбокатіони. В якості каталізаторів катіонної полімеризації також використовують фтористий водень і кислоти Льюїса: BF 3 AlCl 3 AlBr 3 і ін. в присутності дуже малих кількостей води.
4.3.ж. Приєднання алканів (алкілування алкенів)
Інший промисловий метод синтезу "ізооктану" заснований на взаємодії ізобутилену з надлишком ізобутану в присутності концентрованої сірчаної кислоти або безводному фтористому водні при 0 10 0 С.

Ця реакція також протікає за катіонним механізмом і, що особливо цікаво, є прикладом ланцюгового катіонного процесу. Спочатку ізобутилен в умовах реакції димеризується з утворенням третинного октильного катіону (CH 3) 3 CCH 2 C + (CH 3) 2 . Докладно механізм його утворення викладено у попередньому розділі. Далі відбувається швидке перенесення водню (у вигляді гідрид-іону) від ізобутану до октильного катіону з утворенням молекули "ізооктану" та нового трет-бутилкатіону, який у свою чергу швидко реагує з ізобутиленом з утворенням нового октильного катіону і т.д.

Крім синтезу "ізооктану", такий метод алкілування використовується в нафтохімічній промисловості для синтезу висококиплячих розгалужених вуглеводнів з розгалужених алкенів та алканів низькокиплячою фракцією термічного крекінгу.
Алкени
Вуглеводні, в молекулі яких крім простих σ-зв'язків вуглець - вуглець і вуглець - водень є вуглець-вуглецеві π-зв'язки, називаються ненасиченими.Оскільки утворення π-зв'язку формально еквівалентно втраті молекулою двох атомів водню, то ненасичені вуглеводні містять 2патомів водню менше, ніж граничні, де п -число π-зв'язків:
Ряд, члени якого відрізняються один від одного на (2Н) n називається ізологічним рядом.Так, у наведеній вище схемі ізологами є гексани, гексини, гексадієни, гексини, гексатрієни і т.д.
Вуглеводні, що містять один π-зв'язок (тобто подвійний зв'язок), називаються алкенами (олефінами)або, за першим членом ряду - етилену, етиленовими вуглеводнями.Загальна формула їхнього гомологічного ряду С п Н 2л.
1. Номенклатура
Відповідно до правил ІЮПАК при побудові назв алкенів найбільш довгий вуглецевий ланцюг, що містить подвійний зв'язок, отримує назву відповідного алкану, в якому закінчення -анзамінено на -Єн.Цей ланцюг нумерується таким чином, щоб вуглецеві атоми, що беруть участь у освіті подвійного зв'язку, отримали номери, найменші з можливих:

Радикали називаються і нумеруються як і у разі алканів.
Для алкенів порівняно простої будови дозволяється застосовувати простіші назви. Так, деякі алкени, що найчастіше зустрічаються, називають, додаючи суфікс -єндо назви вуглеводневого радикалу з тим же вуглецевим скелетом:
Вуглеводневі радикали, утворені з алкенів, отримують суфікс. -еніл.Нумерація у радикалі починається від вуглецевого атома, що має вільну валентність. Однак для найпростіших алкенільних радикалів замість систематичних назв дозволяється використовувати тривіальні:

Водневі атоми, безпосередньо пов'язані з ненасиченими атомами вуглецю, що утворюють подвійний зв'язок, часто називають вініл'ними атомами водню,
2. Ізомерія
Крім ізомерії вуглецевого скелета, у ряді алкенів з'являється ще й ізомерія положення подвійного зв'язку. У загальному вигляді ізомерія такого типу - ізомерія положення заступника (функції)- спостерігається у всіх випадках, коли в молекулі є якісь функціональні групи. Для алкану С 4 Н 10 можливі два структурні ізомери:
Для алкену С 4 Н 8 (бутена) можливі три ізомери:

Бутен-1 і бутен-2 є ізомерами положення функції (у разі її роль виконує подвійний зв'язок).
Просторові ізомери відрізняються просторовим розташуванням заступників щодо один одного і називаються цис-ізомерами,якщо заступники розташовані по одну сторону від подвійного зв'язку, та транс-ізомерами,якщо по різні боки:

3. Будова подвійного зв'язку
Енергія розриву молекули подвійного зв'язку С=С дорівнює 611 кДж/моль; оскільки енергія σ-зв'язку С-С дорівнює 339 кДж/моль, то енергія розриву π-зв'язку дорівнює лише 611-339 = 272 кДж/моль. π -електрони значно легше σ -електронів піддаються впливу, наприклад, поляризують розчинників або впливу будь-яких атакуючих реагентів. Це пояснюється різницею у симетрії розподілу електронної хмари σ- та π-електронів. Максимальне перекриття р-орбіталей і, отже, мінімальна вільна енергія молекули реалізуються лише за плоскому будові вінільного фрагмента і за укороченому відстані С-С, що дорівнює 0,134нм, тобто. значно менше, ніж відстань між вуглецевими атомами, пов'язаними простим зв'язком (0,154 нм). З поворотом «половинок» молекули щодо один одного по осі подвійного зв'язку ступінь перекривання орбіталей знижується, що пов'язано із витратою енергії. Наслідком є відсутність вільного обертання по осі подвійного зв'язку і існування геометричних ізомерів при відповідному заміщенні в атомів вуглецю.
Алкени- Ненасичені вуглеводні, у складі яких є один подвійний зв'язок. Приклади алкенів:

Методи одержання алкенів.
1. Крекінг алканів за 400-700°С. Реакція йде за вільнорадикальним механізмом:

2. Дегідрування алканів:
3. Реакція елімінування (відщеплення): від сусідніх атомів вуглецю відщеплюються 2 атоми або 2 групи атомів, і утворюється подвійний зв'язок. До таких реакцій відносять:
А) Дегідратацію спиртів (нагрів понад 150°С, за участю сірчаної кислоти, як водовіднімального реагенту):
Б) Відщеплення галогенводнів при дії спиртового розчину лугу:

Атом водню відщеплюється переважно від атома вуглецю, який пов'язаний з меншим числом атомів водню (найменш гідрогенізованого атома) - правило Зайцева.
В) Дегалогенування:

Хімічні властивості алкенів.
Властивості алкенів обумовлюються наявністю кратного зв'язку, тому алкени вступають у реакції електрофільного приєднання, яке протікає у кілька стадій (Н-Х – реагент):
1-ша стадія:

2-я стадія:
 .
.
Іон водню в таких реакціях належить тому атому вуглецю, який має більш негативний заряд. Розподіл щільності такий:

Якщо заступником стоїть донор, який проявляється +I- ефект, то електронна щільність зміщується убік найбільш гидрогенизированного атома вуглецю, створюючи у ньому частково негативний заряд. Реакції йдуть по правилу Марковникова: при приєднанні полярних молекул типу НХ (HCl, HCN, HOHі т.д.) до несиметричних алкенів водень приєднується переважно до більш гідрогенізований атом вуглецю при подвійному зв'язку.
А) Реакції приєднання:
1) Гідрогалогенування:
Реакція йде за правилом Марковнікова. Але якщо в реакції присутній пероксид, то правило не враховується:
2) Гідратація. Реакція йде за правилом Марковникова в присутність фосфорної або сірчаної кислоти:

3) Галогенування. В результаті відбувається знебарвлення бромної води – це якісна реакція на кратний зв'язок:
4) Гідрування. Реакція протікає у присутність каталізаторів.



