Adsorptsioon toimub liideses. Seetõttu on pinnanähtuste termodünaamilist kirjeldamist mõistlik käsitleda heterogeensete süsteemide termodünaamika erijuhtumina.
Riis. 3.4. Gibbsi adsorptsioon: 1- kahefaasiline võrdlussüsteem, 2- tõeline kahefaasiline süsteem ebaühtlase piirkonnaga
Heterogeensete süsteemide termodünaamikas kasutatakse seda liitlikkuse põhimõte mis on järgmine: kõik heterogeense süsteemi ekstensiivsed omadused on võrdsed vastavate ekstensiivsete omaduste summaga, mis faasidel oleksid olnud enne nende kokkupuudet. Tähistame faasid α ja β-ga (joonis 4). Ideaalse süsteemi puhul, kus liidese lähedal olevate faaside omadused langevad kokku nende massiomadustega, kehtivad siseenergia U, ruumala V, massi (moolide arvu) n, entroopia S jaoks pärast tasakaalu loomist heterogeenne süsteem:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
See eeldab, et temperatuur ja rõhk mõlemas faasis on samad.
Tõeliste heterogeensete süsteemide puhul annab üleminekupiirkond kahe faasi piiril täiendava panuse süsteemi ulatuslikesse omadustesse. Pinnanähtuste esinemisel tuleks arvestada erinevusega tegeliku heterogeense süsteemi ekstensiivsete omaduste ja mudelsüsteemi ekstensiivsete omaduste vahel, milles pinnanähtused puuduvad. Sellist süsteemi nimetatakse võrdlussüsteemiks. Võrdlussüsteemil on samad intensiivsed parameetrid (T, P, C i ...) ja sama maht V kui tegelikul süsteemil (joonis 4).
Termodünaamilise vaatenurga all mõistetakse adsorptsiooniväärtust G kui aine n s liigset kogust, väljendatuna moolides või grammides, mis reaalsel heterogeensel süsteemil on võrdlussüsteemiga võrreldes liidese pindala või pinnaga. Eeldatakse, et võrdlussüsteemil on samad intensiivsed parameetrid (T, P, C i) ja sama maht (V = V α + V β) kui tegelikul süsteemil (joonis 4). .
G \u003d (n - n α - n β) / A \u003d n s / A 3.11
Reaalse süsteemi üleminekupiirkonna ülemäärased termodünaamilised funktsioonid (nimetame neid indeksiga s) saab kirjutada järgmiselt.
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S β jne.
Adsorptsiooni eksperimentaalsed mõõtmised annavad adsorptsiooni alati täpselt komponendi liigväärtusena reaalses süsteemis võrreldes valitud võrdlussüsteemiga. Näiteks gaasi adsorptsioonil tahkel adsorbendil või komponentide adsorptsioonil tahkel faasil, määrake adsorptsiooniväärtuste leidmiseks adsorbaadi algkontsentratsioonide muutus pärast faaside α ja β kokkupuudet.
n i s = V(C i o - C i),
Kus C i o– i-nda komponendi algkontsentratsioon, C i– i-nda komponendi kontsentratsioon pärast tasakaalu saavutamist kontaktfaaside vahel. Arvatakse, et maht V ei muutu. Siiski kontsentratsioon i- kolmas komponent C i, mis on saadud katseliselt, määratakse mahu järgi V' faasiliidese kohal, võtmata arvesse üleminekukihi ebahomogeense piirkonna mahtu V α liideses, kus kontsentratsioon on C i α. Seega, kuna reaalses süsteemis on ebaühtlane piirkond, saab süsteemi kogumahtu esitada järgmiselt. V = V’ + V α. Kogu kogus i- kolmas komponent C i o jaotatakse nende kahe köite vahel:
V C i o = V’ C i + V α C i α ,
ja komponendi moolide arv i, liidesele adsorbeeritud, on võrdne
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (C i α – C i) 3.12
Need. eksperimentaalselt määratud adsorptsioon on i-nda komponendi liig mahus V α võrreldes selle komponendi kogusega samas mahus kaugel faasiliidest. Seda tüüpi adsorptsiooni nimetatakse Gibbsi adsorptsiooniks. .
V α C i α nimetatakse täielikuks sisuks mina- komponent adsorptsioonikihis. Väga madalate kontsentratsioonide piirkonnas C i mahus V' muudatus V α C i võrrandi (3.2) võib tähelepanuta jätta ja arvesse võtta mõõdetud väärtust V α C i α täielik sisu mina- th komponent adsorptsioonikihis, näiteks gaasi adsorptsiooni ajal tahkel adsorbendil madalal rõhul.
Adsorptsiooniprotsesside termodünaamika.
| Parameetri nimi | Tähendus |
| Artikli teema: | Adsorptsiooniprotsesside termodünaamika. |
| Rubriik (temaatiline kategooria) | Haridus |
Adsorptsiooniprotsesside klassifitseerimise põhimääratlused ja meetodid.
Adsorptsioon viitab nähtustele, mis tekivad pinnaenergia spontaanse vähenemise tõttu.
Adsorptsioon– heterogeense süsteemi komponentide spontaanse pöörduva või pöördumatu ümberjaotumise protsess pinnakihi ja homogeense faasi ruumala vahel.
Mitmekomponentsetes süsteemides kantakse pinnakihile eelistatavalt liidese pinget tugevamalt vähendav komponent. Ühekomponentsetes süsteemides toimub pinnakihi tekke käigus selle struktuuri muutus (aatomite ja molekulide teatud orientatsioon, polarisatsioon), nn. autoadsorptsioon.
Nimetatakse tihedamat faasi, millel adsorptsiooni interaktsioonid lokaliseeritakse adsorbent. Homogeense faasi mahu ja pinnakihi vahel ümberjaotunud ainet tähistatakse terminiga ʼʼ adsorbeeridaʼʼ.
Mõnel juhul on adsorptsiooniprotsess pöörduv. Sel juhul võib osa molekulaarkineetiliste nähtuste tulemusena adsorbeerunud molekule teatud tingimustel liikuda pinnakihist hulgifaasi. Adsorptsiooni pöördprotsessi nimetatakse desorptsioon.
Adsorptsiooniprotsesside klassifitseerimise meetodid.
Adsorptsiooniprotsesside klassifikatsioon interakteeruvate faaside agregatsiooni oleku järgi. Võttes arvesse sõltuvust külgnevate faaside koondseisundist, eristatakse järgmist tüüpi adsorptsiooniprotsesse:
Gaaside adsorptsioon tahketel adsorbentidel;
lahustunud ainete adsorptsioon "tahke-vedelik" ja "vedelik-vedelik" liidestel;
Pindaktiivsete ainete adsorptsioon vedeliku-gaasi liidesel.
Adsorptsiooniprotsesside klassifikatsioon adsorbendi ja adsorbaadi interaktsiooni mehhanismi järgi. Adsorptsiooni võib pidada adsorbaadi molekulide interaktsiooniks adsorbendi aktiivsete tsentritega. Vastavalt nende interaktsiooni mehhanismile jagunevad järgmised adsorptsiooni tüübid:
1) füüsikaline (molekulaarne) adsorptsioon– adsorbaadi ja adsorbendi molekulide vaheline interaktsioon toimub van der Waalsi jõudude, vesiniksidemete mõjul (ilma keemiliste reaktsioonideta);
2) keemiline adsorptsioon (kemisorptsioon)– adsorbaadi molekulide kinnitumine adsorbendi aktiivtsentrite külge toimub erinevat tüüpi keemiliste reaktsioonide tulemusena (välja arvatud ioonivahetusreaktsioonid);
3) ioonivahetusadsorptsioon (ioonivahetus) – adsorbeeritava aine ümberjaotumine lahuse ja tahke faasi (ioonivaheti) vahel vastavalt ioonivahetusreaktsioonide mehhanismile.
Adsorptsiooniprotsesside kvantitatiivseks kirjeldamiseks kasutatakse kahte suurust.
1) Absoluutne adsorptsioon– adsorbaadi kogus (mol) või mass (kg) adsorbendi pinnaühiku või massi kohta. Nimetus – A; mõõt: mol/m2, mol/kg, kg/m2, kg/kᴦ.
2) Gibbsi (liigne) adsorptsioon– adsorbeeritud aine liig teatud paksusega pinnakihis, võrreldes selle kogusega homogeenses faasis, adsorbendi pinna- või massiühiku kohta. Nimetus – G; mõõt: mol/m 2, mol/kᴦ.
Absoluutse ja liigse adsorptsiooni vahelist seost saab illustreerida võrrandi abil:
Г = А – с * h (3,1)
kus c on aine tasakaalukontsentratsioon faasi mahus, mol/m3;
h on pinnakihi paksus, tinglikult eeldatakse, et see on 10–9 m.
Mitmekomponentsetes heterogeensetes süsteemides, kui üks või teine komponent jaotatakse ümber homogeense faasi ruumala ja pinnakihi vahel, kehtib pinna liigse siseenergia võrrand:
U = T * S + s * s + Sm i * n i (3.2)
Vähendades kõik võrrandi liikmed faasidevahelise pinna pindalaühikuks, saame:
U s = T * S s + s + Sm i * Г i (3.3)
kus Г i = n i / s on pinnakihi i-nda komponendi liig, see tähendab Gibbsi adsorptsioon.
Ühekomponendilise süsteemi korral on võrrand (3.3) järgmine:
G s = s + m * G (3,4)
kus G s = U s - T * S s – pinna Gibbsi energia või ühikulise pindala loomise töö;
m * G – adsorbeeritud aine aine tihenemine pinnakihis.
Võrrandi (3.4) põhjal saame järeldada, et adsorptsiooni käigus faasidevahelise pinna loomise töö koosneb pinna moodustamise tööst (adsorbaadi faasi mahus sidussidemete lõhkumine) ja aine tihendamisest pinnakihis.
Adsorbendi ja adsorbaadi vahelise dünaamilise tasakaalu seisundis heterogeense süsteemi Gibbsi energia muutus ΔG = 0 kirjeldatakse adsorptsiooniprotsessi termodünaamikat võrrandiga nn. Gibbsi põhiline adsorptsioonivõrrand:
Ds = SГ i * dm i (3,5)
See võrrand on universaalne, kuna see kehtib igat tüüpi adsorptsiooniprotsesside jaoks
Gibbsi adsorptsioonivõrrandi erijuhud.
1) Adsorptsioon lahustest.
Süsteemi i-nda komponendi keemilise potentsiaali jaoks adsorptsiooni ajal "vedelik-tahke adsorbent" ja "vedelik-gaas" liidestel kehtivad järgmised võrrandid:
m i = m i 0 + R*T*ln a i (3,6)
dm i = R*T* d ln a i (3,7)
kus m i 0 on süsteemi i-nda komponendi keemiline potentsiaal standardtingimustes;
a i on süsteemi i-nda komponendi aktiivsus standardtingimustes.
Selle põhjal on Gibbsi adsorptsioonivõrrand järgmine:
Г i = - a i / R*T * (ds / da i) (3.8)
Mitteelektrolüütide lahuste jaoks võtame a i = c i, siis:
Г i = - с / R*T * (ds / dс) (3,9)
Elektrolüütide lahuste jaoks:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
kus с ± on lahuse keskmine ioonkontsentratsioon;
n on stöhhiomeetriline koefitsient.
2) Ainete adsorptsioon gaasifaasist.
Vastavalt Mendelejevi-Clayperoni võrrandile:
Р = с * R*T (3,11)
Sellega seoses on Gibbsi võrrand gaaside adsorptsiooni kohta tahketel adsorbentidel kirjutatud järgmisel kujul:
Г i = - Р / R*T * (ds / dР) (3.12)
Praktikas võimaldab Gibbsi adsorptsioonivõrrand pindpinevuste mõõtmiste põhjal vedeliku kontsentratsiooni või tasakaalulise gaasi rõhu erinevatel väärtustel arvutada liidese kihis olevate ainete adsorptsiooni kogust, mille pindpinevus määratakse.
Adsorptsiooniprotsesside termodünaamika. - mõiste ja liigid. Kategooria "Adsorptsiooniprotsesside termodünaamika" klassifikatsioon ja omadused. 2017, 2018.
Adsorptsiooniga kui molekulide spontaanse kontsentratsiooniga pinnal kaasneb süsteemi entroopia vähenemine. Kuna protsessi spontaansuse kriteeriumiks on
∆H - T · ∆S = ∆G< 0,
siis on adsorptsioon võimalik ainult ∆H juures< 0 (экзотермический процесс). Равновесие определяется условием ∆Н = T· ∆S. Temperatuuri tõustes nihkub tasakaal endotermilise protsessi, st desorptsiooni suunas.
Adsorptsioon tahkel pinnal
1. Monomolekulaarne adsorptsioon.
Langmuiri teooria kohaselt interakteeruvad adsorbeerivad molekulid adsorbendi pinnaga, moodustades lõpuks monomolekulaarse kihi. Sel juhul pinna täitumise aste () adsorbeeritud ainega gaasifaasist adsorptsiooni ajal
vedelikust
kus K on tasakaalukonstant (adsorptsioonikonstant);
p on adsorbeeritud gaasi osarõhk;
c on adsorbeeritud aine kontsentratsioon.
β sõltuvus p-st (või c-st) on esitatud graafiku abil (adsorptsiooni isoterm, T = const) joonisel fig. 1.3.

Riis. 1.3. Pinna täituvus adsorbeeritud ainega
Madalatel kontsentratsioonidel ja osarõhul on adsorptsioon võrdeline kontsentratsiooni või osarõhuga:
R<< 1, β ≈ К· r ilis<< 1, β ≈ К· s, st. isotermi alglõik on ligikaudu lineaarne ja tan α = K (tg α määratakse kõvera kalde järgi p (või c) → 0: või ).
Kui on adsorbeeritud aine moolide arv 1 g adsorbendi kohta; - adsorbeeritud aine maksimaalne võimalik moolide arv 1 g adsorbendi kohta ("ühekihi maht"), siis
β asendamine võrrandis (1.3) (gaasifaasist adsorptsiooni korral kontsentratsioon Koos võrrandites tuleks asendada rõhuga R), saame:
 (1.6)
(1.6)
Kuna ja K antud adsorbent-adsorbent paaris on konstandid (at T=const), siis võib sõltuvuse järgi leida TO(joonis 1.4).

Riis. 1.4. Adsorptsioonivõrrandi graafiline lahendus
saadud eksperimentaalse lineaarse sõltuvuse ekstrapoleerimisel väärtusele () = 0; ja alates , siis .
Väärtust saab kasutada adsorbendi eripinna määramiseks UD (m 2 1 g adsorbendi kohta), kui on teada ühe adsorbendi molekuli pindala ω (määratud molekuli suuruse järgi):
UD = · ω · Na, (1,7)
kus Na on Avogadro arv (Na = 6,02 10 23).
Teadaolevat UD väärtust saab omakorda kasutada mis tahes aine ω arvutamiseks selle adsorptsiooni alusel antud adsorbendil.
2. Polümolekulaarne adsorptsioon.
Võrrand (1.5) kirjeldab küllastusega kõverat, st. juures
p (või c) → ∞ kaldub piirväärtusele, mis on võrdne (joon. 1.5,a).

Joon.1.5. Adsorptsiooni isotermid:
a – adsorptsioon küllastumisega; b – polümolekulaarne adsorptsioon
Kuid mõnel juhul näevad adsorptsiooni isotermid välja nagu joonisel fig. 1,5, b, s.o. ei jõua piirini isegi kõrge p (või c) juures.
Joonisel fig. näidatud tüüpi sõltuvused. 1.5,b vastavad polümolekulaarsele adsorptsioonile. Reeglina on sellised isotermid iseloomulikud tugeva molekulidevahelise interaktsiooniga ainetele (näiteks vesi). Kui adsorbendi pinnal olevad adsorptsioonikeskused on hõivatud (monomolekulaarne kiht on küllastunud), toimub järgmiste adsorbaadi molekulide "maandumine" molekulidevahelise interaktsiooni tõttu juba adsorbeerunud molekulidega (joonis 1.6). Sellise adsorptsiooni soojus on absoluutväärtuselt lähedane, kuid märgilt vastupidine vastava vedeliku aurustumissoojusele (mõelge, miks).

Joon.1.6. Adsorptsiooniskeem:
a - monomolekulaarne adsorptsioon; b - polümolekulaarne adsorptsioon
Kui me lähemale jõuame R adsorbeeritud aine küllastunud aururõhule hakkab see adsorbendi pinnal kondenseeruma, mille tulemusena kasvab see kiiresti suurenedes. R.
Kahe aatomi interaktsiooni korral:
U – interaktsioonienergia;
U = U PRIOR. + U TAGASI
 - Lennard-Jonesi võrrand
, c, b, m = konst
- Lennard-Jonesi võrrand
, c, b, m = konst
Tahke pinnaga aatomite interaktsiooni korral on vaja kõik vastastikmõjud kokku võtta.
x – kaugus pinnast
r – tõmbejõudude toimeraadius
dV – helitugevus
n – pinnamolekulide arv
U ADS. – adsorptsiooni interaktsiooni energia



Adsorptsiooni korral külgetõmbejõud suureneb. Ja mittepolaarse-mittepolaarse interaktsiooni korral paikneb adsorptsioon valdavalt süvendites.
Elektrostaatiline interaktsioon.
Polaarne adsorbent – mittepolaarne adsorbaat
Mittepolaarne adsorbent – polaarne adsorbaat
Polaarne adsorbent – polaarne adsorbent.
M  Adsorbaadi molekul on kujutatud dipoolina ja adsorbent on kujutatud juhina, milles adsorbaadi molekul indutseerib dipooli peegli antud suhtes sümmeetriliselt.
Adsorbaadi molekul on kujutatud dipoolina ja adsorbent on kujutatud juhina, milles adsorbaadi molekul indutseerib dipooli peegli antud suhtes sümmeetriliselt.
X – kaugus keskkohani
Suheldes tekib potentsiaal:
 ,
,
 on dipoolmoment.
on dipoolmoment.
Potentsiaal kipub võtma maksimumväärtuse, s.t. dipoolid kalduvad orienteeruma pinnaga risti.
Kuna temperatuuri tõus soodustab Browni liikumise kasvu, põhjustab see adsorptsiooniprotsessi pärssimist.
Elektrostaatilise interaktsiooni korral paikneb adsorbaat valdavalt eenditel.
Adsorptsiooni põhivõrrand.
Adsorptsiooni korral toimub komponendi ümberjaotumine, mis tähendab keemilise potentsiaali muutumist. Adsorptsiooniprotsessi võib pidada pinnaenergia üleminekuks keemiliseks energiaks.
Kihi maht = 0, siis termodünaamika I ja II seaduse üldistatud võrrand:
T = const; (1) = (2) => 

Kahekomponendilise süsteemi jaoks:
,
 ,
,
 =>
=>
=>
 - Gibbsi adsorptsiooni võrrand
.
- Gibbsi adsorptsiooni võrrand
.
Televiisori adsorptsiooni korral. kere - gaas: , 
 ,
,

 - isoterm
- isoterm
 - isobaar
- isobaar
 - isopüknaalne
- isopüknaalne
 - isosteer
- isosteer
Isoterm, isopükne, isosteer on omavahel seotud.
Sest adsorptsiooni funktsioon 



Henry isoterm Langmuiri isoterm



Termodünaamika. Adsorptsioon.
Kondensmeedia jaoks:
 ,
,
 ,
,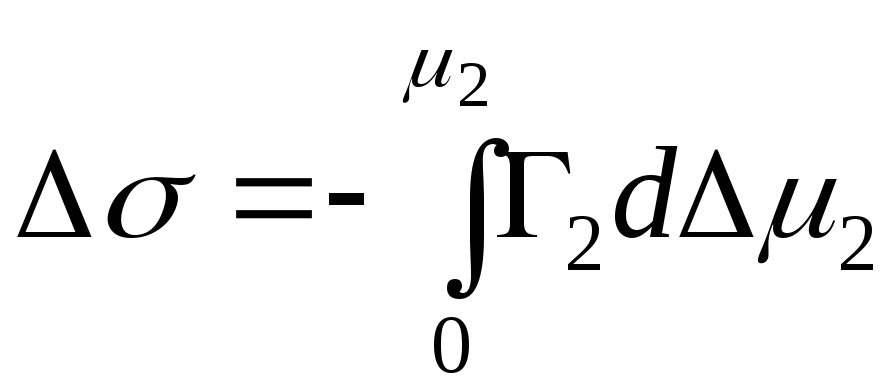
 - Gibbsi energia lahutamatu muutus
.
- Gibbsi energia lahutamatu muutus
.

P – rõhk üle kõvera pinna, Р S – rõhk üle tasase pinna
 - adsorptsioonipotentsiaal
- adsorptsioonipotentsiaal
Diferentsiaalne muutus sisemises 
 , Г = konst
, Г = konst
- diferentsiaalne entroopia muutus
- adsorptsiooni diferentsiaalentalpia
 - isosteeriline adsorptsioonisoojus
- isosteeriline adsorptsioonisoojus
 - kondensatsioonisoojus
- kondensatsioonisoojus
 - adsorptsiooni netosoojus
- adsorptsiooni netosoojus

 ,
,




Qa on lahutamatu adsorptsioonisoojus, 
Qra – integraalne adsorptsiooni netosoojus,

Henry võrrand
Adsorptsiooni uurimist raskendab pinna heterogeensus, mistõttu homogeensete pindade puhul saadakse kõige lihtsamad seadused.
Vaatleme gaaside vastastikmõju tahke pinnaga, kui gaas läheb ruumalalt tasakaaluolekust pinnal tasakaaluolekusse. See juhtum on analoogne gaaside tasakaaluga gravitatsiooniväljas.
 ,
,
 ,
=>
,
=> -Henry võrrand
-Henry võrrand
 - jaotuskoefitsient
- jaotuskoefitsient
Adsorptsiooniprotsessi käigus toimub keemiliste potentsiaalide muutus.
Hulgifaasi jaoks: 
Pinnal oleva gaasi jaoks: 
Tasakaalus olekus  , st.
, st.

Henry võrrandis ei sõltu konstant kontsentratsioonist
Henry võrrand kehtib madalate rõhkude ja kontsentratsioonide piirkonnas. Kontsentratsiooni suurenedes on võimalik kahte tüüpi kõrvalekaldeid Henry seadusest:
1 – positiivsed kõrvalekalded, D väheneb, A väheneb
2 – negatiivsed kõrvalekalded, D – suureneb, A – suureneb.
Hälbe tüübi määrab ühe või teise adsorbendi-adsorbaadi interaktsiooni tüübi ülekaal.
Tugeva kleepuva interaktsiooni korral suurenevad aktiivsuskoefitsiendid - positiivne kõrvalekalle. Kohesiivsete interaktsioonide korral täheldatakse negatiivseid kõrvalekaldeid.
monomolekulaarne adsorptsioon.
Langmuiri isoterm.
Lihtsamad seaduspärasused saadi Henry teoorias. Langmuir pakkus välja teooria, mille kohaselt peetakse adsorptsiooni kvaasikeemiliseks reaktsiooniks. Kus:
Pind on energeetiliselt ühtlane.
Adsorptsioon on lokaliseeritud, iga adsorptsioonikeskus interakteerub ühe adsorbaadi molekuliga.
Adsorbaadi molekulid ei interakteeru üksteisega.
Ühekihiline adsorptsioon.

 - pind,
- pind,  - adsorbeerida,
- adsorbeerida,  - adsorptsioonikompleks.
- adsorptsioonikompleks.
 , siis adsorptsioonisaitide kontsentratsioon:
, siis adsorptsioonisaitide kontsentratsioon:  ,
, - adsorptsiooni piiramine.
- adsorptsiooni piiramine.
 , siis on reaktsioonikonstant:
, siis on reaktsioonikonstant: 

 - Langmuiri võrrand.
- Langmuiri võrrand.
Adsorptsiooni sõltuvus kontsentratsioonist
1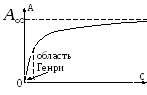 )
)
 ,
,

2) kõrge kontsentratsiooniga piirkond
 - adsorptsiooni piiramine, monomolekulaarse kihi moodustumine
- adsorptsiooni piiramine, monomolekulaarse kihi moodustumine
Gibbsi energia jaoks: .
g on entroopia tegur.
Henry isotermi puhul iseloomustab Gibbsi energia adsorbaadi üleminekut põhiolekust standardolekusse pinnal. Langmuiri isotermi puhul  iseloomustab adsorbendi ja adsorbaadi vahelise afiinsuse astet.
iseloomustab adsorbendi ja adsorbaadi vahelise afiinsuse astet.
 leitud van't Hoffi isobaarist.
leitud van't Hoffi isobaarist.

 , Siis
, Siis  , siit
, siit  .
.

 - pinna täidisaste.
- pinna täidisaste.




 - vabade kohtade arv,
- vabade kohtade arv,  - hõivatud kohtade arv.
- hõivatud kohtade arv.
 ,
,

Need. kõrgete kontsentratsioonide piirkonnas on vabade kohtade arv pöördvõrdeline adsorbaadi kogusega.
Gaaside segu adsorptsioon homogeensel pinnal.
Sel juhul käsitletakse adsorptsiooniprotsessi kahe paralleelse reaktsioonina.
 (1)
(1)

 (2)
(2)


Gaaside segu adsorptsioon ebaühtlasele pinnale.
Ebaühtlase pinna puhul ei saa piirduda keskmiste täidistega.
Konkurentsi tulemusena on võimalik erinevate adsorbaatide lokaliseerimine erinevat tüüpi piirkondades.
Sel juhul suhe  .
.
 ,
,
 - adsorbaadi küllastunud aururõhk.
- adsorbaadi küllastunud aururõhk.
 ,
,
 - adsorptsioonisoojus.
- adsorptsioonisoojus.
"+" - sõltuvus sümbaadist, "-" - antibaadisõltuvus, "N" - korrelatsioon puudub.
"+" - adsorptsioon toimub sama mehhanismi järgi. Energeetiliselt kõige soodsamates piirkondades adsorbeerub valdavalt pinna suhtes kõrge afiinsusega gaas.
“-” - adsorptsioon toimub erinevate mehhanismide kaudu ja kuni teatud ajahetkeni pole pinna pärast konkurentsi.
Monomolekulaarne adsorptsioon realiseerub valdavalt gaaside füüsilise adsorptsiooni käigus madalatel väärtustel lk, samuti vedeliku/gaasi liidesel.
Polümolekulaarne adsorptsioon.
BET teooria(Brunauer, Emmett, Teller).
Juhul, kui pinnaenergia kompenseerimiseks ei piisa monokihi moodustumisest, on adsorptsioon polümolekulaarne ja seda võib pidada sundkondensatsiooni tulemuseks pinnajõudude toimel.
Võtmepunktid:
Kui adsorbaadi molekul tabab hõivatud kohta, moodustub mitmekordne komplekt.
Kui me lähemale jõuame lk To lk s vabade adsorptsioonikohtade arv väheneb. Esialgu üksik-, paaris- jne kohtade arv suureneb ja seejärel väheneb. komplektides.
Kell lk =lk s adsorptsioon muutub kondenseerumiseks.
Horisontaalseid interaktsioone pole.
Esimese kihi puhul on Langmuiri isoterm täidetud.
Pinda peetakse adsorptsioonikohtade komplektiks. Kehtib dünaamilise tasakaalu tingimus: kondensatsiooni kiirus vabades kohtades on võrdne hõivatud kohtadest aurustumise kiirusega.
a on kondensatsioonikoefitsient (pinnal kondenseerunud molekulide osa);
 ,
,
Zm – maksimaalne vabade kohtade arv.
 - aatomi vibratsiooni sagedus pinnaga risti.
- aatomi vibratsiooni sagedus pinnaga risti.
Esimese kihi dünaamilise tasakaalu tingimused:



 , Siis
, Siis
 - Langmuiri võrrand.
- Langmuiri võrrand.
Teise kihi puhul on see tõsi: 
I-nda kihi jaoks: 
Lihtsuse huvides eeldatakse, et a ja ν on kõigi kihtide jaoks samad, välja arvatud esimene. Kõigi kihtide puhul, välja arvatud esimene, on adsorptsioonisoojus konstantne. Viimase kihi puhul on adsorptsioonisoojus võrdne kondenseerumissoojusega. Selle tulemusena saadi võrrand
 (*)
(*)
C- pidev,
BET-teooria puhul konstant KOOS iseloomustab puhta adsorptsiooni Gibbsi energiat. Võrrand sisaldab ainult ühte konstanti ja see võrrand on väga oluline ka adsorbendi eripinna määramisel.
Kuna adsorptsiooni tulemusena eraldub soojust, siis eripindade määramine toimub madalatel temperatuuridel.
 ????????????
????????????


Teooria peamine puudus– horisontaalsete interaktsioonide tähelepanuta jätmine vertikaalsete vastasmõjude kasuks.
Võrrand kehtib vahemikus  0,05 kuni 0,3.
0,05 kuni 0,3.
Kus  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0,3 – mõjutatud on adsorbaadi – adsorbaadi interaktsioon.
> 0,3 – mõjutatud on adsorbaadi – adsorbaadi interaktsioon.
Adsorbaadi-adsorbaadi interaktsioonide arvestamine.
Interaktsioonid ilmnevad adsorptsiooni ajal hargnenud molekulide või molekulide mittepolaarsel pinnal. Võimeline moodustama kaaslasi. Sel juhul muutub adsorptsiooniisotermide kuju.
A  sorbent ei ole polaarne.
sorbent ei ole polaarne.
Graafik 1 vastab nõrkadele interaktsioonidele adsorbaat-adsorbaat, tugev adsorbaat-adsorbent.
Graafik 2 vastab tugevale adsorbaadi-adsorbaadi interaktsioonile, tugevale adsorbaadi-adsorbendi interaktsioonile.
Graafik 3 vastab tugevale adsorbaadi-adsorbaadi interaktsioonile ja nõrgale adsorbaadi-adsorbendi interaktsioonile.
 ,
,

Adsorbaadi molekulide interaktsiooni korral on vaja arvestada aktiivsuskoefitsientide muutustega. Ja see võrrand on kirjutatud järgmiselt:
 - Frunkini, Fowleri, Guggenheimi võrrand.
- Frunkini, Fowleri, Guggenheimi võrrand.
k- külgetõmbe konstant.
Polyany potentsiaali teooria.
See teooria ei tuleta ühtegi adsorptsiooni isotermi tüüpi, vaid võimaldab arvutada isoterme erinevatel temperatuuridel.
Adsorptsioon- see on adsorbatsioonipotentsiaali toime tõttu adsorbaadi tõmbumise tulemus adsorbendi pinnale, mis ei sõltu teiste molekulide olemasolust ning sõltub pinna ja adsorbaadi molekuli vahelisest kaugusest.
 ,
,
 - adsorptsioonipotentsiaal.
- adsorptsioonipotentsiaal.
Kuna pind on ebaühtlane, asendatakse kaugus adsorptsioonimahuga  .adsorptsiooni maht on antud väärtusele vastava pinna ja punkti vahele jääv ruumala
.adsorptsiooni maht on antud väärtusele vastava pinna ja punkti vahele jääv ruumala  .
.
Adsorptsioonipotentsiaal on 1 mooli adsorbaadi ülekandmine väljaspool etteantud adsorptsioonimahtu antud adsorptsioonimahu punkti (või töö, mille käigus viiakse 1 mooli adsorbaadi küllastunud auru, mis on tasakaalus vedela adsorbaadiga adsorbendi puudumisel aurufaasi, mis on adsorbendiga tasakaalus).

Iseloomulik kõver
 - adsorptsioonipotentsiaal,
- adsorptsioonipotentsiaal, 
Teatud adsorbendi ja erinevate adsorbaatide puhul kehtib järgmine: 
Erinevat tüüpi adsorbaatide jaoks  ,
,
Kus  adsorptsiooni isotermide potentsiaal suhtelisel rõhul
adsorptsiooni isotermide potentsiaal suhtelisel rõhul  adsorbaadi 1 ja adsorbaadi 2 jaoks. See suhe on konstantne väärtus.
adsorbaadi 1 ja adsorbaadi 2 jaoks. See suhe on konstantne väärtus.
 - afiinsuskoefitsient
- afiinsuskoefitsient
Kapillaaride kondenseerumise teooria.
Adsorptsiooniprotsessi kulg sõltub suuresti poorse keha struktuurist.
|
Mikropoorne | |
|
Üleminekupoorne | |
|
Makropoorne |
Mikropoorsete sorbentide puhul adsorptsioonijõudude väljad kattuvad. Makropoorsete sorbentide puhul toimivad poorid transpordikanalitena. Kondensatsiooniprotsessid on kõige olulisemad mööduvate poorsete kehade puhul. Kapillaaride kondenseerumine algab teatud väärtustel lk Ja  , kui osa pinnaenergiast on juba kompenseeritud. Vajalik tingimus on, et pind peab olema iseniisutav. Protsessi kirjeldatakse Thompsoni-Kelvini võrrand.
, kui osa pinnaenergiast on juba kompenseeritud. Vajalik tingimus on, et pind peab olema iseniisutav. Protsessi kirjeldatakse Thompsoni-Kelvini võrrand.

 - märgumise korral on kõveruskese gaasifaasis.
- märgumise korral on kõveruskese gaasifaasis.
Kapillaarkondensatsiooni korral on adsorptsiooni isotermil hüstereetiline vorm. Alumine haru vastab adsorptsiooniprotsessile ja ülemine haru vastab desorptsiooniprotsessile.
Igat tüüpi poore saab vähendada kolme tüüpi:
|
Kooniline |
Silindriline ühe suletud otsaga |
Silindriline kahe lahtise otsaga |
|
Protsessi täitmine toimub pooride põhjast. Adsorptsiooni isoterm ja desorptsiooni isoterm langevad sel juhul kokku, kuna adsorptsiooniprotsess algab sfäärist ja desorptsiooniprotsess algab ka mõne sfääri kadumisega.
↓ |
Hüstereesi pole. Edasi- ja tagasikäiku kirjeldatakse võrrandiga:
|
Põhja pole kuskil, pooride täitmine läheb mööda silindri seinu.
silinder: Isotermil on hüstereetiline välimus.
↓ |
IN  Niisutustingimustes tekib madalamal rõhul kondenseerumine, mis on energeetiliselt soodne. Desorptsiooniharust saadakse pooride suuruse jaotuskõverad.
Niisutustingimustes tekib madalamal rõhul kondenseerumine, mis on energeetiliselt soodne. Desorptsiooniharust saadakse pooride suuruse jaotuskõverad.
Diferentsiaalkõvera maksimum nihutatakse integraalkõvera pöördepunkti suhtes vasakule. Väikeste pooride kogumaht on väike, kuid sellel on suured pinnad. Pooride suuruse suurenemisega suureneb nende maht  , ja ala on nagu
, ja ala on nagu  , tänu sellele täheldatakse diferentsiaalkõvera maksimumi nihet.
, tänu sellele täheldatakse diferentsiaalkõvera maksimumi nihet.
Adsorptsioon tahke-vedeliku liidesel.
Tahke-gaasi liidese adsorptsiooni korral jätsime ühe komponendi tähelepanuta. Tahke-vedeliku liidesel toimuva adsorptsiooni korral tõrjub adsorbaat lahusti molekulid adsorbendi pinnalt välja.
 ,
,
Võrrand on õige:

 ,
,
N 1, N 2 – lahusti ja komponendi mooliosad, N 1 + N 2 = 1, siis
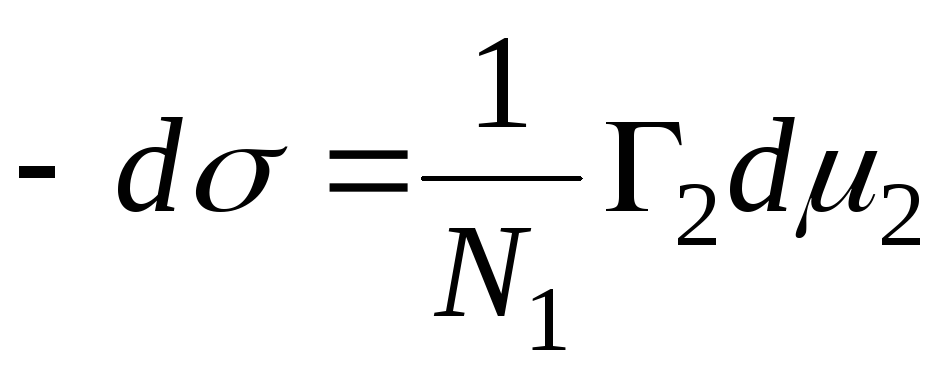 ,
=>
,
=>
 , siis on tahke-vedeliku liidese adsorptsioonivõrrand.
, siis on tahke-vedeliku liidese adsorptsioonivõrrand.
Adsorptsioon (G) > 0 at  <
0
<
0
Kui väärtused  komponent ja lahusti on väga erinevad, antud juhul sõltuvus G alates N väärtusel on ekstreemum N
~ 0,5.
komponent ja lahusti on väga erinevad, antud juhul sõltuvus G alates N väärtusel on ekstreemum N
~ 0,5.
E  kui
kui  on lähedased väärtused, sel juhul võib adsorptsiooni märk muutuda. Sõltuvus G alates N ristub x-teljega
on lähedased väärtused, sel juhul võib adsorptsiooni märk muutuda. Sõltuvus G alates N ristub x-teljega
Funktsioon Ristmik G(N) abstsissteljega nimetatakse adsorptsiooni aseotroop. See tähendab, et antud adsorbendil ei saa kahte komponenti eraldada.
Adsorptsiooni isotermi võrrand vahetuskonstandiga.
Tahke-vedeliku liidesel adsorptsiooni ajal toimub komponentide pidev ümberjaotumine adsorbendi pinna ja lahuse mahu vahel.
 - komponendid (- - viita pinnale)
- komponendid (- - viita pinnale)

 ,
,
 ,
, .
.
 ,
,


Adsorptsioon vedeliku-gaasi liidesel
R  Vaatleme kontsentratsiooniprofiili muutust vedeliku-gaasi liidese ületamisel. Olgu komponent 2 lenduv.
Vaatleme kontsentratsiooniprofiili muutust vedeliku-gaasi liidese ületamisel. Olgu komponent 2 lenduv.
Cs – kontsentratsioon pinnakihis.
Põhineb liigse adsorptsiooni määratlusel

Kui komponent ei ole lenduv, kirjutatakse adsorptsiooni väärtus järgmiselt:
P  ri
ri 

In Eq.  aine olemust kirjeldab selle tuletis
aine olemust kirjeldab selle tuletis  .
.
Pindpinevuse isoterm võib olla kujul 1 või 2:
1 – pindaktiivsed ained
2 – pindaktiivsed ained
Pinnaaktiivsus g on ainete võime vähendada pindpinevusi süsteemis.

 - pinnakihi paksus
- pinnakihi paksus
C s– komponendi kontsentratsioon pinnakihis
KOOS- mahu kontsentratsioon
Homoloogilise seeria jaoks kehtib reegel:
 - Traubeau Duclose reegel
- Traubeau Duclose reegel
Homoloogilise seeria puhul näeb adsorptsiooni isoterm välja järgmine:
A asemele kirjutame G, kuna pinnakihis on adsorptsioon liigne.
Pindpinevus isoterm:

 - puhta lahusti pindpinevus.
- puhta lahusti pindpinevus.
 - põhiline adsorptsioonivõrrand;
- põhiline adsorptsioonivõrrand;
 - Langmuiri võrrand.
- Langmuiri võrrand.
Lahendame need koos:

- Šiškovski võrrand.
B– homoloogsete seeriate konstant.
A- ühelt homoloogilt teisele liikudes suureneb 3-3,5 korda 
![]()
1 – madala kontsentratsiooniga ala
![]()
2 – keskmine kontsentratsioon
3 – monomolekulaarne kiht
Pindaktiivsed ained on difiilsed molekulid, st. Termin "polaarne rühm" ja mittepolaarne süsivesinikradikaal.
o on molekuli polaarne osa.
| - molekuli mittepolaarne osa.
Polaarses lahustis on pindaktiivsete ainete molekulid orienteeritud nii, et molekuli polaarne osa on suunatud lahusti poole ja mittepolaarne osa surutakse gaasifaasi.
Šiškovski võrrandis  , on see homoloogilise seeria jaoks konstantne.
, on see homoloogilise seeria jaoks konstantne.
Pindaktiivse aine efekt hakkab ilmnema n>5. Monomolekulaarse kihi kontsentratsioonist kõrgemate kontsentratsioonide korral toimub pindaktiivsete ainete lahustes mitsellistumine.
Mitsell– nimetatakse amfifiilsete pindaktiivsete ainete molekulide agregaadiks, mille süsivesinikradikaalid moodustavad tuuma ja polaarsed rühmad muudetakse vesifaasiks.
Mitsellimass – mitsellmass.
H  molekulide arv – agregatsiooniarv.
molekulide arv – agregatsiooniarv.
Sfäärilised mitsellid
Mitsellimise korral saavutatakse tasakaal lahuses
CMC – mitselli moodustumise kriitiline kontsentratsioon.
Kuna me käsitleme mitselli eraldi faasina:
Homoloogilise seeria jaoks on empiiriline võrrand:
a– funktsionaalrühma lahustumisenergia.
b – adsorptsioonipotentsiaali kasv, adsorptsiooni töö metüleenühiku kohta.
– adsorptsioonipotentsiaali kasv, adsorptsiooni töö metüleenühiku kohta.
Süsivesiniku tuuma olemasolu mitsellides loob võimaluse vees lahustumatud ühenditel lahustuda pindaktiivsete ainete vesilahustes, seda nähtust nimetatakse solubiliseerimiseks (mis lahustub, on solubilisaat, pindaktiivne aine on solubilisaator).
Muda võib olla täiesti mittepolaarne, sisaldada nii polaarseid kui ka mittepolaarseid osi ja olla orienteeritud nagu pindaktiivse aine molekul.
Igal juhul suureneb solubiliseerimise ajal mitsellimass ja agregatsiooniarv mitte ainult solubilisaadi kaasamise tõttu, vaid ka tasakaaluseisundi säilitamiseks vajalike pindaktiivsete ainete molekulide arvu suurenemise tõttu.
Solubiliseerimine on seda efektiivsem, mida väiksem on solubilisaadi molekulmass.

 ~ 72 mN\m.
~ 72 mN\m.
 ~ 33 mN\m.
~ 33 mN\m.
Pindaktiivsete ainete efektiivsus sõltub CMC väärtusest.
2D pinnakihi rõhk

→ -pindpinevusjõud.
- kahemõõtmeline rõhk.
Pinnakiht on jõud, mis on võrdne pindaktiivse aine lahuse ja puhta lahusti pindpinevuste erinevusega, mis on suunatud puhtale pinnale.
Tekib tasakaal lahuse ja pinnakihi vahel



Kell  on ala, kus
on ala, kus  sõltub lineaarselt kontsentratsioonist.
sõltub lineaarselt kontsentratsioonist.
G [mol/m2].
 - pindala, mille hõivab üks mool ainet
- pindala, mille hõivab üks mool ainet
Siis saab kahemõõtmeline rõhuisoterm kuju 
 - kahemõõtmeline rõhuisoterm.
- kahemõõtmeline rõhuisoterm.
Sõltuvus  S M-st:
S M-st:

Kell  - kahemõõtmeline rõhk suureneb järsult. Kell
- kahemõõtmeline rõhk suureneb järsult. Kell  kahemõõtmeline on deformeerunud, põhjustades äkilist kasvu
kahemõõtmeline on deformeerunud, põhjustades äkilist kasvu  .
.
Mõlemalt poolt identsete faasidega piiratud kilet nimetatakse kahepoolseks. Sellistes filmides täheldatakse emalahuse pidevat liikumist.
Alla 5 nm paksuseid kilesid nimetatakse mustadeks kiledeks.

Adsorptsioonikihtidel peab olema kaks omadust: viskoossus ja kerge liikuvus, voolavus ja elastsus.
Marangoni efekt on isetervendav.
Gibbsi kolmnurk,  - ülerõhk.
- ülerõhk.
Kile on veninud ja tänu sellele, et osa vedelikust on lahkunud, tormavad pindaktiivsed ained vabasse ruumi. Gibbsi kolmnurk.
Kehade adsorptsioonitugevuse mõju.
Kile pinnal on alati adsorptsioonikiht, mille jaoks siis
Langmuiri võrrand:


 kahemõõtmeliseks rõhuks
kahemõõtmeliseks rõhuks
 - Shishkovsky võrrandi analoog
- Shishkovsky võrrandi analoog
Elektrokineetilised nähtused. Elektriline kahekihiline (EDL).
Gelemholtzi mudel. Gouy-Chapmani teooria.
1808 lend

U – kujuga toru, sukeldage sellesse 2 elektroodi. Rikutakse anumate suhtlemise seadust ja toimub vedeliku taseme muutus torus - elektrokineetilised nähtused.
Kineetilised nähtused:
Elektroforees
Elektroosmoos
Voolu (voolu) potentsiaal
Settimispotentsiaal
1 ja 2 tekivad potentsiaalide erinevuse rakendamisel; 3 ja 4, stantsimine ja kolloidosakeste settimine põhjustavad potentsiaalse erinevuse ilmnemist.
Elektroosmoos on dispersioonikeskkonna liikumine statsionaarse hajutatud faasi suhtes elektrivoolu mõjul.
Elektroforees – see on hajutatud faasiosakeste liikumine statsionaarse dispersioonikeskkonna suhtes elektrivoolu mõjul.
P  Elektrokineetiliste nähtuste esinemise põhjuseks on laengute ruumiline eraldumine ja kahekordse elektrikihi tekkimine.
Elektrokineetiliste nähtuste esinemise põhjuseks on laengute ruumiline eraldumine ja kahekordse elektrikihi tekkimine.
Elektriline topeltkiht on lamekondensaator, ühe plaadi moodustavad potentsiaali määravad ioonid, teise vastasioonid. Ioonid on saastunud samamoodi, nagu potentsiaali määravad koioonid surutakse lahuse ruumalasse. Plaatide vaheline kaugus  . Potentsiaal langeb lineaarselt, potentsiaalide erinevus
. Potentsiaal langeb lineaarselt, potentsiaalide erinevus  .
.
Väline potentsiaalide erinevus põhjustab nihkemooduli ilmnemise  on jõudude paar pindalaühiku kohta, mis toimivad piki tahke keha pinda.
on jõudude paar pindalaühiku kohta, mis toimivad piki tahke keha pinda.

Tasakaalus on nihkemoodul võrdne viskoosse hõõrdemooduliga (  ).
).

Meie tingimustes  ,
,

 - Gelemholtz-Smalukowski võrrand
- Gelemholtz-Smalukowski võrrand
 - faasinihke lineaarne kiirus.
- faasinihke lineaarne kiirus.
E- elektrivälja tugevus.
 - plaatide potentsiaalide erinevus
- plaatide potentsiaalide erinevus
 - elektroforeetiline liikuvus [m 2 /(V*s)].
- elektroforeetiline liikuvus [m 2 /(V*s)].
Helemholtzi mudel ei võta arvesse molekulide soojusliikumist. Tegelikkuses on ioonide jaotus topeltkihis keerulisem.
Gui ja Chapman tuvastasid järgmised DES-i põhjused:
Iooni üleminek ühest faasist teise, kui tasakaal on saavutatud.
Tahkefaasilise aine ioniseerimine.
Pinna täiendamine dispersioonikeskkonnas olevate ioonidega.
Polarisatsioon välisest vooluallikast.
Elektriline topeltkiht on häguse või hajusa struktuuriga. Ioonid kipuvad hajuskihis ühtlaselt jaotuma.
Difuusne kiht koosneb kontrainoonidest, kihi pikkuse määrab nende kineetiline energia. Absoluutsele nullile lähenevatel temperatuuridel on vastasioonid võimalikult lähedased potentsiaali määravatele ioonidele.
Danya teooria põhineb kahel võrrandil:
Boltzmanni võrrand

 - töötada elektrostaatilise vastasmõju jõudude vastu.
- töötada elektrostaatilise vastasmõju jõudude vastu.
 on laengu puistetihedus.
on laengu puistetihedus.

Poissoni võrrand 
Kuna EDL paksus on palju väiksem kui osakeste suurus ja lameda EDL puhul tuletis koordinaatide suhtes  Ja
Ja  on tühistatud.
on tühistatud. 
e y kell y<<1 функцию можно разложить в ряд Маклорена:

Piirdume kahe sarja liikmega, siis:


 - DEL paksus on vahemaa, milleni DEL potentsiaal väheneb eüks kord.
- DEL paksus on vahemaa, milleni DEL potentsiaal väheneb eüks kord.
Mida madalam on temperatuur, seda vähem  . Kell Т→0 – korter DES. Mida suurem on kontsentratsioon, seda rohkem mina, seda vähem
. Kell Т→0 – korter DES. Mida suurem on kontsentratsioon, seda rohkem mina, seda vähem  .
.





 “–” tähendab, et potentsiaal väheneb vahemaa kasvades. =>
“–” tähendab, et potentsiaal väheneb vahemaa kasvades. =>
=>

 ,
,
 - potentsiaal väheneb eksponentsiaalselt.
- potentsiaal väheneb eksponentsiaalselt.
Pinnalaengu tiheduse potentsiaal: 
Pinnalaeng on vastupidise märgiga mahulaeng, mis on integreeritud üle kauguse.




=>


Kus potentsiaal väheneb 2,7 korda - 
Kahekihiline mahutavus 
Teooria miinuseks on see, et ei arvestata Helemholtzi kihi olemasolu, s.t. ei arvesta  , sellest ka vead põhiparameetrite määramisel. Samuti ei selgita see erineva iseloomuga ioonide mõju elektrilise kaksikkihi paksusele.
, sellest ka vead põhiparameetrite määramisel. Samuti ei selgita see erineva iseloomuga ioonide mõju elektrilise kaksikkihi paksusele.
Sterni teooria. Kolloidse mitselli struktuur.
Elektriline topeltkiht koosneb kahest osast: tihe ja hajus. Tihe kiht moodustub potentsiaali moodustavate ioonide koostoimel spetsiifiliselt adsorbeerunud ioonidega. Need ioonid on reeglina osaliselt või täielikult dehüdreeritud ja neil võib olla sama või vastupidine laeng kui potentsiaali määravatel ioonidel. See sõltub elektrostaatilise interaktsioonienergia suhtest  ja spetsiifiline adsorptsioonipotentsiaal
ja spetsiifiline adsorptsioonipotentsiaal  . Tiheda kihi ioonid on fikseeritud. Teine osa ioonidest asub difuusses kihis, need ioonid on vabad ja võivad liikuda lahusesse sügavamale, s.t. kõrgema kontsentratsiooniga piirkonnast madalama kontsentratsiooniga piirkonda. Laengu kogutihedus koosneb kahest osast.
. Tiheda kihi ioonid on fikseeritud. Teine osa ioonidest asub difuusses kihis, need ioonid on vabad ja võivad liikuda lahusesse sügavamale, s.t. kõrgema kontsentratsiooniga piirkonnast madalama kontsentratsiooniga piirkonda. Laengu kogutihedus koosneb kahest osast.

 - Helmholtzi kihi laeng
- Helmholtzi kihi laeng
 -Hajutatud kihi laeng
-Hajutatud kihi laeng
Pinnal on teatud arv adsorptsioonikeskusi, millest igaüks interakteerub ühe vastasiooniga. Sellise kvaasikeemilise reaktsiooni konstant on võrdne:

 , Kus
, Kus  - vastasioonide molaarosa lahuses
- vastasioonide molaarosa lahuses
Helmholtzi jaotus
Potentsiaal väheneb lineaarselt
Gouy potentsiaalne jaotus. Tihedat kihti pole, potentsiaal väheneb väärtusest eksponentsiaalselt 
Ahtri jaotus.
Esialgu on potentsiaalne vähenemine lineaarne ja seejärel eksponentsiaalne.
Kui elektroforeesi puhul rakendatakse elektrivälja, siis ei liigu otseselt mitte tahke faasi osake, vaid tahke faasi osake koos seda ümbritseva ioonikihiga. DES kordab hajutatud faasiosakese kuju. Potentsiaali rakendamisel rebitakse osa hajutatud kihist ära. Murdejoont nimetatakse libisev piir.
Potentsiaal, mis tekib libisemispiiril hajuskihi osa eraldumise tulemusena, nimetatakse elektrokineetiline potentsiaal(Zeta potentsiaal  ).
).
Dispergeeritud faasiosakest koos ümbritseva vastasioonikihi ja kahekordse elektrikihiga nimetatakse mitsell.
Kolloidsete mitsellide kirjutamise reeglid:


1-1 laadimiselektrolüüti
T on hajutatud faasi osake.
AA on piir tiheda ja hajutatud osa vahel.
BB – libisev piir.
Libisemispiir võib, aga ei pruugi ühtida joonega AA.
Nimetatakse pH väärtust, mille juures zeta potentsiaal on null isoelektriline punkt.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2NaCl
1. Liigne CaCl 2
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n - x)Cl - ) 2 x + x Cl - - mitselli tähistus.
CaSO 4 m – täiteaine.
CaSO 4 m∙nCa 2+ – tuum.
CaSO 4 m∙nCa 2+ 2( n - x)Cl - - osake.
2. Na 2 SO 4 liig
Na 2 SO 4 ↔ 2 Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - mitsell
CaSO 4 m – täiteaine.
CaSO 4 m∙nSO 4 2 + – tuum.
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - osake
Helemholtz-Smoluchowski võrrand

 - piiride nihke lineaarne kiirus (elektroosmoosi korral).
- piiride nihke lineaarne kiirus (elektroosmoosi korral).
 - potentsiaalide erinevus kondensaatori plaatidel (elektroosmoosi korral).
- potentsiaalide erinevus kondensaatori plaatidel (elektroosmoosi korral).


 - lahuse mahuline voolukiirus, S on raku ristlõikepindala.
- lahuse mahuline voolukiirus, S on raku ristlõikepindala.

E- elektrivälja tugevus.


 (elektroosmoosi jaoks).
(elektroosmoosi jaoks).
Voolupotentsiaali jaoks:

 - potentsiaal
- potentsiaal
 - surve membraanile
- surve membraanile
Reeglina on elektroforeetiliste ja elektroosmootsete liikuvuste väärtused väiksemad kui arvutatud. See juhtub järgmistel põhjustel:
Lõõgastav efekt (dispergeeritud faasiosakese liikumisel ioonse atmosfääri sümmeetria katkeb).
Elektroforeetiline pärssimine (täiendava hõõrdumise tekkimine vastasioonide liikumise tagajärjel).
Vooluliinide moonutamine elektrit juhtivate osakeste korral.
Pindpinevuse ja potentsiaali seos. Lippmanni võrrand.
DEL moodustumine toimub spontaanselt, kuna süsteem soovib oma pinnaenergiat vähendada. Konstantsuse tingimustes T Ja lk Termodünaamika esimese ja teise seaduse üldistatud võrrand näeb välja järgmine:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1. Lippmanni võrrand.
- 1. Lippmanni võrrand.
 - pinna laengu tihedus.
- pinna laengu tihedus.
 - diferentsiaalmahtuvus.
- diferentsiaalmahtuvus.
 - 2. Lippmanni võrrand.
- 2. Lippmanni võrrand.
KOOS– mahutavus.
Lahendame 1. Lippmanni võrrandi ja põhiadsorptsioonivõrrandi:
 ,
,


 , Siis
, Siis
 - Nernsti võrrand
- Nernsti võrrand
 ,
,
 ,
,




 - elektrokapillaarkõvera (ECC) võrrand.
- elektrokapillaarkõvera (ECC) võrrand.
IN  :
: , Aga
, Aga 
Katioonsed pindaktiivsed ained (CPAS) vähendavad EKC katoodharu.
Anioonsed pindaktiivsed ained (APS) vähendavad EKC anoodset haru.
Mitteioonsed pindaktiivsed ained (NSAS) vähendavad ECC keskmist osa.
Hajutatud süsteemide stabiilsus. Lahutav surve.
Dispergeeritud süsteemid võib jagada:
Termodünaamiliselt ebastabiilsed süsteemid võivad metastabiilsesse olekusse ülemineku tõttu olla kineetiliselt stabiilsed.
Stabiilsust on kahte tüüpi:
Sedimentatsiooni stabiilsus (gravitatsiooni suhtes).
Agregatiivne stabiilsus. (adhesiooni suhtes)
Koagulatsioon on osakeste adhesiooniprotsess, mis viib agregatsiooni stabiilsuse kadumiseni. Koagulatsiooni võivad põhjustada temperatuurimuutused, pH, segamine ja ultraheli.
Koagulatsiooni eristatakse:
Pööratav.
Pöördumatu.
Koagulatsioon toimub elektrolüütide sisseviimisega.
Koagulatsiooni reeglid:

Film- see on süsteemi osa, mis asub kahe liidesepinna vahel.
Lahutav surve tekib kile paksuse järsu vähenemisega lähenevate pinnakihtide koosmõjul.

“-” - kile paksuse vähenedes suureneb eraldusrõhk.
P 0 on rõhk mahufaasis, mis on vahekihi jätk.
P 1 – rõhk kiles.
Stabiilsuse teooria. DLFO (Deryagin, Landau, Fairway, Overbeck).
DLFO teooria kohaselt on eraldusrõhul kaks komponenti:
Elektrostaatiline P E (positiivne, see on tingitud elektrostaatilisest tõukejõust). Vastab Gibbsi energia vähenemisele koos kile paksuse suurenemisega.
Molekulaarne P M (negatiivne, tõmbejõudude toime tõttu). Seda põhjustab kile kokkusurumine keemiliste pinnajõudude toimel, jõudude toimeraadius on kümnendikke nm energiaga umbes 400 kJ/mol.
Kogu interaktsioonienergia:

 - süsteem on agregatiivselt stabiilne
- süsteem on agregatiivselt stabiilne
 - ebastabiilne süsteem
- ebastabiilne süsteem
P  positiivne komponent.
positiivne komponent.
Suurenemine on tingitud potentsiaalse energia suurenemisest õhukeste kilede kokkusurumisel. Suure paksusega kilede puhul kompenseeritakse üleliigne ioonienergia ja see on võrdne energia interaktsiooniga dispersioonikeskkonnas.
Kui  (
( - kile paksus,
- kile paksus,  - iooniraadius) kile hõrenemine toob kaasa minimaalse pinnaenergiaga molekulide ja ioonide kadumise ja vähenemise. Naaberosakeste arv väheneb, mille tulemusena suureneb kilesse jäävate osakeste potentsiaalne energia.
- iooniraadius) kile hõrenemine toob kaasa minimaalse pinnaenergiaga molekulide ja ioonide kadumise ja vähenemise. Naaberosakeste arv väheneb, mille tulemusena suureneb kilesse jäävate osakeste potentsiaalne energia.


DLVO teooria käsitleb osakeste vastastikmõju plaatide vastastikmõjuna.

Osakesed ei interakteeru



 - Laplace'i võrrand,
- Laplace'i võrrand,  ,
,


Nõrgalt laetud pindadele
Kõrgelt laetud pindade jaoks:

Molekulaarne komponent on kahe aatomi vastastikmõju:
 ~
~
Aatomi interaktsioon pinnaga:

Võtame kaks rekordit:
D  Molekulaarse komponendi saamiseks on vaja kokku võtta kõik parempoolse ja vasaku plaadi aatomite interaktsioonienergiad.
Molekulaarse komponendi saamiseks on vaja kokku võtta kõik parempoolse ja vasaku plaadi aatomite interaktsioonienergiad.
Kus  - Hamakeri konstant (arvestab interakteeruvate kehade olemust).
- Hamakeri konstant (arvestab interakteeruvate kehade olemust).
See. osakeste interaktsioonienergiat süsteemis saab väljendada potentsiaalikõverate abil.
I – esmane potentsiaali miinimum. See on pöördumatu koagulatsiooni tsoon, domineerivad tõmbejõud.
II – agregatiivse stabiilsuse tsoon, ülekaalus on tõukejõud.
III – sekundaarse potentsiaali miinimum (ehk flokulatsioonitsoon). Dispergeeritud faasi osakeste vahel on elektrolüüdikiht ja osakesed saab eraldada ja viia agregatsiooni stabiilsuse tsooni.

Kõver 1 – süsteem on agregatiivselt stabiilne.
Kõver 2 – stabiilne I tsoonis, ebastabiilne II tsoonis.
Kõver 3 – süsteemis on toimunud koagulatsioon.
Kõver 4 – punktis 4 interaktsiooni koguenergia U=0,  , vastab see äärmuspunkt kiire hüübimise algusele.
, vastab see äärmuspunkt kiire hüübimise algusele.
On kaks juhtumit:
1. Kergelt laetud pinnad:
U = U E + U M = 0
 (1)
(1)
2)

 (2)
(2)



 - see on kihi paksus, mis vastab hüübimisprotsessi algusele.
- see on kihi paksus, mis vastab hüübimisprotsessi algusele.






 - nõrgalt laetud pindadele
- nõrgalt laetud pindadele
 Siis
Siis 
2. Tugevalt laetud pindade puhul:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
Teeme ruudu (3)

Koagulatsioon:
Spetsiifilise adsorptsiooni korral saab ioone adsorbeerida üliekvivalentsetes kogustes, nii et pind võib oma laengut muuta. Pind laetakse uuesti.
Spetsiifilise adsorptsiooni korral saab adsorbeeruda mitte ainult vastandmärgiga ioone, vaid ka sama märgiga ioone.
Kui adsorbeeritakse pinnaga sama märgiga ioonid, siis pinnakihis ei toimu potentsiaali langus, vaid selle suurenemine.

Neutraliseeriv koagulatsioon (toimub nõrgalt laetud osakeste osalusel ja sõltub mitte ainult elektrolüüdi-koagulaatori laengust, vaid ka potentsiaalist tihedate ja hajusate kihtide piiril).
Smoluchowski kiire koagulatsiooni teooria.

Hüübimiskiiruse sõltuvus elektrolüütide kontsentratsioonist.
I – hüübimismäär on madal,
II – hüübimiskiirus on peaaegu võrdeline elektrolüüdi kontsentratsiooniga.
III – kiire koagulatsiooni piirkond, kiirus praktiliselt ei sõltu keskendumisest.
Põhisätted:
Esialgne sool on monodispersne, sarnased osakesed on sfäärilise kujuga.
Kõik osakeste kokkupõrked on tõhusad.
Kui kaks primaarset osakest põrkuvad, moodustub sekundaarne osake. Sekundaarne + esmane = tertsiaarne. Primaarne, sekundaarne, tertsiaarne – paljusus.
Keemilise kineetika osas saab hüübimisprotsessi kirjeldada võrrandiga:
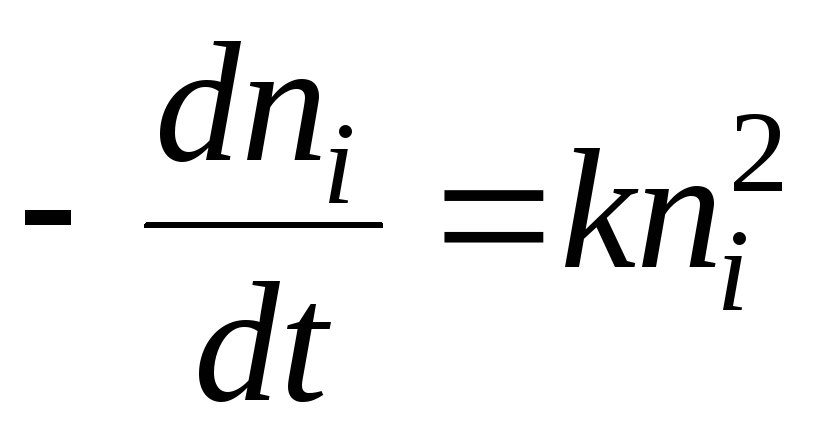
Lahenduseks on võrrand: 
 - pool hüübimisaega. See on aeg, mille jooksul sooli osakeste arv väheneb 2 korda.
- pool hüübimisaega. See on aeg, mille jooksul sooli osakeste arv väheneb 2 korda.

 ,
,
 ,
,
 ,
,


Kui paljusus suureneb, nihkub koagulatsioonikõverate maksimum suuremate väärtuste poole  .
.
Puudused:
Monodisperssuse eeldus.
Eeldus kõigi kokkupõrgete tõhususe kohta.




 - kera,
- kera, ,
,





