Alkeenid on keemiliselt aktiivsed. Nende keemilised omadused on suuresti määratud kaksiksideme olemasoluga. Kõige tavalisemad alkeenide reaktsioonid on elektrofiilsed liitumisreaktsioonid ja radikaalide liitumisreaktsioonid. Nukleofiilsed liitumisreaktsioonid nõuavad tavaliselt tugeva nukleofiili olemasolu ja ei ole alkeenidele tüüpilised. Alkeenid läbivad kergesti oksüdatsiooni- ja liitumisreaktsioone ning on samuti võimelised asendama alüülradikaale.
Lisamisreaktsioonid
Hüdrogeenimine Vesiniku lisamine (hüdrogeenimisreaktsioon) alkeenidele viiakse läbi katalüsaatorite juuresolekul. Kõige sagedamini kasutatakse purustatud metalle - plaatinat, niklit, pallaadiumi jne. Selle tulemusena moodustuvad vastavad alkaanid (küllastunud süsivesinikud).
$CH_2=CH_2 + H2 → CH_3–CH_3$
Halogeenide lisamine. Alkeenid reageerivad tavatingimustes kergesti kloori ja broomiga, moodustades vastavad dihaloalkaanid, milles halogeeniaatomid asuvad külgnevate süsinikuaatomite juures.
Märkus 1
Kui alkeenid interakteeruvad broomiga, muutub broomi värvus kollakaspruuniks. See on üks vanimaid ja lihtsamaid küllastumata süsivesinike kvalitatiivseid reaktsioone, kuna ka alküünid ja alkadieenid reageerivad sarnaselt.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
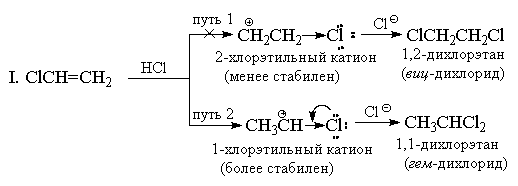
Vesinikhalogeniidide lisamine. Etüleensüsivesinike reageerimisel vesinikhalogeniididega ($HCl$, $HBr$) tekivad haloalkaanid, reaktsiooni suund sõltub alkeenide struktuurist.
Etüleeni või sümmeetriliste alkeenide puhul toimub liitumisreaktsioon ühemõtteliselt ja põhjustab ainult ühe produkti moodustumist:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
Asümmeetriliste alkeenide korral on võimalik kahe erineva liitumisreaktsiooni produkti moodustumine:
Märkus 2
Tegelikult moodustub peamiselt ainult üks reaktsiooniprodukt. Selliste reaktsioonide suuna mustri kehtestas vene keemik V.V. Markovnikov aastal 1869 Seda nimetatakse Markovnikovi valitsemiseks. Kui vesinikhalogeniidid reageerivad ebasümmeetriliste alkeenidega, lisatakse vesinikuaatom kaksiksideme lõhustumise kohale kõige hüdrogeenitud süsinikuaatomil, st enne selle ühendamist suure hulga vesinikuaatomitega.
Markovnikov sõnastas selle reegli katseandmete põhjal ja alles palju hiljem sai see teoreetilise põhjenduse. Mõelge propüleeni reaktsioonile vesinikkloriidiga.
$p$ sideme üks omadusi on selle võime kergesti polariseerida. Metüülrühma (positiivne induktiivne efekt + $I$) mõjul propeeni molekulis nihkub $p$ sideme elektrontihedus ühele süsinikuaatomitest (= $CH_2$). Selle tulemusena ilmub sellele osaline negatiivne laeng ($\delta -$). Kaksiksideme teisele süsinikuaatomile ilmub osaline positiivne laeng ($\delta +$).
Selline elektrontiheduse jaotus propüleeni molekulis määrab tulevase prootonirünnaku asukoha. See on metüleenrühma süsinikuaatom (= $CH_2$), mis kannab osalist negatiivset $\delta-$ laengut. Ja kloor ründab vastavalt süsinikuaatomit osalise positiivse laenguga $\delta+$.
Selle tulemusena on propüleeni ja vesinikkloriidi reaktsiooni põhiproduktiks 2-kloropropaan.
Niisutus
Alkeenide hüdratsioon toimub mineraalhapete juuresolekul ja järgib Markovnikovi reeglit. Reaktsiooniproduktid on alkoholid
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Alküleerimine
Alkaanide lisamine alkeenidele happekatalüsaatori ($HF$ või $H_2SO_4$) juuresolekul madalatel temperatuuridel põhjustab suurema molekulmassiga süsivesinike moodustumist ja seda kasutatakse sageli tööstuses mootorikütuse tootmiseks.
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Oksüdatsioonireaktsioonid
Sõltuvalt oksüdeerivate reaktiivide tingimustest ja tüüpidest võib alkeenide oksüdeerumine toimuda nii kaksiksideme lõhustamisega kui ka süsinikskeleti säilimisega:
Polümerisatsioonireaktsioonid
Alkeenmolekulid on teatud tingimustel võimelised üksteisele lisanduma $\pi$ sidemete avanemise ja dimeeride, trimmerite või suure molekulmassiga ühendite - polümeeride moodustumisega. Alkeenide polümerisatsioon võib toimuda kas vabade radikaalide või katioon-anioonmehhanismi abil. Polümerisatsiooni initsiaatoritena kasutatakse happeid, peroksiide, metalle jne. Polümerisatsioonireaktsioon toimub ka temperatuuri, kiiritamise ja rõhu mõjul. Tüüpiline näide on etüleeni polümerisatsioon polüetüleeni moodustamiseks
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Asendusreaktsioonid
Asendusreaktsioonid ei ole alkeenidele tüüpilised. Kuid kõrgel temperatuuril (üle 400 ° C) pärsitakse radikaalide liitumisreaktsioone, mis on pöörduvad. Sel juhul on võimalik asendada allüülasendis asuv vesinikuaatom, säilitades samas kaksiksideme
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Teadmiste hüpermarket >> Keemia >> Keemia 10. klass >> Keemia: alkeenid
Küllastumata hulka kuuluvad süsivesinikud, mis sisaldavad oma molekulides mitut sidet süsinikuaatomite vahel. Küllastumata on alkeenid, alküünid, alkadieenid (polüeenid). Küllastumata on ka tsüklilised süsivesinikud, mis sisaldavad tsüklis kaksiksidet (tsükloalkeenid), aga ka väikese arvu süsinikuaatomitega tsüklis (kolm või neli aatomit) tsükloalkaanid. "Küllastumatuse" omadus on seotud nende ainete võimega astuda liitumisreaktsioonidesse, peamiselt vesiniku, küllastunud või küllastunud süsivesinike - alkaanide moodustumisega.
Struktuur
Alkeenid on atsüklilised, sisaldades molekulis lisaks üksiksidemetele üht kaksiksidet süsinikuaatomite vahel ja vastavad üldvalemile C n H 2n.
Alkeenid said oma teise nime - "olefiinid" analoogselt küllastumata rasvhapetega (oleiin-, linoolhape), mille jäänused on osa vedelast rasvast - õlidest (inglise keelest õli - õli).
Süsinikuaatomid, mille vahel on kaksikside, nagu teate, on sp 2 hübridisatsiooni olekus. See tähendab, et hübridisatsioonis osalevad üks s- ja kaks p-orbitaali ning üks p-orbitaal jääb hübridiseerimata. Hübriidorbitaalide kattumine viib a-sideme tekkeni ja etüleeni molekuli naabersüsinikuaatomite hübridiseerimata -orbitaalide tõttu tekib teine, P-ühendus. Seega koosneb kaksikside ühest Þ-sidemest ja ühest p-sidemest.
Kaksiksidet moodustavate aatomite hübriidorbitaalid on samas tasapinnas ning n-sideme moodustavad orbitaalid asetsevad risti molekuli tasandiga (vt joonis 5).
Kaksikside (0,132 nm) on lühem kui üksikside ja selle energia on suurem, st tugevam. Sellegipoolest viib liikuva, kergesti polariseeruva 7g-sideme olemasolu selleni, et alkeenid on keemiliselt aktiivsemad kui alkaanid ja on võimelised läbima liitumisreaktsioone.
Eteeni homoloogne seeria
Sirge ahelaga alkeenid moodustavad eteeni (etüleeni) homoloogse seeria.
C2H4 - eteen, C3H6 - propeen, C4H8 - buteen, C5H10 - penteen, C6H12 - hekseen jne.
Isomerism ja nomenklatuur
Alkeene, nagu alkaanegi, iseloomustab struktuurne isomeeria. Nagu mäletate, erinevad struktuursed isomeerid üksteisest süsiniku skeleti struktuuri poolest. Lihtsaim alkeen, mida iseloomustavad struktuursed isomeerid, on buteen.
CH3-CH2-CH=CH2CH3-C=CH2
l
CH3
buteen-1 metüülpropeen
Struktuurse isomeeria eritüüp on kaksiksideme positsiooni isomeeria:
CH3-CH2-CH=CH2CH3-CH=CH-CH3
buteen-1 buteen-2
Süsinikuaatomite peaaegu vaba pöörlemine on võimalik ühe süsinik-süsinik sideme ümber, nii et alkaani molekulid võivad võtta väga erinevaid kujundeid. Pöörlemine ümber kaksiksideme on võimatu, mis põhjustab alkeenides teist tüüpi isomeeride ilmnemist - geomeetrilist või cis-trans isomeeria.
Cis-isomeerid erinevad rindkere isomeeridest molekulaarsete fragmentide (antud juhul metüülrühmade) ruumilise paigutuse poolest tasapinna suhtes P-ühendused ja seega ka omadused.
Alkeenid on tsükloalkaanide suhtes isomeersed (klassidevaheline isomeeria), näiteks:
CH2 = CH-CH2-CH2-CH2-CH3
hekseen-1 tsükloheksaan
Nomenklatuur alkeenid, mille on välja töötanud IUPAC, on sarnane alkaanide nomenklatuuriga.
1. Põhiahela valik
Süsivesiniku nime kujunemine algab peaahela – molekuli pikima süsinikuaatomite ahela – määratlemisest. Alkeenide puhul peab põhiahel sisaldama kaksiksidet.
2. Peaahela aatomite nummerdamine
Peaahela aatomite nummerdamine algab otsast, millele kaksikside on kõige lähemal. Näiteks õige ühenduse nimi on
dn3-dn-dn2-dn=dn-dn3 dn3
5-metüülhekseen-2, mitte 2-metüülhekseen-4, nagu võiks eeldada.
Kui kaksiksideme asend ei suuda määrata aatomite numeratsiooni algust ahelas, siis määratakse see asendajate asukoha järgi samamoodi nagu küllastunud süsivesinike puhul.
CH3-CH2-CH=CH-CH-CH3
l
CH3
2-metüülhekseen-3
3. Nime kujunemine
Alkeenide nimed moodustatakse samamoodi nagu alkaanide nimed. Nime lõppu märkige süsinikuaatomi number, millest kaksikside algab, ja järelliide, mis näitab, et ühend kuulub alkeenide klassi -een.
Kviitung
1. Naftasaaduste krakkimine. Küllastunud süsivesinike termilise krakkimise protsessis koos alkaanide moodustumisega tekivad alkeenid.
2. Küllastunud süsivesinike dehüdrogeenimine. Kui alkaanid juhitakse üle katalüsaatori kõrgel temperatuuril (400-600 °C), elimineeritakse vesiniku molekul ja moodustub alkeen: 
3. Alkoholide dehüdratsioon (vee eemaldamine). Vett eemaldavate ainete (H2804, Al203) toime ühehüdroksüülsetele alkoholidele kõrgel temperatuuril viib veemolekuli elimineerimiseni ja kaksiksideme moodustumiseni:
Seda reaktsiooni nimetatakse intramolekulaarseks dehüdratsiooniks (erinevalt molekulidevahelisest dehüdratsioonist, mis viib eetrite moodustumiseni ja mida uuritakse paragrahvis 16 “Alkoholid”).
4. Dehüdrohalogeenimine (vesinikhalogeniidi elimineerimine).
Kui haloalkaan reageerib alkoholilahuses leelisega, tekib vesinikhalogeniidi molekuli elimineerimise tulemusena kaksikside.
Pange tähele, et see reaktsioon tekitab peamiselt buteen-2, mitte buteen-1, mis vastab Zaitsevi reegel:
Kui vesinikhalogeniid elimineeritakse sekundaarsetest ja tertsiaarsetest haloalkaanidest, elimineeritakse vesinikuaatom kõige vähem hüdrogeenitud süsinikuaatomist.
5. Dehalogeenimine. Kui tsink toimib alkaani dibromoderivaadile, elimineeritakse naabersüsinikuaatomite juures asuvad halogeeniaatomid ja moodustub kaksikside: 
Füüsikalised omadused
Alkeenide homoloogse seeria kolm esimest esindajat on gaasid, ained koostisega C5H10-C16H32 on vedelikud ja kõrgemad alkeenid on tahked ained.
Keemis- ja sulamistemperatuurid tõusevad loomulikult koos ühendite molekulmassi suurenemisega.
Keemilised omadused
Lisamisreaktsioonid
Tuletagem meelde, et küllastumata süsivesinike - alkeenide - esindajate eripäraks on võime osaleda liitumisreaktsioonides. Enamik neist reaktsioonidest kulgeb elektrofiilse liitmismehhanismi abil.
1. Alkeenide hüdrogeenimine. Alkeenid on võimelised lisama vesinikku hüdrogeenimiskatalüsaatorite juuresolekul - metallid - plaatina, pallaadium, nikkel:
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
See reaktsioon toimub nii atmosfäärirõhul kui ka kõrgendatud rõhul ega vaja kõrget temperatuuri, kuna see on eksotermiline. Kui temperatuur tõuseb, võivad samad katalüsaatorid põhjustada pöördreaktsiooni – dehüdrogeenimist.
2. Halogeenimine (halogeenide lisamine). Alkeeni interaktsioon broomveega või broomi lahusega orgaanilises lahustis (CCl4) põhjustab nende lahuste kiiret värvimuutust, mis on tingitud halogeeni molekuli lisamisest alkeenile ja dihaloalkaanide moodustumisest.
Markovnikov Vladimir Vassiljevitš
(1837-1904)
Vene orgaaniline keemik. Formuleeritud (1869) reeglid asendamise, eliminatsiooni, kaksiksideme juures lisamise ja isomeerimisreaktsioonide suuna kohta sõltuvalt keemilisest struktuurist. Ta uuris (alates 1880. aastast) nafta koostist ja pani aluse naftakeemiale kui iseseisvale teadusele. Avastas (1883) uue orgaaniliste ainete klassi – tsükloparafiinid (nafteenid).
3. Hüdrohalogeenimine (vesinikhalogeniidi lisamine).
Vesinikhalogeniidi liitumisreaktsiooni käsitletakse üksikasjalikumalt allpool. See reaktsioon järgib Markovnikovi reeglit:
Kui vesinikhalogeniid seostub alkeeniga, kinnitub vesinik rohkem hüdrogeenitud süsinikuaatomiga, st aatomiga, millel on rohkem vesinikuaatomeid, ja halogeen vähem hüdrogeenitud süsinikuaatomiga.
4. Niisutamine (vee lisamine). Alkeenide hüdratsioon põhjustab alkoholide moodustumist. Näiteks vee lisamine eteenile on ühe etüülalkoholi tootmise tööstusliku meetodi aluseks:
CH2=CH2 + H2O -> CH3-CH2OH
eteen etanool
Pange tähele, et primaarne alkohol (mille primaarsel süsinikul on hüdroksürühm) moodustub ainult siis, kui eteen on hüdraatunud. Propeeni või teiste alkeenide hüdraatumisel tekivad sekundaarsed alkoholid. 
Ka see reaktsioon kulgeb Markovnikovi reegli kohaselt – vesinikkatioon kinnitub rohkem hüdrogeenitud süsinikuaatomiga ja hüdroksürühm vähem hüdrogeenitud aatomiga.
5. Polümerisatsioon. Lisamise erijuhtum on alkeenide polümerisatsioonireaktsioon:
See liitumisreaktsioon toimub vabade radikaalide mehhanismi kaudu.
Oksüdatsioonireaktsioonid
Nagu kõik orgaanilised ühendid, põlevad alkeenid hapnikus, moodustades CO2 ja H20.
Erinevalt alkaanidest, mis on lahustes oksüdeerumisele vastupidavad, oksüdeeruvad alkeenid kergesti kaaliumpermanganaadi vesilahuste toimel. Neutraalsetes või kergelt leeliselistes lahustes oksüdeeritakse alkeenid dioolideks (dihüdroksüülsed alkoholid) ja hüdroksüülrühmad lisatakse nendele aatomitele, mille vahel eksisteeris enne oksüdatsiooni kaksikside.
Nagu te juba teate, on küllastumata süsivesinikud - alkeenid võimelised osalema liitumisreaktsioonides. Enamik neist reaktsioonidest kulgeb elektrofiilse liitmismehhanismi abil.
Elektrofiilne ühendus
Elektrofiilsed reaktsioonid on reaktsioonid, mis toimuvad elektrofiilide - osakeste, millel puudub elektrontihedus, näiteks täitmata orbitaal, mõjul. Lihtsaim elektrofiilne osake on vesiniku katioon. On teada, et vesinikuaatomil on 3. orbitaalil üks elektron. Vesiniku katioon tekib siis, kui aatom kaotab selle elektroni, seega pole vesiniku katioonil üldse elektrone:
Н· - 1е - -> Н +
Sel juhul on katioonil üsna kõrge elektronafiinsus. Nende tegurite kombinatsioon muudab vesiniku katioonist üsna tugeva elektrofiilse osakese.
Vesinikkatiooni moodustumine on võimalik hapete elektrolüütilise dissotsiatsiooni käigus:
НВr -> Н + + Вr -
Just sel põhjusel toimuvad hapete juuresolekul ja osalusel paljud elektrofiilsed reaktsioonid.
Nagu varem mainitud, toimivad elektrofiilsed osakesed süsteemidele, mis sisaldavad suurenenud elektrontihedusega piirkondi. Sellise süsteemi näide on mitmekordne (kaksik- või kolmik) süsinik-süsinik side.
Te juba teate, et süsinikuaatomid, mille vahel moodustub kaksikside, on sp 2 hübridisatsiooni olekus. Samal tasapinnal paiknevate naabersüsinikuaatomite hübridiseerimata p-orbitaalid kattuvad, moodustuvad P-side, mis on vähem tugev kui Þ-side ja mis kõige tähtsam, polariseerub kergesti välise elektrivälja mõjul. See tähendab, et positiivselt laetud osakese lähenemisel nihkuvad CS-sideme elektronid selle poole ja nn. P- keeruline.
Selgub P-kompleks ja vesinikkatiooni lisamisel P- ühendused. Näib, et vesiniku katioon põrkub molekuli tasapinnast väljaulatuvasse elektrontihedusse P-ühendus ja sellega liitumine. ![]()
Järgmises etapis toimub elektronipaari täielik nihkumine P-sideme ühe süsinikuaatomiga, mis viib selle üksiku elektronpaari ilmumiseni. Süsinikuaatomi orbitaal, millel see paar asub, ja vesinikkatiooni hõivamata orbitaal kattuvad, mis viib kovalentse sideme moodustumiseni doonor-aktseptormehhanismi kaudu. Teisel süsinikuaatomil on endiselt täitmata orbitaal, st positiivne laeng.
Saadud osakest nimetatakse karbokatiooniks, kuna see sisaldab süsinikuaatomi positiivset laengut. See osake võib ühineda mis tahes aniooniga, osakesega, millel on üksik elektronpaar, st nukleofiil.
Vaatleme elektrofiilse liitumisreaktsiooni mehhanismi, kasutades eteeni hüdrobroomimise (vesinikbromiidi lisamise) näidet:
СН2= СН2 + НВг --> СНВr-СН3
Reaktsioon algab elektrofiilse osakese – vesinikkatiooni moodustumisega, mis tekib vesinikbromiidi molekuli dissotsiatsiooni tulemusena.
Vesinikkatioonide rünnakud P- ühendamine, moodustamine P- kompleks, mis muundatakse kiiresti karbokatiooniks: 
Vaatame nüüd keerulisemat juhtumit.
Vesinikbromiidi eteenile lisamise reaktsioon kulgeb ühemõtteliselt ning vesinikbromiidi ja propeeni koostoime võib teoreetiliselt anda kaks produkti: 1-bromopropaan ja 2-bromopropaan. Eksperimentaalsed andmed näitavad, et peamiselt toodetakse 2-bromopropaani.
Selle selgitamiseks peame arvestama vaheosakesega - karbokatatsiooniga.
Vesiniku katiooni lisamine propeenile võib viia kahe karbokatiooni moodustumiseni: kui vesiniku katioon liitub esimese süsinikuaatomiga, ahela lõpus asuva aatomiga, siis teine on positiivse laenguga, s.t. molekuli kese (1); kui see liitub teisega, siis on esimesel aatomil positiivne laeng (2). 
Reaktsiooni eelistatud suund sõltub sellest, millist karbokatiooni on reaktsioonikeskkonnas rohkem, mille omakorda määrab karbokatiooni stabiilsus. Katse näitab valdavat 2-bromopropaani moodustumist. See tähendab, et suuremal määral tekib keskaatomil positiivse laenguga karbokatioon (1).
Selle karbokatiooni suurem stabiilsus on seletatav asjaoluga, et keskse süsinikuaatomi positiivset laengut kompenseerib kahe metüülrühma positiivne induktiivne toime, mille kogumõju on suurem kui ühe etüülrühma +/- mõju:
Alkeenide hüdrohalogeenimise reaktsioonide seadusi uuris kuulus vene keemik V. V. Markovnikov, A. M. Butlerovi õpilane, kes, nagu eespool mainitud, sõnastas oma nime kandva reegli.
See reegel kehtestati empiiriliselt, st eksperimentaalselt. Praegu saame sellele anda täiesti veenva seletuse.
Huvitaval kombel järgivad Markovnikovi reeglit ka teised elektrofiilsed liitmisreaktsioonid, mistõttu oleks õige sõnastada see üldisemal kujul.
Elektrofiilsetes liitumisreaktsioonides lisandub elektrofiil (täitmata orbitaaliga osake) rohkem hüdrogeenitud süsinikuaatomile ja nukleofiil (üksiku elektronide paariga osake) vähem hüdrogeenitud süsinikuaatomile.
Polümerisatsioon
Liitmisreaktsiooni erijuht on alkeenide ja nende derivaatide polümerisatsioonireaktsioon. See reaktsioon toimub vabade radikaalide lisamise mehhanismi kaudu:
Polümerisatsioon viiakse läbi initsiaatorite - peroksiidühendite juuresolekul, mis on vabade radikaalide allikas. Peroksiidühendid on ained, mille molekulid sisaldavad -O-O- rühma. Lihtsaim peroksiidiühend on vesinikperoksiid HOOH.
Temperatuuril 100 °C ja rõhul 100 MPa toimub ebastabiilse hapniku-hapniku sideme homolüüs ja radikaalide - polümerisatsiooni initsiaatorite - moodustumine. KO-radikaalide mõjul käivitatakse polümerisatsioon, mis areneb vabade radikaalide liitumisreaktsioonina. Ahela kasv peatub, kui reaktsioonisegus toimub radikaalide rekombinatsioon - polümeeri ahel ja radikaalid ehk COCH2CH2-.
Kaksiksidet sisaldavate ainete vabade radikaalide polümerisatsiooni reaktsiooni abil saadakse suur hulk suure molekulmassiga ühendeid: 
Erinevate asendajatega alkeenide kasutamine võimaldab sünteesida laia valikut polümeerseid materjale, millel on lai valik omadusi. 
Kõiki neid polümeerseid ühendeid kasutatakse laialdaselt erinevates inimtegevuse valdkondades – tööstuses, meditsiinis, kasutatakse biokeemiliste laborite seadmete valmistamiseks, mõned on vaheühendid teiste kõrgmolekulaarsete ühendite sünteesiks.
Oksüdatsioon
Te juba teate, et neutraalsetes või kergelt leeliselistes lahustes toimub alkeenide oksüdatsioon dioolideks (dihüdroksüülsete alkoholide). Happelises keskkonnas (väävelhappega hapestatud lahus) kaksikside hävib täielikult ja süsinikuaatomid, mille vahel kaksikside eksisteeris, muundatakse karboksüülrühma süsinikuaatomiteks: 
Alkeenide destruktiivset oksüdatsiooni saab kasutada nende struktuuri määramiseks. Näiteks kui teatud alkeeni oksüdeerimisel saadakse äädik- ja propioonhapped, tähendab see, et penteen-2 on oksüdeerunud ja kui saadakse võihape ja süsinikdioksiid, on algne süsivesinik penteen-1. .
Rakendus
Alkeene kasutatakse keemiatööstuses laialdaselt toorainena mitmesuguste orgaaniliste ainete ja materjalide tootmiseks.
Näiteks eteen on etanooli, etüleenglükooli, epoksiidide ja dikloroetaani tootmise lähteaine.
Suur hulk eteeni töödeldakse polüetüleeniks, millest valmistatakse pakkekile, lauanõusid, torusid ja elektriisolatsioonimaterjale.
Glütseriin, atsetoon, isopropanool ja lahustid saadakse propeenist. Propeeni polümeriseerimisel saadakse polüpropüleen, mis on mitmes mõttes parem kui polüetüleen: sellel on kõrgem sulamistemperatuur ja keemiline vastupidavus.
Praegu toodetakse ainulaadsete omadustega kiude polümeeridest - polüetüleeni analoogidest. Näiteks polüpropüleenkiud on tugevam kui kõik teadaolevad sünteetilised kiud.
Nendest kiududest valmistatud materjalid on paljulubavad ja neid kasutatakse üha enam erinevates inimtegevuse valdkondades.

1. Mis tüüpi isomeeria on alkeenidele iseloomulik? Kirjutage penteen-1 võimalike isomeeride valemid.
2. Millistest ühenditest saab: a) isobuteen (2-metüülpropeen); b) buteen-2; c) buteen-1? Kirjutage vastavate reaktsioonide võrrandid.
3. Dešifreerige järgmine teisenduste ahel. Nimetage ühendid A, B, C. 4. Pakkuge välja meetod 2-kloropropaani saamiseks 1-kloropropaanist. Kirjutage vastavate reaktsioonide võrrandid.
5. Soovitage meetod etaani puhastamiseks etüleeni lisanditest. Kirjutage vastavate reaktsioonide võrrandid.
6. Tooge näiteid reaktsioonidest, mille abil saab eristada küllastunud ja küllastumata süsivesinikke.
7. 2,8 g alkeeni täielikuks hüdrogeenimiseks kulutati 0,896 liitrit vesinikku (n.e.). Mis on selle normaalse süsinikuaatomiahelaga ühendi molekulmass ja struktuurivalem?
8. Mis gaas on silindris (eteen või propeen), kui on teada, et 20 cm3 selle gaasi täielikuks põlemiseks kulus 90 cm3 (n.s.) hapnikku?
9*. Kui alkeen reageerib pimedas klooriga, tekib 25,4 g dikloriidi ja kui see sama massiga alkeen reageerib broomiga süsiniktetrakloriidis, siis 43,2 g dibromiidi. Määrake lähtealkeeni kõik võimalikud struktuurivalemid.
Avastamise ajalugu
Ülaltoodud materjalist oleme juba aru saanud, et etüleen on küllastumata süsivesinike homoloogse seeria esivanem, millel on üks kaksikside. Nende valem on C n H 2n ja neid nimetatakse alkeenideks.
1669. aastal sai saksa arst ja keemik Becher esimesena etüleeni väävelhappe reageerimisel etüülalkoholiga. Becher leidis, et etüleen on keemiliselt aktiivsem kui metaan. Kuid kahjuks ei suutnud teadlane sel ajal tekkinud gaasi tuvastada ega andnud seetõttu sellele nime.
Veidi hiljem kasutasid Hollandi keemikud etüleeni tootmiseks sama meetodit. Ja kuna see kippus klooriga suhtlemisel moodustama õlist vedelikku, sai see vastavalt nimetuse "naftagaas". Hiljem sai teatavaks, et see vedelik oli dikloroetaan.
Prantsuse keeles on mõiste "õli" oléfiant. Ja pärast teiste seda tüüpi süsivesinike avastamist võttis prantsuse keemik ja teadlane Antoine Fourcroix kasutusele uue termini, mis sai tavaliseks kogu olefiinide või alkeenide klassi jaoks.
Kuid juba 19. sajandi alguses avastas prantsuse keemik J. Gay-Lussac, et etanool ei koosne mitte ainult naftagaasist, vaid ka veest. Lisaks avastati sama gaas etüülkloriidis.
Ja kuigi keemikud tegid kindlaks, et etüleen koosneb vesinikust ja süsinikust, ning teadsid juba ainete koostist, ei suutnud nad pikka aega selle tegelikku valemit leida. Ja alles 1862. aastal õnnestus E. Erlenmeyeril tõestada kaksiksideme olemasolu etüleeni molekulis. Seda tunnistas ka vene teadlane A. M. Butlerov ja kinnitas selle vaatenurga õigsust eksperimentaalselt.
Alkeenide esinemine looduses ja füsioloogiline roll
Paljud inimesed on huvitatud küsimusest, kus alkeene looduses leidub. Niisiis selgub, et looduses neid praktiliselt ei esine, kuna selle lihtsaim esindaja etüleen on taimede hormoon ja seda sünteesitakse neis ainult väikestes kogustes.
Tõsi, looduses leidub selline alkeen nagu muskalur. See üks looduslikest alkeenidest on emase kodukärbse seksuaalne atraktant.
Tasub pöörata tähelepanu asjaolule, et kõrge kontsentratsiooniga madalamatel alkeenidel on narkootiline toime, mis võib põhjustada krampe ja limaskestade ärritust.
Alkeenide rakendused
Tänapäeva kaasaegse ühiskonna elu on raske ette kujutada ilma polümeermaterjalide kasutamiseta. Kuna erinevalt looduslikest materjalidest on polümeeridel erinevad omadused, on neid lihtne töödelda ja kui hinda vaadata, siis on need suhteliselt odavad. Teine oluline aspekt polümeeride kasuks on see, et paljusid neist saab taaskasutada.
Alkeene on kasutatud plastide, kummide, kilede, tefloni, etüülalkoholi, atseetaldehüüdi ja muude orgaaniliste ühendite tootmisel.

Põllumajanduses kasutatakse seda vahendina, mis kiirendab puuviljade valmimisprotsessi. Propüleeni ja butüleene kasutatakse erinevate polümeeride ja alkoholide tootmiseks. Kuid sünteetilise kummi tootmisel kasutatakse isobutüleeni. Seetõttu võime järeldada, et ilma alkeenideta ei saa hakkama, kuna need on kõige olulisemad keemilised toorained.
Etüleeni tööstuslik kasutamine
Tööstuslikus mastaabis kasutatakse propüleeni tavaliselt polüpropüleeni sünteesiks ning isopropanooli, glütserooli, butüüraldehüüdide jms tootmiseks. Igal aastal suureneb nõudlus propüleeni järele.

4.3.b. Vesinikhalogeniidide lisamine (hüdrohalogeenimine)
Teine oluline elektrofiilne liitumisreaktsioon alkeenidele on alkeenide ammu tuntud hüdrohalogeenimine.
Allpool on toodud tüüpilised näited HCl, HBr ja HI lisamisest erinevatele alkeenidele.


Alküülasendajate mõju kaksiksidemele liitumiskiirusele kirjeldatakse järgmise järjestusega:
R2 C=CHR > RCH=CHR > RCH=CH2
See on kooskõlas mehhanismiga, milles reaktsiooni kiirust määrav etapp hõlmab karbokatiooni moodustumist, kuna alküülkatioonide stabiilsus väheneb järjekorras tertsiaarne> sekundaarne> primaarne. Seega peab lisamise mehhanism hõlmama kas vaba karbokatiooni vaheühendi, mida täheldatakse harva, või karbokatioonse iseloomuga vaheühendi moodustumist. Viimane juhtum on kõige tüüpilisem.
Kui lisamine toimuks "vaba karbokatiooni" kaudu, oleks reaktsioon täiesti mittestereoselektiivne, kuna alküülkatioonidel on tasapinnaline struktuur. Kuid hüdrohalogeenimine toimub reeglina stereoselektiivselt ja sõltuvalt alkeeni tüübist selektiivne anti-kinnitus, valikuline sün- või segatud sün-anti- ühinemine.
Alkeenidele, milles kaksikside ei ole konjugeeritud aromaatse ringiga, on see iseloomulik anti-vesinikhalogeniidi lisamine. Anti- tsüklohekseeni, tsüklopenteeni, 1,2-dimetüülhekseeni, 1,2-dimetüülpenteeni puhul on täheldatud vesinikkloriidi ja bromiidi, deuteeriumkloriidi ja bromiidi lisamist, cis- Ja transs-buteen-2, hekseen-3 ja paljud teised lihtsad alkeenid ja tsükloalkeenid.

Liitsaaduses paiknevad identsed asendajad (metüülrühmad) tsükloheksaanitsükli kesktasandi erinevatel külgedel, mistõttu see kuulub transs- rida. Anti-liitumist on raske ühildada mehhanismiga, mille puhul eeldatakse diskreetse karbokatiooni moodustumist. Tasapinnalise karbokatsiooni korral on halogeniidiooni nukleofiilne rünnak võrdselt tõenäoline mõlemal pool tasapinda, mis peaks viima produktide segu moodustumiseni. sün- Ja anti- liitumised. Alkeeni hüdrohalogeenimise kineetika viitab ka keerukamale lisamismehhanismile. Konjugeerimata alkeenide puhul kirjeldatakse reaktsioonikiirust kolmandat järku võrrandiga vesinikhalogeniidis, st see vastab Ad E3 mehhanismile.
v = k [alkeen] 2
Vesinikhalogeniidi liitumisvastane ja teist järku reaktsioon sobib hästi Ad E3 mehhanismiga, kus alkeen reageerib kahe vesinikhalogeniidi molekuliga, millest üks toimib elektrofiilse ja teine nukleofiilse ainena.

See trimolekulaarne mehhanism eeldab, et algselt moodustub alkeeni ja ühe vesinikhalogeniidi molekuli kompleks, millele järgneb teise HX molekuli rünnak sellele kompleksile. anti-küljed ilma diskreetse karbokaadi moodustumiseta. Eriti tuleb märkida, et iga trimolekulaarne mehhanism peab koosnema kahest järjestikusest etapist, kuna kolme molekuli samaaegne kokkupõrge on äärmiselt ebatõenäoline.

Lisamisvastane toime näitab eelistatud nukleofiilset rünnakut vesinikhalogeniidi poolt alkeeni protoneerimise koha vastasküljelt. Vesinikhalogeniidi asemel võib nukleofiilse aine funktsiooni lõppfaasis täita ka halogeniidiioon. Tõepoolest, reaktsioonikiirus suureneb tavaliselt otseses proportsioonis halogeniidiiooni kontsentratsiooniga, mis viiakse reaktsioonisegusse tetraalküülammooniumhalogeniidide NR4+ X kujul. - või liitium LiX. Sel juhul stereospetsiifiline anti- ühinemine.
Alkaanidele, milles kaksikside on konjugeeritud aromaatse ringiga, on see iseloomulik sün- ühinemine või segatud sün-anti-vesinikhalogeniidi lisamine, näiteks:

Sünni lisamine on domineeriv protsess cis- Ja transs- 1-fenüülpropeeni, 1-fenüül-4-alküültsüklohekseeni, atsenaftüleeni, indeeni isomeerid. Selliste alkeenide protoneerimisel tekivad bensüül-tüüpi karbokatioonid, mis on stabiilsemad kui puhtalt alküülkatioonid, mis tekivad tavaliste alkeenide ja tsükloalkeenide protoneerimisel. Reaktsiooni kineetikat kirjeldatakse sel juhul tavaliselt lihtsama teist järku võrrandiga v = k[alkeen], st see vastab bimolekulaarsele Ad E 2 mehhanismile. Ad E 2-mehhanism hõlmab ioonipaari moodustumist, mis hõlmab karbokatiooni ja halogeniidiooni.

Ioonipaare hõlmav liitmismehhanism ei saa eeldada, et see oleks väga stereoselektiivne. Kui ioonipaar muudetakse lõppsaaduseks kiiremini, kui see suudab ühe süsinik-süsinik sideme ümber pöörata, on lõpptulemus sün-liitmine, kus kaksiksideme samale küljele lisatakse prooton ja halogeniidiioon. Vastasel juhul tekivad sellised tooted nagu sün- nii anti- NH ühendus. See juhtum esineb hüdrohalogeenimise ajal paar-asendatud stüreen Z-C6H4-CH=CH2. Siin täheldatud muster on selline sün-liitmine on tüüpiline ainult nendele olefiinidele, mis protoneerimisel annavad suhteliselt stabiilse karbokatatsiooni, st doonorasendajate Z puhul.
Ad E2 mehhanismi järgi kulgevaid hüdrohalogeenimisreaktsioone iseloomustab konkurents konjugaadi lisamise ja ümberpaigutamise protsesside vahel, kuna vaheühendina moodustub karbokatioon või ioonipaar.

Alküülrühma ja hüdriidiooni 1,2-migratsiooniga ümberkorralduste näitena esitame vastavalt tert-butüületüleeni ja isopropüületüleeni hüdrohalogeenimisreaktsioonid.

Kui sama reaktsioon viiakse läbi ilma lahustita külmas (-78 0 C), moodustub segu 33% normaalsetest ja 67% ebanormaalsetest (ümberrühmitatud) liitumisproduktidest.

4.3.c. Orienteerumine. Markovnikovi reegel
Erinevalt sümmeetrilistest elektrofiilidest (Hal 2) on vesinikhalogeniidid ebasümmeetrilised elektrofiilsed reaktiivid. Mis tahes ebasümmeetrilise elektrofiili (HBr, ICl, H2O, Hg(OAc)2 jne) lisamine ebasümmeetrilisele alkeenile võib põhimõtteliselt tekitada kahe alternatiivse produkti segu, kuid praktikas tekib neist tavaliselt ainult üks. Näiteks kaaluge vesinikbromiidi lisamist propüleenile.

Veel 1870. aastal V.V. Markovnikov sõnastas empiirilise reegli, mille kohaselt ebasümmeetrilised alkeenid lisavad HX-i nii, et eelistatult moodustub saadus, milles kaksiksideme kõige vähem asendatud otsa on lisatud vesinik ja kõige enam asendatud otsa X.
Markovnikovi reeglit seletatakse tavaliselt kahe alternatiivse karbokatiooni stabiilsuse erinevusega. Näiteks ülaltoodud näites tavaline n-propüülkatioon on palju vähem stabiilne kui isopropüülkatioon ja seetõttu kulgeb reaktsioon mööda teist rada.
Markovnikovi reeglit kasutati algselt ainult süsivesiniksubstraatidele HX lisamise korral, kuid põhimõtteliselt saab seda laiendada ka teiste asendatud alkeenide reaktsioonidele. Seega annab HCl lisamine CF3 CH=CH2-le " anti-Markovnikov" toode CF 3 CH 2 CH 2 Cl. See oli ootuspärane, kuna CF 3 CH+ CH 3 katioon on CF 3 CH 2 CH 2+ katioonist vähem stabiilne, kuna katioon on tugeva (-I) toimega. CF 3 rühm Moodustub valdavalt katioon CF 3 CH 2 CH 2+, kuid seda, kuigi vähemal määral, destabiliseerib ka CF 3 rühma induktiivne toime, mille tulemusena tekib HCl lisamine trifluorometüületüleenile. palju aeglasem kui asendamata etüleeni lisamine.
Sarnasel põhjusel lisavad vinüültrialküülammooniumi katioonid HBr ka Markovnikovi reegli vastu:
HX lisamine tugevate (-I) ja (-M) asendajatega alkeenidele, näiteks akrüülnitriilile või nitroetüleenile, peaks samuti olema vastuolus Markovnikovi reegliga. Kuid sel juhul on kaksikside elektrofiilsete reagentide suhtes nii tugevalt deaktiveeritud, et need reaktsioonid toimuvad ainult väga rangetes tingimustes. Vinüülkloriid CH 2 =CHCl annab alati eranditult “Markovnikovi adukte”. Näiteks kui see reageerib HCl-ga, moodustub ainult 1,1-dikloroetaan (geminaalne dikloriid) CH 3 CHCl 2. Kloor on sarnaselt CF 3 rühmaga tugeva (-I) toimega ja esmapilgul tundub, et sel põhjusel peaks lisamine olema Markovnikovi-vastase orientatsiooniga, kuna + CH 2 CH 2 Cl katioon peaks olema stabiilsem kui katioon CH 3 CH + Cl. Kuid erinevalt CF 3 rühmast on klooril lisaks (-I) efektile ka vastandlik (+M) toime (kuna sellel on üksikud paarid). Kogemused näitavad, et mesomeerse efekti suurus on täiesti piisav, et viia 1-kloroetüülkatiooni energia alla 2-kloroetüülkatiooni energiataseme, mille puhul +M efekt ei avaldu.
II. Resonantsi teooria seisukohalt võib 1-kloroetüülkatiooni struktuuri kujutada järgmiselt:
Samas toimub vinüülkloriidi lisamine samadel tingimustel aeglasemalt kui etüleenile, st vastavalt üldmõjule (-I > +M) jääb kloor vesinikuga võrreldes elektrone väljatõmbavaks asendajaks ja 1-kloroetüülkatiooniks on vähem stabiilne kui C 2 H 5 +. Teised vinüülhalogeniidid reageerivad sarnaselt HX-ga.
Vinüüleetrid CH 2 = CHOR lisavad HX (X = Hal) vastavalt Markovnikovi reeglile palju suurema kiirusega kui kõik eespool loetletud asendatud alkeenid. Selle põhjuseks on RO rühma oluline +M mõju. Erinevalt klooriaatomist on RO rühm kogu elektroonilise efekti (+M > -I) seisukohalt tugev elektrone loovutav asendaja, mis stabiliseerib tõhusalt naaberkarbokatatsioonikeskust. Karbokatsiooni struktuuri võib sel juhul esitada ka kahe resonantsstruktuuri komplektina
Oksooniumi katiooni rünnak halogeniidi aniooni poolt põhjustab CH3CH(Hal)OR tüüpi α-halogeeneetrite moodustumist.
4.3.g. Alkeenide hüdratsioon
Alkeenide happega katalüüsitud hüdratsioon põhjustab alkoholide moodustumist. Alkeenide hüdratatsiooni suund määratakse Markovnikovi reegliga, mistõttu eeldatakse, et selles reaktsioonis tekib vaheosakesena karbokatioon.
Sekundaarsete alküülkarbokatioonide kalduvus ümber korraldada takistab alkeenide hüdratatsiooni kasutamist sekundaarsete alkoholide tootmiseks.

Seda meetodit on laboris vähe kasutatud ainult tertsiaarsete alkoholide valmistamiseks. Hüdratsioonireaktsioon on sel juhul suures osas pöörduv ja tertsiaarsed alkoholid tekivad madala saagisega (40-45%).


Lihtsaimate alkeenide – etüleeni ja propüleeni – hüdraatimine on oluline tööstuslik meetod etüül- ja isopropüülalkoholide tootmiseks.

Laboripraktikas ei ole alkeenide otsene hüdratiseerimine leidnud laialdast kasutust, seda nii karmide tingimuste kui ka märkimisväärse koguse isomeersete alkoholide moodustumise tõttu. Praegu kasutatakse alkoholide regioselektiivseks tootmiseks alkeenidest tavaliselt sellega seotud hüdroksümerkuratsiooni reaktsiooni – demerkuratsiooni.
4.3.d. Hüdroksümerkuratsioon-demerkuratsioon
Alkeeni kaksiksideme elektrofiilse rünnaku võivad läbi viia metalliioonid, mille hulgas on elavhõbeda (II) katioon erilisel positsioonil. Elavhõbedaatsetaat lisab väga pehmetes tingimustes temperatuuril 20 0 C alkeenidele tetrahüdrofuraani vesilahuses (THF) või äädikhappe vesilahuses, moodustades elavhõbedaorgaanilisi ühendeid. Elavhõbedaatsetaadi lisamine kaksiksidemele toimub regiospetsiifiliselt vastavalt Markovnikovi reeglile, st elavhõbeda katioon kinnitub kõige vähem asendatud süsinikuaatomiga.
C-Hg sidet elavhõbedaorgaanilistes ühendites saab naatriumboorhüdriidi NaBH 4 toimel kergesti lõhustada, moodustades elavhõbeda ja uue CH-sideme. Eeldatakse, et alküülelavhõbehüdriid saadakse ebastabiilse vaheühendina, mis laguneb edasi, vabastades radikaalse mehhanismi abil metallilise elavhõbeda.

Kokkuvõttes kujutab see kaheetapiline hüdroksümerkuratsiooni-demerkuratsiooni protsess lõppkokkuvõttes Markovnikovi reegli järgi alkeeni regiospetsiifilist hüdraatimist äärmiselt pehmetes tingimustes, kui kõrvalsaaduste teket vähendatakse võimalikult miinimumini. Seda saab selgelt illustreerida järgmiste näidetega, milles reaktsiooniproduktide kogusaagis on 90-98%. Antud digitaalsed andmed ei näita antud juhul mitte tekkivate ühendite saagiseid, vaid nende suhet segus.




Nagu ülaltoodud näidetest näha, tagab alkeenide hüdroksümerkureerimine-demerkureerimine enamikul juhtudel alkeenide regiospetsiifilise hüdratatsiooni, moodustades peaaegu ainult ühe kahest isomeersest alkoholist. Tuleb märkida, et elavhõbedaorgaanilist ühendit ei ole vaja eraldada ja mõlemat protsessi saab läbi viia vahetult üksteise järel.
Asümmeetriliste alkeenide hüdroksümerkureerimine algab ilmselt AcOHg + katiooni rünnakuga ja ebasümmeetrilise tsüklilise elavhõbeda katiooni (ebasümmeetrilise halogeeniumiooni analoog) vaheühendina moodustumisega, mis seejärel avaneb maksimaalselt vee nukleofiilse rünnaku tulemusena. asendatud süsinikuaatom, mis kannab suuremat positiivset laengut.

Sildavat elavhõbeda iooni saab fikseerida mittenukleofiilses tugevalt happelises keskkonnas isegi temperatuuril 20 0 C, lisades tugevama elektrofiilse aine - elavhõbeda trifluoroatsetaadi fluorosulfoonhappe ja antimonpentafluoriidi segus.

Elavhõbeda katiooni saab lagundada mitte ainult vee toimel, vaid ka teiste elektrone loovutavate lahustitega: alkoholid, äädikhape, atsetonitriil jne. Reaktsiooni lõppsaaduseks on sel juhul eetrid, atsetaadid või N-asendatud amiidid. äädikhape, näiteks:


Kui alkoksümerkuratsiooni-demerkuratsiooni reaktsioonis kasutatakse hargnenud sekundaarseid või tertsiaarseid alkohole, on trifluoroatsetaat Hg(OCOCF 3) 2 või elavhõbedatriflaat Hg(OSO 2 CF 3) 2 tõhusamad kui elavhõbedaatsetaat.

Seega on hüdroksü- ja alkoksümerkuratsioon-demerkureerimine üks parimaid ettevalmistusmeetodeid hargnenud ahelaga alküülradikaalidega alkoholide ja eetrite sünteesiks.
Elavhõbedasoolade lisamine alkeenidele on kõige ilmekam näide konjugaadi liitumisreaktsioonist kaksiksidemele, kus välise nukleofiilse aine rolli täidab lahusti. Kahekordse hüdroksümerkuratsiooni-demerkuratsiooni protsessi stereokeemia sõltub iga üksiku etapi stereokeemilisest tulemusest. Hüdroksümerkuratsiooni iseloomustab anti-liitmine, nagu ka teiste reaktsioonide puhul, mis hõlmavad tsüklilist katiooni. Kuid radikaalne demerkureerimine ei ole väga stereoselektiivne. Seetõttu on ka kogu protsess tervikuna mittestereospetsiifiline.
4.3.e. Alkeenide lisamine (katioonne dimerisatsioon ja alkeenide polümerisatsioon)
Seda tüüpi reaktsiooni kõige huvitavam näide on isobutüleeni dimerisatsioon ja polümerisatsioon väävelhappe juuresolekul.

Selle alkeenide segu tehniline nimetus on "diisobutüleen". See reaktsioon kulgeb katioonse mehhanismi abil, mis sarnaneb mineraalhapete lisamise mehhanismiga alkeenide kaksiksidemele. Esimeses etapis kinnitub prooton isobutüleeni molekuliga, moodustades suhteliselt stabiilse hõõrub-butüülkatioon. Moodustati edasi hõõrub-butüülkatioon (Lewise hape) reageerib isobutüleeni molekuliga (Lewise alus), moodustades uue stabiilse tertsiaarse oktüülkatiooni.

Nendes tingimustes kaotab oktüülkarbokatioon aluste (H 2 O, HSO 4 - ioonid) toimel kiiresti prootoni ja muutub isomeersete penteenide seguks, kuna prootoni abstraheerimine toimub kahest erinevast positsioonist:

Termodünaamiliselt vähem stabiilse alkeeni - 2,4,4-trimetüülpenteen-1 (80% reaktsioonisegus) eelistatud moodustumine on seotud vesinikuga võrreldes suurema ruumilise ligipääsetavusega metüülrühmade vesinikuaatomite aluse poolt. metüleenrühma aatomid. Tööstuslikult hüdrogeenitakse "diisobutüleeni" Ni-Raneyga, et saada "isooktaan" (süsivesinike tehniline nimetus 2,2,4-trimetüülpentaan), mida kasutatakse sisepõlemismootorite kõrge oktaanarvuga kütusena.
Väävelhappe kõrgel kontsentratsioonil (üle 80%) toimub isobutüleeni katioonne polümerisatsioon, mille tulemusena moodustub polümeer, mida nimetatakse polüisobutüleeniks (-CH 2 C(CH 3) 2 -) n. Seda kummitaolist polümeeri kasutatakse korrosioonivastaste ja veekindlate kattekihtide, hermeetikute jms tootmiseks.
Lisaks isobutüleenile polümeriseeritakse katioonmehhanismi abil 3-metüülbuteen-1, vinüüleetrid ja mõned stüreeni derivaadid, mis on võimelised moodustama suhteliselt stabiilseid karbokatione. Vesinikfluoriidi ja Lewise happeid kasutatakse ka katioonse polümerisatsiooni katalüsaatoritena: BF 3, AlCl 3, AlBr 3 jne väga väikeste veekoguste juuresolekul.
4.3.g. Alkaanide lisamine (alkeenide alküülimine)
Teine tööstuslik meetod isooktaani sünteesiks põhineb isobutüleeni reaktsioonil isobutaani liiaga kontsentreeritud väävelhappe või veevaba vesinikfluoriidi juuresolekul temperatuuril 0 10 0 C.

See reaktsioon kulgeb samuti katioonse mehhanismi kaudu ja mis on eriti huvitav, on näide ahelkatioonprotsessist. Esiteks, isobutüleen dimeriseerub reaktsioonitingimustes, moodustades tertsiaarse oktüülkatiooni (CH 3) 3 CCH 2 C + (CH 3) 2. Selle moodustumise mehhanismi kirjeldatakse üksikasjalikult eelmises jaotises. Järgmisena toimub vesiniku kiire ülekanne (hüdriidiooni kujul) isobutaanilt oktüülkatioonile, moodustades "isooktaani" molekuli ja uue tert-butüülkatiooni, mis omakorda reageerib kiiresti isobutüleeniga, moodustades uue. oktüülkatioon jne.

Lisaks "isooktaani" sünteesile kasutatakse seda alküülimismeetodit naftakeemiatööstuses kõrge keemistemperatuuriga hargnenud ahelaga süsivesinike sünteesimiseks hargnenud ahelaga alkeenidest ja madala keemistemperatuuriga alkaanidest termilise krakkimise fraktsiooni abil.
ALKEENID
Süsivesinikke, mille molekulis on lisaks lihtsatele süsinik-süsinik ja süsinik-vesinik σ-sidemetele süsinik-süsinik π-sidemed, nn. piiramatu. Kuna π-sideme moodustumine on formaalselt samaväärne kahe vesinikuaatomi kadumisega molekuli poolt, sisaldavad küllastumata süsivesinikud 2p vesinikuaatomeid on vähem kui piiravaid, kus P -π-sidemete arv:
Nimetatakse rida, mille liikmed erinevad üksteisest (2H) n võrra isoloogiline sari. Seega on ülaltoodud skeemis isoloogideks heksaanid, heksaenid, heksadieenid, heksaniinid, heksatrieenid jne.
Süsivesinikke, mis sisaldavad ühte π sidet (s.o kaksiksidet), nimetatakse alkeenid (olefiinid) või vastavalt seeria esimesele liikmele - etüleen, etüleeni süsivesinikud. Nende homoloogsete seeriate üldvalem on C p H 2l.
1. Nomenklatuur
Vastavalt IUPAC reeglitele antakse alkeenide nimetuste koostamisel kõige pikemale kaksiksidet sisaldavale süsinikuahelale vastava alkaani nimi, milles lõpp -an asendatud -en. See ahel on nummerdatud nii, et kaksiksideme moodustumisel osalevad süsinikuaatomid saaksid võimalikult väikese arvu:

Radikaalid on nimetatud ja nummerdatud nagu alkaanide puhul.
Suhteliselt lihtsa struktuuriga alkeenide puhul on lubatud lihtsamad nimetused. Seega on mõned kõige sagedamini esinevad alkeenid nime saanud järelliide lisamise teel -en sama süsiniku karkassiga süsivesinikradikaali nimetuse juurde:
Alkeenidest moodustunud süsivesinikradikaalid saavad järelliide -enil. Nummerdamine radikaalis algab süsinikuaatomist, millel on vaba valents. Lihtsamate alkenüülradikaalide puhul on aga süstemaatiliste nimede asemel lubatud kasutada triviaalseid:

Vesinikuaatomeid, mis on otseselt seotud kaksiksideme moodustavate küllastumata süsinikuaatomitega, nimetatakse sageli vinüülvesiniku aatomid,
2. Isomerism
Lisaks süsinikskeleti isomeeriale ilmneb alkeenide reas ka kaksiksideme positsiooni isomeeria. Üldiselt on seda tüüpi isomeeria asenduspositsiooni isomeeria (funktsioon)- täheldatud kõigil juhtudel, kui molekul sisaldab mis tahes funktsionaalrühmi. Alkaan C4H10 puhul on võimalikud kaks struktuurset isomeeri:
C4H8 alkeeni (buteeni) puhul on võimalikud kolm isomeeri:

Buteen-1 ja buteen-2 on funktsiooni asukoha isomeerid (sel juhul mängib selle rolli kaksikside).
Ruumilised isomeerid erinevad asendajate ruumilise paigutuse poolest üksteise suhtes ja neid nimetatakse cis-isomeerid, kui asendajad asuvad kaksiksidemega samal küljel ja trans-isomeerid, kui vastaskülgedel:

3. Kaksiksideme struktuur
Molekuli lõhustumise energia C=C kaksiksideme juures on 611 kJ/mol; kuna C-C σ sideme energia on 339 kJ/mol, siis on π sideme katkemise energia vaid 611-339 = 272 kJ/mol. π -elektronid on palju kergemad kui σ -elektronid ja on vastuvõtlikud näiteks polariseerivate lahustite või mis tahes ründavate reaktiivide mõjule. Seda seletatakse σ- ja π-elektronide elektronpilve jaotuse sümmeetria erinevusega. P-orbitaalide maksimaalne kattuvus ja seega ka molekuli minimaalne vaba energia realiseeritakse ainult vinüülfragmendi lameda struktuuriga ja lühendatud C-C vahekaugusega 0,134 nm, s.o. oluliselt väiksem kui üksiksidemega ühendatud süsinikuaatomite vaheline kaugus (0,154 nm). Kuna molekuli "pooled" pöörlevad üksteise suhtes piki kaksiksideme telge, väheneb orbiidi kattumise määr, mis on seotud energiatarbimisega. Selle tagajärjeks on vaba pöörlemise puudumine piki kaksiksideme telge ja sobivate asendustega geomeetriliste isomeeride olemasolu süsinikuaatomite juures.
Alkeenid- küllastumata süsivesinikud, mis sisaldavad ühte kaksiksidet. Alkeenide näited:

Alkeenide saamise meetodid.
1. Alkaanide krakkimine 400-700°C juures. Reaktsioon toimub vabade radikaalide mehhanismi kaudu:

2. Alkaanide dehüdrogeenimine:
3. Eliminatsioonireaktsioon (eliminatsioon): naabersüsinikuaatomitest elimineeritakse 2 aatomit või 2 aatomirühma ja tekib kaksikside. Sellised reaktsioonid hõlmavad järgmist:
A) Alkoholide dehüdratsioon (kuumutamine üle 150°C, vett eemaldava reaktiivina väävelhapet kasutades):
B) Vesinikhalogeniidide eemaldamine alkoholilahusega kokkupuutel:

Vesinikuaatom eraldatakse eelistatavalt süsinikuaatomist, mis on seotud vähemate vesinikuaatomitega (kõige vähem hüdrogeenitud aatom) - Zaitsevi reegel.
B) Dehalogeenimine:

Alkeenide keemilised omadused.
Alkeenide omadused määratakse mitmekordse sideme olemasoluga, seetõttu sisenevad alkeenid elektrofiilsetesse liitumisreaktsioonidesse, mis toimuvad mitmes etapis (H-X - reagent):
1. etapp:

2. etapp:
 .
.
Seda tüüpi reaktsioonide vesinikioon kuulub süsinikuaatomile, millel on negatiivsem laeng. Tiheduse jaotus on järgmine:

Kui asendajaks on doonor, mis avaldab +I-efekti, siis elektrontihedus nihkub enim hüdrogeenitud süsinikuaatomi poole, tekitades sellele osaliselt negatiivse laengu. Reaktsioonid käivad vastavalt Markovnikovi reegel: polaarsete molekulide ühendamisel nagu NH (HCl, HCN, HOH jne) ebasümmeetriliste alkeenide külge kinnitub vesinik eelistatavalt kaksiksideme juures rohkem hüdrogeenitud süsinikuaatomiga.
A) Lisamisreaktsioonid:
1) Hüdrohalogeenimine:
Reaktsioon järgib Markovnikovi reeglit. Kuid kui reaktsioonis esineb peroksiidi, siis reeglit ei võeta arvesse:
2) Niisutus. Reaktsioon järgib Markovnikovi reeglit fosfor- või väävelhappe juuresolekul:

3) Halogeenimine. Selle tulemusena muutub broomivesi värvituks - see on kvalitatiivne reaktsioon mitmekordsele sidemele:
4) Hüdrogeenimine. Reaktsioon toimub katalüsaatorite juuresolekul.



