Ադսորբցիան տեղի է ունենում փուլային սահմաններում: Ուստի նպատակահարմար է մակերեսային երևույթների թերմոդինամիկական նկարագրությունը դիտարկել որպես տարասեռ համակարգերի թերմոդինամիկայի առանձնահատուկ դեպք։
Բրինձ. 3.4. Գիբսի կլանումը. 1- երկփուլ հղման համակարգ, 2- իրական երկփուլ համակարգ անհամասեռ շրջանով
Տարասեռ համակարգերի թերմոդինամիկան օգտագործում է հավելումների սկզբունքը, որը հետևյալն է. Տարասեռ համակարգի բոլոր ընդարձակ հատկությունները հավասար են համապատասխան ընդարձակ հատկությունների գումարին, որոնք կունենային փուլերը նախքան դրանց շփման մեջ մտնելը:Ֆազերը նշանակենք α և β-ով (նկ. 4): Այնուհետև իդեալական համակարգի համար, այնպիսին, որ միջերեսի մոտ գտնվող փուլերի հատկությունները համընկնում են դրանց զանգվածային հատկությունների հետ, U ներքին էներգիայի համար V ծավալը, զանգվածը (մոլերի թիվը) n, էնտրոպիան S հավասարակշռությունից հետո հաստատվում է տարասեռ համակարգում, հարաբերությունները վավեր են.
U = U α + U β, V = V α + V β, n = n α + n β, S = S α + S β.
Սա ենթադրում է, որ ջերմաստիճանը և ճնշումը երկու փուլերում նույնն են:
Իրական տարասեռ համակարգերի համար երկու փուլերի միջերեսի անցումային շրջանը լրացուցիչ ներդրում է կատարում համակարգի լայնածավալ հատկությունների մեջ: Եթե մակերևութային երևույթներ են տեղի ունենում, պետք է հաշվի առնել իրական տարասեռ համակարգի ընդարձակ հատկությունների և մոդելային համակարգի ընդարձակ հատկությունների տարբերությունը, որտեղ մակերեսային երևույթներ չկան: Նման համակարգը կոչվում է համեմատական համակարգ: Համեմատության համակարգն ունի նույն ինտենսիվ պարամետրերը (T, P, C i…) և նույն ծավալը V, ինչ իրական համակարգը (նկ. 4):
Թերմոդինամիկական տեսանկյունից կլանման արժեքը G հասկացվում է որպես նյութի ավելցուկ n s՝ արտահայտված մոլերով կամ գրամներով, որը իրական տարասեռ համակարգը ունի հղման համակարգի համեմատ՝ կապված փուլի մակերեսի հետ։ տարանջատումը կամ ներծծող A-ի մակերեսի մակերեսը: Ենթադրվում է, որ համեմատական համակարգն ունի նույն ինտենսիվ պարամետրերը (T, P, C i) և նույն ծավալը (V = V α + V β), ինչ իրական համակարգը: (նկ. 4):
G \u003d (n - n α - n β) / A \u003d n s / A 3.11
Իրական համակարգի անցումային շրջանի ավելցուկային թերմոդինամիկական ֆունկցիաները (նշվում են s ինդեքսով) կարելի է գրել այսպես.
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S βև այլն:
Ադսորբցիայի փորձարարական չափումները միշտ տալիս են կլանումը հենց որպես իրական համակարգում բաղադրիչի ավելցուկ՝ համեմատած ընտրված հղման համակարգի հետ: Օրինակ՝ պինդ ներծծվող նյութի վրա գազը կլանելիս կամ պինդ փուլի վրա բաղադրիչները ներծծելիս, կլանման արժեքները գտնելու համար, ադսորբատի սկզբնական կոնցենտրացիաների փոփոխությունը որոշվում է α և β փուլերի շփումից հետո։
n i s = V (C i o - C i),
Որտեղ C i o- i-րդ բաղադրիչի սկզբնական կոնցենտրացիան, C i i-րդ բաղադրիչի կոնցենտրացիան է հարակից փուլերի միջև հավասարակշռություն հաստատելուց հետո։ Ենթադրվում է, որ ծավալը Վչի փոխվում. Այնուամենայնիվ, կոնցենտրացիան ես-րդ բաղադրիչը C i, ստացված փորձարարական եղանակով, որոշվում է ծավալով V'միջերեսից վեր՝ առանց հաշվի առնելու անցումային շերտի անհամասեռ շրջանի ծավալը Վաայն միջերեսում, որտեղ գտնվում է կոնցենտրացիան C i α. Այսպիսով, իրական համակարգում անհամասեռ շրջանի առկայության պատճառով համակարգի ընդհանուր ծավալը կարող է ներկայացվել որպես. V = V' + Va. Ամբողջ քանակ ես-րդ բաղադրիչը C i oբաշխված այս երկու հատորների միջև.
V C i o = V' C i + V α C i α,
և բաղադրիչի մոլերի քանակը ես, ներծծված ինտերֆեյսի վրա, հավասար կլինի
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (C i α – C i) 3.12
Նրանք. Փորձնականորեն որոշված կլանումը i-րդ բաղադրիչի ավելցուկ է V α ծավալում՝ համեմատած միջերեսից հեռու նույն ծավալում այս բաղադրիչի քանակի հետ: Այս տեսակի կլանումը կոչվում է Գիբսի ադսորբցիա: .
V α C i αկոչվում է ամբողջական բովանդակություն ես-ադսորբցիոն շերտի րդ բաղադրիչը: Շատ ցածր կոնցենտրացիաների տարածաշրջանում C iծավալով V'փոփոխություն V α C iհավասարումը (3.2) կարելի է անտեսել և չափված արժեքը դիտարկել V α C i αամբողջական բովանդակություն ես-ադսորբցիոն շերտի րդ բաղադրիչը, օրինակ՝ ցածր ճնշման դեպքում պինդ ներծծվող նյութի վրա գազի կլանման ժամանակ։
Ադսորբցիոն գործընթացների թերմոդինամիկան:
| Պարամետրի անվանումը | Իմաստը |
| Հոդվածի թեման. | Ադսորբցիոն գործընթացների թերմոդինամիկան: |
| Ռուբրիկա (թեմատիկ կատեգորիա) | Կրթություն |
Ադսորբցիոն գործընթացների դասակարգման հիմնական սահմանումներ և մեթոդներ:
Ադսորբցիան վերաբերում է երևույթներին, որոնք տեղի են ունենում մակերեսային էներգիայի ինքնաբուխ նվազման արդյունքում:
Ադսորբցիա- մակերեսային շերտի և միատարր փուլի ծավալի միջև տարասեռ համակարգի բաղադրիչների ինքնաբուխ հետադարձելի կամ անշրջելի վերաբաշխման գործընթացը.
Բազմաբաղադրիչ համակարգերում միջերեսային լարվածությունը իջեցնող բաղադրիչը գերադասելի է մակերեսային շերտից: Մի բաղադրիչ համակարգերում մակերևութային շերտի ձևավորման ժամանակ փոխվում է նրա կառուցվածքը (ատոմների և մոլեկուլների որոշակի կողմնորոշում, բևեռացում), որը կոչվում է. autoadsorption.
Ավելի խիտ փուլը, որի վրա տեղայնացված են կլանման փոխազդեցությունները, կոչվում է adsorbent. Միասեռ փուլի և մակերեսային շերտի ծավալի միջև վերաբաշխված նյութը նշվում է ʼʼ տերմինով. կլանելʼʼ.
Որոշ դեպքերում կլանման գործընթացը շրջելի է: Այս դեպքում որոշակի պայմաններում կլանված մոլեկուլների մի մասը մոլեկուլային կինետիկ երևույթների արդյունքում մակերեսային շերտից կարող է անցնել փուլի ծավալի։ Ադսորբցիայի հակառակ գործընթացը կոչվում է դեզորբցիա.
Ադսորբցիոն գործընթացների դասակարգման մեթոդներ.
Ադսորբցիոն գործընթացների դասակարգումն ըստ փոխազդող փուլերի ագրեգացման վիճակի.Հաշվի առնելով հարակից փուլերի ագրեգատային վիճակից կախվածությունը՝ առանձնանում են կլանման գործընթացների հետևյալ տեսակները.
Գազերի կլանումը պինդ կլանիչների վրա;
Լուծված նյութերի կլանումը «պինդ-հեղուկ» և «հեղուկ-հեղուկ» միջերեսներում;
Մակերեւութային ակտիվ նյութերի կլանումը «հեղուկ-գազ» միջերեսում:
Ադսորբցիոն գործընթացների դասակարգումն ըստ ադսորբենտի և ադսորբատի փոխազդեցության մեխանիզմի:Ադսորբցիան կարելի է համարել որպես ադսորբատի մոլեկուլների փոխազդեցություն ադսորբենտի ակտիվ կենտրոնների հետ։ Ըստ դրանց փոխազդեցության մեխանիզմի՝ բաժանվում են ադսորբցիայի հետևյալ տեսակները.
1) ֆիզիկական (մոլեկուլային) կլանումը- ադսորբատի և ադսորբենտի մոլեկուլների փոխազդեցությունն իրականացվում է վան դեր Վալսի ուժերի, ջրածնային կապերի (առանց քիմիական ռեակցիաների առաջացման) շնորհիվ.
2) քիմիական ադսորբցիա (քիմիածրում)- ադսորբատի մոլեկուլների կցումը ադսորբենտի ակտիվ տեղամասերին տեղի է ունենում տարբեր տեսակի քիմիական ռեակցիաների արդյունքում (բացառությամբ իոնափոխանակման ռեակցիաների).
3) իոնափոխանակման ադսորբցիա (իոնափոխանակում) - ադսորբատային նյութի վերաբաշխում լուծույթի և պինդ փուլի (իոնափոխանակիչի) միջև՝ ըստ իոնափոխանակման ռեակցիաների մեխանիզմի.
Ադսորբցիոն գործընթացների քանակական նկարագրության համար օգտագործվում է երկու քանակություն.
1) Բացարձակ adsorptionադսորբատի քանակն է (մոլ) կամ զանգվածը (կգ) մեկ միավորի մակերեսի կամ ներծծվող նյութի զանգվածի վրա: Նշանակում - Ա; միավոր՝ մոլ/մ 2, մոլ/կգ, կգ/մ 2, կգ/կᴦ:
2) Gibbs (ավելորդ) adsorptionմակերևութային շերտում որոշակի հաստությամբ ադսորբատային նյութի ավելցուկն է՝ համեմատած դրա քանակի հետ միատարր փուլի ծավալում՝ մեկ միավորի մակերեսի կամ ներծծվող նյութի զանգվածի վրա։ Նշում - G; միավոր՝ mol/m 2, mol/kᴦ:
Բացարձակ և ավելցուկային կլանման միջև կապը կարելի է ցույց տալ՝ օգտագործելով հավասարումը.
G \u003d A - c * h (3.1)
որտեղ c-ն նյութի հավասարակշռության կոնցենտրացիան է փուլի ծավալում, մոլ/մ3;
h-ն մակերեսային շերտի հաստությունն է՝ պայմանականորեն վերցված 10 -9 մ.
Բազմաբաղադրիչ տարասեռ համակարգերում, երբ այս կամ այն բաղադրիչը վերաբաշխվում է համասեռ փուլի և մակերևութային շերտի ծավալների միջև, գործում է մակերեսի ավելցուկային ներքին էներգիայի հավասարումը.
U = T * S + s * s + Sm i * n i (3.2)
Հավասարման բոլոր պայմանները բերելով միջերեսային մակերեսի միավորի մակերեսին, մենք ստանում ենք.
U s = T * S s + s + Sm i * Г i (3.3)
որտեղ Г i = n i/s-ը մակերեսային շերտում i-րդ բաղադրիչի ավելցուկն է, այսինքն՝ Գիբսի կլանումը:
Մեկ բաղադրիչ համակարգի համար (3.3) հավասարումը ունի հետևյալ ձևը.
G s = s + m * Г (3.4)
որտեղ G s = U s - T * S s-ը մակերեսի Գիբսի էներգիան է կամ մակերեսի միավոր տարածք ստեղծելու աշխատանքը.
m * Г - ներծծվող նյութի նյութի խտացում մակերեսային շերտում.
Ելնելով (3.4) հավասարումից՝ կարող ենք եզրակացնել, որ ադսորբցիայի ընթացքում միջերեսային մակերես ստեղծելու աշխատանքը բաղկացած է մակերեսի ձևավորման աշխատանքից (համակցված կապերի կոտրում ադսորբատային փուլի մեծ մասում) և նյութը մակերեսային շերտում խտացնելու աշխատանքից:
Ադսորբենտի և ադսորբատի միջև դինամիկ հավասարակշռության վիճակում, տարասեռ համակարգի Գիբսի էներգիայի փոփոխություն ΔG = 0, կլանման գործընթացի թերմոդինամիկան նկարագրվում է հավասարմամբ, որը կոչվում է. Գիբսի հիմնարար կլանման հավասարումը:
Ds = SГ i * dm i (3.5)
Այս հավասարումը ունիվերսալ է, քանի որ այն վավեր է բոլոր տեսակի կլանման գործընթացների համար
Գիբսի կլանման հավասարման առանձին դեպքեր:
1) ադսորբցիա լուծույթներից.
Համակարգի i-րդ բաղադրիչի քիմիական ներուժի համար «հեղուկ-պինդ ներծծող» և «հեղուկ-գազ» միջերեսներում ադսորբցիայի ժամանակ վավեր են հավասարումները.
m i = m i 0 + R*T*ln a i (3.6)
dm i = R*T* d ln a i (3.7)
որտեղ m i 0-ը համակարգի i-րդ բաղադրիչի քիմիական ներուժն է ստանդարտ պայմաններում.
a i – համակարգի i-րդ բաղադրիչի ակտիվությունը ստանդարտ պայմաններում:
Դրա հիման վրա Գիբսի կլանման հավասարումը կունենա հետևյալ ձևը.
Г i = - a i / R*T * (ds / da i) (3.8)
Ոչ էլեկտրոլիտային լուծույթների համար մենք վերցնում ենք i \u003d c i, ապա.
Г i \u003d - s / R * T * (ds / ds) (3.9)
Էլեկտրոլիտային լուծույթների համար.
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
որտեղ c ± լուծույթի միջին իոնային կոնցենտրացիան է.
n-ը ստոյխիոմետրիկ գործակիցն է:
2) նյութերի ադսորբցիա գազային փուլից.
Մենդելեև-Կլայպերոնի հավասարման համաձայն.
P \u003d c * R * T (3.11)
Այս առումով պինդ կլանիչների վրա գազերի կլանման Գիբսի հավասարումը գրված է հետևյալ ձևով.
Г i = - Р / R*T * (ds / dР) (3.12)
Գործնականում Գիբսի կլանման հավասարումը հնարավորություն է տալիս հաշվարկել միջերեսային շերտում նյութերի կլանման քանակը, որի համար որոշվում է մակերևութային լարվածությունը՝ ելնելով մակերևութային լարվածության չափումից հեղուկի կոնցենտրացիայի կամ հավասարակշռված գազի ճնշման տարբեր արժեքներում: .
Ադսորբցիոն գործընթացների թերմոդինամիկան: - հայեցակարգ և տեսակներ: «Ադսորբցիոն պրոցեսների թերմոդինամիկա» կատեգորիայի դասակարգումը և առանձնահատկությունները. 2017թ., 2018թ.
Ադսորբցիան որպես մակերևույթի վրա մոլեկուլների ինքնաբուխ կոնցենտրացիան ուղեկցվում է համակարգի էնտրոպիայի նվազմամբ։ Քանի որ գործընթացի ինքնաբուխության չափանիշն է
∆N - Տ · ∆S = ∆G< 0,
ապա կլանումը հնարավոր է միայն ∆Н-ում< 0 (экзотермический процесс). Равновесие определяется условием ∆Н = T· ∆S. Ջերմաստիճանի բարձրացմամբ հավասարակշռությունը տեղափոխվում է դեպի էնդոթերմիկ պրոցեսը, այսինքն՝ կլանումը:
Adsorption պինդ մակերեսի վրա
1. մոնոմոլեկուլային կլանումը.
Համաձայն Լանգմյուիրի տեսության՝ ադսորբատային մոլեկուլները փոխազդում են ներծծող մակերեսի հետ՝ ի վերջո ձևավորելով մոնոմոլեկուլային շերտ։ Այս դեպքում մակերևույթի () լցման աստիճանը ներծծվող նյութով գազային փուլից կլանման ժամանակ.
հեղուկից
որտեղ K-ը հավասարակշռության հաստատուն է (ադսորբցիոն հաստատուն);
p-ը ներծծվող գազի մասնակի ճնշումն է.
c-ն ներծծվող նյութի կոնցենտրացիան է:
β-ի կախվածությունը p (կամ c)-ից ներկայացված է գծապատկերով (ադսորբցիոն իզոթերմ, Т = const) Նկար 1-ում: 1.3.

Բրինձ. 1.3. Մակերեւույթը ներծծվող նյութով լցնելու աստիճանը
Ցածր կոնցենտրացիաների և մասնակի ճնշման դեպքում կլանումը համաչափ է կոնցենտրացիայի կամ մասնակի ճնշմանը.
Ռ<< 1, β ≈ К· r oris<< 1, β ≈ К· s, այսինքն. Իզոթերմի սկզբնական հատվածը մոտավորապես գծային է, և tan α \u003d K (tg α-ն որոշվում է կորի թեքությամբ p (կամ c) → 0: կամ ).
Եթե - ներծծվող նյութի մոլերի քանակը ներծծվող նյութի 1 գ-ի դիմաց. - ներծծվող նյութի առավելագույն հնարավոր մոլերի քանակը ներծծվող նյութի 1 գ-ի դիմաց («միաշերտ հզորություն»), ապա.
β-ի փոխարինումը (1.3) հավասարման մեջ (գազային փուլից կլանման դեպքում՝ կոնցենտրացիան Հետհավասարումների մեջ պետք է փոխարինվի ճնշմամբ Ռ), մենք ստանում ենք.
 (1.6)
(1.6)
Քանի որ և K-ն այս զույգ կլանիչ-ադսորբենտում հաստատուններ են (at Տ= const), ապա կախվածությունը կարելի է գտնել և TO(նկ. 1.4):

Բրինձ. 1.4. Ադսորբցիոն հավասարման գրաֆիկական լուծում
ստացված փորձարարական գծային կախվածությունը () = 0-ի էքստրապոլյացիայի միջոցով; և, քանի որ, այնուհետև, .
Արժեքը կարող է օգտագործվել adsorbent-ի հատուկ մակերեսը որոշելու համար UD (մ 2-ով 1 գ ներծծվող նյութի դիմաց), եթե հայտնի է մակերեսի վրա ω մակերեսը, որը զբաղեցնում է ներծծվող նյութի մեկ մոլեկուլը (որոշվում է մոլեկուլի չափից).
UD = · ω · Na, (1.7)
որտեղ Na-ն Ավոգադրոյի թիվն է (Na = 6.02 10 23):
Իր հերթին, SD-ի հայտնի արժեքը կարող է օգտագործվել ցանկացած նյութի կամ ω-ն հաշվարկելու համար՝ տվյալ adsorbent-ի վրա դրա կլանման միջոցով:
2. Պոլիմոլեկուլային կլանումը.
Հավասարումը (1.5) նկարագրում է հագեցվածությամբ կոր, այսինքն. ժամը
p (կամ c) → ∞ ձգտում է սահմանային արժեքին, որը հավասար է (նկ. 1.5, ա):

Նկ.1.5. Adsorption isotherms:
ա – կլանումը հագեցվածությամբ; բ – պոլիմոլեկուլային ադսորբցիա
Այնուամենայնիվ, որոշ դեպքերում կլանման իզոթերմները նման են Նկ. 1.5b, այսինքն. չի հասնում սահմանին նույնիսկ բարձր p (կամ c) դեպքում։
նկ. 1.5b համապատասխանում է պոլիմոլեկուլային կլանմանը: Որպես կանոն, նման իզոթերմները բնորոշ են ուժեղ միջմոլեկուլային փոխազդեցություններ ունեցող նյութերին (օրինակ՝ ջուր)։ Երբ կլանման կենտրոնները ադսորբենտի մակերեսի վրա զբաղված են (մոնոմոլեկուլային շերտը հագեցած է), հաջորդ ադսորբատային մոլեկուլների «վայրէջքը» տեղի է ունենում արդեն կլանված մոլեկուլների հետ միջմոլեկուլային փոխազդեցությունների պատճառով (նկ. 1.6): Նման կլանման ջերմությունը բացարձակ արժեքով մոտ է, բայց նշանով հակադիր է համապատասխան հեղուկի գոլորշիացման ջերմությանը (մտածեք, թե ինչու):

Նկ.1.6. Adsorption սխեման:
ա - մոնոմոլեկուլային կլանումը; բ - պոլիմոլեկուլային կլանումը
Երբ մոտենում ես Ռներծծվող նյութի հագեցած գոլորշիների ճնշման նկատմամբ այն սկսում է խտանալ ներծծվող նյութի մակերևույթի վրա, ինչի հետևանքով այն արագորեն մեծանում է աճի հետ: Ռ.
Երկու ատոմների փոխազդեցության դեպքում.
U-ը փոխազդեցության էներգիան է;
U = U + U ՔԱՇՐԵՔ.
 - Լենարդ-Ջոնսի հավասարումը
, c, b, m = const
- Լենարդ-Ջոնսի հավասարումը
, c, b, m = const
Պինդ մակերեսի հետ ատոմների փոխազդեցության դեպքում անհրաժեշտ է ամփոփել բոլոր փոխազդեցությունները։
x-ը մակերեսի հեռավորությունն է
r - ներգրավման ուժերի գործողության շառավիղը
dV - ծավալ
n-ը մակերեսային մոլեկուլների թիվն է
U ADS. կլանման փոխազդեցության էներգիան է



Ադսորբցիայի դեպքում ուժեղանում է գրավչությունը: Իսկ ոչ բևեռ-ոչ բևեռ տիպի փոխազդեցության դեպքում ադսորբցիան հիմնականում տեղայնացված է խորշերում։
էլեկտրաստատիկ փոխազդեցություն.
Բևեռային adsorbent - ոչ բևեռային adsorbate
Ոչ բևեռային adsorbent - բևեռային adsorbate
Բևեռային կլանիչը բևեռային ադսորբատ է:
Մ  ադսորբատային մոլեկուլը ներկայացված է որպես դիպոլ, իսկ ներծծողը՝ որպես հաղորդիչ, որի դեպքում ադսորբատային մոլեկուլը տվյալի նկատմամբ սիմետրիկորեն ներդնում է դիպոլային հայելին։
ադսորբատային մոլեկուլը ներկայացված է որպես դիպոլ, իսկ ներծծողը՝ որպես հաղորդիչ, որի դեպքում ադսորբատային մոլեկուլը տվյալի նկատմամբ սիմետրիկորեն ներդնում է դիպոլային հայելին։
X - հեռավորությունը դեպի միջին
Շփվելիս առաջանում է ներուժ.
 ,
,
 դիպոլային պահն է:
դիպոլային պահն է:
Պոտենցիալը ձգտում է վերցնել առավելագույն արժեքը, այսինքն. դիպոլները հակված են մակերեսին ուղղահայաց կողմնորոշվելու։
Քանի որ ջերմաստիճանի բարձրացումը նպաստում է Բրոունյան շարժման աճին, այն հանգեցնում է կլանման գործընթացի դանդաղմանը:
Էլեկտրաստատիկ փոխազդեցության դեպքում ադսորբատը հիմնականում տեղայնացված է ելուստների վրա:
Հիմնական կլանման հավասարումը.
Ադսորբցիայի դեպքում բաղադրիչը վերաբաշխվում է, ինչը նշանակում է, որ քիմիական ներուժը փոխվում է։ Ադսորբցիայի գործընթացը կարելի է համարել որպես մակերևութային էներգիայի անցում քիմիական էներգիայի։
Շերտի ծավալը = 0, ապա թերմոդինամիկայի օրենքի I և II ընդհանուր հավասարումը.
T = const; (1) = (2) => 

Երկու բաղադրիչ համակարգի համար.
,
 ,
,
 =>
=>
=>
 - Գիբսի կլանման հավասարումը
.
- Գիբսի կլանման հավասարումը
.
Հեռուստացույցի ադսորբցիայի դեպքի համար։ մարմին - գազ:, 
 ,
,

 - իզոթերմ
- իզոթերմ
 - isobar
- isobar
 - isopykne
- isopykne
 - իզոստեր
- իզոստեր
Իզոթերմը, իզոպիկնը, իզոստերները կապված են միմյանց հետ։
Որովհետեւ կլանման գործառույթ 



Հենրի իզոթերմ Լանգմյուիրի իզոթերմ



Թերմոդինամիկա. Ադսորբցիա.
Խտացրած լրատվամիջոցների համար.
 ,
,
 ,
,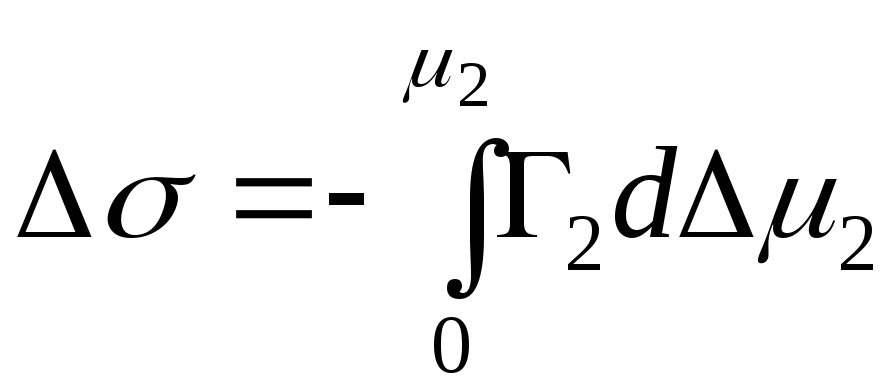
 - Գիբսի էներգիայի անբաժանելի փոփոխություն
.
- Գիբսի էներգիայի անբաժանելի փոփոխություն
.

P- ճնշում կոր մակերևույթի վրա, P S- ճնշում հարթ մակերեսի վրա
 - կլանման ներուժ
- կլանման ներուժ
Դիֆերենցիալ փոփոխություն ծուղակում 
 , Г = Const
, Г = Const
- դիֆերենցիալ էնտրոպիայի փոփոխություն
- կլանման դիֆերենցիալ էթալպիա
 - կլանման իզոստերիկ ջերմություն
- կլանման իզոստերիկ ջերմություն
 - խտացման ջերմություն
- խտացման ջերմություն
 - կլանման զուտ ջերմություն
- կլանման զուտ ջերմություն

 ,
,




Qa-ն կլանման ամբողջական ջերմությունն է, 
Qra-ն կլանման ամբողջական զուտ ջերմությունն է,

Հենրիի հավասարումը
Ադսորբցիայի ուսումնասիրությանը խոչընդոտում է մակերեսի անհամասեռությունը, ուստի միատարր մակերեսների համար ստացվում են ամենապարզ օրինաչափությունները։
Դիտարկենք գազերի փոխազդեցությունը պինդ մակերևույթի հետ, երբ գազը ծավալով հավասարակշռված վիճակից անցնում է մակերևույթի վրա գտնվող հավասարակշռության վիճակի։ Այս դեպքը նման է գրավիտացիոն դաշտում գազերի հավասարակշռությանը:
 ,
,
 ,
=>
,
=> -Հենրիի հավասարումը
-Հենրիի հավասարումը
 - բաշխման գործակիցը
- բաշխման գործակիցը
Ադսորբցիայի գործընթացում տեղի է ունենում քիմիական պոտենցիալների փոփոխություն։
Զանգվածային փուլի համար. 
Մակերեւութային գազի համար. 
Հավասարակշռության վիճակում  , այսինքն.
, այսինքն.

Հենրիի հավասարման մեջ հաստատունը կախված չէ կոնցենտրացիայից
Հենրիի հավասարումը վավեր է ցածր ճնշումների և կոնցենտրացիաների տարածաշրջանում: Քանի որ համակենտրոնացումը մեծանում է, Հենրիի օրենքից հնարավոր են 2 տեսակի շեղումներ.
1 - դրական շեղումներ, D-ն նվազում է, Ա-ն նվազում է
2 - բացասական շեղումներ, D - աճում է, A - մեծանում է:
Շեղման տեսակը որոշվում է ադսորբենտ-ադսորբատ փոխազդեցության այս կամ այն տեսակի գերակշռությամբ։
Կպչուն ուժեղ փոխազդեցությամբ ակտիվության գործակիցները մեծանում են՝ դրական շեղում: Համահունչ փոխազդեցությունների դեպքում նկատվում են բացասական շեղումներ։
մոնոմոլեկուլային կլանումը.
Լանգմյուիրի իզոթերմ.
Ամենապարզ օրինաչափությունները ստացվել են Հենրիի տեսության մեջ. Լանգմյուիրն առաջարկեց մի տեսություն, ըստ որի ադսորբցիան համարվում է քվազիքիմիական ռեակցիա։ Որտեղ:
Մակերեսը էներգետիկորեն միատարր է։
Ադսորբցիան տեղայնացված է, յուրաքանչյուր կլանման կենտրոն փոխազդում է մեկ ադսորբացիոն մոլեկուլի հետ:
Adsorbate մոլեկուլները չեն փոխազդում միմյանց հետ:
Ադսորբցիան միաշերտ է:

 - մակերեւույթ,
- մակերեւույթ,  - կլանել,
- կլանել,  - կլանման համալիր.
- կլանման համալիր.
 , ապա կլանման վայրերի կոնցենտրացիան.
, ապա կլանման վայրերի կոնցենտրացիան.  ,
, - սահմանափակող կլանումը.
- սահմանափակող կլանումը.
 , ապա ռեակցիայի հաստատունը՝
, ապա ռեակցիայի հաստատունը՝ 

 - Լանգմյուիրի հավասարումը.
- Լանգմյուիրի հավասարումը.
Adsorption ընդդեմ համակենտրոնացման
1 )
)
 ,
,

2) բարձր կոնցենտրացիաների տարածք
 - սահմանափակող կլանումը, մոնոմոլեկուլային շերտի ձևավորումը
- սահմանափակող կլանումը, մոնոմոլեկուլային շերտի ձևավորումը
Գիբսի էներգիայի համար.
g-ն էնտրոպիայի գործակիցն է:
Հենրիի իզոթերմի դեպքում Գիբսի էներգիան բնութագրում է ադսորբատի անցումը ստանդարտ վիճակից մակերևույթի ստանդարտ վիճակին: Լանգմյուիրի իզոթերմի դեպքում  բնութագրում է ադսորբենտի և ադսորբատի մերձեցման աստիճանը:
բնութագրում է ադսորբենտի և ադսորբատի մերձեցման աստիճանը:
 հայտնաբերվել է van't Hoff isobar-ից:
հայտնաբերվել է van't Hoff isobar-ից:

 , Հետո
, Հետո  , հետևաբար
, հետևաբար  .
.

 - մակերեսի լցոնման աստիճանը.
- մակերեսի լցոնման աստիճանը.




 - թափուր աշխատատեղերի քանակը,
- թափուր աշխատատեղերի քանակը,  - զբաղեցրած տեղերի քանակը.
- զբաղեցրած տեղերի քանակը.
 ,
,

Նրանք. բարձր կոնցենտրացիաների շրջանում ազատ տեղամասերի քանակը հակադարձ համեմատական է ադսորբատի քանակին:
Միատարր մակերեսի վրա գազերի խառնուրդի կլանումը:
Այս դեպքում կլանման գործընթացը դիտարկվում է որպես երկու զուգահեռ ռեակցիաներ։
 (1)
(1)

 (2)
(2)


Անհամասեռ մակերեսի վրա գազերի խառնուրդի կլանումը:
Ոչ միատարր մակերեսի դեպքում չպետք է սահմանափակվել միջին լիցքերով։
Մրցակցության արդյունքում տարբեր տեսակի տեղամասերում հնարավոր է տարբեր ադսորբատների տեղայնացում:
Այս դեպքում հարաբերությունը  .
.
 ,
,
 ադսորբատի հագեցվածության գոլորշի ճնշումն է:
ադսորբատի հագեցվածության գոլորշի ճնշումն է:
 ,
,
 կլանման ջերմությունն է։
կլանման ջերմությունն է։
«+» - սիմբատիկ կախվածություն, «-» - հակաբատիկ կախվածություն, «H» - ոչ հարաբերակցություն:
«+» - ադսորբցիան ընթանում է նույն մեխանիզմով: Էներգետիկ առումով առավել բարենպաստ տարածքներում գերակշռում է ներծծվում մակերևույթի հետ բարձր կապ ունեցող գազը:
«-» - ադսորբցիան ընթանում է տարբեր մեխանիզմներով, և մինչև որոշակի ժամանակ մակերեսի համար մրցակցություն չկա:
Մոնոմոլեկուլային ադսորբցիան հիմնականում իրականացվում է ցածր արժեքներով գազերի ֆիզիկական կլանման ժամանակ էջ, ինչպես նաև հեղուկ/գազի միջերեսում։
Պոլիմոլեկուլային կլանումը.
BET տեսություն(Brunauer, Emmet, Teller):
Այն դեպքում, երբ միաշերտի ձևավորումը անբավարար է մակերևույթի էներգիան փոխհատուցելու համար, ադսորբցիան բազմամոլեկուլային է և կարող է դիտարկվել որպես մակերևութային ուժերի ազդեցությամբ հարկադիր խտացման արդյունք։
Հիմնական դրույթներ.
Երբ ադսորբատի մոլեկուլը հարվածում է զբաղեցրած տեղամասին, ձևավորվում է բազմակի հավաքածու:
Երբ մոտենում ես էջԴեպի էջ սնվազում է անվճար կլանման վայրերի թիվը: Սկզբում աճում է մենախաղի, զուգախաղի և այլնի զբաղեցրած տեղերը, հետո նվազում։ փաթեթներ.
ժամը էջ =էջ ս ադսորբցիան վերածվում է խտացման.
Հորիզոնական փոխազդեցություններ չկան:
Առաջին շերտի համար կատարվում է Լանգմյուիրի իզոթերմը։
Մակերեւույթը դիտվում է որպես կլանման տեղամասերի հավաքածու: Վավերական է դինամիկ հավասարակշռության պայմանը. ազատ տեղերում խտացման արագությունը հավասար է զբաղեցրած վայրերից գոլորշիացման արագությանը:
a-ն խտացման գործակիցն է (մակերեսի վրա խտացված մոլեկուլների մասնաբաժինը);
 ,
,
Zm-ը անվճար տեղերի առավելագույն քանակն է:
 - մակերեսին ուղղահայաց ուղղությամբ ատոմների թրթռումների հաճախականությունը.
- մակերեսին ուղղահայաց ուղղությամբ ատոմների թրթռումների հաճախականությունը.
Առաջին շերտի համար դինամիկ հավասարակշռության պայմաններն են.



 , Հետո
, Հետո
 - Լանգմյուիրի հավասարումը.
- Լանգմյուիրի հավասարումը.
Երկրորդ շերտի համար ճիշտ կլինի. 
i-րդ շերտի համար. 
Պարզության համար ենթադրվում է, որ a-ն և ν-ը նույնն են բոլոր շերտերի համար, բացառությամբ առաջինի: Բոլոր շերտերի համար, բացի առաջինից, կլանման ջերմությունը մշտական է: Վերջին շերտի համար կլանման ջերմությունը հավասար է խտացման ջերմությանը: Արդյունքում հավասարումը
 (*)
(*)
Գ- մշտական,
BET տեսության դեպքում հաստատունը ՀԵՏբնութագրում է Գիբսի մաքուր կլանման էներգիան: Հավասարումը պարունակում է միայն մեկ հաստատուն, և այս հավասարումը նույնպես շատ կարևոր է ներծծող նյութի հատուկ մակերեսը որոշելու համար:
Քանի որ ջերմությունը արտազատվում է կլանման արդյունքում, հատուկ մակերեսների որոշումն իրականացվում է ցածր ջերմաստիճաններում:
 ????????????
????????????


Տեսության հիմնական թերությունը– Հորիզոնական փոխազդեցությունների անտեսում՝ հօգուտ ուղղահայացների:
Հավասարումը գտնվում է միջակայքում  0,05-ից մինչև 0,3:
0,05-ից մինչև 0,3:
Որտեղ  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0.3 - ադսորբատ-ադսորբատ փոխազդեցությունը ազդում է:
> 0.3 - ադսորբատ-ադսորբատ փոխազդեցությունը ազդում է:
Ադսորբատ-ադսորբատ փոխազդեցությունների հաշվառում:
Փոխազդեցությունները հայտնվում են ճյուղավորված մոլեկուլների կամ մոլեկուլների ոչ բևեռային մակերեսի վրա կլանման ժամանակ: կարող է միավորումներ ստեղծել. Այս դեպքում փոխվում է կլանման իզոթերմների ձևը։
Ա  սորբենտը բևեռային չէ:
սորբենտը բևեռային չէ:
Գծապատկեր 1-ը համապատասխանում է թույլ փոխազդեցություններին adsorbate-adsorbat, ուժեղ adsorbate-adsorbent:
Գրաֆիկ 2-ը համապատասխանում է ուժեղ ադսորբատ-ադսորբատ փոխազդեցությանը, ուժեղ ադսորբատ-ադսորբենտ փոխազդեցությանը:
Գծապատկեր 3-ը համապատասխանում է ուժեղ ադսորբատ-ադսորբատ փոխազդեցությանը, թույլ ադսորբատ-ադսորբենտ փոխազդեցությանը:
 ,
,

Ադսորբատային մոլեկուլների փոխազդեցության դեպքում անհրաժեշտ է հաշվի առնել ակտիվության գործակիցների փոփոխությունները։ Եվ այս հավասարումը գրված է այսպես.
 - Ֆրանկինի, Ֆաուլերի, Գուգենհայմի հավասարումը:
- Ֆրանկինի, Ֆաուլերի, Գուգենհայմի հավասարումը:
կձգողականության հաստատունն է:
Պոլանի պոտենցիալ տեսությունը.
Այս տեսությունը չի բխում որևէ տեսակի ադսորբցիոն իզոթերմից, սակայն հնարավորություն է տալիս հաշվարկել իզոթերմները տարբեր ջերմաստիճանում։
Ադսորբցիակլանման ներուժի ազդեցությամբ ադսորբատի մակերևույթին ադսորբատի ձգման արդյունքն է, որը կախված չէ այլ մոլեկուլների առկայությունից և կախված է մակերեսի և ադսորբատի մոլեկուլի միջև հեռավորությունից:
 ,
,
 - կլանման ներուժ.
- կլանման ներուժ.
Քանի որ մակերեսը անհամասեռ է, հեռավորությունը փոխարինվում է կլանման ծավալով  .կլանման ծավալըմակերեսի և տվյալ արժեքին համապատասխան կետի միջև ընկած ծավալն է
.կլանման ծավալըմակերեսի և տվյալ արժեքին համապատասխան կետի միջև ընկած ծավալն է  .
.
Ադսորբցիոն ներուժ 1 մոլ ադսորբատի՝ տրված կլանման ծավալից դուրս, կլանման ծավալի տվյալ կետ տեղափոխելու աշխատանքն է (կամ ադսորբատի 1 մոլ հագեցած գոլորշի տեղափոխման աշխատանք, որը հավասարակշռության մեջ է հեղուկ ադսորբատի բացակայության դեպքում։ ներծծող, գոլորշիների փուլ՝ կլանիչի հետ հավասարակշռության մեջ):

Բնութագրական կոր
 - կլանման ներուժ,
- կլանման ներուժ, 
Տվյալ կլանիչի և տարբեր ադսորբատների համար ճշմարիտ է հետևյալը. 
Տարբեր տեսակի ադսորբատների համար  ,
,
Որտեղ  հարաբերական ճնշումների դեպքում կլանման իզոթերմների ներուժը
հարաբերական ճնշումների դեպքում կլանման իզոթերմների ներուժը  adsorbate 1-ի և adsorbate 2-ի համար: Այս հարաբերակցությունը հաստատուն արժեք է:
adsorbate 1-ի և adsorbate 2-ի համար: Այս հարաբերակցությունը հաստատուն արժեք է:
 - հարաբերակցության գործակիցը
- հարաբերակցության գործակիցը
Մազանոթային խտացման տեսություն.
Ադսորբցիոն գործընթացի ընթացքը մեծապես կախված է ծակոտկեն մարմնի կառուցվածքից։
|
միկրոծակոտկեն | |
|
Անցումային ծակոտկեն | |
|
Մակրոպորոզ |
Միկրոծակոտկեն սորբենտների դեպքում ադսորբցիոն ուժերի դաշտերը համընկնում են։ Մակրոծակոտկեն սորբենտների դեպքում ծակոտիները գործում են որպես տրանսպորտային ուղիներ։ Խտացման գործընթացներն առավել նշանակալից են անցողիկ ծակոտկեն մարմիններում: Մազանոթների խտացումը սկսվում է որոշակի արժեքներից էջԵվ  երբ մակերեսային էներգիայի մի մասն արդեն փոխհատուցվել է։ Պարտադիր պայմանն այն է, որ մակերեսը պետք է լինի ինքնուրույն։ Գործընթացը նկարագրված է Թոմփսոն-Քելվինի հավասարումը.
երբ մակերեսային էներգիայի մի մասն արդեն փոխհատուցվել է։ Պարտադիր պայմանն այն է, որ մակերեսը պետք է լինի ինքնուրույն։ Գործընթացը նկարագրված է Թոմփսոն-Քելվինի հավասարումը.

 - թրջման դեպքում կորության կենտրոնը գտնվում է գազային փուլում։
- թրջման դեպքում կորության կենտրոնը գտնվում է գազային փուլում։
Մազանոթային խտացման դեպքում ադսորբցիոն իզոթերմն ունի հիստերեզի ձև։ Ստորին ճյուղը համապատասխանում է կլանման գործընթացին, իսկ վերին ճյուղը համապատասխանում է կլանման գործընթացին:
Բոլոր տեսակի ծակոտիները կարող են կրճատվել երեք տեսակի.
|
կոնաձև |
Գլանաձև մեկ փակ ծայրով |
Գլանաձև երկու բաց ծայրերով |
|
Գործընթացային լցոնումն իրականացվում է ծակոտիի հատակից։ Ադսորբցիոն իզոթերմը և դեզորբցիոն իզոթերմը այս դեպքում համընկնում են, քանի որ ադսորբցիայի գործընթացը սկսվում է մի գնդիկից, իսկ կլանման գործընթացը նույնպես սկսվում է որոշ ոլորտների անհետացումից։
↓ |
Հիստերեզ չկա։ Առաջ և հետադարձ հարվածները նկարագրվում են հավասարմամբ.
|
Ոչ մի տեղ հատակ չկա, ծակոտիի լցոնումը կգնա մխոցի պատերով։
գլան: Իզոթերմ և կունենա հիստերեզի ձև:
↓ |
IN  խոնավության պայմաններում, խտացումն առաջանում է ավելի ցածր ճնշումների դեպքում, ինչը էներգետիկ առումով բարենպաստ է: Դեզորբցիոն ճյուղից ստացվում են ծակոտիների չափերի բաշխման կորեր։
խոնավության պայմաններում, խտացումն առաջանում է ավելի ցածր ճնշումների դեպքում, ինչը էներգետիկ առումով բարենպաստ է: Դեզորբցիոն ճյուղից ստացվում են ծակոտիների չափերի բաշխման կորեր։
Դիֆերենցիալ կորի առավելագույնը տեղափոխվում է ձախ՝ ինտեգրալի թեքման կետի համեմատ: Փոքր ծակոտիների ընդհանուր ծավալը փոքր է, բայց ունի մեծ մակերեսներ: Քանի որ ծակոտի չափը մեծանում է, դրանց ծավալը մեծանում է, քանի որ  , իսկ տարածքը որպես
, իսկ տարածքը որպես  , դրա շնորհիվ նկատվում է դիֆերենցիալ կորի առավելագույնի տեղաշարժ։
, դրա շնորհիվ նկատվում է դիֆերենցիալ կորի առավելագույնի տեղաշարժ։
Adsorption պինդ-հեղուկ միջերեսում:
Պինդ-գազի միջերեսում կլանման դեպքում մենք անտեսել ենք մեկ բաղադրիչ: Պինդ-հեղուկ միջերեսում ադսորբցիայի դեպքում ադսորբատը տեղափոխում է լուծիչի մոլեկուլները ներծծվող նյութի մակերեսից:
 ,
,
Ճիշտ հավասարումը հետևյալն է.

 ,
,
N 1, N 2 - լուծիչի և բաղադրիչի մոլային ֆրակցիաներ, N 1 + N 2 \u003d 1, ապա
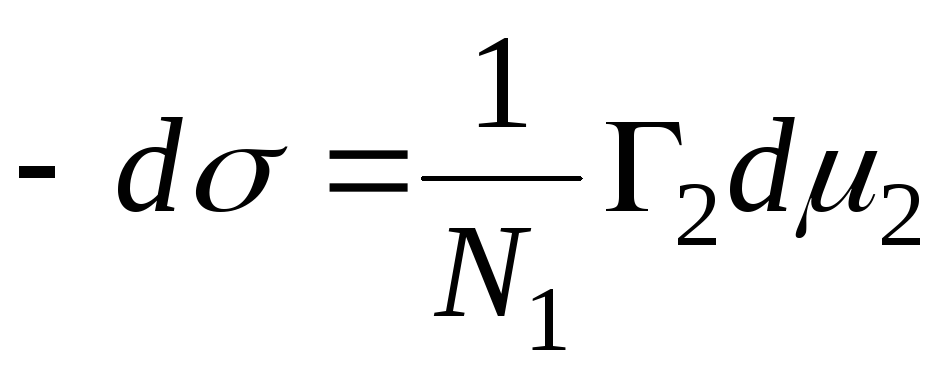 ,
=>
,
=>
 , ապա - կլանման հավասարումը փուլային սահմանի պինդ - հեղուկ.
, ապա - կլանման հավասարումը փուլային սահմանի պինդ - հեղուկ.
Adsorption (G) > 0 at  <
0
<
0
Եթե արժեքները  քանի որ բաղադրիչը և լուծիչը շատ տարբեր են, այս դեպքում կախվածությունը Գ-ից Նունի էքստրեմում արժեքի վրա Ն
~ 0,5.
քանի որ բաղադրիչը և լուծիչը շատ տարբեր են, այս դեպքում կախվածությունը Գ-ից Նունի էքստրեմում արժեքի վրա Ն
~ 0,5.
Ե  եթե
եթե  ունեն նմանատիպ արժեքներ, այս դեպքում կլանման նշանը կարող է փոխվել։ Կախվածություն Գ-ից Նհատում է x առանցքը
ունեն նմանատիպ արժեքներ, այս դեպքում կլանման նշանը կարող է փոխվել։ Կախվածություն Գ-ից Նհատում է x առանցքը
Ֆունկցիան Խաչմերուկ Գ(Ն) աբսցիսային առանցքով կոչվում է adsorption azeotrope. Սա նշանակում է, որ երկու բաղադրիչները չեն կարող առանձնացվել այս adsorbent-ի վրա:
Ադսորբցիոն իզոթերմի հավասարումը փոխանակման հաստատունով:
Պինդ-հեղուկ միջերեսում կլանման ընթացքում բաղադրիչները մշտապես վերաբաշխվում են ներծծող նյութի մակերեսի և լուծույթի ծավալի միջև:
 - բաղադրիչներ (- - վերաբերում է մակերեսին)
- բաղադրիչներ (- - վերաբերում է մակերեսին)

 ,
,
 ,
, .
.
 ,
,


Ադսորբցիա հեղուկ-գազի միջերեսում
Ռ  Եկեք դիտարկենք կոնցենտրացիայի պրոֆիլի փոփոխությունը, երբ հատվում է հեղուկ-գազի միջերեսը: Թող բաղադրիչ 2-ը լինի անկայուն:
Եկեք դիտարկենք կոնցենտրացիայի պրոֆիլի փոփոխությունը, երբ հատվում է հեղուկ-գազի միջերեսը: Թող բաղադրիչ 2-ը լինի անկայուն:
Cs-ը մակերեսային շերտի կոնցենտրացիան է։
Ավելորդ կլանման սահմանման հիման վրա

Եթե բաղադրիչը անկայուն չէ, ապա կլանման արժեքը կգրվի հետևյալ կերպ.
Պ  րի
րի 

Հավասարման մեջ  նյութի բնույթը նկարագրվում է ածանցյալով
նյութի բնույթը նկարագրվում է ածանցյալով  .
.
Մակերեւութային լարվածության իզոթերմը կարող է լինել 1 կամ 2 ձևի.
1 - մակերեսային ակտիվ նյութեր
2 - մակերեսային ակտիվ նյութեր
Մակերեւութային ակտիվությունը g-ը նյութերի ունակությունն է՝ նվազեցնելու մակերևութային լարվածությունը համակարգում:

 - մակերեսային շերտի հաստությունը
- մակերեսային շերտի հաստությունը
Գ սբաղադրիչի կոնցենտրացիան է մակերեսային շերտում
ՀԵՏ- ծավալի կոնցենտրացիան
Հոմոլոգ շարքի համար կա կանոն.
 - Տրաուբո Դուկլո կանոն
- Տրաուբո Դուկլո կանոն
Հոմոլոգ շարքի համար կլանման իզոթերմն ունի հետևյալ տեսքը.
A-ի փոխարեն գրում ենք D, քանի որ մակերեսային շերտում ադսորբցիան չափազանց մեծ է:
Մակերեւութային լարվածության իզոթերմ.

 մաքուր լուծիչի մակերեսային լարվածությունն է։
մաքուր լուծիչի մակերեսային լարվածությունն է։
 - հիմնարար կլանման հավասարումը;
- հիմնարար կլանման հավասարումը;
 - Լանգմյուիրի հավասարումը.
- Լանգմյուիրի հավասարումը.
Եկեք միասին լուծենք դրանք.

- Շիշկովսկու հավասարումը.
Բհաստատուն է հոմոլոգ շարքի համար:
Ա- մի հոմոլոգից մյուսին անցնելիս այն ավելանում է 3-3,5 անգամ 
![]()
1 - ցածր կոնցենտրացիաների տարածք
![]()
2 - միջին կոնցենտրացիան
3 - մոնոմոլեկուլային շերտ
Մակերեւութային ակտիվ նյութերը ամֆիֆիլային մոլեկուլներ են, այսինքն. ներառում են բևեռային խումբ և ոչ բևեռ ածխաջրածնային ռադիկալ:
o մոլեկուլի բևեռային մասն է:
| մոլեկուլի ոչ բևեռ մասն է։
Բևեռային լուծիչում մակերևութային ակտիվ նյութի մոլեկուլները կողմնորոշված են այնպես, որ մոլեկուլի բևեռային մասը ուղղված է լուծիչին, մինչդեռ ոչ բևեռային մասը մղվում է գազային փուլ:
Շիշկովսկու հավասարման մեջ  , այն հաստատուն է հոմոլոգ շարքի համար։
, այն հաստատուն է հոմոլոգ շարքի համար։
Մակերեւութային ակտիվ գործողությունը սկսում է ի հայտ գալ n>5. Մոնոմոլեկուլային շերտի կոնցենտրացիայից ավելի բարձր կոնցենտրացիաների դեպքում միցելիզացիան տեղի է ունենում մակերեսային ակտիվ նյութերի լուծույթներում:
Միսել- կոչվում է ամֆիֆիլ մակերեւութային ակտիվ մոլեկուլների ագրեգատ, որի ածխաջրածնային ռադիկալները կազմում են միջուկը, իսկ բևեռային խմբերը վերածվում են ջրային փուլի։
Միցելային զանգված - միցելային զանգված:
Հ  մոլեկուլների թիվը ագրեգացիայի քանակն է:
մոլեկուլների թիվը ագրեգացիայի քանակն է:
Գնդաձև միցելներ
Միցելիզացիայի դեպքում լուծույթում հավասարակշռություն է հաստատվում
CMC-ն միցելի կրիտիկական կոնցենտրացիան է:
Քանի որ մենք համարում ենք միցելը առանձին փուլ.
Հոմոլոգիական շարքի համար կա էմպիրիկ հավասարում.
աֆունկցիոնալ խմբի տարրալուծման էներգիան է։
բ կլանման ներուժի աճն է, ադսորբցիայի աշխատանքը մեթիլենի մեկ միավորի համար:
կլանման ներուժի աճն է, ադսորբցիայի աշխատանքը մեթիլենի մեկ միավորի համար:
Միկելներում ածխաջրածնային միջուկի առկայությունը հնարավորություն է տալիս ջրի մեջ չլուծվող միացություններին լուծարվել մակերևութային ակտիվ նյութերի ջրային լուծույթներում, այս երևույթը կոչվում է լուծույթ (այն, ինչ լուծվում է, լուծվող նյութ է, մակերեսային ակտիվ նյութը՝ լուծվող):
Ցեխը կարող է լինել ամբողջովին ոչ բևեռ, կարող է պարունակել ինչպես բևեռային, այնպես էլ ոչ բևեռ մասեր և կողմնորոշված կլինի որպես մակերևութային ակտիվ նյութի մոլեկուլ:
Ամեն դեպքում, լուծարման ընթացքում միցելյար զանգվածի և ագրեգացիայի քանակի ավելացում տեղի է ունենում ոչ միայն լուծույթի ընդգրկման, այլև հավասարակշռության վիճակը պահպանելու համար անհրաժեշտ մակերեսային ակտիվ նյութի մոլեկուլների քանակի ավելացման պատճառով:
Լուծումը ավելի արդյունավետ է, այնքան ցածր է լուծույթի մոլեկուլային քաշը:

 ~ 72 մՆ/մ.
~ 72 մՆ/մ.
 ~ 33 մՆ/մ.
~ 33 մՆ/մ.
Մակերեւութային ակտիվ նյութերի արդյունավետությունը կախված է CMC-ի մեծությունից:
2D մակերևութային շերտի ճնշում

→ -մակերևութային լարվածության ուժեր.
- երկչափ ճնշում.
Մակերեւութային շերտը ուժ է, որը հավասար է մակերեւութային ակտիվ նյութի լուծույթի և մաքուր լուծիչի մակերևութային լարվածության տարբերությանը, որն ուղղված է դեպի մաքուր մակերես:
Լուծույթի և մակերեսային շերտի միջև հավասարակշռություն է հաստատվում



ժամը  կա տարածք, որտեղ
կա տարածք, որտեղ  գծայինորեն կախված է համակենտրոնացումից:
գծայինորեն կախված է համակենտրոնացումից:
G [մոլ / մ 2]:
 տարածքը, որը զբաղեցնում է նյութի մեկ մոլը
տարածքը, որը զբաղեցնում է նյութի մեկ մոլը
Այնուհետև երկչափ ճնշման իզոթերմը կունենա ձև 
 երկչափ ճնշման իզոթերմն է։
երկչափ ճնշման իզոթերմն է։
Կախվածություն  S M-ից:
S M-ից:

ժամը  - երկչափ ճնշումը կտրուկ աճում է. ժամը
- երկչափ ճնշումը կտրուկ աճում է. ժամը  երկչափը դեֆորմացվում է, որն առաջացնում է կտրուկ աճ
երկչափը դեֆորմացվում է, որն առաջացնում է կտրուկ աճ  .
.
Նույն փուլերով սահմանափակված երկու կողմերի ֆիլմը կոչվում է երկկողմանի: Նման ֆիլմերում նկատվում է մայրական լիկյորի անընդհատ շարժում։
5 նմ-ից պակաս հաստությամբ ֆիլմերը կոչվում են սև թաղանթներ:

Ադսորբցիոն շերտերը պետք է ունենան երկու հատկանիշ՝ մածուցիկություն և հեշտ շարժունակություն, հեղուկություն և առաձգականություն:
Մարանգոնիի էֆեկտը ինքնաբուժող է:
Գիբսի եռանկյունի,  - գերճնշում.
- գերճնշում.
Թաղանթը ձգվում է, և հեղուկի մի մասի անհետանալու պատճառով մակերեսային ակտիվ նյութերը շտապում են ազատ տարածություն: Գիբսի եռանկյունին.
Մարմինների կլանման ուժի ազդեցությունը.
Ֆիլմի մակերեսի վրա միշտ կա կլանման շերտ, որի համար, ապա
Լանգմյուիրի հավասարումը.


 երկչափ ճնշման մեջ
երկչափ ճնշման մեջ
 - Շիշկովսկու հավասարման անալոգը
- Շիշկովսկու հավասարման անալոգը
էլեկտրակինետիկ երևույթներ. Կրկնակի էլեկտրական շերտ (DES):
Հելեմհոլցի մոդելը. Գույ-Չապմենի տեսություն.
1808 Թռիչք

U – ձեւավորված խողովակ, դրա մեջ ընկղմված 2 էլեկտրոդ: Խախտվում է հաղորդակցվող անոթների օրենքը և խողովակում տեղի է ունենում հեղուկի մակարդակի փոփոխություն՝ էլեկտրակինետիկ երևույթներ։
Կինետիկ երևույթներ.
էլեկտրոֆորեզ
Էլեկտրոսմոզ
Հոսքի (հոսքի) ներուժ
Նստվածքային ներուժ
1-ը և 2-ը առաջանում են, երբ կիրառվում է պոտենցիալ տարբերություն, 3 և 4 կոլոիդային մասնիկների ծակումը և նստվածքը առաջացնում են պոտենցիալ տարբերության տեսք:
Էլեկտրոսմոզ ցրված միջավայրի շարժումն է անշարժ ցրված փուլի նկատմամբ էլեկտրական հոսանքի ազդեցության տակ։
էլեկտրոֆորեզ ցրված փուլի մասնիկների շարժումն է անշարժ դիսպերսիոն միջավայրի նկատմամբ էլեկտրական հոսանքի ազդեցության տակ։
Պ  Էլեկտրոկինետիկ երևույթների առաջացման պատճառը լիցքերի տարածական տարանջատումն է և կրկնակի էլեկտրական շերտի առաջացումը։
Էլեկտրոկինետիկ երևույթների առաջացման պատճառը լիցքերի տարածական տարանջատումն է և կրկնակի էլեկտրական շերտի առաջացումը։
Էլեկտրական կրկնակի շերտը հարթ կոնդենսատոր է, մի թիթեղը ձևավորվում է պոտենցիալ որոշող իոններով, մյուսը՝ հականետներով։ Իոնները նույնպես աղտոտված են, քանի որ պոտենցիալ որոշող կոիոնները մղվում են լուծույթի մեծ մասի մեջ: Թիթեղների միջև հեռավորությունը  . Պոտենցիալը ընկնում է գծային, պոտենցիալ տարբերությունը
. Պոտենցիալը ընկնում է գծային, պոտենցիալ տարբերությունը  .
.
Արտաքին պոտենցիալ տարբերությունը առաջացնում է կտրվածքի մոդուլի տեսք  պինդ մարմնի մակերեսի երկայնքով գործող միավորի մակերեսի վրա գտնվող ուժերի զույգ է:
պինդ մարմնի մակերեսի երկայնքով գործող միավորի մակերեսի վրա գտնվող ուժերի զույգ է:

Հավասարակշռության ժամանակ կտրվածքի մոդուլը հավասար է մածուցիկ շփման մոդուլին (  ).
).

Մեր պայմաններում  ,
,

 - Հելեմհոլց-Սմալուկովսկի հավասարումը
- Հելեմհոլց-Սմալուկովսկի հավասարումը
 - գծային արագության տեղաշարժ i փուլեր:
- գծային արագության տեղաշարժ i փուլեր:
Եէլեկտրական դաշտի ուժգնությունն է։
 - թիթեղների միջև պոտենցիալ տարբերություն
- թիթեղների միջև պոտենցիալ տարբերություն
 - էլեկտրոֆորետիկ շարժունակություն [m 2 / (V * s)]:
- էլեկտրոֆորետիկ շարժունակություն [m 2 / (V * s)]:
Հելեմհոլցի մոդելը հաշվի չի առնում մոլեկուլների ջերմային շարժումը։ Իրականում իոնների բաշխումը երկշերտում ավելի բարդ է։
Գույը և Չեփմենը բացահայտեցին DES-ի հետևյալ պատճառները.
Իոնի անցումը մի փուլից մյուսը, երբ հավասարակշռություն է հաստատվում:
Պինդ փուլային նյութի իոնացում:
Մակերեւույթի լրացումը ցրման միջավայրում առկա իոններով:
Բևեռացում արտաքին հոսանքի աղբյուրից:
Էլեկտրական կրկնակի շերտը ունի լղոզված կամ ցրված կառուցվածք: Իոնները հակված են հավասարաչափ բաշխվել ցրված շերտով:
Ցրված շերտը բաղկացած է հակահարվածներից, շերտի երկարությունը որոշվում է նրանց կինետիկ էներգիայով։ Բացարձակ զրոյի հակված ջերմաստիճանի դեպքում կոնտրինոնները հնարավորինս մոտ են պոտենցիալ որոշող իոններին:
Այս տեսությունը հիմնված է երկու հավասարումների վրա.
Բոլցմանի հավասարումը

 - աշխատել էլեկտրաստատիկ փոխազդեցության ուժերի դեմ.
- աշխատել էլեկտրաստատիկ փոխազդեցության ուժերի դեմ.
 զանգվածային լիցքի խտությունն է:
զանգվածային լիցքի խտությունն է:

Պուասոնի հավասարումը 
Քանի որ DEL հաստությունը շատ ավելի փոքր է, քան մասնիկի չափը, իսկ հարթ DEL-ի համար ածանցյալը կոորդինատների նկատմամբ  Եվ
Եվ  վերացվում է։
վերացվում է։ 
e y-ի համար y-ի հետ<<1 функцию можно разложить в ряд Маклорена:

Մենք սահմանափակվում ենք շարքի երկու անդամներով, այնուհետև.


 - DEL հաստությունը այն հեռավորությունն է, որով DEL ներուժը նվազում է եմեկ անգամ.
- DEL հաստությունը այն հեռավորությունն է, որով DEL ներուժը նվազում է եմեկ անգամ.
Որքան ցածր է ջերմաստիճանը, այնքան քիչ  . Т→0-ում – հարթ DES: Որքան բարձր է կոնցենտրացիան, այնքան ես, այնքան քիչ
. Т→0-ում – հարթ DES: Որքան բարձր է կոնցենտրացիան, այնքան ես, այնքան քիչ  .
.





 «–» նշանակում է, որ պոտենցիալը նվազում է հեռավորության հետ: =>
«–» նշանակում է, որ պոտենցիալը նվազում է հեռավորության հետ: =>
=>

 ,
,
 - պոտենցիալը երկրաչափականորեն նվազում է:
- պոտենցիալը երկրաչափականորեն նվազում է:
Մակերեւութային լիցքի խտության ներուժը. 
Մակերեւութային լիցքը հակադիր նշանով տիեզերական լիցք է՝ ինտեգրված հեռավորության վրա։




=>


Որտեղ պոտենցիալը նվազում է 2,7 անգամ. 
Կրկնակի շերտի հզորություն 
Տեսության թերությունն այն է, որ հաշվի չի առնվում Հելեմհոլցի շերտի առկայությունը, այսինքն. հաշվի չի առնում  , այստեղից էլ՝ հիմնական պարամետրերի որոշման սխալները։ Այն նաև չի բացատրում տարբեր բնույթի իոնների ազդեցությունը էլեկտրական կրկնակի շերտի հաստության վրա։
, այստեղից էլ՝ հիմնական պարամետրերի որոշման սխալները։ Այն նաև չի բացատրում տարբեր բնույթի իոնների ազդեցությունը էլեկտրական կրկնակի շերտի հաստության վրա։
Ստեռնի տեսությունը. Կոլոիդային միցելի կառուցվածքը.
Էլեկտրական կրկնակի շերտը բաղկացած է երկու մասից՝ խիտ և ցրված։ Պոտենցիալ առաջացնող իոնների՝ հատուկ կլանվածների հետ փոխազդեցության արդյունքում առաջանում է խիտ շերտ։ Այս իոնները, որպես կանոն, մասամբ կամ ամբողջությամբ ջրազրկված են և կարող են ունենալ պոտենցիալ որոշող իոնների կամ նույն կամ հակառակ լիցքը։ Դա կախված է էլեկտրաստատիկ փոխազդեցության էներգիայի հարաբերակցությունից  և հատուկ կլանման ներուժ
և հատուկ կլանման ներուժ  . Խիտ շերտի իոնները ամրացված են։ Իոնների մյուս մասը գտնվում է ցրված շերտում, այդ իոնները ազատ են և կարող են խորանալ լուծույթի մեջ, այսինքն. ավելի բարձր կոնցենտրացիայի տարածքից դեպի ավելի ցածր կենտրոնացվածության տարածք: Լիցքավորման ընդհանուր խտությունը բաղկացած է երկու մասից.
. Խիտ շերտի իոնները ամրացված են։ Իոնների մյուս մասը գտնվում է ցրված շերտում, այդ իոնները ազատ են և կարող են խորանալ լուծույթի մեջ, այսինքն. ավելի բարձր կոնցենտրացիայի տարածքից դեպի ավելի ցածր կենտրոնացվածության տարածք: Լիցքավորման ընդհանուր խտությունը բաղկացած է երկու մասից.

 - Հելմհոլցի շերտի լիցքավորում
- Հելմհոլցի շերտի լիցքավորում
 -Ցրված շերտի լիցքավորում
-Ցրված շերտի լիցքավորում
Մակերեւույթն ունի որոշակի քանակությամբ կլանման կենտրոններ, որոնցից յուրաքանչյուրը փոխազդում է մեկ հակաիոնի հետ։ Նման քվազիքիմիական ռեակցիայի հաստատունը հետևյալն է.

 , Որտեղ
, Որտեղ  - լուծույթում հակաիոնների մոլային բաժին
- լուծույթում հակաիոնների մոլային բաժին
Հելմհոլցի բաշխումը
Պոտենցիալը նվազում է գծային
Գույի ներուժի բաշխում. Խիտ շերտ չկա, պոտենցիալը արժեքից երկրաչափորեն նվազում է 
Stern բաշխում.
Սկզբում պոտենցիալ նվազումը գծային է, իսկ հետո՝ էքսպոնենցիալ։
Երբ էլեկտրոֆորեզի դեպքում կիրառվում է էլեկտրական դաշտ, ուղղակիորեն շարժվում է ոչ թե պինդ փուլի մասնիկը, այլ պինդ փուլի մասնիկը շրջապատող իոնների շերտով։ DES-ը կրկնում է ցրված փուլի մասնիկի ձևը: Երբ կիրառվում է պոտենցիալ, ցրված շերտի մի մասը պոկվում է։ Ընդմիջման գիծը կոչվում է լոգարիթմական սահման.
Դիֆուզիոն շերտի մի մասի անջատման արդյունքում սայթաքման սահմանին առաջացող պոտենցիալը կոչվում է. էլեկտրակինետիկ ներուժ(Զետա ներուժ  ).
).
Ցրված փուլի մասնիկը, որը շրջապատում է հակաիոնների շերտը և կրկնակի էլեկտրական շերտը, կոչվում է միցել.
Կոլոիդային միցելներ գրելու կանոններ.


1-1 լիցքավորման էլեկտրոլիտ
T-ն ցրված փուլի մասնիկ է։
AA-ն խիտ և ցրված մասերի սահմանն է:
BB-ն սայթաքման սահմանն է:
Սայթաքման սահմանը կարող է կամ չհամընկնել AA տողի հետ:
Այն pH արժեքը, որի դեպքում զետա պոտենցիալը զրո է, կոչվում է իզոէլեկտրական կետ.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2 NaCl
1. CaCl 2-ից ավել
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n-x)Cl - ) 2 x + x Cl - - ռեկորդային միցելներ:
CaSO 4 մ - ագրեգատ:
CaSO 4 m∙nCa 2+ միջուկն է:
CaSO 4 m∙nCa 2+ 2( n-x)Cl - մասնիկ.
2. Na 2 SO 4-ից ավել
Na 2 SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - միցել
CaSO 4 մ - ագրեգատ:
CaSO 4 m∙nSO 4 2 + միջուկն է:
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - մասնիկ
Հելեմհոլց-Սմոլուչովսկի հավասարումը

 - սահմանների տեղաշարժի գծային արագություն (էլեկտրոսմոզում):
- սահմանների տեղաշարժի գծային արագություն (էլեկտրոսմոզում):
 - պոտենցիալ տարբերություն կոնդենսատորի թիթեղների վրա (էլեկտրոսմոզում):
- պոտենցիալ տարբերություն կոնդենսատորի թիթեղների վրա (էլեկտրոսմոզում):


 - լուծույթի ծավալային հոսքի արագություն, Սբջիջի խաչմերուկի տարածքն է:
- լուծույթի ծավալային հոսքի արագություն, Սբջիջի խաչմերուկի տարածքն է:

Եէլեկտրական դաշտի ուժն է։


 (էլեկտրոսմոզի համար):
(էլեկտրոսմոզի համար):
Հոսքի ներուժի համար.

 - ներուժ
- ներուժ
 - մեմբրանի ճնշում
- մեմբրանի ճնշում
Որպես կանոն, էլեկտրաֆորետիկ շարժունակության և էլեկտրաօսմոտիկ շարժունակության արժեքը փոքր է հաշվարկվածից։ Սա պայմանավորված է.
Ռելաքսացիոն էֆեկտ (ցրված փուլի մասնիկի շարժման ժամանակ խախտվում է իոնային մթնոլորտի համաչափությունը)։
Էլեկտրաֆորետիկ արգելակում (հակաիոնների շարժման արդյունքում հավելյալ շփման առաջացում):
Էլեկտրական հաղորդիչ մասնիկների դեպքում հոսքագծերի աղավաղում:
Մակերեւութային լարվածության և ներուժի միջև կապը: Լիպմանի հավասարումը.
DEL-ի ձևավորումը տեղի է ունենում ինքնաբերաբար՝ համակարգի մակերևութային էներգիան նվազեցնելու ցանկության պատճառով: Մշտականության համատեքստում ՏԵվ էջԹերմոդինամիկայի առաջին և երկրորդ օրենքների ընդհանրացված հավասարումն ունի հետևյալ տեսքը.
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1-ին Լիպմանի հավասարումը.
- 1-ին Լիպմանի հավասարումը.
 մակերեսային լիցքի խտությունն է։
մակերեսային լիցքի խտությունն է։
 - դիֆերենցիալ հզորություն.
- դիֆերենցիալ հզորություն.
 - 2-րդ Լիպմանի հավասարումը.
- 2-րդ Լիպմանի հավասարումը.
ՀԵՏ- հզորություն.
Մենք լուծում ենք 1-ին Լիպմանի և կլանման հիմնարար հավասարումը.
 ,
,


 , Հետո
, Հետո
 - Ներնստի հավասարումը
- Ներնստի հավասարումը
 ,
,
 ,
,




 - էլեկտրամազանոթ կորի (ECC) հավասարումը.
- էլեկտրամազանոթ կորի (ECC) հավասարումը.
IN  :
: , Բայց
, Բայց 
Կատիոնային մակերեսային ակտիվ նյութերը (CSAS) նվազեցնում են ECC-ի կաթոդիկ ճյուղը:
Anionic surfactants (ASS) նվազեցնում են ECC-ի անոդային ճյուղը:
Ոչ իոնային մակերեսային ակտիվ նյութերը (NSA) նվազեցնում են ECC-ի միջին մասը:
Ցրված համակարգերի կայունություն: Սեպային ճնշում.
Ցրված համակարգերը կարելի է բաժանել.
Թերմոդինամիկորեն անկայուն համակարգերը կարող են լինել կինետիկ կայուն՝ մետաստաբիլ վիճակի անցնելու պատճառով:
Կա կայունության երկու տեսակ.
Նստվածքային կայունություն (կապված ձգողականության հետ):
Ագրեգատիվ կայունություն. (կպչելու հետ կապված)
Կոագուլյացիամասնիկների կպչման գործընթացն է, որը հանգեցնում է ագրեգատիվ կայունության կորստի: Կոագուլյացիա կարող է առաջանալ ջերմաստիճանի, pH-ի, խառնման, ուլտրաձայնի փոփոխության պատճառով:
Տարբերակել կոագուլյացիան.
Հետադարձելի։
Անշրջելի.
Կոագուլյացիան ընթանում է էլեկտրոլիտների ներմուծմամբ։
Կոագուլյացիայի կանոններ.

Ֆիլմ- Սա համակարգի այն մասն է, որը գտնվում է երկու ինտերֆեյսի միջև:
տարանջատող ճնշումտեղի է ունենում թաղանթի հաստության կտրուկ նվազմամբ՝ մոտեցող մակերեսային շերտերի փոխազդեցության արդյունքում։

«-» - երբ թաղանթի հաստությունը նվազում է, տարանջատող ճնշումը մեծանում է:
P 0 ճնշումն է զանգվածային փուլում, որը միջշերտի շարունակությունն է:
P 1-ը ֆիլմի ճնշումն է:
Կայունության տեսություն. DLFO (Deryagin, Landau, Fairway, Overbeck):
Համաձայն DLVO տեսության, տարանջատման ճնշման մեջ առանձնանում են երկու բաղադրիչ.
էլեկտրաստատիկ P E (դրական, դա պայմանավորված է էլեկտրաստատիկ վանման ուժերով): Համապատասխանում է Գիբսի էներգիայի նվազմանը թաղանթի հաստության աճով:
ՄոլեկուլայինՊՄ (բացասական, գրավիչ ուժերի գործողության շնորհիվ): Այն առաջանում է թաղանթի սեղմումից՝ քիմիական մակերևութային ուժերի հետևանքով, ուժերի գործողության շառավիղը նմ-ի տասներորդներ է՝ 400 կՋ/մոլ կարգի էներգիայով։
Ընդհանուր փոխազդեցության էներգիա:

 - համակարգը ագրեգատային կայուն է
- համակարգը ագրեգատային կայուն է
 - անկայուն համակարգ
- անկայուն համակարգ
Պ  դրական բաղադրիչ.
դրական բաղադրիչ.
Աճը պայմանավորված է բարակ թաղանթների սեղմման ժամանակ պոտենցիալ էներգիայի ավելացմամբ։ Հաստ թաղանթների համար ավելցուկային իոնային էներգիան փոխհատուցվում է և հավասար է էներգիայի փոխազդեցությանը դիսպերսիոն միջավայրի մեծ մասում:
Եթե  (
( - թաղանթի հաստությունը,
- թաղանթի հաստությունը,  - իոնի շառավիղ) թաղանթի նոսրացումը հանգեցնում է նվազագույն մակերեսային էներգիա ունեցող մոլեկուլների և իոնների անհետացմանն ու նվազմանը: Նվազում է հարեւան մասնիկների թիվը, ինչի արդյունքում թաղանթում մնացած մասնիկների պոտենցիալ էներգիան մեծանում է։
- իոնի շառավիղ) թաղանթի նոսրացումը հանգեցնում է նվազագույն մակերեսային էներգիա ունեցող մոլեկուլների և իոնների անհետացմանն ու նվազմանը: Նվազում է հարեւան մասնիկների թիվը, ինչի արդյունքում թաղանթում մնացած մասնիկների պոտենցիալ էներգիան մեծանում է։


DLVO տեսությունը մասնիկների փոխազդեցությունը համարում է թիթեղների փոխազդեցություն։

Մասնիկները չեն փոխազդում



 - Լապլասի հավասարումը,
- Լապլասի հավասարումը,  ,
,


Թույլ լիցքավորված մակերեսների համար
Բարձր լիցքավորված մակերեսների համար.

Մոլեկուլային բաղադրիչը երկու ատոմների փոխազդեցությունն է.
 ~
~
Ատոմի փոխազդեցությունը մակերեսի հետ.

Վերցնենք երկու գրառում.
Դ  Մոլեկուլային բաղադրիչը ստանալու համար անհրաժեշտ է ամփոփել աջ և ձախ թիթեղների ատոմների փոխազդեցության բոլոր էներգիաները։
Մոլեկուլային բաղադրիչը ստանալու համար անհրաժեշտ է ամփոփել աջ և ձախ թիթեղների ատոմների փոխազդեցության բոլոր էներգիաները։
Որտեղ  - Համակերի հաստատունը (հաշվի է առնում փոխազդող մարմինների բնույթը).
- Համակերի հաստատունը (հաշվի է առնում փոխազդող մարմինների բնույթը).
Դա. համակարգում մասնիկների փոխազդեցության էներգիան կարող է արտահայտվել պոտենցիալ կորերի միջոցով:
Ես առաջնային պոտենցիալ նվազագույնն է: Սա անշրջելի կոագուլյացիայի գոտի է, գերակշռում են ձգողական ուժերը։
II - ագրեգատիվ կայունության գոտի, գերակշռում են վանող ուժերը։
III - երկրորդական պոտենցիալ նվազագույնը (կամ ֆլոկուլյացիայի գոտի): Ցրված փուլի մասնիկների միջև կա էլեկտրոլիտային շերտ, և մասնիկները կարելի է առանձնացնել և տեղափոխել ագրեգատիվ կայունության գոտի։

Կոր 1 – համակարգը ագրեգատիվ կայուն է:
Կորը 2-ը կայուն է I գոտում, կայուն չէ II գոտում:
Կոր 3 - համակարգում տեղի է ունեցել կոագուլյացիա:
Կոր 4 - 4-րդ կետում փոխազդեցության ընդհանուր էներգիան U=0,  , այս ծայրահեղ կետը համապատասխանում է արագ կոագուլյացիայի սկզբին։
, այս ծայրահեղ կետը համապատասխանում է արագ կոագուլյացիայի սկզբին։
Երկու դեպք կա.
1. Մակերեւույթները թույլ լիցքավորված են.
U \u003d U E + U M \u003d 0
 (1)
(1)
2)

 (2)
(2)



 - սա շերտի հաստությունն է, որը համապատասխանում է կոագուլյացիայի գործընթացի սկզբին:
- սա շերտի հաստությունն է, որը համապատասխանում է կոագուլյացիայի գործընթացի սկզբին:






 - թույլ լիցքավորված մակերեսների համար
- թույլ լիցքավորված մակերեսների համար
 Հետո
Հետո 
2. Բարձր լիցքավորված մակերեսների համար.
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
Եկեք հրապարակենք (3)

Կոագուլյացիա:
Հատուկ կլանման ժամանակ իոնները կարող են ներծծվել գերհամարժեք քանակով այնպես, որ մակերեսը կարողանա փոխել իր լիցքը: Մակերեսը լիցքավորվում է։
Սպեցիֆիկ ադսորբցիայի դեպքում կարող են կլանվել ոչ միայն հակադիր նշանների, այլ նաև մեկ իոնի իոններ։
Եթե մակերեսի հետ նույն նշանի իոնները ներծծվում են, ապա մակերեսային շերտում կլինի ոչ թե պոտենցիալի անկում, այլ դրա աճ։

Չեզոքացման կոագուլյացիա (առաջանում է թույլ լիցքավորված մասնիկների մասնակցությամբ և կախված է ոչ միայն կոագուլացնող էլեկտրոլիտի լիցքից, այլև խիտ և ցրված շերտերի սահմանի ներուժից)։
Սմոլուչովսկու արագ կոագուլյացիայի տեսությունը:

Կոագուլյացիայի արագության կախվածությունը էլեկտրոլիտի կոնցենտրացիայից.
I - կոագուլյացիայի մակարդակը ցածր է,
II - կոագուլյացիայի արագությունը գործնականում համեմատական է էլեկտրոլիտի կոնցենտրացիայի հետ:
III - արագ կոագուլյացիայի տարածք, արագությունը գործնականում անկախ է կոնցենտրացիայից:
Հիմնական կետերը:
Սկզբնական sol-ը մոնադիսպերս է, նմանատիպ մասնիկները ունեն գնդաձև ձև։
Բոլոր մասնիկների բախումները արդյունավետ են:
Երբ երկու առաջնային մասնիկներ բախվում են, առաջանում է երկրորդական մասնիկ։ Երկրորդական + առաջնային = երրորդական: Առաջնային, երկրորդական, երրորդական - բազմապատկություն:
Քիմիական կինետիկայի առումով կոագուլյացիայի գործընթացը կարելի է նկարագրել հետևյալ հավասարմամբ.
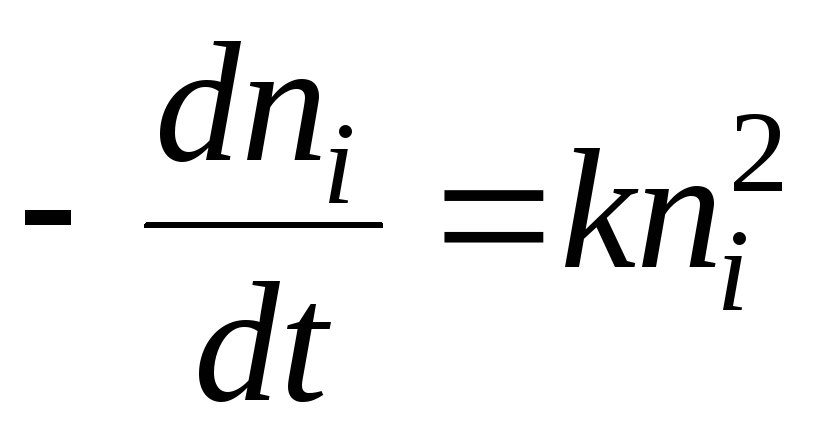
Լուծումը կլինի հավասարումը. 
 - կես կոագուլյացիայի ժամանակը. Սա այն ժամանակն է, որի ընթացքում sol մասնիկների թիվը նվազում է 2 անգամ։
- կես կոագուլյացիայի ժամանակը. Սա այն ժամանակն է, որի ընթացքում sol մասնիկների թիվը նվազում է 2 անգամ։

 ,
,
 ,
,
 ,
,


Քանի որ բազմակիությունը մեծանում է, կոագուլյացիայի կորերի առավելագույնը տեղափոխվում է ավելի մեծ արժեքներ  .
.
Թերություններ:
Մոնոդիսպերսիայի ենթադրություն.
Բոլոր բախումների արդյունավետության մասին ենթադրությունը.




 - ոլորտ,
- ոլորտ, ,
,





