Alkenlar kimyoviy jihatdan faoldir. Ularning kimyoviy xossalari asosan qo'sh bog'ning mavjudligi bilan belgilanadi. Alkenlar uchun elektrofil qo'shilish reaktsiyalari va radikal qo'shilish reaktsiyalari eng xarakterlidir. Nukleofil qo'shilish reaktsiyalari odatda kuchli nukleofilni talab qiladi va alkenlarga xos emas. Alkenlar osongina oksidlanish, qo'shilish reaktsiyalariga kirishadi, shuningdek, allil radikallarini almashtirishga qodir.
Qo'shilish reaktsiyalari
Gidrogenlanish Alkenlarga vodorod qo'shilishi (gidrogenlanish reaksiyasi) katalizatorlar ishtirokida amalga oshiriladi. Ko'pincha maydalangan metallar - platina, nikel, palladiy va boshqalar ishlatiladi. Natijada, tegishli alkanlar (to'yingan uglevodorodlar) hosil bo'ladi.
$CH_2=CH_2 + H2 → CH_3–CH_3$
galogenlar qo'shilishi. Alkenlar oddiy sharoitda xlor va brom bilan oson reaksiyaga kirishib, galogen atomlari qo‘shni uglerod atomlarida joylashgan tegishli digalalkanlarni hosil qiladi.
Izoh 1
Alkenlar brom bilan o'zaro ta'sirlashganda, bromning sariq-jigarrang rangi o'zgaradi. Bu to'yinmagan uglevodorodlar uchun eng qadimgi va eng oddiy sifat reaktsiyalaridan biridir, chunki alkinlar va alkadienlar ham xuddi shunday reaksiyaga kirishadi.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
vodorod galogenidlarini qo'shish. Etilen uglevodorodlari galogen vodorod ($HCl$, $HBr$) bilan reaksiyaga kirishganda galolalkanlar hosil boʻladi, reaksiya yoʻnalishi alkenlarning tuzilishiga bogʻliq boʻladi.
Etilen yoki simmetrik alkenlar bo'lsa, qo'shilish reaktsiyasi bir xil tarzda sodir bo'ladi va faqat bitta mahsulot hosil bo'lishiga olib keladi:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
Nosimmetrik alkenlarda ikki xil qo'shilish reaktsiyasi mahsuloti hosil bo'lishi mumkin:
Izoh 2
Aslida, asosan, faqat bitta reaksiya mahsuloti hosil bo'ladi. Bunday reaktsiyalarning o'tish yo'nalishining qonuniyligini rus kimyogari V.V. Markovnikov 1869 yilda Markovnikov qoidasi deb ataladi. Vodorod galogenidlarining nosimmetrik alkenlar bilan o'zaro ta'sirida vodorod atomi eng ko'p vodorodlangan uglerod atomida qo'sh bog'lanish buzilgan joyda, ya'ni ko'p sonli vodorod atomlari bilan bog'lanishdan oldin qo'shiladi.
Markovnikov bu qoidani eksperimental ma'lumotlar asosida shakllantirdi va faqat keyinroq nazariy asoslandi. Propilenning vodorod xlorid bilan reaksiyasini ko'rib chiqing.
$p$ aloqasining xususiyatlaridan biri uning oson qutblanish qobiliyatidir. Propen molekulasidagi metil guruhi (musbat induktiv effekt + $I$) taʼsirida $p$ bogʻining elektron zichligi uglerod atomlaridan biriga (= $CH_2$) siljiydi. Natijada, unda qisman manfiy zaryad ($\delta -$) paydo bo'ladi. Qo'sh bog'ning boshqa uglerod atomida qisman musbat zaryad paydo bo'ladi ($\delta +$).
Propilen molekulasidagi elektron zichligining bunday taqsimoti protonning kelajakdagi hujumi joyini aniqlaydi. Bu qisman manfiy zaryad $\delta-$ olib yuruvchi metilen guruhining uglerod atomi (= $CH_2$). Va xlor, shunga ko'ra, uglerod atomiga qisman musbat zaryad $\delta+$ bilan hujum qiladi.
Natijada, propilenning vodorod xlorid bilan asosiy reaksiya mahsuloti 2-xlorpropandir.
Hidratsiya
Alkenlarning hidratsiyasi mineral kislotalar ishtirokida sodir bo'ladi va Markovnikov qoidasiga bo'ysunadi. Reaktsiya mahsulotlari spirtli ichimliklardir
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Alkillanish
Past haroratlarda kislota katalizatori ($HF$ yoki $H_2SO_4$) ishtirokida alkenlarga alkanlarning qoʻshilishi molekulyar ogʻirligi yuqori boʻlgan uglevodorodlarning hosil boʻlishiga olib keladi va koʻpincha sanoatda motor yoqilgʻisi ishlab chiqarish uchun ishlatiladi.
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Oksidlanish reaksiyalari
Alkenlarning oksidlanishi oksidlovchi reagentlarning sharoitlari va turlariga qarab, qo'sh bog'lanishning uzilishi bilan ham, uglerod skeletining saqlanishi bilan ham sodir bo'lishi mumkin:
polimerlanish reaksiyalari
Alken molekulalari $\pi$-bog'larning ochilishi va dimerlar, trimerlar yoki yuqori molekulyar birikmalar - polimerlar hosil bo'lishi bilan ma'lum sharoitlarda bir-biriga qo'shilishga qodir. Alkenlarning polimerizatsiyasi ham erkin radikal, ham kation-anion mexanizmlari bilan borishi mumkin. Polimerlanish inisiatorlari sifatida kislotalar, peroksidlar, metallar va boshqalar ishlatiladi.Polimerlanish reaksiyasi harorat, nurlanish va bosim ta’sirida ham amalga oshiriladi. Oddiy misol - polietilen hosil qilish uchun etilenning polimerizatsiyasi
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Almashtirish reaksiyalari
Alkenlarni almashtirish reaksiyalari xos emas. Biroq, yuqori haroratlarda (400 ° C dan yuqori) teskari bo'lgan radikal qo'shilish reaktsiyalari bostiriladi. Bunday holda, qo'sh bog'lanishni saqlab, vodorod atomini allil holatida almashtirishni amalga oshirish mumkin bo'ladi.
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Bilim gipermarketi >>Kimyo >>Kimyo 10-sinf >> Kimyo: Alkenlar
Toʻyinmagan uglevodorodlarga molekulalardagi uglerod atomlari oʻrtasida koʻp bogʻlangan uglevodorodlar kiradi. To'yinmaganlar alkenlar, alkinlar, alkadienlar (polienlar). Tsiklda qo`sh bog`ni o`z ichiga olgan siklik uglevodorodlar (sikloalkenlar), shuningdek, siklda oz sonli uglerod atomlari (uch yoki to`rt atom) bo`lgan sikloalkanlar ham to`yinmagan xarakterga ega. "To'yinmaganlik" xususiyati bu moddalarning to'yingan yoki to'yingan uglevodorodlar - alkanlar hosil bo'lishi bilan, birinchi navbatda, vodorodni qo'shish reaktsiyalariga kirishi bilan bog'liq.
Tuzilishi
Alkenlar asiklik bo'lib, molekulada yagona bog'lardan tashqari, uglerod atomlari orasidagi bitta qo'sh bog' mavjud va C n H 2n umumiy formulasiga mos keladi.
Alkenlar o'zlarining ikkinchi nomini - "olefinlar" ni to'yinmagan yog 'kislotalari (oleik, linoleik) bilan taqqoslab oldilar, ularning qoldiqlari suyuq yog'larning bir qismi - yog'lar (inglizcha yog'dan - moy).
O'rtalarida qo'sh bog' mavjud bo'lgan uglerod atomlari, siz bilganingizdek, sp 2 gibridlanish holatidadir. Demak, bitta s- va ikkita p-orbital gibridlanishda ishtirok etadi, bitta p-orbital esa gibridlanmagan holda qoladi. Gibrid orbitallarning bir-birining ustiga chiqishi a-bog'ning hosil bo'lishiga olib keladi va qo'shni etilen molekulalarining gibridlanmagan a-orbitallari tufayli uglerod atomlari ikkinchi, P- ulanish. Shunday qilib, qo'sh bog'lanish bitta z- va bitta p-bog'lardan iborat.
Qo'sh bog'ni hosil qiluvchi atomlarning gibrid orbitallari bir tekislikda, n-bog'ni hosil qiluvchi orbitallar esa molekula tekisligiga perpendikulyar (5-rasmga qarang).
Qo'sh bog' (0,132 nm) bitta bog'dan qisqaroq va uning energiyasi kattaroq, ya'ni mustahkamroqdir. Shunga qaramay, mobil, oson qutblanadigan 7r bog'ning mavjudligi alkenlarning alkanlarga qaraganda kimyoviy jihatdan faolroq bo'lishiga va qo'shilish reaktsiyalariga kirishishiga olib keladi.
Etenning gomologik qatori
Tarmoqlanmagan alkenlar etenning (etilen) gomologik qatorini tashkil qiladi.
C2H4 - eten, C3H6 - propen, C4H8 - buten, C5H10 - penten, C6H12 - geksen va boshqalar.
Izomeriya va nomenklatura
Alkenlar uchun ham, alkanlar uchun ham strukturaviy izomeriya xarakterlidir. Strukturaviy izomerlar, siz eslayotganingizdek, uglerod skeletining tuzilishida bir-biridan farq qiladi. Strukturaviy izomerlar bilan tavsiflangan eng oddiy alken butendir.
CH3-CH2-CH=CH2 CH3-C=CH2
l
CH3
buten-1 metilpropen
Strukturaviy izomeriyaning alohida turi qo'sh bog'lanish pozitsiyasi izomeriyasidir:
CH3-CH2-CH=CH2 CH3-CH=CH-CH3
buten-1 buten-2
Yagona uglerod-uglerod aloqasi atrofida uglerod atomlarining deyarli erkin aylanishi mumkin, shuning uchun alkan molekulalari turli xil shakllarga ega bo'lishi mumkin. Ikkilamchi bog'lanish atrofida aylanish mumkin emas, bu alkenlarda boshqa turdagi izomeriyaning paydo bo'lishiga olib keladi - geometrik yoki sis-trans izomeriyasi.
Sis-izomerlar toraks-izomerlardan molekulyar fragmentlarning (bu holda metil guruhlari) tekislikka nisbatan fazoda joylashishi bilan farqlanadi. P munosabatlar, shuning uchun xususiyatlar.
Alkenlar sikloalkanlarga izomerdir (sinflararo izomeriya), masalan:
ch2=ch-ch2-ch2-ch2-ch3
geksen-1 siklogeksan
Nomenklatura alkenlar, IUPAC tomonidan ishlab chiqilgan, alkanlarning nomenklaturasiga o'xshaydi.
1. Asosiy sxemani tanlash
Uglevodorod nomining shakllanishi asosiy zanjirni - molekuladagi uglerod atomlarining eng uzun zanjirini aniqlashdan boshlanadi. Alkenlar bo'lsa, asosiy zanjirda qo'sh bog' bo'lishi kerak.
2. Asosiy zanjir atomlarini raqamlash
Asosiy zanjirning atomlarini raqamlash qo'sh bog'lanish eng yaqin bo'lgan uchidan boshlanadi. Masalan, to'g'ri ulanish nomi
ch3-chn-ch2-ch=ch-ch3 ch3
Kutilganidek, 2-metilheksen-4 emas, balki 5-metilheksen-2.
Zanjirdagi atomlarning raqamlanishining boshlanishini qo'sh bog'lanish joylashuvi bo'yicha aniqlashning iloji bo'lmasa, u holda to'yingan uglevodorodlar bilan bir xil tarzda o'rinbosarlarning joylashuvi bilan aniqlanadi.
CH3-CH2-CH=CH-CH-CH3
l
CH3
2-metilgeksen-3
3. Ismning shakllanishi
Alkenlarning nomlari ham alkanlarning nomlari kabi shakllanadi. Ism oxirida qo'sh bog'lanish boshlanadigan uglerod atomining raqami va birikmaning alkenlar sinfiga tegishli ekanligini ko'rsatadigan qo'shimcha -ene ko'rsatiladi.
Kvitansiya
1. Neft mahsulotlarini kreking qilish. To'yingan uglevodorodlarning termik kreking jarayonida alkanlarning hosil bo'lishi bilan birga alkenlarning hosil bo'lishi sodir bo'ladi.
2. To'yingan uglevodorodlarni degidrogenlash. Alkanlarni katalizator ustidan yuqori haroratda (400-600 °C) o'tkazilsa, vodorod molekulasi ajralib chiqadi va alken hosil bo'ladi: 
3. Spirtlarning suvsizlanishi (suvning parchalanishi). Suvni olib tashlaydigan moddalarning (H2804, Al203) yuqori haroratlarda monohidrik spirtlarga ta'siri suv molekulasini yo'q qilishga va qo'sh bog'lanishga olib keladi:
Ushbu reaktsiya molekulyar suvsizlanish deb ataladi (molekulyar suvsizlanishdan farqli o'laroq, bu efirlarning shakllanishiga olib keladi va § 16 "Spirtli ichimliklar" da o'rganiladi).
4. Degidrogalogenlash (galogen vodorodni yo'q qilish).
Spirtli eritmada galolalkan ishqor bilan reaksiyaga kirishganda, galogen vodorod molekulasining yo‘q bo‘lib ketishi natijasida qo‘sh bog‘ hosil bo‘ladi.
E'tibor bering, bu reaktsiya asosan buten-1 ga emas, balki buten-2 ga mos keladi Zaitsev qoidasi:
Vodorod galogenid ikkilamchi va uchinchi darajali haloalkanlardan ajratilganda, vodorod atomi eng kam vodorodlangan uglerod atomidan ajralib chiqadi.
5. Degalogenatsiya. Ruxning alkanning dibromo hosilasiga ta'sirida galogen atomlari qo'shni uglerod atomlaridan ajralib chiqadi va qo'sh bog' hosil bo'ladi: 
Jismoniy xususiyatlar
Alkenlarning gomologik qatorining dastlabki uchta vakili gazlar, C5H10-C16H32 tarkibidagi moddalar suyuqliklar, yuqori alkenlar qattiq moddalardir.
Qaynatish va erish nuqtalari tabiiy ravishda birikmalarning molekulyar og'irligi oshishi bilan ortadi.
Kimyoviy xossalari
Qo'shilish reaktsiyalari
Eslatib o'tamiz, to'yinmagan uglevodorodlar - alkenlar vakillarining o'ziga xos xususiyati qo'shilish reaktsiyalariga kirish qobiliyatidir. Ushbu reaktsiyalarning aksariyati elektrofil qo'shilish mexanizmi bilan davom etadi.
1. Alkenlarning gidrogenlanishi. Alkenlar gidrogenlash katalizatorlari - metallar - platina, palladiy, nikel ishtirokida vodorod qo'shishga qodir:
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
Bu reaksiya atmosfera va yuqori bosimda ham davom etadi va yuqori haroratni talab qilmaydi, chunki u ekzotermikdir. Xuddi shu katalizatorlarda haroratning oshishi bilan teskari reaktsiya, dehidrogenatsiya sodir bo'lishi mumkin.
2. Galogenlash (galogenlarning qo'shilishi). Alkenning bromli suv yoki bromning organik erituvchidagi (SCl4) eritmasi bilan oʻzaro taʼsiri alkenga galogen molekulasi qoʻshilishi va digalolkanlarning hosil boʻlishi natijasida bu eritmalarning tez rangsizlanishiga olib keladi.
Markovnikov Vladimir Vasilevich
(1837-1904)
Rus organik kimyogari. Kimyoviy tuzilishga qarab oʻrin almashish, yoʻq qilish, qoʻsh bogʻlanish va izomerlanish reaksiyalarining yoʻnalishi boʻyicha tuzilgan (1869-yil) qoidalar. Neft tarkibini (1880 yildan) o'rganib chiqdi, mustaqil fan sifatida neft kimyosiga asos soldi. (1883) organik moddalarning yangi sinfi - sikloparafinlar (naftenlar) ochildi.
3. Gidrogalogenlash (galogen vodorod qo'shilishi).
Vodorod galoid qo'shilishi reaktsiyasi quyida batafsilroq muhokama qilinadi. Bu reaktsiya Markovnikov qoidasiga bo'ysunadi:
Alkenga vodorod galogenid qo'shilsa, vodorod ko'proq vodorodlangan uglerod atomiga, ya'ni vodorod atomlari ko'proq bo'lgan atomga, galogen esa kamroq vodorodlanganga biriktiriladi.
4. Hidratsiya (suv qo'shilishi). Alkenlarning hidratsiyasi spirtlar hosil bo'lishiga olib keladi. Masalan, etenga suv qo'shilishi etil spirtini ishlab chiqarishning sanoat usullaridan biri hisoblanadi:
CH2=CH2 + H2O -> CH3-CH2OH
eten etanol
E'tibor bering, birlamchi spirt (birlamchi uglerodda gidroksil guruhi bilan) faqat eten gidratlanganda hosil bo'ladi. Propen yoki boshqa alkenlar gidratlanganda ikkilamchi spirtlar hosil bo'ladi. 
Bu reaksiya ham Markovnikov qoidasiga muvofiq davom etadi - vodorod kationi ko'proq vodorodlangan uglerod atomiga, gidroksi guruhi esa kamroq vodorodlanganga qo'shiladi.
5. Polimerlanish. Qo'shishning alohida holati alkenlarning polimerizatsiya reaktsiyasidir:
Ushbu qo'shilish reaktsiyasi erkin radikal mexanizm bilan davom etadi.
Oksidlanish reaksiyalari
Har qanday organik birikmalar singari, alkenlar CO2 va H20 hosil qilish uchun kislorodda yonadi.
Eritmalarda oksidlanishga chidamli alkanlardan farqli ravishda alkenlar kaliy permanganatning suvdagi eritmalari bilan oson oksidlanadi. Neytral yoki ozgina ishqoriy eritmalarda alkenlar diollarga (dihidrik spirtlar) oksidlanadi va oksidlanishdan oldin o'rtasida qo'sh bog'lanish mavjud bo'lgan atomlarga gidroksil guruhlari biriktiriladi.
Ma'lumki, to'yinmagan uglevodorodlar - alkenlar qo'shilish reaktsiyalariga kirisha oladi. Ushbu reaktsiyalarning aksariyati elektrofil qo'shilish mexanizmi bilan davom etadi.
elektrofil qo'shilishi
Elektrofil reaktsiyalar elektrofillar ta'sirida sodir bo'ladigan reaktsiyalar - elektron zichligi etishmasligi bo'lgan zarralar, masalan, to'ldirilmagan orbital. Eng oddiy elektrofil zarracha vodorod kationidir. Ma'lumki, vodorod atomi 3-orbitalda bitta elektronga ega. Vodorod kationi atom elektronni yo'qotganda hosil bo'ladi, shuning uchun vodorod kationida umuman elektron yo'q:
H - 1e - -> H +
Bunday holda, kation ancha yuqori elektron yaqinlikka ega. Bu omillarning kombinatsiyasi vodorod kationini ancha kuchli elektrofil zarrachaga aylantiradi.
Vodorod kationining hosil bo'lishi kislotalarning elektrolitik dissotsiatsiyasi paytida mumkin:
HBr -> H + + Br -
Aynan shuning uchun ham ko'plab elektrofil reaktsiyalar kislotalar ishtirokida va ishtirokida sodir bo'ladi.
Elektrofil zarralar, yuqorida aytib o'tilganidek, yuqori elektron zichligi bo'lgan hududlarni o'z ichiga olgan tizimlarga ta'sir qiladi. Bunday tizimga misol sifatida ko'p (ikki yoki uch) uglerod-uglerod aloqasi bo'lishi mumkin.
Siz allaqachon bilasizki, ular orasida qo'sh bog' hosil bo'lgan uglerod atomlari sp 2 gibridlanish holatidadir. Bir tekislikda joylashgan qo'shni uglerod atomlarining gibridlanmagan p-orbitallari bir-biriga yopishib, hosil bo'ladi. P-bog', z-bog'dan kamroq kuchli va eng muhimi, tashqi elektr maydoni ta'sirida oson qutblanadi. Bu shuni anglatadiki, musbat zaryadlangan zarracha yaqinlashganda, TC aloqasining elektronlari o'z yo'nalishi bo'yicha siljiydi va P- murakkab.
Bu chiqadi P-kompleks va vodorod kationi qo'shilganda P- ulanishlar. Vodorod kationi, xuddi molekula tekisligidan chiqib turgan elektron zichligiga qoqiladi. P- bog'laydi va unga qo'shiladi. ![]()
Keyingi bosqichda elektron juftining to'liq siljishi sodir bo'ladi. P-uglerod atomlaridan biri bilan bog'lanadi, bu uning ustida yolg'iz elektron juftining paydo bo'lishiga olib keladi. Bu juftlik joylashgan uglerod atomining orbitali va vodorod kationining to'ldirilmagan orbitali bir-birining ustiga chiqadi, bu esa donor-akseptor mexanizmi orqali kovalent bog'lanish hosil bo'lishiga olib keladi. Shu bilan birga, ikkinchi uglerod atomi to'ldirilmagan orbital, ya'ni musbat zaryad bo'lib qoladi.
Olingan zarracha karbokation deb ataladi, chunki u uglerod atomida musbat zaryadni o'z ichiga oladi. Bu zarracha har qanday anion bilan birlasha oladi, bo'linmagan elektron juftiga ega bo'lgan zarracha, ya'ni nukleofil.
Etenning gidrobromlanishi (brom vodorod qo'shilishi) misolida elektrofil qo'shilish reaktsiyasining mexanizmini ko'rib chiqing:
CH2= CH2 + HBr --> CHBr-CH3
Reaktsiya elektrofil zarracha - vodorod kationining hosil bo'lishi bilan boshlanadi, bu vodorod bromid molekulasining dissotsiatsiyasi natijasida yuzaga keladi.
Vodorod kationlarining hujumlari P-bog'lanish, shakllantirish P- tez karbokatatsiyaga aylanadigan kompleks: 
Endi yanada murakkab ishni ko'rib chiqing.
Vodorod bromidning etenga qo'shilish reaktsiyasi bir ma'noda davom etadi va vodorod bromidning propen bilan o'zaro ta'siri nazariy jihatdan ikkita mahsulotni berishi mumkin: 1-bromopropan va 2-bromopropan. Tajriba ma'lumotlari shuni ko'rsatadiki, asosan 2-bromopropan olinadi.
Buni tushuntirish uchun biz oraliq zarracha - karbokatiyani ko'rib chiqishimiz kerak.
Propenga vodorod kationining qo'shilishi ikkita karbokation hosil bo'lishiga olib kelishi mumkin: agar vodorod kationi birinchi uglerod atomiga, zanjir oxirida joylashgan atomga biriktirilgan bo'lsa, ikkinchisi, ya'ni. molekulaning markazi (1), musbat zaryadga ega bo'ladi; agar ikkinchisiga qo'shilsa, birinchi atom (2) musbat zaryadga ega bo'ladi. 
Reaksiyaning afzal yo'nalishi reaksiya muhitida qaysi karbokatsiya ko'proq bo'lishiga bog'liq bo'ladi, bu esa, o'z navbatida, karbokatsiyaning barqarorligi bilan belgilanadi. Tajriba 2-bromopropanning ustun shakllanishini ko'rsatadi. Demak, markaziy atomda musbat zaryadga ega bo'lgan karbokation (1) hosil bo'lishi ko'proq darajada sodir bo'ladi.
Ushbu karbokatsiyaning barqarorligi markaziy uglerod atomidagi musbat zaryad ikki metil guruhining ijobiy induktiv ta'siri bilan qoplanishi bilan izohlanadi, ularning umumiy ta'siri bitta etil guruhining +/- ta'siridan yuqori:
Alkenlarning gidrogalogenlanish reaksiyalari qonuniyatlarini A. M. Butlerovning shogirdi, mashhur rus kimyogari V. V. Markovnikov o‘rganib, yuqorida aytib o‘tilganidek, uning nomi bilan atalgan qoidani tuzgan.
Bu qoida empirik, ya'ni empirik tarzda o'rnatildi. Ayni paytda biz bunga to'liq ishonarli tushuntirish berishimiz mumkin.
Qizig'i shundaki, boshqa elektrofil qo'shilish reaktsiyalari ham Markovnikov qoidasiga bo'ysunadi, shuning uchun uni umumiyroq shaklda shakllantirish to'g'ri bo'ladi.
Elektrofil qo'shilish reaktsiyalarida elektrofil (to'ldirilmagan orbitalga ega bo'lgan zarracha) ko'proq vodorodlangan uglerod atomiga, nukleofil (yakka juft elektronga ega bo'lgan zarracha) esa kamroq gidrogenlangan atomga biriktiriladi.
Polimerizatsiya
Qo'shilish reaktsiyasining alohida holati alkenlar va ularning hosilalarini polimerizatsiya qilishdir. Bu reaktsiya erkin radikal qo'shilish mexanizmi bilan boradi:
Polimerizatsiya erkin radikallar manbai bo'lgan tashabbuskorlar - peroksid birikmalari ishtirokida amalga oshiriladi. Peroksid birikmalari moddalar deb ataladi, ularning molekulalari -O-O- guruhini o'z ichiga oladi. Eng oddiy peroksid birikmasi vodorod peroksid HOOH hisoblanadi.
100 °C haroratda va 100 MPa bosimda beqaror kislorod-kislorod aloqasining gomolizlanishi va radikallar - polimerizatsiya tashabbuskorlari hosil bo'ladi. KO-radikallarning ta'siri ostida polimerizatsiya boshlanadi, bu erkin radikal qo'shilish reaktsiyasi sifatida rivojlanadi. Reaksiya aralashmasi radikallar - polimer zanjiri va radikallar yoki KOCH2CH2- rekombinatsiyalanganda zanjir o'sishi to'xtaydi.
Tarkibida qoʻsh bogʻ boʻlgan moddalarning erkin radikal polimerizatsiyasi reaksiyasidan foydalanib, koʻp miqdordagi makromolekulyar birikmalar olinadi: 
Alkenlarning turli o'rinbosarlari bilan qo'llanilishi keng ko'lamli xossalarga ega bo'lgan polimer materiallarning keng spektrini sintez qilish imkonini beradi. 
Bu polimer birikmalarining barchasi inson faoliyatining turli sohalarida - sanoatda, tibbiyotda keng qo'llaniladi, biokimyoviy laboratoriyalar uchun asbob-uskunalar ishlab chiqarish uchun ishlatiladi, ba'zilari boshqa makromolekulyar birikmalarni sintez qilish uchun oraliq mahsulotlardir.
Oksidlanish
Neytral yoki ozgina ishqoriy eritmalarda alkenlar diollarga (ikki atomli spirtlar) oksidlanishini allaqachon bilasiz. Kislotali muhitda (sulfat kislotasi bilan kislotalangan eritma) qo'sh bog' butunlay yo'q qilinadi va qo'sh aloqa mavjud bo'lgan uglerod atomlari karboksil guruhining uglerod atomlariga aylanadi: 
Alkenlarning vayron qiluvchi oksidlanishi ularning tuzilishini aniqlash uchun ishlatilishi mumkin. Masalan, agar ba'zi alkenlarning oksidlanishida sirka va propion kislotalar olingan bo'lsa, bu penten-2 oksidlanishdan o'tganligini anglatadi va agar butirik (butanik) kislota va karbonat angidrid olingan bo'lsa, unda boshlang'ich uglevodorod pentendir. -1.
Ilova
Alkenlar kimyo sanoatida turli organik moddalar va materiallar olish uchun xom ashyo sifatida keng qo'llaniladi.
Masalan, eten etanol, etilen glikol, epoksidlar, dikloroetan ishlab chiqarish uchun boshlang'ich materialdir.
Ko'p miqdorda eten polietilenga qayta ishlanadi, u qadoqlash plyonkalari, idish-tovoqlar, quvurlar va elektr izolyatsion materiallarni ishlab chiqarish uchun ishlatiladi.
Propendan glitserin, aseton, izopropanol, erituvchilar olinadi. Propenning polimerizatsiyasi natijasida polipropilen ishlab chiqariladi, bu ko'p jihatdan polietilendan ustundir: u yuqori erish nuqtasi va kimyoviy qarshilikka ega.
Hozirgi vaqtda polimerlardan - polietilen analoglaridan noyob xususiyatlarga ega tolalar ishlab chiqariladi. Misol uchun, polipropilen tolasi barcha ma'lum sintetik tolalardan kuchliroqdir.
Ushbu tolalardan tayyorlangan materiallar istiqbolli va inson faoliyatining turli sohalarida tobora ko'proq foydalanilmoqda.

1. Alkenlarga qanday izomeriya turlari xos? Penten-1 ning mumkin bo'lgan izomerlari uchun formulalarni yozing.
2. Qanday birikmalarni olish mumkin: a) izobuten (2-metilpropen); b) buten-2; c) buten-1? Tegishli reaksiyalar tenglamalarini yozing.
3. Quyidagi transformatsiyalar zanjirining shifrini aniqlang. A, B, C birikmalarini ayting. 4. 1-xlor-propandan 2-xlorpropan olish usulini taklif qiling. Tegishli reaksiyalar tenglamalarini yozing.
5. Etanni etilen aralashmalaridan tozalash usulini taklif qiling. Tegishli reaksiyalar tenglamalarini yozing.
6. To‘yingan va to‘yinmagan uglevodorodlarni farqlashda qo‘llaniladigan reaksiyalarga misollar keltiring.
7. 2,8 g alkenni to‘liq gidrogenlashda 0,896 l vodorod (n.a.) sarflangan. Oddiy uglerod atomlari zanjiriga ega bo'lgan bu birikmaning molekulyar og'irligi va struktura formulasi qanday?
8. Agar bu gazning 20 sm3 qismini toʻliq yoqish uchun 90 sm3 (n.a.) kislorod ketgani maʼlum boʻlsa, silindrda qanday gaz (eten yoki propen) bor?
9*. Alken xlor bilan qorong'uda reaksiyaga kirishganda 25,4 g dixlorid, bir xil massadagi bu alken brom bilan to'rt xlorid uglerod bilan reaksiyaga kirishganda 43,2 g dibromid hosil bo'ladi. Boshlang'ich alkenning barcha mumkin bo'lgan struktura formulalarini belgilang.
Kashfiyot tarixi
Yuqoridagi materialdan biz etilenning bitta qo'sh bog'ga ega bo'lgan to'yinmagan uglevodorodlarning gomologik qatorining ajdodi ekanligini allaqachon tushundik. Ularning formulasi C n H 2n va ular alkenlar deyiladi.
Nemis shifokori va kimyogari Bexer 1669 yilda birinchi bo'lib sulfat kislotaning etil spirtiga ta'sirida etilen oldi. Bexer etilenning metanga qaraganda faolroq ekanligini aniqladi. Ammo, afsuski, o'sha paytda olim olingan gazni aniqlay olmadi, shuning uchun u unga hech qanday nom bermadi.
Biroz vaqt o'tgach, Gollandiyalik kimyogarlar etilenni olish uchun xuddi shu usuldan foydalanishdi. Va xlor bilan o'zaro ta'sirlashganda, u yog'li suyuqlik hosil qilish qobiliyatiga ega bo'lganligi sababli, u "kislorod gazi" nomini oldi. Keyinchalik bu suyuqlik dikloroetan ekanligi ma'lum bo'ldi.
Frantsuz tilida "yog'li" atamasi oléfiant kabi eshitiladi. Va bu turdagi boshqa uglevodorodlar kashf etilgandan so'ng, frantsuz kimyogari va olimi Antuan Fourcroix olefinlar yoki alkenlarning butun sinfi uchun umumiy bo'lgan yangi atamani kiritdi.
Ammo allaqachon o'n to'qqizinchi asrning boshida frantsuz kimyogari J. Gay-Lyussak etanol nafaqat "yog'li" gazdan, balki suvdan ham iborat ekanligini ko'rsatdi. Bundan tashqari, xuddi shu gaz etilxloridda ham topilgan.
Garchi kimyogarlar etilenning vodorod va ugleroddan iboratligini aniqlashgan va moddalar tarkibini allaqachon bilishgan bo'lsa-da, uzoq vaqt davomida uning haqiqiy formulasini topa olmadilar. Va faqat 1862 yilda E. Erlenmeyer etilen molekulasida qo'sh bog'lanish mavjudligini isbotlashga muvaffaq bo'ldi. Buni rus olimi A. M. Butlerov ham tan oldi va bu nuqtai nazarning to'g'riligini eksperimental tarzda tasdiqladi.
Tabiatda topilishi va alkenlarning fiziologik roli
Ko'pchilik alkenlarni tabiatda qayerda topish mumkinligi haqidagi savolga qiziqish bildirmoqda. Shunday qilib, ular tabiatda deyarli uchramaydi, chunki uning eng oddiy vakili etilen o'simliklar uchun gormon bo'lib, ularda faqat oz miqdorda sintezlanadi.
To'g'ri, tabiatda muskalur kabi alken mavjud. Bu tabiiy alkenlardan biri ayol chivinlarining jinsiy jalb qiluvchisidir.
Shunisi e'tiborga loyiqki, yuqori konsentratsiyaga ega bo'lgan pastki alkenlar shilliq qavatlarning konvulsiyalari va tirnash xususiyati keltirib chiqarishi mumkin bo'lgan giyohvandlik ta'siriga ega.
Alkenlarning qo'llanilishi
Zamonaviy jamiyat hayotini polimer materiallardan foydalanmasdan tasavvur qilish qiyin. Chunki, tabiiy materiallardan farqli o'laroq, polimerlar turli xil xususiyatlarga ega, ularni qayta ishlash oson va agar siz narxga qarasangiz, ular nisbatan arzon. Polimerlar foydasiga yana bir muhim jihat shundaki, ularning ko'pchiligi qayta ishlanishi mumkin.
Alkenlar plastmassa, kauchuk, plyonka, teflon, etil spirti, atsetaldegid va boshqa organik birikmalar ishlab chiqarishda o'z qo'llanilishini topdi.

Qishloq xo'jaligida meva pishishini tezlashtiradigan vosita sifatida ishlatiladi. Propilen va butilenlar turli polimerlar va spirtlarni ishlab chiqarish uchun ishlatiladi. Ammo sintetik kauchuk ishlab chiqarishda izobutilen ishlatiladi. Shunday qilib, biz alkenlardan voz kechib bo'lmaydi, degan xulosaga kelishimiz mumkin, chunki ular eng muhim kimyoviy xom ashyo hisoblanadi.
Etilendan sanoatda foydalanish
Sanoat miqyosida propilen odatda polipropilen sintezi va izopropanol, glitserin, butirik aldegidlar va boshqalarni ishlab chiqarish uchun ishlatiladi. Har yili propilenga bo'lgan ehtiyoj ortib bormoqda.

4.3.b. Vodorod galogenidlarini qo'shish (gidrogalogenlash)
Alkenlarga elektrofil qo'shilishning yana bir muhim reaktsiyasi - bu alkenlarning uzoq vaqtdan beri ma'lum bo'lgan gidrogalogenlanishi.
Quyida turli alkenlarga HCl, HBr va HI qo'shilishining tipik misollari keltirilgan.


Alkil o'rnini bosuvchi moddalarning qo'sh bog'lanish tezligiga ta'siri quyidagi ketma-ketlik bilan tavsiflanadi:
R 2 C=CHR > RCH=CHR > RCH=CH 2
Bu reaksiya tezligini belgilovchi bosqich karbokation hosil bo'lishi mexanizmiga mos keladi, chunki uchinchi>ikkilamchi>birlamchi qatorda alkil kationlarining barqarorligi pasayadi. Shunday qilib, qo'shilish mexanizmi oraliq hosil bo'lishini o'z ichiga olishi kerak erkin karbokation , bu kamdan-kam uchraydi, yoki karbokatsion xarakterga ega bo'lgan oraliq. Oxirgi holat eng tipik hisoblanadi.
Agar qo'shilish "erkin karbokation" orqali sodir bo'lsa, u holda reaksiya mutlaqo stereoselektiv bo'lmagan bo'lar edi, chunki alkil kationlari tekis tuzilishga ega. Biroq, gidrogalogenlanish, qoida tariqasida, stereoselektiv tarzda davom etadi va alkenning turiga qarab, tanlab olinadi. qarshi- ulanish, tanlangan sin- yoki aralash sin-qarshi- qo'shilish.
Qo'sh bog'lanish aromatik halqa bilan konjuge bo'lmagan alkenlar uchun xarakterlidir. qarshi- galogen vodorod qo'shilishi. Anti- siklogeksen, siklopenten, 1,2-dimetilgeksen, 1,2-dimetilpenten uchun vodorod xlorid va vodorod bromid, deyteriy xlorid va bromid qoʻshilishi kuzatiladi, cis- Va trans-buten-2, geksen-3 va boshqa ko'plab oddiy alkenlar va sikloalkenlar.

Qo'shilgan mahsulotda bir xil o'rinbosarlar (metil guruhlari) siklogeksan halqasining o'rta tekisligining qarama-qarshi tomonlarida joylashgan, shuning uchun u trans- qator. Anti-qo'shilish diskret karbokatsiya hosil bo'lishi taxmin qilinadigan mexanizmga deyarli mos kelmaydi. Planar karbokatatsiya uchun galoid ionining nukleofil hujumi tekislikning har ikki tomonida ham bir xil bo'lishi mumkin, bu esa mahsulotlar aralashmasining hosil bo'lishiga olib kelishi kerak. sin- Va qarshi- ulanishlar. Alkenlarni gidrogalogenlashning kinetikasi ham murakkabroq qo'shilish mexanizmiga ishora qiladi. Konjugatsiyalanmagan alkenlar uchun reaksiya tezligi galogen vodorod bo'yicha ikkinchi tartibli uchinchi tartibli tenglama bilan tavsiflanadi, ya'ni u Ad E 3 mexanizmiga mos keladi.
v = k [alken] 2
Vodorod galogenidiga nisbatan qo'shilishga qarshi va ikkinchi tartibli reaksiya Ad E 3 mexanizmiga yaxshi mos keladi, bunda alken ikkita galogen vodorod molekulasi bilan reaksiyaga kirishadi, ulardan biri elektrofil, ikkinchisi esa nukleofil agent sifatida ishlaydi.

Bunday trimolekulyar mexanizm dastlab alken va bitta vodorod galogenid molekulasidan iborat kompleks hosil bo'lishini, so'ngra ikkinchi HX molekulasining ushbu kompleksga hujum qilishini ko'rsatadi. qarshi-diskret karbokatsiya hosil bo'lmagan tomonlar. Shuni alohida ta'kidlash kerakki, har qanday trimolekulyar mexanizm ikkita ketma-ket bosqichdan iborat bo'lishi kerak, chunki uchta molekulaning bir vaqtning o'zida to'qnashuvi juda dargumon.

Anti-qo'shilish alken protonlangan tomonga qarama-qarshi tomondan vodorod galoidining imtiyozli nukleofil hujumini ko'rsatadi. Vodorod galogenid o'rniga, nukleofil agentning oxirgi bosqichdagi funktsiyasini halid ioni ham bajarishi mumkin. Darhaqiqat, reaksiya tezligi odatda reaksiya aralashmasiga NR 4+ X tetraalkilamoniy halidlari shaklida kiritilgan galoid ionining kontsentratsiyasiga to'g'ridan-to'g'ri mutanosib ravishda ortadi. - yoki lityum LiX. Bunday holda, stereospesifik qarshi- qo'shilish.
Qo'sh bog'lanish aromatik halqa bilan konjugatsiyalangan alkanlar uchun xarakterlidir sin- ulanish yoki aralash sin-qarshi-galogen vodorod qo'shilishi, masalan:

Syn-birikma uchun dominant jarayon cis- Va trans-1-fenilpropen, 1-fenil-4-alkiltsiklogeksenlar, asenaftilen, inden izomerlari. Bunday alkenlarning protonlanishi natijasida oddiy alkenlar va sikloalkenlarning protonlanishi natijasida hosil bo‘lgan sof alkil kationlariga nisbatan barqarorroq bo‘lgan benzil tipidagi karbokatsiyalar hosil bo‘ladi. Bu holda reaksiya kinetikasi odatda oddiyroq ikkinchi tartibli tenglama v = k[alken] bilan tavsiflanadi, ya'ni u bimolekulyar Ad E 2 mexanizmiga mos keladi. Ad E 2 mexanizmi karbokation va galoid ionini o'z ichiga olgan ion juftligini hosil qilishni o'z ichiga oladi.

Ion juftlarini o'z ichiga olgan qo'shish mexanizmi juda stereoselektiv bo'lishini kutish mumkin emas. Agar ion jufti oddiy uglerod-uglerod aloqasi atrofida aylanishdan tezroq yakuniy mahsulotga aylansa, yakuniy natija bo'ladi. sin-qo'shilish, bu erda proton va galoid ioni qo'sh bog'ning bir tomonida biriktiriladi. Aks holda, mahsulotlarning shakllanishi sifatida kuzatiladi sin- shunday va qarshi- HX ulanishlari. Bunday holat gidrogalogenlash jarayonida amalga oshiriladi juftlik-almashtirilgan stirollar Z-C 6 H 4 -CH=CH 2. Bu erda kuzatilgan naqsh shundan iborat sin-qo'shilish faqat protonlanganda nisbatan barqaror karbokatatsiya beradigan olefinlarga xosdir, ya'ni donor o'rnini bosuvchi Z uchun.
Ad E 2 mexanizmi bo'yicha olib boriladigan gidrogalogenlash reaktsiyalari konjugatsiyalangan qo'shilish va qayta tashkil etish jarayonlari o'rtasidagi raqobat bilan tavsiflanadi, chunki oraliq mahsulot sifatida karbokation yoki ion jufti hosil bo'ladi.

Alkil guruhi va gidrid ionining 1,2-migratsiyasi bilan qayta tashkil etilishiga misol sifatida biz mos ravishda tert-butiletil va izopropiletilning gidrogalogenlanish reaksiyalarini keltiramiz.

Sovuqda (-78 0 S) erituvchisiz bir xil reaksiya o'tkazilganda 33% normal va 67% anomal (qayta tartibga solingan) qo'shilgan mahsulotlar aralashmasi hosil bo'ladi.

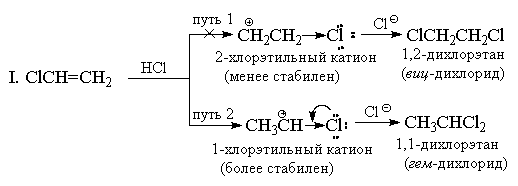
4.3.c. Orientatsiya. Markovnikov qoidasi
Simmetrik elektrofillardan (Hal 2) farqli o'laroq, vodorod galogenidlari nosimmetrik elektrofil reagentlardir. Nosimmetrik alkenga har qanday nosimmetrik elektrofil (HBr, ICl, H 2 O, Hg (OAc) 2 va boshqalar) qo'shilishi printsipial jihatdan ikkita muqobil mahsulot aralashmasini berishi mumkin, lekin amalda odatda ulardan faqat bittasi hosil bo'ladi. Misol tariqasida propilenga vodorod bromid qo'shilishini ko'rib chiqing.

1870 yilda V.V. Markovnikov empirik qoidani ishlab chiqdi, unga ko'ra nosimmetrik alkenlar HXni shunday qo'shadiki, mahsulot asosan hosil bo'ladi, bunda vodorod eng kam almashtirilganiga, X esa qo'sh bog'ning eng ko'p almashtirilgan uchiga qo'shiladi.
Odatda, Markovnikov qoidasi ikkita muqobil karbokatsiyaning barqarorligidagi farq bilan izohlanadi. Misol uchun, yuqoridagi misolda, normal n-propil kation izopropil kationga qaraganda ancha barqaror emas va shuning uchun reaksiya ikkinchi yo'l bo'ylab boradi.
Markovnikov qoidasi dastlab faqat HX ni uglevodorodli substratlarga qo'shish uchun ishlatilgan, lekin printsipial jihatdan uni boshqa almashtirilgan alkenlarning reaktsiyalariga ham kengaytirish mumkin. Demak, CF 3 CH=CH 2 ga HCl qo'shilishi " qarshi-Markovnikov "mahsuloti CF 3 CH 2 CH 2 Cl. Buni kutish kerak edi, chunki CF 3 CH+ CH 3 kationi kuchli (-I) ta'siri tufayli CF 3 CH 2 CH 2+ kationiga qaraganda barqaror emas. CF 3-guruhi asosan CF 3 CH 2 CH 2+ kationi hosil bo'ladi, lekin u ham ozroq bo'lsa-da, CF 3 guruhining induktiv ta'sirida beqarorlashadi, buning natijasida HCl qo'shiladi. trifluorometiletilen almashtirilmagan etilenga qo'shilganidan ancha sekinroq.
Xuddi shunga o'xshash sababga ko'ra, viniltrialkilammoniy kationlari Markovnikov qoidasiga qarshi HBr qo'shadi:
Kuchli (-I) va (-M) oʻrnini bosuvchi alkenlarga, masalan, akrilonitril yoki nitroetilenga HX qoʻshilishi ham Markovnikov qoidasiga zid boʻlishi kerak. Biroq, bu holda, qo'sh bog'lanish elektrofil reagentlarga nisbatan shunchalik kuchli o'chiriladiki, bu reaktsiyalar faqat juda og'ir sharoitlarda davom etadi. Vinilxlorid CH 2 =CHCl har doim faqat "Markovnikov qo'shimchalarini" beradi. Masalan, HCl bilan reaksiyaga kirishganda, faqat 1,1-dikloroetan (geminal dixlorid) CH 3 CHCl 2 hosil bo'ladi. Xlor, xuddi CF 3 guruhiga o'xshab, kuchli (-I) ta'sirga ega va birinchi qarashda, shu sababli qo'shilish Markovnikovga qarshi yo'nalishga ega bo'lishi kerak, chunki kation + CH 2 CH 2 Cl bo'lishi kerak. kation CH 3 CH + Cl dan barqarorroq. Biroq, CF 3 guruhidan farqli o'laroq, xlor, (-I) ta'siridan tashqari, unga qarshi ta'sir qiluvchi (+ M) ta'sirga ham ega (chunki uning yolg'iz juftlari bor). Tajriba shuni ko'rsatadiki, mezomer effektining kattaligi 1-xloroetil kation energiyasini +M effekti o'zini namoyon qilmaydigan 2-xloroetil kationning energiya darajasidan pastga tushirish uchun juda etarli.
II. Rezonans nazariyasi nuqtai nazaridan 1-xloroetil kationning tuzilishini quyidagicha ifodalash mumkin:
Biroq, vinilxloridga qo'shilishi bir xil sharoitlarda etilenga qaraganda sekinroq sodir bo'ladi, ya'ni umumiy ta'sirga ko'ra (-I> +M), xlor vodorodga nisbatan elektronni tortib oluvchi o'rinbosar bo'lib qoladi va 1-xloroetil kation kamroq barqaror, C 2 H 5 + ga qaraganda. Boshqa vinilgalogenidlar HX bilan xuddi shunday reaksiyaga kirishadi.
Vinil efirlar CH 2 =CHOR Markovnikov qoidasiga ko'ra HX (X=Hal) yuqorida sanab o'tilgan barcha almashtirilgan alkenlarga qaraganda ancha yuqori tezlikda qo'shadi. Bu RO guruhining muhim +M ta'siriga bog'liq. Xlor atomidan farqli o'laroq, umumiy elektron effekt (+M > -I) bo'yicha RO guruhi kuchli elektron beruvchi o'rinbosar bo'lib, qo'shni karbokatsion markazni samarali barqarorlashtiradi. Bu holda karbokatatsiyaning tuzilishi ikkita rezonans tuzilmalari to'plami sifatida ham ifodalanishi mumkin
Oksoniy kationining galoid anioni bilan hujumi CH 3 CH (Hal) OR tipidagi a-galoesterlarning hosil bo'lishiga olib keladi.
4.3.d. Alkenlarning hidratsiyasi
Alkenlarning kislota bilan katalizlangan hidratsiyasi spirtlar hosil bo'lishiga olib keladi. Alkenlarning gidratlanish yo`nalishi Markovnikov qoidasi bilan belgilanadi, shuning uchun bu reaksiyada oraliq zarracha sifatida karbokation hosil bo`ladi, deb faraz qilinadi.
Ikkilamchi alkil karbokatsiyalarning o'zlarini qayta tashkil qilish tendentsiyasi ikkilamchi spirtlarni olish uchun alkenlarning hidratsiyasidan foydalanishga to'sqinlik qiladi.

Laboratoriyada bu usul faqat uchinchi darajali spirtlarni tayyorlash uchun cheklangan doirani topdi. Bu holda hidratsiya reaktsiyasi ko'p jihatdan qaytariladi va uchinchi darajali spirtlar past hosildorlikda (40-45%) hosil bo'ladi.


Eng oddiy alkenlarni - etilen va propilenni hidratsiya qilish etil va izopropil spirtlarini olishning muhim sanoat usuli hisoblanadi.

Laboratoriya amaliyotida alkenlarning to'g'ridan-to'g'ri hidratsiyasi og'ir sharoitlar tufayli ham, izomer spirtlarining sezilarli darajada hosil bo'lishi tufayli ham keng qo'llanilmadi. Hozirgi vaqtda tegishli gidroksimerkuratsiya-demerkuratsiya reaktsiyasi alkenlardan spirtli ichimliklarni regioselektiv ishlab chiqarish uchun keng qo'llaniladi.
4.3.e. Gidroksimerkuratsiya-demerkuratsiya
Alkenning qo'sh bog'lanishiga elektrofil hujum metall ionlari tomonidan amalga oshirilishi mumkin, ular orasida simob (II) kationi alohida o'rinni egallaydi. Simob asetat juda yumshoq sharoitda 20 0 C da suvli tetrahidrofuran (THF) yoki suvli sirka kislotasidagi alkenlarga qo'shilib organomerkuriy birikmalarini hosil qiladi. Simob asetatning qo'sh bog'lanishga qo'shilishi mintaqaviy ravishda Markovnikov qoidasiga qat'iy muvofiq davom etadi, ya'ni simob kationi eng kam almashtirilgan uglerod atomiga biriktiriladi.
Organomerkuriy birikmalardagi C-Hg aloqasi simob va yangi C-H bog'ini hosil qilish uchun natriy borgidrid NaBH 4 tomonidan osonlikcha ajralishi mumkin. Beqaror oraliq mahsulot sifatida alkil simob gidridi olinadi, deb taxmin qilinadi, u keyinchalik radikal mexanizm bilan metall simob ajralib chiqishi bilan parchalanadi.

Xulosa qilib aytadigan bo'lsak, bu ikki bosqichli gidroksimerkuratsiya-demerkuratsiya jarayoni oxir-oqibatda qo'shimcha mahsulotlarning hosil bo'lishi maksimal mumkin bo'lgan minimal darajaga tushirilganda, o'ta yumshoq sharoitlarda Markovnikov qoidasiga ko'ra, mintaqaviy alkenlarning hidratsiyasini ifodalaydi. Buni reaksiya mahsulotlarining umumiy unumi 90-98% ni tashkil etadigan quyidagi misollar orqali aniq ko'rsatish mumkin. Berilgan raqamli ma'lumotlar bu holda hosil bo'lgan birikmalarning hosildorligini emas, balki ularning aralashmadagi nisbatini ko'rsatadi.




Yuqoridagi misollardan ko'rinib turibdiki, alkenlarning gidroksimerkuratsiyasi-demerkuratsiyasi ko'p hollarda alkenlarning regiospesifik hidratsiyasini amalda ikkita izomer spirtidan faqat bittasi hosil bo'lishini ta'minlaydi. Shuni ta'kidlash kerakki, organomerkuriy birikmani ajratib olishning hojati yo'q va ikkala jarayon ham to'g'ridan-to'g'ri birin-ketin amalga oshirilishi mumkin.
Nosimmetrik alkenlarning gidroksimerkuratsiyasi, aftidan, AcOHg+ kationining hujumi va oraliq mahsulot sifatida nosimmetrik siklik merkuriniy kationining (nosimmetrik bo'lmagan galoniy ioniga o'xshash) hosil bo'lishi bilan boshlanadi, keyinchalik u suvning eng ko'p nukleofil hujumi natijasida ochiladi. kattaroq musbat zaryadga ega bo'lgan almashtirilgan uglerod atomi.

Ko'prik simob ioni nukleofil bo'lmagan kuchli kislotali muhitda, hatto ftorsulfon kislotasi va surma pentaflorid aralashmasiga kuchliroq elektrofil agent - simob triftoratsetat qo'shib, 20 0 C da ham o'rnatilishi mumkin.

Simob kationi nafaqat suv ta'sirida, balki boshqa elektron beruvchi erituvchilar: spirtlar, sirka kislotasi, atsetonitril va boshqalar bilan ham bo'linishi mumkin. sirka kislotasi, masalan:


Alkoksimerkuratsiya-demerkuratsiya reaksiyasida shoxlangan ikkilamchi yoki uchinchi darajali spirtlardan foydalanilganda simob asetatga qaraganda Hg(OCOCF 3) 2 trifloroatsetat yoki Hg (OSO 2 CF 3) 2 trifloroatsetat samaraliroqdir.

Shunday qilib, gidroksi- va alkoksimerkuratsiya-demerkuratsiya spirtlar va shoxlangan alkil radikallari bilan efirlarni sintez qilish uchun eng yaxshi tayyorgarlik usullaridan biridir.
Simob tuzlarining alkenlarga qo'shilishi qo'sh bog'lanishga konjugatsiyalangan qo'shilish reaktsiyasining eng yorqin misolidir, bu erda tashqi nukleofil agent rolini erituvchi o'ynaydi. Ikkilamchi gidroksimerkuratsiya-demerkuratsiya jarayonining stereokimyosi har bir alohida bosqichning stereokimyoviy natijasiga bog'liq. Gidroksimerkuratsiya bilan xarakterlanadi qarshi-qo'shilish, siklik kation ishtirokidagi boshqa reaksiyalarda bo'lgani kabi. Biroq, radikal demerkuratsiya yuqori stereoselektivlik bilan tavsiflanmaydi. Shu sababli, butun jarayon bir butun sifatida ham stereospesifik emas.
4.3.f. Alkenlarning qo'shilishi (kationik dimerizatsiya va alkenlarning polimerizatsiyasi)
Ushbu turdagi reaksiyaning eng qiziqarli misoli sulfat kislota ishtirokida izobutilenning dimerizatsiyasi va polimerizatsiyasi.

Ushbu alkenlar aralashmasining texnik nomi "diizobutilen" dir. Bu reaksiya mineral kislotalarning alkenlarning qoʻsh bogʻlanishiga qoʻshilish mexanizmiga oʻxshash katyonik mexanizm boʻyicha boradi. Birinchi bosqichda proton nisbatan barqaror molekula hosil qilish uchun izobutilen molekulasiga biriktiriladi. tert-butillanish. Keyinchalik shakllangan tert-butillanish (Lyuis kislotasi) izobutilen molekulasi (Lyuis asosi) bilan reaksiyaga kirishib, yangi barqaror uchinchi darajali oktil kation hosil qiladi.

Bunday sharoitda asoslar (H 2 O, HSO 4 - ionlari) ta'sirida oktil karbokat protonni tezda yo'qotadi va izomer pentenlar aralashmasiga aylanadi, chunki protonning ajralishi ikki xil holatda sodir bo'ladi:

Termodinamik jihatdan kamroq barqaror alken - 2,4,4-trimetilpenten-1 (reaksiya aralashmasida 80%) ning imtiyozli shakllanishi vodorod atomlariga nisbatan metil guruhlari vodorod atomlarining bazaviy hujumi uchun ko'proq fazoviy kirish bilan bog'liq. metilen guruhidan. Sanoatda "diizobutilen" Ni-Raneyda gidrogenlanib, ichki yonuv dvigatellari uchun yuqori oktanli yoqilg'i sifatida ishlatiladigan "izooktan" (2,2,4-trimetilpentan uglevodorodining texnik nomi) ishlab chiqariladi.
Sulfat kislotaning yuqori konsentratsiyasida (80% dan ortiq) izobutilenning katyonik polimerizatsiyasi natijasida poliizobutilen (-CH 2 C(CH 3) 2 -) n deb ataladigan polimer hosil bo'ladi. Ushbu kauchukga o'xshash polimer korroziyaga qarshi va gidroizolyatsiya qoplamalari, plomba moddalari va boshqalarni olish uchun ishlatiladi.
Izobutilendan tashqari, 3-metilbuten-1, vinil efirlar va nisbatan barqaror karbokatsiyalar hosil qila oladigan ba'zi stirol hosilalari katyonik mexanizm bo'yicha polimerlanadi. Vodorod ftorid va Lyuis kislotalari ham katyonik polimerlanish uchun katalizator sifatida ishlatiladi: BF 3, AlCl 3, AlBr 3 va boshqalar juda oz miqdorda suv borligida.
4.3.g. Alkanlarning qo'shilishi (alkenlarning alkillanishi)
"Izooktan" sintezining yana bir sanoat usuli konsentrlangan sulfat kislota ishtirokida yoki 0 10 0 S da suvsiz vodorod ftoridida izobutilenning ortiqcha izobutan bilan o'zaro ta'siriga asoslangan.

Bu reaksiya katyonik mexanizm orqali ham davom etadi va ayniqsa qiziq bo'lgan narsa katyonik zanjir jarayoniga misoldir. Birinchidan, izobutilen reaksiya sharoitida dimerlanadi va uchinchi darajali oktil kation (CH 3) 3 CCH 2 C + (CH 3) 2 hosil qiladi. Uning shakllanish mexanizmi oldingi bobda batafsil tavsiflangan. Keyinchalik, vodorodning (gidrid ioni shaklida) izobutandan oktil kationga tez o'tishi, "izooktan" molekulasi va yangi tert-butil kation hosil bo'ladi, bu esa o'z navbatida izobutilen bilan tezda reaksiyaga kirishadi. yangi oktil kationi va boshqalar.

“Izooktan” sintezidan tashqari, bu alkillash usuli neft-kimyo sanoatida shoxlangan alkenlardan yuqori qaynaydigan tarmoqlangan uglevodorodlar va termal kreking fraktsiyasi bilan past qaynaydigan alkanlarni sintez qilish uchun ishlatiladi.
ALKENLAR
Molekulasida oddiy uglerod-uglerod va uglerod-vodorod s-bog'lardan tashqari uglerod-uglerod p-bog'lari mavjud bo'lgan uglevodorodlar deyiladi. cheksiz. p bog'lanishning hosil bo'lishi rasmiy ravishda molekula tomonidan ikkita vodorod atomini yo'qotishga teng bo'lganligi sababli, to'yinmagan uglevodorodlar tarkibida 2p chegaradan kamroq vodorod atomlari, bu erda P - p-obligatsiyalar soni:
A'zolari bir-biridan (2H) n ga farq qiladigan qator deyiladi izologik tomoni. Demak, yuqoridagi sxemada izologlar geksanlar, geksenlar, geksadienlar, geksinlar, geksatrienlar va boshqalar.
Tarkibida bitta p-bog' (ya'ni qo'sh bog') bo'lgan uglevodorodlar deyiladi alkenlar (olefinlar) yoki seriyaning birinchi a'zosiga ko'ra - etilen, etilen uglevodorodlari. Ularning gomologik qatori uchun umumiy formula C p H 2l.
1. Nomenklatura
IUPAC qoidalariga muvofiq, alkenlarning nomlarini qurishda, qo'sh bog'lanishni o'z ichiga olgan eng uzun uglerod zanjiri tegishli alkan nomini oladi, unda tugaydi. -an ga o'zgartirildi -en. Bu zanjir shunday raqamlanganki, qo‘sh bog‘ hosil bo‘lishida ishtirok etuvchi uglerod atomlari mumkin bo‘lgan eng kichik sonni oladi:

Radikallar alkanlardagi kabi nomlanadi va raqamlanadi.
Nisbatan oddiy tuzilishga ega alkenlar uchun oddiyroq nomlarga ruxsat beriladi. Shunday qilib, eng keng tarqalgan alkenlarning ba'zilari qo'shimchani qo'shish orqali chaqiriladi -en bir xil uglerod skeletiga ega uglevodorod radikali nomiga:
Alkenlardan hosil bo'lgan uglevodorod radikallari qo'shimchani oladi -enil. Radikaldagi raqamlash erkin valentlikka ega bo'lgan uglerod atomidan boshlanadi. Biroq, eng oddiy alkenil radikallari uchun tizimli nomlar o'rniga, ahamiyatsizlarini ishlatishga ruxsat beriladi:

To'yinmagan uglerod atomlari bilan bevosita bog'langan vodorod atomlari qo'sh bog'lanish hosil qiladi. vinil vodorod atomlari,
2. Izomeriya
Alkenlar qatorida uglerod skeletining izomeriyasidan tashqari qo`sh bog`lanish holatining izomeriyasi ham mavjud. Umuman olganda, ushbu turdagi izomeriya - o'rnini bosuvchi joy izomeriyasi (funktsiyalari)- molekulada har qanday funksional guruhlar mavjud bo'lgan barcha hollarda kuzatiladi. C 4 H 10 alkan uchun ikkita strukturaviy izomer bo'lishi mumkin:
Alken C 4 H 8 (buten) uchun uchta izomer bo'lishi mumkin:

Buten-1 va buten-2 funktsiya pozitsiyasining izomerlaridir (bu holda uning roli qo'sh bog' bilan o'ynaydi).
Fazoviy izomerlar o'rinbosarlarning bir-biriga nisbatan fazoda joylashishi bilan farqlanadi va ular deyiladi. cis izomerlari, agar o'rinbosarlar qo'sh bog'ning bir tomonida bo'lsa va trans izomerlari, qarama-qarshi tomonlarda bo'lsa:

3. Qo‘sh bog‘lanish tuzilishi
C=C qo‘sh bog‘lanishda molekulaning uzilish energiyasi 611 kJ/mol; s-bog'ning energiyasi C-C 339 kJ / mol bo'lganligi sababli, p bog'lanishning uzilish energiyasi atigi 611-339 = 272 kJ / mol. p-elektronlar s-elektronlarga qaraganda ancha oson, masalan, qutblanuvchi erituvchilar yoki har qanday hujum qiluvchi reagentlar ta'sirida. Bu s- va p-elektronlarning elektron bulutining taqsimlanish simmetriyasidagi farq bilan izohlanadi. P-orbitallarning maksimal bir-biriga mos kelishi va shuning uchun molekulaning minimal erkin energiyasi faqat vinil bo'lagining planar tuzilishi va 0,134 nm ga teng qisqartirilgan C-C masofasi bilan amalga oshiriladi, ya'ni. bitta bog' bilan bog'langan uglerod atomlari orasidagi masofadan (0,154 nm) ancha kichik. Molekulaning "yarmlari" ning qo'sh bog'lanish o'qi bo'ylab bir-biriga nisbatan aylanishi bilan orbitallarning bir-birining ustiga chiqish darajasi pasayadi, bu energiya sarflanishi bilan bog'liq. Buning oqibati qo'sh bog'lanish o'qi bo'ylab erkin aylanishning yo'qligi va uglerod atomlarida mos keladigan almashinish bilan geometrik izomerlarning mavjudligi.
Alkenlar- to'yinmagan uglevodorodlar, ularda bitta qo'sh bog'lanish mavjud. Alkenlarga misollar:

Alkenlarni olish usullari.
1. 400-700°S da alkanlarning yorilishi. Reaksiya erkin radikal mexanizmiga muvofiq davom etadi:

2. Alkanlarning gidrogenlanishi:
3. Eliminatsiya reaktsiyasi (ajralish): 2 atom yoki 2 atom guruhi qo'shni uglerod atomlaridan ajraladi va qo'sh bog' hosil bo'ladi. Bu reaktsiyalarga quyidagilar kiradi:
A) Spirtlarni suvsizlantirish (150 ° C dan yuqori qizdirish, sulfat kislotaning suvni tozalash reaktivi sifatida ishtirokida):
B) Ishqorning alkogolli eritmasi ta’sirida galogen vodorodning parchalanishi:

Vodorod atomi asosan kamroq miqdordagi vodorod atomlari bilan bog'liq bo'lgan uglerod atomidan bo'linadi (eng kam vodorodlangan atom) - Zaitsev hukmronligi.
B) degalogenatsiya:

Alkenlarning kimyoviy xossalari.
Alkenlarning xususiyatlari bir nechta bog'lanish mavjudligi bilan belgilanadi, shuning uchun alkenlar bir necha bosqichda (H-X - reagent) davom etadigan elektrofil qo'shilish reaktsiyalariga kiradi:
1-bosqich:

2-bosqich:
 .
.
Ushbu turdagi reaktsiyadagi vodorod ioni manfiy zaryadga ega bo'lgan uglerod atomiga tegishli. Zichlik taqsimoti:

Agar o'rinbosar sifatida donor bo'lsa, u o'zini +I- effekti sifatida namoyon qiladi, u holda elektron zichligi eng ko'p vodorodlangan uglerod atomi tomon siljiydi va unda qisman manfiy zaryad hosil qiladi. Reaksiyalar davom etadi Markovnikov qoidasi: turdagi qutbli molekulalarni biriktirganda HX (HCl, HCN, HOH va boshqalar) nosimmetrik alkenlar uchun vodorod qo'sh bog'lanishda ko'proq vodorodlangan uglerod atomiga qo'shiladi.
A) qo‘shilish reaksiyalari:
1) gidrogalogenlash:
Reaksiya Markovnikov qoidasi bo‘yicha boradi. Ammo agar reaktsiyada peroksid mavjud bo'lsa, unda qoida hisobga olinmaydi:
2) hidratsiya. Reaksiya Markovnikov qoidasiga muvofiq fosfor yoki sulfat kislota ishtirokida boradi:

3) Galogenlash. Natijada, brom suvi rangsizlanadi - bu ko'p bog'lanishga sifatli reaktsiya:
4) gidrogenlash. Reaksiya katalizatorlar ishtirokida davom etadi.



