Adsorpsiyon ara yüzeyde gerçekleşir. Bu nedenle yüzey olaylarının termodinamik tanımını heterojen sistemlerin termodinamiğinin özel bir durumu olarak düşünmek mantıklıdır.
Pirinç. 3.4. Gibbs adsorpsiyonu: 1- iki fazlı karşılaştırma sistemi, 2- düzgün olmayan bölgeye sahip gerçek iki fazlı sistem
Heterojen sistemlerin termodinamiğinde kullanılır toplanabilirlik ilkesi aşağıdaki gibidir: Heterojen bir sistemin tüm kapsamlı özellikleri, fazların temas etmeden önce sahip olacağı karşılık gelen kapsamlı özelliklerin toplamına eşittir. Aşamaları α ve β ile gösterelim (Şekil 4). O halde, arayüzey yakınındaki fazların özelliklerinin toplu özellikleriyle örtüştüğü ideal bir sistem için, iç enerji U, hacim V, kütle (mol sayısı) n, entropi S için denge kurulduktan sonra aşağıdaki ilişkiler geçerlidir. heterojen bir sistem:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
Bu, her iki fazdaki sıcaklık ve basıncın aynı olduğunu varsayar.
Gerçek heterojen sistemler için iki fazın sınırındaki geçiş bölgesi sistemin kapsamlı özelliklerine ek bir katkı sağlar. Yüzey olgusu ortaya çıkarsa, gerçek bir heterojen sistemin kapsamlı özellikleri ile yüzey olgusunun bulunmadığı bir model sistemin kapsamlı özellikleri arasındaki fark dikkate alınmalıdır. Böyle bir sisteme karşılaştırma sistemi denir. Karşılaştırma sistemi, gerçek sistemle aynı yoğun parametrelere (T, P, Ci...) ve aynı V hacmine sahiptir (Şekil 4).
Termodinamik açıdan bakıldığında, adsorpsiyon değeri G, gerçek bir heterojen sistemin referans sistemle karşılaştırıldığında arayüz alanı veya yüzey alanı ile ilgili olarak sahip olduğu, mol veya gram cinsinden ifade edilen fazla miktarda madde ns olarak anlaşılır. adsorban A'nın. Karşılaştırma sisteminin, gerçek sistemle aynı yoğun parametrelere (T, P, C i) ve aynı hacme (V = V α + V β) sahip olduğu varsayılmaktadır (Şekil 4) .
Г = (n - n α - n β)/A = n s /A 3.11
Gerçek bir sistemin geçiş bölgesinin aşırı termodinamik fonksiyonları (bunları s indeksiyle belirtiyoruz) şu şekilde yazılabilir:
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S β vesaire.
Adsorpsiyonun deneysel ölçümleri, seçilen referans sistemle karşılaştırıldığında gerçek sistemdeki bileşenin fazlası olarak her zaman adsorpsiyonu tam olarak verir. Örneğin, gazın katı bir adsorban üzerinde adsorpsiyonu veya bileşenlerin bir katı faz üzerinde adsorpsiyonu sırasında, adsorpsiyon değerlerini bulmak için, α ve β fazlarının temasından sonra adsorbatın başlangıç konsantrasyonlarındaki değişikliği belirleyin.
n ben s = V(C ben o - C ben),
Nerede C i o– i-inci bileşenin başlangıç konsantrasyonu, C ben– temas eden fazlar arasında denge kurulduktan sonra i-th bileşeninin konsantrasyonu. Hacmin olduğuna inanılıyor V değişmez. Ancak konsantrasyon Ben bileşen C ben Deneysel olarak elde edilen hacim olarak belirlenir V' geçiş katmanının homojen olmayan bölgesinin hacmini hesaba katmadan faz arayüzünün üstünde Va konsantrasyonun olduğu arayüzde C i α. Böylece, gerçek bir sistemde düzgün olmayan bir bölgenin varlığından dolayı sistemin toplam hacmi şu şekilde temsil edilebilir: V = V’ + V α. Tüm miktar Ben-inci bileşen C i o bu iki cilt arasında dağıtılacaktır:
V C ben o = V’ C ben + V α C ben α,
ve bileşenin mol sayısı Ben arayüzde adsorbe edilen, şuna eşit olacaktır:
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (C i α – C i) 3.12
Onlar. deneysel olarak belirlenen adsorpsiyon, V α hacmindeki i-th bileşeninin faz arayüzünden uzakta aynı hacimdeki bu bileşenin miktarına kıyasla fazlalığıdır. Bu tür adsorpsiyona Gibbs adsorpsiyonu denir. .
V α C i α tam içerik denir Ben- Adsorpsiyon katmanındaki bileşen. Çok düşük konsantrasyonların olduğu bölgede C ben hacim olarak V' değişiklik V α C ben denklem (3.2) ihmal edilebilir ve ölçülen değer dikkate alınabilir V α C i α tam içerik Ben-Örneğin düşük basınçlarda katı bir adsorban üzerinde gaz adsorpsiyonu sırasında adsorpsiyon katmanındaki bu bileşen.
Adsorpsiyon proseslerinin termodinamiği.
| Parametre adı | Anlam |
| Makale konusu: | Adsorpsiyon proseslerinin termodinamiği. |
| Değerlendirme listesi (tematik kategori) | Eğitim |
Adsorpsiyon proseslerinin temel tanımları ve sınıflandırılma yöntemleri.
Adsorpsiyon, yüzey enerjisindeki kendiliğinden azalma nedeniyle ortaya çıkan olayları ifade eder.
Adsorpsiyon- Heterojen bir sistemin bileşenlerinin yüzey katmanı ile homojen fazın hacmi arasında kendiliğinden geri dönüşümlü veya geri döndürülemez şekilde yeniden dağıtılması süreci.
Çok bileşenli sistemlerde, arayüzey gerilimini daha güçlü bir şekilde azaltan bileşen tercihen yüzey katmanına aktarılır. Tek bileşenli sistemlerde, yüzey katmanının oluşumu sırasında yapısında bir değişiklik meydana gelir (atomların ve moleküllerin belirli bir yönelimi, polarizasyon), adı verilen otoadsorpsiyon.
Adsorpsiyon etkileşimlerinin lokalize olduğu daha yoğun faza denir emici. Homojen fazın hacmi ile yüzey katmanı arasında yeniden dağıtılan madde `' terimiyle gösterilir. adsorplamakʼʼ.
Bazı durumlarda adsorpsiyon süreci tersine çevrilebilir. Bu durumda, belirli koşullar altında, moleküler kinetik olayların bir sonucu olarak adsorplanan moleküllerin bir kısmı, yüzey katmanından yığın fazına geçebilir. Adsorpsiyonun ters işlemine denir desorpsiyon.
Adsorpsiyon proseslerini sınıflandırma yöntemleri.
Etkileşimli fazların bir araya gelme durumuna göre adsorpsiyon işlemlerinin sınıflandırılması. Bitişik fazların toplam durumuna olan bağımlılık dikkate alındığında, aşağıdaki adsorpsiyon işlemleri türleri ayırt edilir:
Gazların katı adsorbanlar üzerinde adsorpsiyonu;
Çözünmüş maddelerin “katı-sıvı” ve “sıvı-sıvı” arayüzlerinde adsorpsiyonu;
Yüzey aktif maddelerin sıvı-gaz arayüzünde adsorpsiyonu.
Adsorban ve adsorbat arasındaki etkileşimin mekanizmasına göre adsorpsiyon işlemlerinin sınıflandırılması. Adsorpsiyon, adsorbat moleküllerinin adsorbanın aktif merkezleri ile etkileşimi olarak düşünülebilir. Etkileşim mekanizmalarına göre aşağıdaki adsorpsiyon türleri ayrılır:
1) fiziksel (moleküler) adsorpsiyon- adsorbat ve adsorban molekülleri arasındaki etkileşim, van der Waals kuvvetleri, hidrojen bağları (kimyasal reaksiyonlar olmadan) nedeniyle gerçekleştirilir;
2) kimyasal adsorpsiyon (kemisorpsiyon)- adsorbat moleküllerinin adsorbanın aktif merkezlerine bağlanması, çeşitli tipteki kimyasal reaksiyonların (iyon değiştirme reaksiyonları hariç) bir sonucu olarak meydana gelir;
3) iyon değişimi adsorpsiyonu (iyon değişimi) – iyon değişim reaksiyonlarının mekanizmasına göre adsorbat maddenin çözelti ile katı faz (iyon değiştirici) arasında yeniden dağıtılması.
Adsorpsiyon proseslerini kantitatif olarak tanımlamak için iki miktar kullanılır.
1) Mutlak adsorpsiyon– adsorbanın birim yüzey alanı veya kütlesi başına adsorbatın miktarı (mol) veya kütlesi (kg). Tanım – A; boyut: mol/m2, mol/kg, kg/m2, kg/kᴦ.
2) Gibbs (fazla) adsorpsiyonu- adsorbanın birim yüzey alanı veya kütlesi başına, homojen fazın hacmindeki miktarına kıyasla belirli bir kalınlıktaki yüzey tabakasındaki adsorbat maddesinin fazlalığı. Tanım – G; boyut: mol/m 2, mol/kᴦ.
Mutlak ve aşırı adsorpsiyon arasındaki ilişki aşağıdaki denklem kullanılarak gösterilebilir:
Г = А – с * h (3.1)
burada c, fazın hacmindeki maddenin denge konsantrasyonudur, mol/m3;
h, geleneksel olarak 10-9 m olduğu varsayılan yüzey katmanının kalınlığıdır.
Çok bileşenli heterojen sistemlerde, homojen fazın hacmi ile yüzey katmanı arasında bir veya daha fazla bileşen yeniden dağıtıldığında, yüzeyin aşırı iç enerjisi denklemi geçerlidir:
U = T * S + s * s + Sm i * n ben (3.2)
Denklemin tüm terimlerini fazlar arası yüzeyin birim alanına indirgeyerek şunu elde ederiz:
U s = T * S s + s + Sm i * Г i (3.3)
burada Г i = n i / s, yüzey katmanındaki i-th bileşeninin fazlalığıdır, yani Gibbs adsorpsiyonudur.
Tek bileşenli bir sistem için denklem (3.3) şu şekli alacaktır:
G s = s + m * G (3.4)
burada G s = U s - T * S s – Yüzeyin Gibbs enerjisi veya birim yüzey alanı yaratma işi;
m * G – adsorbe edilen maddenin maddesinin yüzey tabakasında sıkıştırılması.
Denklem (3.4)'e dayanarak, adsorpsiyon sırasında, fazlar arası bir yüzey oluşturma işinin, yüzey oluşumu (adsorbat fazının hacmindeki yapışkan bağların kırılması) ve yüzey tabakasındaki maddenin sıkıştırılması işinden oluştuğu sonucuna varabiliriz.
Adsorban ve adsorbat arasındaki dinamik denge durumunda, heterojen sistemin Gibbs enerjisindeki değişiklik ΔG = 0, adsorpsiyon işleminin termodinamiği adı verilen denklem ile tanımlanır. Gibbs temel adsorpsiyon denklemi:
Ds = SГ i * dm i (3,5)
Bu denklem evrenseldir ve her türlü adsorpsiyon prosesi için geçerlidir.
Gibbs adsorpsiyon denkleminin özel durumları.
1) Çözeltilerden adsorpsiyon.
“Sıvı – katı adsorban” ve “sıvı – gaz” arayüzeylerinde adsorpsiyon sırasında sistemin i. bileşeninin kimyasal potansiyeli için aşağıdaki denklemler geçerlidir:
m ben = m ben 0 + R*T*ln a ben (3,6)
dm i = R*T* d ln a i (3,7)
burada m ben 0 standart koşullar altında sistemin i-inci bileşeninin kimyasal potansiyelidir;
a i, sistemin i-inci bileşeninin standart koşullar altındaki aktivitesidir.
Buna dayanarak Gibbs adsorpsiyon denklemi şu şekli alır:
Г i = - a i / R*T * (ds / da i) (3.8)
Elektrolit olmayan çözeltiler için a i = c i alırız, o zaman:
Г i = - с / R*T * (ds / dс) (3,9)
Elektrolit çözeltileri için:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
burada с ± çözeltinin ortalama iyonik konsantrasyonudur;
n stokiyometrik katsayıdır.
2) Maddelerin gaz fazından adsorpsiyonu.
Mendeleev-Clayperon denklemine göre:
Р = с * R*T (3.11)
Bu bağlamda, gazların katı adsorbanlar üzerindeki adsorpsiyonu için Gibbs denklemi aşağıdaki biçimde yazılmıştır:
Г i = - Р / R*T * (ds / dР) (3.12)
Uygulamada Gibbs adsorpsiyon denklemi, çeşitli sıvı konsantrasyonu veya denge gaz basıncı değerlerinde yüzey gerilimi ölçümlerine dayanarak, yüzey geriliminin belirlendiği ara yüzey katmanındaki maddelerin adsorpsiyon miktarını hesaplamaya izin verir.
Adsorpsiyon proseslerinin termodinamiği. - kavram ve türleri. "Adsorpsiyon işlemlerinin termodinamiği" kategorisinin sınıflandırılması ve özellikleri. 2017, 2018.
Bir yüzey üzerinde moleküllerin kendiliğinden konsantrasyonu olarak adsorpsiyona, sistemin entropisinde bir azalma eşlik eder. Sürecin kendiliğindenliğinin kriteri şu olduğundan
∆H - T · ∆S = ∆G< 0,
bu durumda adsorpsiyon yalnızca ∆H'de mümkündür< 0 (экзотермический процесс). Равновесие определяется условием ∆Н = T· ∆S. Sıcaklık arttıkça denge endotermik sürece, yani desorpsiyona doğru kayar.
Katı bir yüzeyde adsorpsiyon
1. Monomoleküler adsorpsiyon.
Langmuir'in teorisine göre adsorban molekülleri adsorbanın yüzeyi ile etkileşime girerek sonuçta monomoleküler bir katman oluşturur. Bu durumda gaz fazından adsorpsiyon sırasında yüzeyin adsorbe edilen madde ile dolma derecesi ()
sıvıdan
burada K denge sabitidir (adsorpsiyon sabiti);
p, adsorbe edilen gazın kısmi basıncıdır;
c adsorbe edilen maddenin konsantrasyonudur.
β'nın p'ye (veya c'ye) bağımlılığı, Şekil 2'deki grafikte (adsorpsiyon izotermi, T = sabit) gösterilmektedir. 1.3.

Pirinç. 1.3. Yüzeyin adsorbe edilen maddeyle dolma derecesi
Düşük konsantrasyonlarda ve kısmi basınçlarda adsorpsiyon, konsantrasyon veya kısmi basınçla orantılıdır:
R<< 1, β ≈ К· R ilis<< 1, β ≈ К· yani izotermin başlangıç bölümü yaklaşık olarak doğrusaldır ve tan α = K (tg α, p (veya c) → 0: veya ) noktasındaki eğrinin eğimi ile belirlenir.
1 g adsorban başına adsorbe edilen maddenin mol sayısı ise; - 1 g adsorban başına adsorbe edilen maddenin mümkün olan maksimum mol sayısı (“tek tabaka kapasitesi”), ardından
β'nın denklem (1.3)'te değiştirilmesi (gaz fazından adsorpsiyon durumunda, konsantrasyon İle denklemlerde basınçla değiştirilmelidir R), şunu elde ederiz:
 (1.6)
(1.6)
Belirli bir adsorban-adsorban çiftindeki ve K sabit olduğundan ( T=const), o zaman bağımlılıkla bulunabilir İLE(Şekil 1.4).

Pirinç. 1.4. Adsorpsiyon denkleminin grafiksel çözümü
deneysel doğrusal bağımlılığın () = 0'a ekstrapolasyonuyla elde edilmiştir; ve o zamandan beri , .
Değer, adsorbanın spesifik yüzey alanını belirlemek için kullanılabilir UD (1 g adsorban başına m2 cinsinden), eğer adsorbanın bir molekülü tarafından yüzeyde kaplanan ω alanı biliniyorsa (molekülün boyutundan belirlenir):
ABD = · ω · Hayır, (1.7)
burada Na, Avogadro sayısıdır (Na = 6,02 10 23).
Buna karşılık, bilinen UD değeri, belirli bir adsorban üzerindeki adsorpsiyonuna dayalı olarak herhangi bir maddenin ω'sini hesaplamak için kullanılabilir.
2. Polimoleküler adsorpsiyon.
Denklem (1.5), doygunluğa sahip bir eğriyi tanımlar; en
p (veya c) → ∞ sınır değerine eşit olma eğilimindedir (Şekil 1.5,a).

Şekil 1.5. Adsorpsiyon izotermleri:
a – doygunlukta adsorpsiyon; b – polimoleküler adsorpsiyon
Ancak bazı durumlarda adsorpsiyon izotermleri Şekil 2'de gösterilenlere benzemektedir. 1.5, b, yani. yüksek p (veya c) değerinde bile sınıra ulaşmaz.
Şekil 2'de gösterilen türün bağımlılıkları. 1.5,b polimoleküler adsorpsiyona karşılık gelir. Kural olarak, bu tür izotermler, güçlü moleküller arası etkileşimlere sahip maddelerin (örneğin su) karakteristiğidir. Adsorbanın yüzeyindeki adsorpsiyon merkezleri işgal edildiğinde (monomoleküler katman doymuş olduğunda), bir sonraki adsorbat moleküllerinin "inişi", halihazırda adsorbe edilmiş moleküllerle moleküller arası etkileşimler nedeniyle meydana gelir (Şekil 1.6). Bu tür bir adsorpsiyonun ısısı mutlak değere yakındır, ancak karşılık gelen sıvının buharlaşma ısısının tersidir (nedenini düşünün).

Şekil 1.6. Adsorpsiyon şeması:
a - monomoleküler adsorpsiyon; b - polimoleküler adsorpsiyon
Yaklaştıkça R Adsorplanan maddenin doymuş buhar basıncına bağlı olarak adsorban yüzeyinde yoğunlaşmaya başlar ve bunun sonucunda artan hızla büyür. R.
İki atom arasındaki etkileşim durumunda:
U – etkileşim enerjisi;
U = U ÖNCEKİ. + U DÖNÜŞ
 - Lennard-Jones denklemi
, c, b, m = sabit
- Lennard-Jones denklemi
, c, b, m = sabit
Atomların katı bir yüzeyle etkileşimi durumunda tüm etkileşimlerin toplanması gerekir.
x – yüzeye olan mesafe
r - çekici kuvvetlerin etki yarıçapı
dV – hacim
n - yüzey moleküllerinin sayısı
U ADS. – adsorpsiyon etkileşiminin enerjisi



Adsorpsiyon durumunda çekim artar. Polar olmayan-polar olmayan etkileşim durumunda adsorpsiyon ağırlıklı olarak girintilerde lokalize olur.
Elektrostatik etkileşim.
Polar adsorban – polar olmayan adsorbat
Polar olmayan adsorban – polar adsorbat
Polar adsorban – polar adsorbat.
M  Adsorbat molekülü bir dipol olarak temsil edilir ve adsorban, adsorbat molekülünün verilene göre simetrik olarak bir dipol aynasını indüklediği bir iletken olarak temsil edilir.
Adsorbat molekülü bir dipol olarak temsil edilir ve adsorban, adsorbat molekülünün verilene göre simetrik olarak bir dipol aynasını indüklediği bir iletken olarak temsil edilir.
X – ortaya olan mesafe
Etkileşim sırasında potansiyel ortaya çıkar:
 ,
,
 - dipol momenti.
- dipol momenti.
Potansiyel maksimum değeri alma eğilimindedir; dipoller kendilerini yüzeye dik olarak yönlendirme eğilimindedir.
Sıcaklıktaki artış Brownian hareketinin büyümesini teşvik ettiğinden adsorpsiyon sürecinin inhibisyonuna yol açar.
Elektrostatik etkileşim durumunda adsorbat ağırlıklı olarak çıkıntılarda lokalize olur.
Temel adsorpsiyon denklemi.
Adsorpsiyon durumunda bileşenin yeniden dağılımı meydana gelir, bu da kimyasal potansiyelin değişmesi anlamına gelir. Adsorpsiyon süreci yüzey enerjisinin kimyasal enerjiye dönüşümü olarak düşünülebilir.
Katman hacmi = 0, bu durumda termodinamiğin I ve II yasalarının genelleştirilmiş denklemi:
T = sabit; (1) = (2) => 

İki bileşenli bir sistem için:
,
 ,
,
 =>
=>
=>
 - Gibbs adsorpsiyon denklemi
.
- Gibbs adsorpsiyon denklemi
.
TV adsorpsiyonu durumunda. vücut - gaz: , 
 ,
,

 - izoterm
- izoterm
 - izobar
- izobar
 - izopiknal
- izopiknal
 - izoster
- izoster
İzoterm, izopikne, izoster birbiriyle ilişkilidir.
Çünkü adsorpsiyon fonksiyonu 



Henry izotermi Langmuir izotermi



Termodinamik. Adsorpsiyon.
Yoğunlaştırılmış madde için:
 ,
,
 ,
,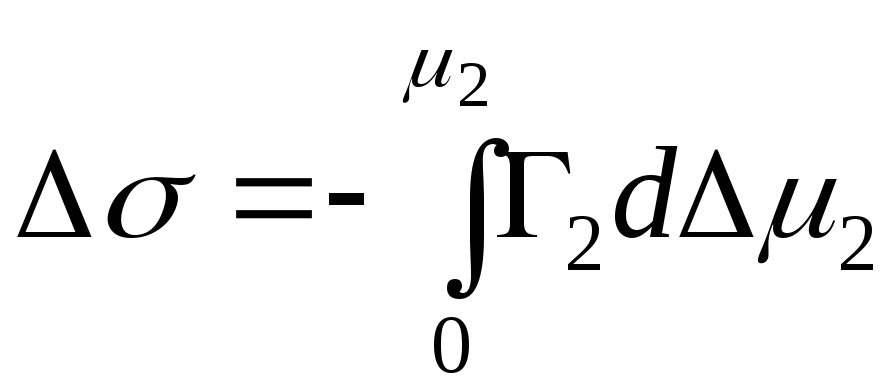
 - Gibbs enerjisindeki integral değişim
.
- Gibbs enerjisindeki integral değişim
.

P – kavisli bir yüzey üzerindeki basınç, Р S – düz bir yüzey üzerindeki basınç
 - adsorpsiyon potansiyeli
- adsorpsiyon potansiyeli
Entrapy'deki farklı değişim 
 , Г = sabit
, Г = sabit
- diferansiyel entropi değişimi
- adsorpsiyonun diferansiyel entalpisi
 - izosterik adsorpsiyon ısısı
- izosterik adsorpsiyon ısısı
 - yoğunlaşma ısısı
- yoğunlaşma ısısı
 - net adsorpsiyon ısısı
- net adsorpsiyon ısısı

 ,
,




Qa – adsorpsiyonun integral ısısı, 
Qra – integral net adsorpsiyon ısısı,

Henry'nin denklemi
Adsorpsiyon çalışması yüzeyin heterojenliği nedeniyle karmaşıklaşır, bu nedenle en basit yasalar homojen yüzeyler için elde edilir.
Bir gaz hacimdeki denge durumundan yüzeydeki denge durumuna geçtiğinde, gazların katı bir yüzeyle etkileşimini ele alalım. Bu durum, yerçekimi alanındaki gazların dengesine benzer.
 ,
,
 ,
=>
,
=> -Henry'nin denklemi
-Henry'nin denklemi
 - dağıtım katsayısı
- dağıtım katsayısı
Adsorpsiyon işlemi sırasında kimyasal potansiyellerde bir değişiklik meydana gelir.
Toplu aşama için: 
Yüzeydeki gaz için: 
Denge halinde  yani
yani

Henry denkleminde sabit konsantrasyona bağlı değildir
Henry denklemi düşük basınç ve konsantrasyon bölgesinde geçerlidir. Konsantrasyon arttıkça Henry yasasından 2 tür sapma mümkündür:
1 – pozitif sapmalar, D azalır, A azalır
2 – negatif sapmalar, D – artar, A – artar.
Sapmanın türü, bir veya başka tür adsorban-adsorbat etkileşiminin baskınlığına göre belirlenir.
Güçlü yapışkan etkileşimi ile aktivite katsayıları artar - pozitif bir sapma. Yapışkan etkileşimler durumunda negatif sapmalar gözlenir.
Monomoleküler adsorpsiyon.
Langmuir izotermi.
En basit modeller Henry'nin teorisinde elde edildi. Langmuir, adsorpsiyonun yarı kimyasal bir reaksiyon olarak kabul edildiği bir teori önerdi. Burada:
Yüzey enerjik olarak homojendir.
Adsorpsiyon lokalizedir, her adsorpsiyon merkezi bir adsorbat molekülü ile etkileşime girer.
Adsorbat molekülleri birbirleriyle etkileşime girmez.
Tek katmanlı adsorpsiyon.

 - yüzey,
- yüzey,  - adsorbat,
- adsorbat,  - adsorpsiyon kompleksi.
- adsorpsiyon kompleksi.
 , daha sonra adsorpsiyon bölgelerinin konsantrasyonu:
, daha sonra adsorpsiyon bölgelerinin konsantrasyonu:  ,
, - adsorpsiyonun sınırlandırılması.
- adsorpsiyonun sınırlandırılması.
 ise reaksiyon sabiti şöyledir:
ise reaksiyon sabiti şöyledir: 

 - Langmuir denklemi.
- Langmuir denklemi.
Adsorpsiyonun konsantrasyona bağımlılığı
1 )
)
 ,
,

2) yüksek konsantrasyonlu alan
 - adsorpsiyonun sınırlanması, monomoleküler bir tabakanın oluşumu
- adsorpsiyonun sınırlanması, monomoleküler bir tabakanın oluşumu
Gibbs enerjisi için: .
g entropi faktörüdür.
Henry izotermi durumunda Gibbs enerjisi, adsorbatın kütledeki standart durumdan yüzeydeki standart duruma geçişini karakterize eder. Langmuir izotermi durumunda  adsorban ve adsorbat arasındaki afinitenin derecesini karakterize eder.
adsorban ve adsorbat arasındaki afinitenin derecesini karakterize eder.
 van't Hoff isobar'dan bulundu.
van't Hoff isobar'dan bulundu.

 , Daha sonra
, Daha sonra  , buradan
, buradan  .
.

 - yüzey doldurma derecesi.
- yüzey doldurma derecesi.




 - boş koltuk sayısı,
- boş koltuk sayısı,  - işgal edilen yerlerin sayısı.
- işgal edilen yerlerin sayısı.
 ,
,

Onlar. yüksek konsantrasyonlu bölgede serbest bölgelerin sayısı adsorbat miktarıyla ters orantılıdır.
Bir gaz karışımının homojen bir yüzey üzerinde adsorpsiyonu.
Bu durumda adsorpsiyon prosesi iki paralel reaksiyon olarak kabul edilir.
 (1)
(1)

 (2)
(2)


Düzgün olmayan bir yüzey üzerinde bir gaz karışımının adsorpsiyonu.
Düzgün olmayan bir yüzey durumunda, kişi kendini ortalama dolgularla sınırlandıramaz.
Rekabetin bir sonucu olarak farklı türdeki alanlarda farklı adsorbatların lokalizasyonu mümkündür.
Bu durumda ilişki  .
.
 ,
,
 - adsorbatın doymuş buhar basıncı.
- adsorbatın doymuş buhar basıncı.
 ,
,
 - adsorpsiyon ısısı.
- adsorpsiyon ısısı.
“+” - simbat bağımlılığı, “-” - antibat bağımlılığı, “N” - korelasyon yok.
“+” - adsorpsiyon aynı mekanizmaya göre ilerler. Enerji açısından en uygun bölgelerde, yüzeye yüksek ilgi gösteren gaz ağırlıklı olarak adsorbe edilir.
“-” - adsorpsiyon çeşitli mekanizmalar yoluyla gerçekleşir ve belirli bir noktaya kadar yüzey için rekabet olmaz.
Monomoleküler adsorpsiyon ağırlıklı olarak gazların düşük değerlerdeki fiziksel adsorpsiyonu sırasında gerçekleşir. P ve ayrıca sıvı/gaz arayüzünde.
Polimoleküler adsorpsiyon.
BAHİS teorisi(Brunauer, Emmett, Teller).
Tek tabaka oluşumunun yüzey enerjisini telafi etmek için yeterli olmadığı durumda adsorpsiyon polimolekülerdir ve yüzey kuvvetlerinin etkisi altında zorlanmış yoğunlaşmanın bir sonucu olarak düşünülebilir.
Anahtar noktaları:
Bir adsorbat molekülü işgal edilmiş bir bölgeye çarptığında çoklu bir set oluşur.
Yaklaştıkça Pİle P S serbest adsorpsiyon bölgelerinin sayısı azalır. Başlangıçta tekler, çiftler vb. kişilerin kapladığı yer sayısı artar ve sonra azalır. setler halinde.
Şu tarihte: P =P S adsorpsiyon yoğunlaşmaya dönüşür.
Yatay etkileşim yoktur.
İlk katman için Langmuir izotermi sağlanmıştır.
Yüzey bir dizi adsorpsiyon bölgesi olarak kabul edilir. Dinamik denge koşulu geçerlidir: Boş yerlerdeki yoğunlaşma hızı, işgal edilen yerlerdeki buharlaşma hızına eşittir.
a yoğunlaşma katsayısıdır (yüzeyde yoğunlaşan moleküllerin fraksiyonu);
 ,
,
Zm – maksimum boş koltuk sayısı.
 - yüzeye dik yönde atomik titreşimlerin frekansı.
- yüzeye dik yönde atomik titreşimlerin frekansı.
İlk katman için dinamik denge koşulları:



 , Daha sonra
, Daha sonra
 - Langmuir denklemi.
- Langmuir denklemi.
İkinci katman için bu doğru olacaktır: 
İ'inci katman için: 
Basitlik açısından, a ve ν'nun birincisi hariç tüm katmanlar için aynı olduğu varsayılmaktadır. Birinci katman dışındaki tüm katmanlar için adsorpsiyon ısısı sabittir. Son katman için adsorpsiyon ısısı yoğunlaşma ısısına eşittir. Sonuç olarak denklem elde edildi
 (*)
(*)
C- devamlı,
BET teorisi durumunda, sabit İLE saf adsorpsiyonun Gibbs enerjisini karakterize eder. Denklem yalnızca bir sabit içerir ve bu denklem adsorbanın spesifik yüzey alanının belirlenmesi için de çok önemlidir.
Adsorpsiyon sonucu ısı açığa çıktığı için düşük sıcaklıklarda spesifik yüzey alanları belirlenir.
 ????????????
????????????


Teorinin ana dezavantajı– dikey etkileşimler lehine yatay etkileşimlerin ihmal edilmesi.
Denklem aralıkta geçerlidir  0,05'ten 0,3'e.
0,05'ten 0,3'e.
Nerede  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0,3 – adsorbat – adsorbat etkileşimi etkilenir.
> 0,3 – adsorbat – adsorbat etkileşimi etkilenir.
Adsorbat-adsorbat etkileşimlerinin muhasebeleştirilmesi.
Etkileşimler, dallanmış moleküller veya moleküller polar olmayan bir yüzey üzerinde adsorbe edildiğinde meydana gelir. Ortaklık kurma yeteneğine sahip. Bu durumda adsorpsiyon izotermlerinin şekli değişir.
A  adsorban polar değildir.
adsorban polar değildir.
Grafik 1, zayıf adsorbat-adsorbat etkileşimlerine ve güçlü adsorbat-adsorban etkileşimlerine karşılık gelir.
Grafik 2 güçlü adsorbat-adsorbat ve güçlü adsorbat-adsorban etkileşimlerine karşılık gelir.
Grafik 3, güçlü adsorbat-adsorbat etkileşimine ve zayıf adsorbat-adsorban etkileşimine karşılık gelir.
 ,
,

Adsorbat molekülleri arasındaki etkileşim durumunda aktivite katsayılarındaki değişikliklerin dikkate alınması gerekir. Ve bu denklem şu şekilde yazılır:
 - Frunkin, Fowler, Guggenheim denklemi.
- Frunkin, Fowler, Guggenheim denklemi.
k– çekim sabiti.
Polyany'nin potansiyel teorisi.
Bu teori herhangi bir adsorpsiyon izotermi türetmez ancak farklı bir sıcaklıkta izotermlerin hesaplanmasını mümkün kılar.
Adsorpsiyon- bu, diğer moleküllerin varlığına bağlı olmayan ve yüzey ile adsorbat molekülü arasındaki mesafeye bağlı olan adsorpsiyon potansiyelinin etkisi nedeniyle adsorbatın adsorbanın yüzeyine çekilmesinin sonucudur.
 ,
,
 - adsorpsiyon potansiyeli.
- adsorpsiyon potansiyeli.
Yüzey düzgün olmadığından mesafenin yerini adsorpsiyon hacmi alır  .Adsorpsiyon hacmi yüzey ile belirli bir değere karşılık gelen nokta arasında kalan hacimdir
.Adsorpsiyon hacmi yüzey ile belirli bir değere karşılık gelen nokta arasında kalan hacimdir  .
.
Adsorpsiyon potansiyeli 1 mol adsorbatın belirli bir adsorpsiyon hacminin dışında adsorpsiyon hacminin belirli bir noktasına aktarılması işidir (veya bir adsorban yokluğunda sıvı adsorbat ile dengede olan bir adsorbatın 1 mol doymuş buharının transfer edilmesi işidir) adsorban ile dengede bir buhar fazına dönüşür).

Karakteristik eğri
 - adsorpsiyon potansiyeli,
- adsorpsiyon potansiyeli, 
Belirli bir adsorban ve çeşitli adsorbatlar için aşağıdakiler doğrudur: 
Farklı adsorbat türleri için  ,
,
Nerede  bağıl basınçlarda adsorpsiyon izotermleri için potansiyeller
bağıl basınçlarda adsorpsiyon izotermleri için potansiyeller  adsorbat 1 ve adsorbat 2 için. Bu oran sabit bir değerdir.
adsorbat 1 ve adsorbat 2 için. Bu oran sabit bir değerdir.
 - afinite katsayısı
- afinite katsayısı
Kılcal yoğunlaşma teorisi.
Adsorpsiyon sürecinin seyri büyük ölçüde gözenekli gövdenin yapısına bağlıdır.
|
Mikro gözenekli | |
|
Geçiş gözenekli | |
|
Büyük gözenekli |
Mikro gözenekli sorbentlerde adsorpsiyon kuvvetlerinin alanları örtüşür. Makro gözenekli sorbentlerde gözenekler taşıma kanalları görevi görür. Yoğuşma süreçleri, geçişli gözenekli gövdelerde en belirgindir. Kılcal yoğuşma belirli değerlerde başlar P Ve  , yüzey enerjisinin bir kısmı zaten telafi edildiğinde. Gerekli bir koşul, yüzeyin kendi kendini ıslatmasıdır. Süreç anlatılıyor Thompson-Kelvin denklemi.
, yüzey enerjisinin bir kısmı zaten telafi edildiğinde. Gerekli bir koşul, yüzeyin kendi kendini ıslatmasıdır. Süreç anlatılıyor Thompson-Kelvin denklemi.

 - Islanma durumunda eğriliğin merkezi gaz fazındadır.
- Islanma durumunda eğriliğin merkezi gaz fazındadır.
Kılcal yoğunlaşma durumunda adsorpsiyon izotermi histeretik bir forma sahiptir. Alt dal adsorpsiyon işlemine, üst dal ise desorpsiyon işlemine karşılık gelir.
Tüm gözenek türleri üç türe indirgenebilir:
|
Konik |
Bir kapalı ucu olan silindirik |
İki açık uçlu silindirik |
|
Proses dolumu gözeneğin alt kısmından gerçekleştirilir. Bu durumda adsorpsiyon izotermi ve desorpsiyon izotermi örtüşür, çünkü adsorpsiyon süreci bir küreden başlar ve desorpsiyon süreci de bazı kürelerin kaybolmasıyla başlar.
↓ |
Histerezis yok. İleri ve geri vuruş aşağıdaki denklemle tanımlanır:
|
Hiçbir yerde dip yok, gözeneklerin doldurulması silindirin duvarları boyunca ilerleyecek.
silindir: İzoterm histeretik bir görünüme sahip olacaktır.
↓ |
İÇİNDE  Islanma koşulları altında, enerji açısından uygun olan daha düşük basınçlarda yoğuşma meydana gelir. Desorpsiyon dalından gözenek boyutu dağılım eğrileri elde edilir.
Islanma koşulları altında, enerji açısından uygun olan daha düşük basınçlarda yoğuşma meydana gelir. Desorpsiyon dalından gözenek boyutu dağılım eğrileri elde edilir.
Diferansiyel eğrinin maksimumu, integral eğrinin bükülme noktasına göre sola kaydırılır. Küçük gözeneklerin toplam hacmi küçüktür ancak geniş yüzey alanlarına sahiptir. Gözenek boyutu arttıkça hacimleri de artar.  ve alan şöyle
ve alan şöyle  bundan dolayı diferansiyel eğrinin maksimumunda bir kayma gözlenir.
bundan dolayı diferansiyel eğrinin maksimumunda bir kayma gözlenir.
Katı-sıvı arayüzünde adsorpsiyon.
Katı-gaz arayüzünde adsorpsiyon durumunda bir bileşeni ihmal ettik. Katı-sıvı ara yüzeyinde adsorpsiyon durumunda, adsorbat, solvent moleküllerini adsorbanın yüzeyinden uzaklaştırır.
 ,
,
Denklem doğrudur:

 ,
,
N 1, N 2 - çözücü ve bileşenin mol kesirleri, N 1 + N 2 = 1, o zaman
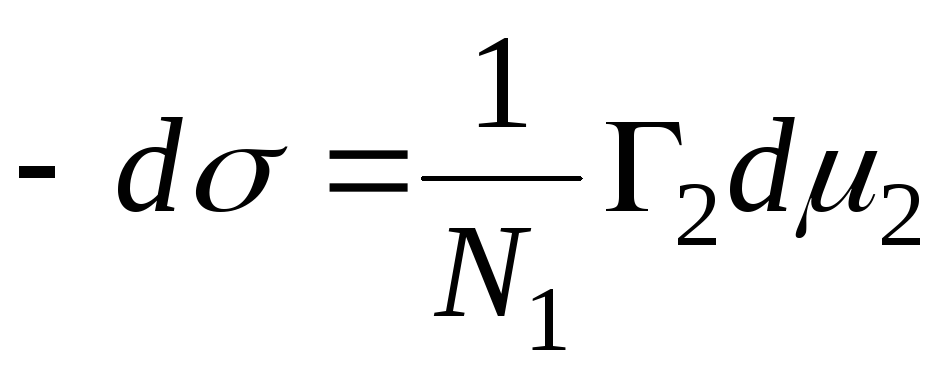 ,
=>
,
=>
 , katı-sıvı arayüzü için adsorpsiyon denklemidir.
, katı-sıvı arayüzü için adsorpsiyon denklemidir.
Adsorpsiyon (G) > 0  <
0
<
0
Eğer değerler  bileşen ve çözücü için çok farklıdır, bu durumda bağımlılık G itibaren N değerde bir ekstremum var N
~ 0,5.
bileşen ve çözücü için çok farklıdır, bu durumda bağımlılık G itibaren N değerde bir ekstremum var N
~ 0,5.
e  eğer
eğer  birbirine yakın değerlere sahip olduğundan bu durumda adsorpsiyonun işareti değişebilir. Bağımlılık G itibaren N x eksenini geçiyor
birbirine yakın değerlere sahip olduğundan bu durumda adsorpsiyonun işareti değişebilir. Bağımlılık G itibaren N x eksenini geçiyor
Fonksiyon kesişme noktası G(N) x ekseni ile denir adsorpsiyon azeotropu. Bu, iki bileşenin belirli bir adsorban üzerinde ayrılamayacağı anlamına gelir.
Adsorpsiyon izoterminin değişim sabiti ile denklemi.
Katı-sıvı ara yüzeyindeki adsorpsiyon sırasında, adsorbanın yüzeyi ile çözeltinin hacmi arasında bileşenlerin sürekli bir yeniden dağılımı meydana gelir.
 - bileşenler (- - yüzeye bakın)
- bileşenler (- - yüzeye bakın)

 ,
,
 ,
, .
.
 ,
,


Sıvı-gaz arayüzünde adsorpsiyon
R  Sıvı-gaz ara yüzeyi geçildiğinde konsantrasyon profilindeki değişimi ele alalım. Bileşen 2'nin uçucu olmasına izin verin.
Sıvı-gaz ara yüzeyi geçildiğinde konsantrasyon profilindeki değişimi ele alalım. Bileşen 2'nin uçucu olmasına izin verin.
Cs – yüzey katmanındaki konsantrasyon.
Aşırı adsorpsiyonun tanımına dayanarak

Bileşen uçucu değilse adsorpsiyon değeri aşağıdaki gibi yazılacaktır:
P  ri
ri 

Denklemde.  Bir maddenin doğası onun türeviyle tanımlanır
Bir maddenin doğası onun türeviyle tanımlanır  .
.
Yüzey gerilimi izotermi 1 veya 2 formunda olabilir:
1 – yüzey aktif maddeler
2 – yüzey aktif maddeler
Yüzey aktivitesi g, maddelerin bir sistemdeki yüzey gerilimini azaltma yeteneğidir.

 - yüzey katmanının kalınlığı
- yüzey katmanının kalınlığı
C S– bileşenin yüzey katmanındaki konsantrasyonu
İLE– hacim konsantrasyonu
Homolog bir seri için bir kural vardır:
 - Traubo Duclos kuralı
- Traubo Duclos kuralı
Homolog bir seri için adsorpsiyon izotermi şöyle görünür:
Yüzey katmanında adsorpsiyon fazla olduğundan A yerine G yazıyoruz.
Yüzey gerilimi izotermi:

 - saf bir çözücünün yüzey gerilimi.
- saf bir çözücünün yüzey gerilimi.
 - temel adsorpsiyon denklemi;
- temel adsorpsiyon denklemi;
 - Langmuir denklemi.
- Langmuir denklemi.
Gelin bunları birlikte çözelim:

- Shishkovsky denklemi.
B– homolog seriler için sabit.
A- bir homologdan diğerine geçerken 3-3,5 kat artar 
![]()
1 – düşük konsantrasyonlu alan
![]()
2 – ortalama konsantrasyon
3 – monomoleküler katman
Yüzey aktif maddeler difilik moleküllerdir, yani. bir polar grup ve bir polar olmayan hidrokarbon radikali içerir.
o molekülün polar kısmıdır.
| - molekülün polar olmayan kısmı.
Polar bir çözücüde, yüzey aktif madde molekülleri, molekülün polar kısmı çözücüye bakacak ve polar olmayan kısmı gaz fazına itilecek şekilde yönlendirilir.
Shishkovsky'nin denkleminde  homolojik seriler için sabittir.
homolojik seriler için sabittir.
Yüzey aktif madde etkisi şu şekilde ortaya çıkmaya başlar: N>5. Monomoleküler tabakanın konsantrasyonundan daha yüksek konsantrasyonlarda, yüzey aktif madde çözeltilerinde miselleşme meydana gelir.
Misel- hidrokarbon radikalleri bir çekirdek oluşturan ve polar grupları sulu faza dönüştürülen amfifilik yüzey aktif madde moleküllerinin toplamı olarak adlandırılır.
Misel kütlesi – misel kütlesi.
H  molekül sayısı – toplanma sayısı.
molekül sayısı – toplanma sayısı.
Küresel miseller
Miselleşme durumunda çözeltide denge sağlanır
CMC – misel oluşumunun kritik konsantrasyonu.
Miselin ayrı bir aşama olduğunu düşündüğümüz için:
Homolojik bir seri için ampirik bir denklem vardır:
A– fonksiyonel grubun çözünme enerjisi.
B – adsorpsiyon potansiyelinin arttırılması, metilen birimi başına adsorpsiyon işi.
– adsorpsiyon potansiyelinin arttırılması, metilen birimi başına adsorpsiyon işi.
Misellerde bir hidrokarbon çekirdeğinin varlığı, suda çözünmeyen bileşiklerin yüzey aktif maddelerin sulu çözeltilerinde çözünmesi fırsatını yaratır; bu olaya çözünme denir (çözünen çözündürücüdür, yüzey aktif madde çözündürücüdür).
Çamur tamamen polar olmayabilir, hem polar hem de polar olmayan kısımlar içerebilir ve bir yüzey aktif madde molekülü gibi yönlendirilecektir.
Her durumda, çözündürme sırasında misel kütlesinde ve toplanma sayısında, yalnızca çözündürücünün dahil edilmesine bağlı olarak değil, aynı zamanda bir denge durumunu korumak için gerekli yüzey aktif madde moleküllerinin sayısındaki artışa bağlı olarak da bir artış olur.
Çözündürmenin moleküler ağırlığı ne kadar düşük olursa, çözündürme o kadar etkilidir.

 ~ 72 mN\m.
~ 72 mN\m.
 ~ 33 mN\m.
~ 33 mN\m.
Yüzey aktif maddelerin etkinliği CMC değerine bağlıdır.
2D Yüzey Katmanı Basıncı

→ -yüzey gerilim kuvvetleri.
- iki boyutlu basınç.
Yüzey tabakası, temiz bir yüzeye doğru yönlendirilen bir yüzey aktif madde çözeltisi ile saf bir çözücünün yüzey gerilimi farkına eşit bir kuvvettir.
Çözelti ile yüzey katmanı arasında bir denge kurulur



Şu tarihte:  bir alan var
bir alan var  konsantrasyona doğrusal olarak bağlıdır.
konsantrasyona doğrusal olarak bağlıdır.
G [mol/m2].
 -Bir mol maddenin kapladığı alan
-Bir mol maddenin kapladığı alan
O zaman iki boyutlu basınç izotermi şu şekle sahip olacaktır: 
 - iki boyutlu basınç izotermi.
- iki boyutlu basınç izotermi.
Bağımlılık  S M'den:
S M'den:

Şu tarihte:  - iki boyutlu basınç keskin bir şekilde artar. Şu tarihte:
- iki boyutlu basınç keskin bir şekilde artar. Şu tarihte:  iki boyutlu deforme olup ani büyümeye neden olur
iki boyutlu deforme olup ani büyümeye neden olur  .
.
Her iki tarafı da aynı fazlarla sınırlanmış bir filme çift taraflı denir. Bu tür filmlerde ana likörün sürekli hareketi gözlemlenir.
Kalınlığı 5 nm'den az olan filmlere siyah film denir.

Adsorpsiyon katmanlarının iki özelliği olmalıdır: viskozite ve kolay hareket etme, akışkanlık ve esneklik.
Marangoni etkisi kendi kendini iyileştirir.
Gibbs üçgeni,  - aşırı basınç.
- aşırı basınç.
Film gerildi ve sıvının bir kısmının kalması nedeniyle yüzey aktif maddeler boş alana akıyor. Gibbs üçgeni.
Cisimlerin adsorpsiyon kuvvetinin etkisi.
Filmin yüzeyinde her zaman bir adsorpsiyon katmanı bulunur ve bu katman için
Langmuir denklemi:


 iki boyutlu basınca
iki boyutlu basınca
 - Shishkovsky denkleminin bir benzeri
- Shishkovsky denkleminin bir benzeri
Elektrokinetik olaylar. Elektrikli çift katman (EDL).
Gelemholtz modeli. Gouy-Chapman teorisi.
1808 Uçuş

sen – şeklindeki tüpün içine 2 elektrot daldırın. İletişim kuran kapların kanunu ihlal edilir ve tüpteki sıvı seviyesinde bir değişiklik meydana gelir - elektrokinetik fenomen.
Kinetik olaylar:
Elektroforez
Elektroosmoz
Akış (akış) potansiyeli
Sedimantasyon potansiyeli
1 ve 2, potansiyel bir fark uygulandığında ortaya çıkar; 3 ve 4, koloidal parçacıkların delinmesi ve çökelmesi, potansiyel bir farkın ortaya çıkmasına neden olur.
Elektroosmoz bir elektrik akımının etkisi altında bir dağılım ortamının sabit bir dağılmış faza göre hareketidir.
Elektroforez – bu, bir elektrik akımının etkisi altında dağılmış faz parçacıklarının sabit bir dağılım ortamına göre hareketidir.
P  Elektrokinetik olayların ortaya çıkmasının nedeni, yüklerin mekansal olarak ayrılması ve çift elektriksel katmanın ortaya çıkmasıdır.
Elektrokinetik olayların ortaya çıkmasının nedeni, yüklerin mekansal olarak ayrılması ve çift elektriksel katmanın ortaya çıkmasıdır.
Elektrikli çift katman düz bir kapasitördür; bir plaka potansiyel belirleyici iyonlardan, diğeri ise karşı iyonlardan oluşur. İyonlar, potansiyel belirleyici ortak iyonların çözeltinin hacmine itilmesiyle aynı şekilde kirlenir. Plakalar arasındaki mesafe  . Potansiyel doğrusal olarak düşer, potansiyel fark
. Potansiyel doğrusal olarak düşer, potansiyel fark  .
.
Dış potansiyel farkı kayma modülünün ortaya çıkmasına neden olur  katı bir cismin yüzeyi boyunca birim alan başına etki eden kuvvet çiftidir.
katı bir cismin yüzeyi boyunca birim alan başına etki eden kuvvet çiftidir.

Dengede, kayma modülü viskoz sürtünme modülüne eşittir (  ).
).

bizim koşullarımızda  ,
,

 - Gelemholtz-Smalukowski denklemi
- Gelemholtz-Smalukowski denklemi
 - faz yer değiştirmesinin doğrusal hızı.
- faz yer değiştirmesinin doğrusal hızı.
e– elektrik alan kuvveti.
 - plakalar arasındaki potansiyel fark
- plakalar arasındaki potansiyel fark
 - elektroforetik hareketlilik [m2 /(V*s)].
- elektroforetik hareketlilik [m2 /(V*s)].
Helemholtz modeli moleküllerin termal hareketini hesaba katmaz. Gerçekte iyonların çift katmandaki dağılımı daha karmaşıktır.
Gui ve Chapman DES'in aşağıdaki nedenlerini belirledi:
Denge kurulduğunda iyonun bir fazdan diğerine geçişi.
Katı fazdaki maddenin iyonlaşması.
Dispersiyon ortamında mevcut iyonlarla yüzeyin tamamlanması.
Harici bir akım kaynağından polarizasyon.
Elektriksel çift katman bulanık veya dağınık bir yapıya sahiptir. İyonlar dağınık katman boyunca eşit şekilde dağılma eğilimindedir.
Dağınık katman karşıt iyonlardan oluşur; katmanın uzunluğu kinetik enerjilerine göre belirlenir. Mutlak sıfıra yaklaşan sıcaklıklarda, karşı iyonlar potansiyel belirleyici iyonlara mümkün olduğunca yakındır.
Danya'nın teorisi iki denkleme dayanmaktadır:
Boltzmann denklemi

 - elektrostatik etkileşim kuvvetlerine karşı çalışın.
- elektrostatik etkileşim kuvvetlerine karşı çalışın.
 - hacimsel yük yoğunluğu.
- hacimsel yük yoğunluğu.

Poisson denklemi 
EDL'nin kalınlığı parçacık boyutundan çok daha küçük olduğundan ve düz bir EDL için koordinatlara göre türev  Ve
Ve  kaldırıldı.
kaldırıldı. 
e y için y'de<<1 функцию можно разложить в ряд Маклорена:

O halde kendimizi serinin iki terimiyle sınırlayalım:


 - DEL kalınlığı DEL potansiyelinin azaldığı mesafedir. e bir kere.
- DEL kalınlığı DEL potansiyelinin azaldığı mesafedir. e bir kere.
Sıcaklık ne kadar düşük olursa o kadar az olur  . T→0'da – düz DEL. Konsantrasyon ne kadar yüksek olursa, o kadar çok ben, o kadar az
. T→0'da – düz DEL. Konsantrasyon ne kadar yüksek olursa, o kadar çok ben, o kadar az  .
.





 “-” potansiyelin mesafeyle azaldığı anlamına gelir. =>
“-” potansiyelin mesafeyle azaldığı anlamına gelir. =>
=>

 ,
,
 - potansiyel katlanarak azalır.
- potansiyel katlanarak azalır.
Yüzey yük yoğunluğu potansiyeli: 
Yüzey yükü, ters işaretli, mesafeye göre entegre edilmiş bir hacim yüküdür.




=>


Potansiyelin 2,7 kat azaldığı yerde - 
Çift katmanlı kapasite 
Teorinin dezavantajı Helemholtz katmanının varlığının dikkate alınmamasıdır. dikkate almıyor  , dolayısıyla ana parametrelerin belirlenmesindeki hatalar. Aynı zamanda farklı doğadaki iyonların elektriksel çift tabakanın kalınlığı üzerindeki etkisini de açıklamıyor.
, dolayısıyla ana parametrelerin belirlenmesindeki hatalar. Aynı zamanda farklı doğadaki iyonların elektriksel çift tabakanın kalınlığı üzerindeki etkisini de açıklamıyor.
Stern'ün teorisi. Kolloidal bir miselin yapısı.
Elektrikli çift katman iki bölümden oluşur: yoğun ve dağınık. Potansiyel oluşturan iyonların spesifik olarak adsorbe edilmiş iyonlarla etkileşimi sonucu yoğun bir katman oluşur. Bu iyonlar, kural olarak, kısmen veya tamamen susuzdur ve potansiyeli belirleyen iyonlarla aynı veya zıt yüke sahip olabilirler. Elektrostatik etkileşim enerjisinin oranına bağlıdır  ve spesifik adsorpsiyon potansiyeli
ve spesifik adsorpsiyon potansiyeli  . Yoğun katman iyonları sabittir. İyonların diğer kısmı dağınık tabakada bulunur; bu iyonlar serbesttir ve çözeltinin derinliklerine doğru hareket edebilirler. Daha yüksek konsantrasyonlu bir alandan daha düşük konsantrasyonlu bir alana. Toplam yük yoğunluğu iki bölümden oluşur.
. Yoğun katman iyonları sabittir. İyonların diğer kısmı dağınık tabakada bulunur; bu iyonlar serbesttir ve çözeltinin derinliklerine doğru hareket edebilirler. Daha yüksek konsantrasyonlu bir alandan daha düşük konsantrasyonlu bir alana. Toplam yük yoğunluğu iki bölümden oluşur.

 Helmholtz katmanının yükü
Helmholtz katmanının yükü
 -Yaygın katman yükü
-Yaygın katman yükü
Yüzeyde her biri bir karşı iyonla etkileşime giren belirli sayıda adsorpsiyon merkezi vardır. Böyle bir yarı kimyasal reaksiyonun sabiti şuna eşittir:

 , Nerede
, Nerede  - çözeltideki karşı iyonların mol kesri
- çözeltideki karşı iyonların mol kesri
Helmholtz dağılımı
Potansiyel doğrusal olarak azalır
Gouy potansiyel dağılımı. Yoğun bir katman yoktur, potansiyel değerden katlanarak azalır 
Kıç dağılımı.
Başlangıçta potansiyel azalma doğrusaldır ve daha sonra üsteldir.
Elektroforez durumunda bir elektrik alanı uygulandığında, doğrudan hareket eden katı fazın parçacığı değil, onu çevreleyen bir iyon tabakasıyla birlikte katı fazın parçacığıdır. DES, dağılmış faz partikülünün şeklini tekrarlar. Bir potansiyel uygulandığında dağınık katmanın bir kısmı yırtılır. Kırılma çizgisi denir kayan sınır.
Yaygın tabakanın bir kısmının ayrılması sonucu kayma sınırında ortaya çıkan potansiyele denir. elektrokinetik potansiyel(Zeta potansiyeli  ).
).
Etrafını saran karşıt iyon katmanı ve çift elektriksel katmana sahip dağılmış faz parçacığına denir. misel.
Kolloidal miseller yazma kuralları:


1-1 şarj elektroliti
T – dağılmış faz partikülü.
AA yoğun ve dağınık kısımlar arasındaki sınırdır.
BB – kayan sınır.
Kayan sınır AA çizgisiyle çakışabilir veya çakışmayabilir.
Zeta potansiyelinin sıfır olduğu pH değerine denir. izoelektrik nokta.
CaCl2 + Na2S04 → CaS04 ↓ + 2NaCl
1. Fazla CaCl 2
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaS04 4 m∙nCa 2+ 2( n - x)Cl-) 2 X + X Cl - - misel gösterimi.
CaSO 4 m – agrega.
CaSO 4 m∙nCa 2+ – çekirdek.
CaSO 4 m∙nCa 2+ 2( n - x)Cl - - parçacığı.
2. Fazla Na 2 SO 4
Na 2 SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - misel
CaSO 4 m – agrega.
CaSO 4 m∙nSO 4 2 + – çekirdek.
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - parçacık
Gelemholtz-Smoluchowski denklemi

 - sınır yer değiştirmesinin doğrusal hızı (elektroosmozda).
- sınır yer değiştirmesinin doğrusal hızı (elektroosmozda).
 - kapasitör plakaları arasındaki potansiyel fark (elektroosmozda).
- kapasitör plakaları arasındaki potansiyel fark (elektroosmozda).


 - çözeltinin hacimsel akış hızı, S– hücrenin kesit alanı.
- çözeltinin hacimsel akış hızı, S– hücrenin kesit alanı.

e– elektrik alan kuvveti.


 (elektroosmoz için).
(elektroosmoz için).
Akış potansiyeli için:

 - potansiyel
- potansiyel
 - membran üzerindeki basınç
- membran üzerindeki basınç
Kural olarak, elektroforetik hareketliliklerin ve elektroozmotik hareketliliklerin değerleri hesaplananlardan daha azdır. Bunun nedeni şudur:
Gevşeme etkisi (dağınık fazlı bir parçacık hareket ettiğinde iyonik atmosferin simetrisi bozulur).
Elektroforetik inhibisyon (karşı iyonların hareketinin bir sonucu olarak ek sürtünmenin ortaya çıkması).
Elektriksel olarak iletken parçacıklar durumunda akım hatlarının bozulması.
Yüzey gerilimi ve potansiyel arasındaki ilişki. Lippmann denklemi.
EDL'nin oluşumu sistemin yüzey enerjisini azaltma isteği nedeniyle kendiliğinden meydana gelir. Sürekli koşullar altında T Ve P termodinamiğin birinci ve ikinci yasalarının genelleştirilmiş denklemi şöyle görünür:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1. Lippmann denklemi.
- 1. Lippmann denklemi.
 - yüzey yük yoğunluğu.
- yüzey yük yoğunluğu.
 - diferansiyel kapasitans.
- diferansiyel kapasitans.
 - 2. Lippmann denklemi.
- 2. Lippmann denklemi.
İLE- kapasite.
1. Lippmann denklemini ve temel adsorpsiyon denklemini çözelim:
 ,
,


 , Daha sonra
, Daha sonra
 - Nernst denklemi
- Nernst denklemi
 ,
,
 ,
,




 - elektrokapiler eğrinin denklemi (ECC).
- elektrokapiler eğrinin denklemi (ECC).
İÇİNDE  :
: , Ancak
, Ancak 
Katyonik yüzey aktif maddeler (CPAS), EKC'nin katodik dalını azaltır.
Anyonik yüzey aktif maddeler (APS), EKC'nin anodik dalını azaltır.
İyonik olmayan yüzey aktif maddeler (NSAS) ECC'nin orta kısmını azaltır.
Dağınık sistemlerin kararlılığı. Ayrıştırıcı basınç.
Dağınık sistemler ayrılabilir:
Termodinamik olarak kararsız olan sistemler, yarı kararlı duruma geçiş nedeniyle kinetik olarak kararlı olabilir.
İki tür kararlılık vardır:
Sedimantasyon stabilitesi (yer çekimine göre).
Toplu kararlılık. (yapışmayla ilgili)
Pıhtılaşma toplanma stabilitesinin kaybına yol açan bir parçacık yapışma işlemidir. Pıhtılaşmaya sıcaklık değişiklikleri, pH, karıştırma ve ultrason neden olabilir.
Pıhtılaşma ayırt edilir:
Geri dönüşümlü.
Geri döndürülemez.
Elektrolitlerin eklenmesiyle pıhtılaşma meydana gelir.
Pıhtılaşma kuralları:

Film- sistemin iki arayüz yüzeyi arasında bulunan kısmıdır.
Ayrık basınç yaklaşan yüzey katmanlarının etkileşimi sonucu film kalınlığının keskin bir şekilde azalmasıyla ortaya çıkar.

“-” - film kalınlığı azaldıkça ayrılma basıncı artar.
P 0, ara katmanın devamı olan yığın fazındaki basınçtır.
P 1 – filmdeki basınç.
Kararlılık teorisi. DLFO (Deryagin, Landau, Fairway, Overbeck).
DLFO teorisine göre ayrışan basıncın iki bileşeni vardır:
Elektrostatik PE (pozitif, elektrostatik itme kuvvetlerinden kaynaklanmaktadır). Film kalınlığının artmasıyla Gibbs enerjisindeki azalmaya karşılık gelir.
Moleküler P M (çekici kuvvetlerin etkisi nedeniyle negatif). Kimyasal yüzey kuvvetleri nedeniyle film sıkışmasından kaynaklanır; kuvvetlerin etki yarıçapı nm'nin onda biri kadardır ve enerji yaklaşık 400 kJ/mol'dür.
Toplam etkileşim enerjisi:

 - sistem toplu olarak kararlıdır
- sistem toplu olarak kararlıdır
 - kararsız sistem
- kararsız sistem
P  pozitif bileşen.
pozitif bileşen.
Artış, ince filmler sıkıştırıldığında potansiyel enerjideki artıştan kaynaklanmaktadır. Büyük kalınlıktaki filmler için fazla iyon enerjisi telafi edilir ve dispersiyon ortamının hacmindeki enerji etkileşimine eşittir.
Eğer  (
( - film kalınlığı,
- film kalınlığı,  - iyon yarıçapı) filmin incelmesi, içinde minimum yüzey enerjisi olan moleküllerin ve iyonların kaybolmasına ve azalmasına yol açar. Komşu parçacıkların sayısı azalır, bunun sonucunda filmde kalan parçacıkların potansiyel enerjisi artar.
- iyon yarıçapı) filmin incelmesi, içinde minimum yüzey enerjisi olan moleküllerin ve iyonların kaybolmasına ve azalmasına yol açar. Komşu parçacıkların sayısı azalır, bunun sonucunda filmde kalan parçacıkların potansiyel enerjisi artar.


DLVO teorisi parçacıkların etkileşimini plakaların etkileşimi olarak kabul eder.

Parçacıklar etkileşime girmez



 - Laplace denklemi,
- Laplace denklemi,  ,
,


Zayıf yüklü yüzeyler için
Yüksek yüklü yüzeyler için:

Moleküler bileşen iki atomun etkileşimidir:
 ~
~
Bir atomun bir yüzeyle etkileşimi:

İki kayıt alalım:
D  Moleküler bileşeni elde etmek için sağ ve sol plakalardaki atomların tüm etkileşim enerjilerini toplamak gerekir.
Moleküler bileşeni elde etmek için sağ ve sol plakalardaki atomların tüm etkileşim enerjilerini toplamak gerekir.
Nerede  - Hamaker sabiti (etkileşim halindeki cisimlerin doğasını dikkate alır).
- Hamaker sabiti (etkileşim halindeki cisimlerin doğasını dikkate alır).
O. Bir sistemdeki parçacıkların etkileşim enerjisi potansiyel eğriler kullanılarak ifade edilebilir.
I – birincil potansiyel minimum. Burası geri dönüşü olmayan bir pıhtılaşma bölgesidir, çekim kuvvetleri hakimdir.
II – toplu istikrar bölgesi, itici güçler hakimdir.
III - ikincil potansiyel minimum (veya topaklanma bölgesi). Dağınık fazın parçacıkları arasında bir elektrolit tabakası vardır ve parçacıklar ayrılabilir ve toplanma stabilitesi bölgesine aktarılabilir.

Eğri 1 – sistem toplu olarak kararlıdır.
Eğri 2 – Bölge I'de stabil, Bölge II'de kararsız.
Eğri 3 – sistemde pıhtılaşma meydana geldi.
Eğri 4 – 4. noktada toplam etkileşim enerjisi U=0,  Bu uç nokta hızlı pıhtılaşmanın başlangıcına karşılık gelir.
Bu uç nokta hızlı pıhtılaşmanın başlangıcına karşılık gelir.
İki durum var:
1. Hafif yüklü yüzeyler:
U = U E + U M = 0
 (1)
(1)
2)

 (2)
(2)



 - bu, pıhtılaşma işleminin başlangıcına karşılık gelen tabakanın kalınlığıdır.
- bu, pıhtılaşma işleminin başlangıcına karşılık gelen tabakanın kalınlığıdır.






 - zayıf yüklü yüzeyler için
- zayıf yüklü yüzeyler için
 Daha sonra
Daha sonra 
2. Yüksek yüklü yüzeyler için:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
(3)'ün karesini alalım

Pıhtılaşma:
Spesifik adsorpsiyonda iyonlar, yüzeyin yükünü değiştirebilecek şekilde süper eşdeğer miktarlarda adsorbe edilebilir. Yüzey yeniden şarj edilir.
Spesifik adsorpsiyon durumunda, yalnızca zıt işaretli iyonlar değil, aynı işaretli iyonlar da adsorbe edilebilir.
Yüzey ile aynı işarete sahip iyonlar adsorbe edilirse, yüzey katmanında potansiyelde bir düşüş değil, artış olacaktır.

Nötralizasyon pıhtılaşması (zayıf yüklü parçacıkların katılımıyla oluşur ve yalnızca elektrolit pıhtılaştırıcının yüküne değil, aynı zamanda yoğun ve dağınık katmanların sınırındaki potansiyele de bağlıdır).
Smoluchowski'nin hızlı pıhtılaşma teorisi.

Pıhtılaşma hızının elektrolit konsantrasyonuna bağımlılığı.
I – pıhtılaşma oranı düşük,
II – pıhtılaşma hızı elektrolit konsantrasyonuyla neredeyse orantılıdır.
III – hızlı pıhtılaşma bölgesi, hız pratik olarak konsantrasyondan bağımsızdır.
Temel hükümler:
Başlangıçtaki sol tek dağılımlıdır, benzer parçacıklar küresel bir şekle sahiptir.
Tüm parçacık çarpışmaları etkilidir.
İki birincil parçacık çarpıştığında ikincil bir parçacık oluşur. İkincil + birincil = üçüncül. Birincil, ikincil, üçüncül – çokluk.
Kimyasal kinetik açısından pıhtılaşma süreci aşağıdaki denklemle açıklanabilir:
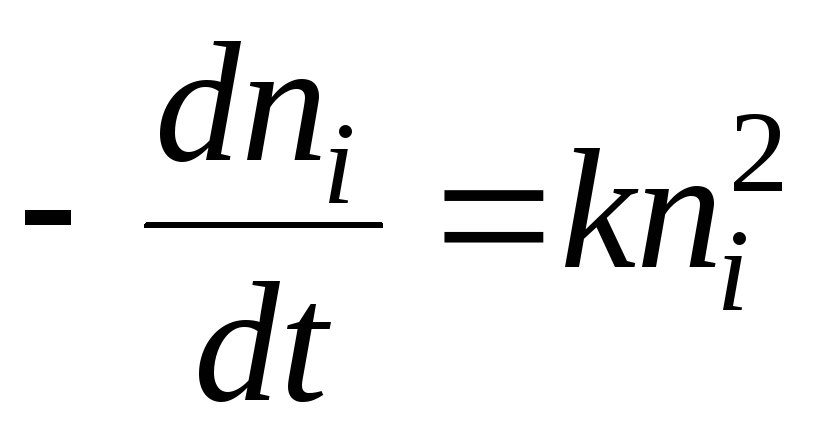
Çözüm şu denklem olacaktır: 
 - yarı pıhtılaşma süresi. Bu, sol parçacıklarının sayısının 2 kat azaldığı zamandır.
- yarı pıhtılaşma süresi. Bu, sol parçacıklarının sayısının 2 kat azaldığı zamandır.

 ,
,
 ,
,
 ,
,


Çokluk arttıkça pıhtılaşma eğrilerinin maksimumu daha büyük değerlere doğru kayar  .
.
Kusurlar:
Monodispersite varsayımı.
Tüm çarpışmaların etkinliğine ilişkin varsayım.




 - küre,
- küre, ,
,





