Adsorpcija se odvija na interfejsu. Stoga je razumno smatrati termodinamički opis površinskih pojava kao poseban slučaj termodinamike heterogenih sistema.
Rice. 3.4. Gibbsova adsorpcija: 1- dvofazni sistem poređenja, 2- pravi dvofazni sistem sa neujednačenim područjem
U termodinamici heterogenih sistema se koristi princip aditivnostišto je kako slijedi: sva ekstenzivna svojstva heterogenog sistema jednaka su zbiru odgovarajućih ekstenzivnih svojstava koje bi faze imale prije nego što su došle u kontakt. Označimo faze sa α i β (slika 4). Tada za idealan sistem, takav da se svojstva faza u blizini interfejsa poklapaju sa njihovim zapreminskim svojstvima, važe sledeće relacije za unutrašnju energiju U, zapreminu V, masu (broj molova) n, entropiju S nakon uspostavljanja ravnoteže u heterogeni sistem:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
Ovo pretpostavlja da su temperatura i pritisak u obe faze isti.
Za realne heterogene sisteme, prelazna oblast na granici dve faze daje dodatni doprinos ekstenzivnim svojstvima sistema. Ako se pojave površinski fenomeni, treba uzeti u obzir razliku između ekstenzivnih svojstava realnog heterogenog sistema i ekstenzivnih svojstava modela sistema u kojem površinske pojave izostaju. Takav sistem se zove sistem poređenja. Sistem poređenja ima iste intenzivne parametre (T, P, C i ...) i isti volumen V kao i realni sistem (slika 4).
Sa termodinamičke tačke gledišta, adsorpciona vrednost G se shvata kao višak količine supstance n s, izražen u molovima ili gramima, koji pravi heterogeni sistem ima u poređenju sa referentnim sistemom, koji se odnosi na površinu interfejsa ili na površinu adsorbenta A. Pretpostavlja se da sistem poređenja ima iste intenzivne parametre (T, P, C i), i istu zapreminu (V = V α + V β) kao i pravi sistem (slika 4) .
G = (n - n α - n β)/A = n s /A 3.11
Višak termodinamičkih funkcija prelaznog područja realnog sistema (označavamo ih indeksom s) mogu se zapisati kao
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S β itd.
Eksperimentalna mjerenja adsorpcije uvijek daju adsorpciju upravo kao višak komponente u stvarnom sistemu u odnosu na odabrani referentni sistem. Na primjer, kod adsorpcije plina na čvrstom adsorbentu ili kod adsorpcije komponenti na čvrstoj fazi, da bi se pronašle vrijednosti adsorpcije, odredite promjenu početnih koncentracija adsorbata nakon kontakta faza α i β
n i s = V(C i o - C i),
Gdje C i o– početna koncentracija i-te komponente, C i– koncentracija i-te komponente nakon uspostavljanja ravnoteže između faza u kontaktu. Vjeruje se da je volumen V se ne mijenja. Međutim, koncentracija i th komponenta C i, dobijen eksperimentalno, određuje se zapreminom V' iznad fazne granice bez uzimanja u obzir zapremine nehomogenog regiona prelaznog sloja V α na granici gdje je koncentracija C i α. Dakle, zbog postojanja neujednačenog područja u realnom sistemu, ukupni volumen sistema se može predstaviti kao V = V’ + Vα. Sva količina i-th komponenta C i oće biti raspoređena između ova dva toma:
V C i o = V’ C i + V α C i α ,
i broj molova komponente i, adsorbovana na interfejsu, biće jednaka
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (C i α – C i) 3.12
One. eksperimentalno određena adsorpcija je višak i-te komponente u zapremini V α u poređenju sa količinom ove komponente u istoj zapremini daleko od međufazne granice. Ova vrsta adsorpcije naziva se Gibbsova adsorpcija. .
V α C i α naziva kompletnim sadržajem ja- komponenta u adsorpcionom sloju. U području vrlo niskih koncentracija C i u zapremini V' amandman V α C i jednadžba (3.2) se može zanemariti i izmjerena vrijednost se može uzeti u obzir V α C i α pun sadržaj ja- komponenta u adsorpcionom sloju, na primer, tokom adsorpcije gasa na čvrstom adsorbentu pri niskim pritiscima.
Termodinamika adsorpcionih procesa.
| Naziv parametra | Značenje |
| Tema članka: | Termodinamika adsorpcionih procesa. |
| Rubrika (tematska kategorija) | Obrazovanje |
Osnovne definicije i metode klasifikacije procesa adsorpcije.
Adsorpcija se odnosi na pojave koje nastaju zbog spontanog smanjenja površinske energije.
Adsorpcija– proces spontane reverzibilne ili ireverzibilne preraspodjele komponenti heterogenog sistema između površinskog sloja i zapremine homogene faze.
U višekomponentnim sistemima, komponenta koja jače smanjuje međufaznu napetost poželjno se prenosi na površinski sloj. U jednokomponentnim sistemima prilikom formiranja površinskog sloja dolazi do promjene njegove strukture (određena orijentacija atoma i molekula, polarizacija), tzv. autoadsorpcija.
Gušća faza na kojoj se lokaliziraju adsorpcijske interakcije naziva se adsorbent. Tvar preraspodijeljena između volumena homogene faze i površinskog sloja označava se pojmom ʼʼ adsorbatʼʼ.
U nekim slučajevima, proces adsorpcije je reverzibilan. U tom slučaju, pod određenim uvjetima, dio adsorbiranih molekula kao rezultat molekularno kinetičkih pojava može se kretati iz površinskog sloja u masivnu fazu. Obrnuti proces adsorpcije se naziva desorpcija.
Metode za klasifikaciju procesa adsorpcije.
Klasifikacija procesa adsorpcije prema stanju agregacije interakcijskih faza. Uzimajući u obzir ovisnost o agregatnom stanju susjednih faza, razlikuju se sljedeće vrste procesa adsorpcije:
Adsorpcija plinova na čvrstim adsorbentima;
Adsorpcija otopljenih supstanci na granicama “čvrsta-tečnost” i “tečnost-tečnost”;
Adsorpcija surfaktanata na granici tečnost-gas.
Klasifikacija procesa adsorpcije prema mehanizmu interakcije između adsorbenta i adsorbata. Adsorpcija se može posmatrati kao interakcija molekula adsorbata sa aktivnim centrima adsorbenta. Prema mehanizmu njihove interakcije, dijele se sljedeće vrste adsorpcije:
1) fizička (molekularna) adsorpcija– interakcija između molekula adsorbata i adsorbenta se odvija zahvaljujući van der Waalsovim silama, vodikovim vezama (bez hemijskih reakcija);
2) hemijska adsorpcija (kemisorpcija)– vezivanje molekula adsorbata za aktivne centre adsorbenta nastaje kao rezultat hemijskih reakcija različitih vrsta (sa izuzetkom reakcija jonske izmene);
3) adsorpcija jonske izmene (jonska razmena) – preraspodela adsorbatne supstance između rastvora i čvrste faze (jonski izmenjivač) prema mehanizmu reakcija jonske razmene.
Za kvantitativno opisivanje procesa adsorpcije koriste se dvije veličine.
1) Apsolutna adsorpcija– količinu (mol) ili masu (kg) adsorbata po jedinici površine ili masi adsorbenta. Oznaka – A; dimenzija: mol/m2, mol/kg, kg/m2, kg/kᴦ.
2) Gibbsova (višak) adsorpcija– višak adsorbatne supstance u površinskom sloju određene debljine u odnosu na njenu količinu u zapremini homogene faze, po jedinici površine ili masi adsorbenta. Oznaka – G; dimenzija: mol/m 2, mol/kᴦ.
Odnos između apsolutne i viška adsorpcije može se ilustrirati pomoću jednačine:
G = A – s * h (3.1)
gdje je c ravnotežna koncentracija tvari u volumenu faze, mol/m3;
h je debljina površinskog sloja, za koju se konvencionalno pretpostavlja da je 10 -9 m.
U višekomponentnim heterogenim sistemima, kada se jedna ili druga komponenta redistribuira između zapremine homogene faze i površinskog sloja, važi jednačina za višak unutrašnje energije površine:
U = T * S + s * s + Sm i * n i (3.2)
Svodeći sve članove jednačine na jediničnu površinu međufazne površine, dobijamo:
U s = T * S s + s + Sm i * G i (3.3)
gdje je G i = n i / s višak i-te komponente u površinskom sloju, odnosno Gibbsova adsorpcija.
Za jednokomponentni sistem, jednačina (3.3) će imati oblik:
G s = s + m * G (3.4)
gdje je G s = U s - T * S s – Gibsova energija površine ili rad stvaranja jedinične površine;
m * G – zbijanje supstance adsorbovane supstance u površinskom sloju.
Na osnovu jednačine (3.4) možemo zaključiti da se tokom adsorpcije rad stvaranja međufazne površine sastoji od rada površinskog formiranja (razbijanje kohezivnih veza u zapremini adsorbatne faze) i zbijanja supstance u površinskom sloju.
U stanju dinamičke ravnoteže između adsorbenta i adsorbata, promjena Gibbsove energije heterogenog sistema ΔG = 0, termodinamika procesa adsorpcije opisuje se jednačinom tzv. Gibbsova osnovna adsorpciona jednačina:
Ds = SG i * dm i (3.5)
Ova jednadžba je univerzalna, jer vrijedi za sve vrste procesa adsorpcije
Posebni slučajevi Gibbsove adsorpcijske jednačine.
1) Adsorpcija iz rastvora.
Za hemijski potencijal i-te komponente sistema tokom adsorpcije na interfejsu „tečnost – čvrst adsorbent” i „tečnost – gas” važe sledeće jednačine:
m i = m i 0 + R*T*ln a i (3.6)
dm i = R*T* d ln a i (3.7)
gde je m i 0 hemijski potencijal i-te komponente sistema u standardnim uslovima;
a i je aktivnost i-te komponente sistema u standardnim uslovima.
Na osnovu toga, Gibbsova adsorpciona jednačina ima oblik:
G i = - a i / R*T * (ds / da i) (3.8)
Za otopine neelektrolita uzimamo a i = c i, tada:
G i = - s / R*T * (ds / ds) (3.9)
Za otopine elektrolita:
G i = - s ± n / R*T * (ds / ds ± n) (3.10)
gdje je s ± prosječna koncentracija jona u otopini;
n je stehiometrijski koeficijent.
2) Adsorpcija supstanci iz gasne faze.
U skladu sa Mendeljejev-Klejperonovom jednačinom:
R = s * R*T (3.11)
S tim u vezi, Gibbsova jednadžba za adsorpciju plinova na čvrstim adsorbentima je napisana u sljedećem obliku:
G i = - R / R*T * (ds / dR) (3.12)
U praksi, Gibbsova adsorpciona jednadžba omogućava, na osnovu mjerenja površinske napetosti pri različitim vrijednostima koncentracije tekućine ili ravnotežnog tlaka plina, da se izračuna količina adsorpcije tvari u međufaznom sloju za koji se određuje površinska napetost.
Termodinamika adsorpcionih procesa. - koncept i vrste. Klasifikacija i karakteristike kategorije "Termodinamika adsorpcionih procesa." 2017, 2018.
Adsorpcija kao spontana koncentracija molekula na površini je praćena smanjenjem entropije sistema. Pošto je kriterijum spontanosti procesa
∆H - T · ∆S = ∆G< 0,
tada je adsorpcija moguća samo na ∆H< 0 (экзотермический процесс). Равновесие определяется условием ∆Н = T· ∆S. Kako temperatura raste, ravnoteža se pomjera prema endotermnom procesu, odnosno desorpciji.
Adsorpcija na čvrstoj površini
1. Monomolekularna adsorpcija.
Prema Langmuirovoj teoriji, molekuli adsorbenta stupaju u interakciju s površinom adsorbenta, formirajući na kraju monomolekularni sloj. U ovom slučaju, stepen ispunjenosti () površine adsorbovanom supstancom tokom adsorpcije iz gasne faze
iz tečnosti
gdje je K konstanta ravnoteže (konstanta adsorpcije);
p je parcijalni pritisak adsorbovanog gasa;
c je koncentracija adsorbirane supstance.
Zavisnost β od p (ili c) predstavljena je grafikom (izoterma adsorpcije, T = const) na Sl. 1.3.

Rice. 1.3. Stepen ispunjenosti površine adsorbiranom supstancom
Pri niskim koncentracijama i parcijalnim pritiscima, adsorpcija je proporcionalna koncentraciji ili parcijalnom pritisku:
R<< 1, β ≈ К· r ilis<< 1, β ≈ К· s, tj. početni presjek izoterme je približno linearan, a tan α = K (tg α je određen nagibom krive pri p (ili c) → 0: ili ).
If je broj molova adsorbovane supstance po 1 g adsorbenta; - maksimalno mogući broj molova adsorbirane tvari po 1 g adsorbenta („jednoslojni kapacitet“), tada
Zamjena β u jednačinu (1.3) (za slučaj adsorpcije iz gasne faze, koncentracija With u jednadžbama treba zamijeniti pritiskom R), dobijamo:
 (1.6)
(1.6)
Budući da su i K u datom paru adsorbent-adsorbent konstante (at T=const), onda se prema zavisnosti može pronaći TO(Sl. 1.4).

Rice. 1.4. Grafičko rješenje adsorpcijske jednačine
dobijeno ekstrapolacijom eksperimentalne linearne zavisnosti na () = 0; i, budući da , tada , .
Vrijednost se može koristiti za određivanje specifične površine adsorbenta UD (u m 2 po 1 g adsorbenta), ako je poznata površina ω koju na površini zauzima jedan molekul adsorbenta (određena iz veličine molekula):
UD = · ω · Na, (1.7)
gdje je Na Avogadrov broj (Na = 6,02 10 23).
Zauzvrat, poznata vrijednost UD može se koristiti za izračunavanje ω bilo koje supstance na osnovu njene adsorpcije na datom adsorbentu.
2. Polimolekularna adsorpcija.
Jednačina (1.5) opisuje krivu sa zasićenjem, tj. at
p (ili c) → ∞ teži graničnoj vrijednosti koja je jednaka (slika 1.5,a).

Sl.1.5. Izoterme adsorpcije:
a – adsorpcija sa zasićenjem; b – polimolekularna adsorpcija
Međutim, u nekim slučajevima, izoterme adsorpcije izgledaju kao one prikazane na Sl. 1.5, b, tj. ne dostiže granicu čak ni pri visokom p (ili c).
Zavisnosti tipa prikazane na sl. 1.5,b odgovaraju polimolekularnoj adsorpciji. U pravilu su takve izoterme karakteristične za tvari s jakim međumolekularnim interakcijama (na primjer, voda). Kada su centri adsorpcije na površini adsorbenta zauzeti (monomolekularni sloj je zasićen), dolazi do “slijetanja” sljedećih molekula adsorbata zbog intermolekularnih interakcija sa već adsorbiranim molekulima (slika 1.6). Toplina takve adsorpcije je bliska po apsolutnoj vrijednosti, ali suprotna po predznaku toplini isparavanja odgovarajuće tekućine (razmislite zašto).

Sl.1.6. Shema adsorpcije:
a - monomolekularna adsorpcija; b - polimolekularna adsorpcija
Kako se približavamo R na pritisak zasićene pare adsorbirane tvari, počinje se kondenzirati na površini adsorbenta, kao rezultat toga, brzo raste s povećanjem R.
U slučaju interakcije između dva atoma:
U – energija interakcije;
U = U PRIOR. + U RETURN
 - Lennard-Jones jednadžba
, c, b, m = konst
- Lennard-Jones jednadžba
, c, b, m = konst
U slučajevima interakcije atoma sa čvrstom površinom, potrebno je sumirati sve interakcije.
x – udaljenost do površine
r – radijus djelovanja privlačnih sila
dV – jačina zvuka
n – broj površinskih molekula
U ADS. – energija adsorpcione interakcije



U slučaju adsorpcije, privlačnost se povećava. A u slučaju nepolarno-nepolarne interakcije, adsorpcija je pretežno lokalizovana u udubljenjima.
Elektrostatička interakcija.
Polarni adsorbent – nepolarni adsorbat
Nepolarni adsorbent – polarni adsorbat
Polarni adsorbent – polarni adsorbat.
M  Molekul adsorbata je predstavljen kao dipol, a adsorbent je predstavljen kao provodnik u kojem molekula adsorbata indukuje dipolno ogledalo simetrično u odnosu na dato.
Molekul adsorbata je predstavljen kao dipol, a adsorbent je predstavljen kao provodnik u kojem molekula adsorbata indukuje dipolno ogledalo simetrično u odnosu na dato.
X – rastojanje do sredine
U interakciji se javlja potencijal:
 ,
,
 - dipolni moment.
- dipolni moment.
Potencijal teži da poprimi maksimalnu vrijednost, tj. dipoli teže da se orijentišu okomito na površinu.
Budući da povećanje temperature potiče rast Brownovog kretanja, to dovodi do inhibicije procesa adsorpcije.
U slučaju elektrostatičke interakcije, adsorbat je pretežno lokalizovan na izbočinama.
Osnovna adsorpciona jednačina.
U slučaju adsorpcije dolazi do preraspodjele komponente, što znači da se kemijski potencijal mijenja. Proces adsorpcije se može posmatrati kao prelazak površinske energije u hemijsku energiju.
Volumen sloja = 0, zatim generalizirana jednadžba I i II zakona termodinamike:
T = const; (1) = (2) => 

Za dvokomponentni sistem:
,
 ,
,
 =>
=>
=>
 - Gibbsova adsorpciona jednačina
.
- Gibbsova adsorpciona jednačina
.
Za slučaj TV adsorpcije. karoserija - gas: , 
 ,
,

 - izoterma
- izoterma
 - izobar
- izobar
 - izopičan
- izopičan
 - izoster
- izoster
Izoterma, izopika, izostera su međusobno povezani.
Jer adsorpcionu funkciju 



Henrijeva izoterma Langmuirova izoterma



Termodinamika. Adsorpcija.
Za kondenzovanu materiju:
 ,
,
 ,
,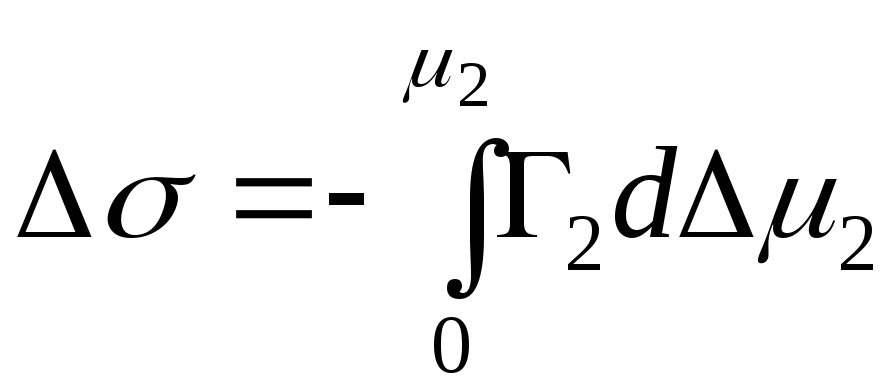
 - integralna promjena Gibbsove energije
.
- integralna promjena Gibbsove energije
.

P – pritisak na zakrivljenoj površini, R S – pritisak na ravnu površinu
 - adsorpcioni potencijal
- adsorpcioni potencijal
Diferencijalna promjena entrapije 
 , G = konst
, G = konst
- diferencijalna promjena entropije
- diferencijalna entalpija adsorpcije
 - izosterična toplota adsorpcije
- izosterična toplota adsorpcije
 - toplota kondenzacije
- toplota kondenzacije
 - neto toplota adsorpcije
- neto toplota adsorpcije

 ,
,




Qa – integralna toplota adsorpcije, 
Qra – integralna neto toplota adsorpcije,

Henrijeva jednačina
Proučavanje adsorpcije je komplikovano heterogenošću površine, pa se za homogene površine dobijaju najjednostavniji zakoni.
Razmotrimo interakciju gasova sa čvrstom površinom, kada gas prelazi iz ravnotežnog stanja u zapremini u ravnotežno stanje na površini. Ovaj slučaj je analogan ravnoteži gasova u gravitacionom polju.
 ,
,
 ,
=>
,
=> -Henrijeva jednačina
-Henrijeva jednačina
 - koeficijent raspodjele
- koeficijent raspodjele
Tokom procesa adsorpcije dolazi do promjene hemijskih potencijala.
Za masovnu fazu: 
Za plin na površini: 
U stanju ravnoteže  , tj.
, tj.

U Henryjevoj jednačini konstanta ne ovisi o koncentraciji
Henryjeva jednačina vrijedi u području niskih pritisaka i koncentracija. Kako koncentracija raste, moguće su 2 vrste odstupanja od Henryjevog zakona:
1 – pozitivna odstupanja, D opada, A opada
2 – negativna odstupanja, D – raste, A – raste.
Vrsta odstupanja određena je dominacijom jedne ili druge vrste interakcije adsorbent-adsorbat.
S jakom interakcijom ljepila povećavaju se koeficijenti aktivnosti - pozitivno odstupanje. U slučaju kohezivnih interakcija uočavaju se negativna odstupanja.
Monomolekularna adsorpcija.
Langmuirova izoterma.
Najjednostavniji obrasci dobijeni su u Henrijevoj teoriji. Langmuir je predložio teoriju prema kojoj se adsorpcija smatra kvazihemijskom reakcijom. pri čemu:
Površina je energetski homogena.
Adsorpcija je lokalizirana, svaki adsorpcijski centar je u interakciji s jednom molekulom adsorbata.
Molekuli adsorbata ne stupaju u interakciju jedni s drugima.
Jednoslojna adsorpcija.

 - površina,
- površina,  - adsorbat,
- adsorbat,  - adsorpcioni kompleks.
- adsorpcioni kompleks.
 , zatim koncentracija adsorpcijskih mjesta:
, zatim koncentracija adsorpcijskih mjesta:  ,
, - ograničavanje adsorpcije.
- ograničavanje adsorpcije.
 , tada je konstanta reakcije:
, tada je konstanta reakcije: 

 - Langmuir jednačina.
- Langmuir jednačina.
Ovisnost adsorpcije o koncentraciji
1 )
)
 ,
,

2) područje visokih koncentracija
 - ograničavanje adsorpcije, formiranje monomolekularnog sloja
- ograničavanje adsorpcije, formiranje monomolekularnog sloja
Za Gibbsovu energiju: .
g je faktor entropije.
U slučaju Henryjeve izoterme, Gibbsova energija karakterizira prijelaz adsorbata iz standardnog stanja u masi u standardno stanje na površini. U slučaju Langmuirove izoterme  karakteriše stepen afiniteta između adsorbenta i adsorbata.
karakteriše stepen afiniteta između adsorbenta i adsorbata.
 pronađeno iz van't Hoff izobare.
pronađeno iz van't Hoff izobare.

 , Onda
, Onda  , odavde
, odavde  .
.

 - stepen ispunjenosti površine.
- stepen ispunjenosti površine.




 - broj slobodnih sedišta,
- broj slobodnih sedišta,  - broj zauzetih mjesta.
- broj zauzetih mjesta.
 ,
,

One. u području visokih koncentracija, broj slobodnih mjesta je obrnuto proporcionalan količini adsorbata.
Adsorpcija mješavine plinova na homogenoj površini.
U ovom slučaju, proces adsorpcije se posmatra kao dvije paralelne reakcije.
 (1)
(1)

 (2)
(2)


Adsorpcija mješavine plinova na neujednačenoj površini.
U slučaju neujednačene površine, ne može se ograničiti na prosječne ispune.
Kao rezultat konkurencije, moguća je lokalizacija različitih adsorbata u područjima različitih tipova.
U ovom slučaju relacija  .
.
 ,
,
 - pritisak zasićene pare adsorbata.
- pritisak zasićene pare adsorbata.
 ,
,
 - toplota adsorpcije.
- toplota adsorpcije.
“+” - ovisnost o simbatu, "-" - ovisnost o antibatu, "N" - nema korelacije.
“+” - adsorpcija se odvija po istom mehanizmu. U energetski najpovoljnijim područjima pretežno se adsorbuje gas sa visokim afinitetom prema površini.
“-” - adsorpcija se odvija kroz različite mehanizme i do određenog trenutka nema konkurencije za površinu.
Monomolekularna adsorpcija se pretežno ostvaruje tokom fizičke adsorpcije gasova pri niskim vrednostima str, kao i na interfejsu tečnost/gas.
Polimolekularna adsorpcija.
BET teorija(Brunauer, Emmett, Teller).
U slučaju kada formiranje monosloja nije dovoljno za kompenzaciju površinske energije, adsorpcija je polimolekularna i može se smatrati rezultatom prisilne kondenzacije pod djelovanjem površinskih sila.
Ključne točke:
Kada molekul adsorbata udari u zauzeto mjesto, formira se višestruki skup.
Kako se približavamo str To str s smanjuje se broj slobodnih adsorpcijskih mjesta. U početku se broj mjesta koje zauzimaju samci, parovi itd. povećava, a zatim opada. u setovima.
At str =str s adsorpcija prelazi u kondenzaciju.
Ne postoje horizontalne interakcije.
Za prvi sloj je ispunjena Langmuirova izoterma.
Površina se smatra skupom adsorpcijskih mjesta. Važi uslov dinamičke ravnoteže: brzina kondenzacije na slobodnim mestima jednaka je brzini isparavanja sa zauzetih mesta.
a je koeficijent kondenzacije (udio molekula kondenziranih na površini);
 ,
,
Zm – maksimalan broj slobodnih mjesta.
 - frekvencija atomskih vibracija u smjeru okomitom na površinu.
- frekvencija atomskih vibracija u smjeru okomitom na površinu.
Za prvi sloj, uslovi dinamičke ravnoteže:



 , Onda
, Onda
 - Langmuir jednačina.
- Langmuir jednačina.
Za drugi sloj bit će istina: 
Za i-ti sloj: 
Radi jednostavnosti, pretpostavlja se da su a i ν isti za sve slojeve osim prvog. Za sve slojeve osim prvog, toplota adsorpcije je konstantna. Za posljednji sloj, toplina adsorpcije jednaka je toplini kondenzacije. Kao rezultat, dobijena je jednačina
 (*)
(*)
C– konstantno,
U slučaju BET teorije, konstanta WITH karakterizira Gibbsovu energiju čiste adsorpcije. Jednačina sadrži samo jednu konstantu, a ova jednadžba je također vrlo važna za određivanje specifične površine adsorbenta.
Budući da se toplina oslobađa kao rezultat adsorpcije, specifične površine se određuju na niskim temperaturama.
 ????????????
????????????


Glavni nedostatak teorije– zanemarivanje horizontalnih interakcija u korist vertikalnih.
Jednačina vrijedi u rasponu  od 0,05 do 0,3.
od 0,05 do 0,3.
Gdje  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0,3 – utiče na interakciju adsorbat – adsorbat.
> 0,3 – utiče na interakciju adsorbat – adsorbat.
Obračun interakcija adsorbat-adsorbat.
Interakcije nastaju kada se razgranati molekuli ili molekuli adsorbiraju na nepolarnoj površini. Sposoban za formiranje saradnika. U tom slučaju se mijenja oblik izoterme adsorpcije.
A  adsorbens nije polarni.
adsorbens nije polarni.
Grafikon 1 odgovara slabim interakcijama adsorbat-adsorbat i jakim interakcijama adsorbat-adsorbent.
Grafikon 2 odgovara jakim interakcijama adsorbat-adsorbat i jakim adsorbat-adsorbentom.
Grafikon 3 odgovara jakoj interakciji adsorbat-adsorbat i slaboj interakciji adsorbat-adsorbent.
 ,
,

U slučaju interakcije između molekula adsorbata, potrebno je uzeti u obzir promjene koeficijenata aktivnosti. I ova jednadžba se piše kao:
 - Frunkin, Fowler, Guggenheim jednačina.
- Frunkin, Fowler, Guggenheim jednačina.
k– konstanta privlačnosti.
Polyanyjeva teorija potencijala.
Ova teorija ne izvodi nikakvu vrstu izoterme adsorpcije, ali omogućava izračunavanje izoterme na različitoj temperaturi.
Adsorpcija- to je rezultat privlačenja adsorbata na površinu adsorbenta zbog djelovanja adsorpcionog potencijala, koji ne ovisi o prisutnosti drugih molekula i ovisi o udaljenosti između površine i molekule adsorbata.
 ,
,
 - adsorpcioni potencijal.
- adsorpcioni potencijal.
Pošto je površina neujednačena, udaljenost se zamjenjuje adsorpcijskim volumenom  .Zapremina adsorpcije je zapremina zatvorena između površine i tačke koja odgovara datoj vrednosti
.Zapremina adsorpcije je zapremina zatvorena između površine i tačke koja odgovara datoj vrednosti  .
.
Potencijal adsorpcije je rad prijenosa 1 mola adsorbata izvan datog adsorpcionog volumena na datu tačku adsorpcionog volumena (ili rad prijenosa 1 mola zasićene pare adsorbata koji je u ravnoteži s tekućim adsorbatom u odsustvu adsorbenta u parnu fazu u ravnoteži sa adsorbentom).

Karakteristična kriva
 - potencijal adsorpcije,
- potencijal adsorpcije, 
Za dati adsorbens i razne adsorbate vrijedi sljedeće: 
Za različite vrste adsorbata  ,
,
Gdje  potencijali za izoterme adsorpcije pri relativnim pritiscima
potencijali za izoterme adsorpcije pri relativnim pritiscima  za adsorbat 1 i za adsorbat 2. Ovaj omjer je konstantna vrijednost.
za adsorbat 1 i za adsorbat 2. Ovaj omjer je konstantna vrijednost.
 - koeficijent afiniteta
- koeficijent afiniteta
Teorija kapilarne kondenzacije.
Tok procesa adsorpcije u velikoj mjeri ovisi o strukturi poroznog tijela.
|
Mikroporozna | |
|
Prijelazno porozna | |
|
Makroporozna |
U slučaju mikroporoznih sorbenata, polja adsorpcionih sila se preklapaju. U slučaju makroporoznih sorbenata, pore djeluju kao transportni kanali. Kondenzacijski procesi su najznačajniji u prelazno poroznim tijelima. Kapilarna kondenzacija počinje pri određenim vrijednostima str I  , kada je dio površinske energije već kompenziran. Neophodan uslov je da površina mora biti samonavlažujuća. Proces je opisan Thompson–Kelvinova jednadžba.
, kada je dio površinske energije već kompenziran. Neophodan uslov je da površina mora biti samonavlažujuća. Proces je opisan Thompson–Kelvinova jednadžba.

 - za slučaj vlaženja, centar zakrivljenosti je u gasnoj fazi.
- za slučaj vlaženja, centar zakrivljenosti je u gasnoj fazi.
U slučaju kapilarne kondenzacije, izoterma adsorpcije ima histeretički oblik. Donja grana odgovara procesu adsorpcije, a gornja grana desorpcionom procesu.
Sve vrste pora mogu se svesti na tri tipa:
|
Konusno |
Cilindrične sa jednim zatvorenim krajem |
Cilindrične sa dva otvorena kraja |
|
Proces punjenja se vrši sa dna pora. Izoterma adsorpcije i izoterma desorpcije u ovom slučaju se poklapaju, budući da proces adsorpcije počinje od sfere, a proces desorpcije također počinje nestankom nekih sfera.
↓ |
Nema histereze. Hod naprijed i nazad opisani su jednadžbom:
|
Nigdje nema dna, punjenje pora će ići duž zidova cilindra.
cilindar: Izoterma će imati histerezni izgled.
↓ |
IN  U uslovima vlaženja dolazi do kondenzacije pri nižim pritiscima, što je energetski povoljno. Iz grane desorpcije dobijaju se krivulje raspodjele veličine pora.
U uslovima vlaženja dolazi do kondenzacije pri nižim pritiscima, što je energetski povoljno. Iz grane desorpcije dobijaju se krivulje raspodjele veličine pora.
Maksimum diferencijalne krive je pomaknut ulijevo u odnosu na prevojnu tačku integralne krive. Ukupni volumen malih pora je mali, ali ima velike površine. Sa povećanjem veličine pora, njihov volumen se povećava kao  , a područje je kao
, a područje je kao  , zbog toga se uočava pomak maksimuma diferencijalne krive.
, zbog toga se uočava pomak maksimuma diferencijalne krive.
Adsorpcija na granici čvrsta-tečnost.
U slučaju adsorpcije na granici čvrstog gasa, zanemarili smo jednu komponentu. U slučaju adsorpcije na granici čvrsta-tečnost, adsorbat istiskuje molekule rastvarača sa površine adsorbenta.
 ,
,
Jednačina je tačna:

 ,
,
N 1, N 2 – molni udio rastvarača i komponente, N 1 + N 2 = 1, tada
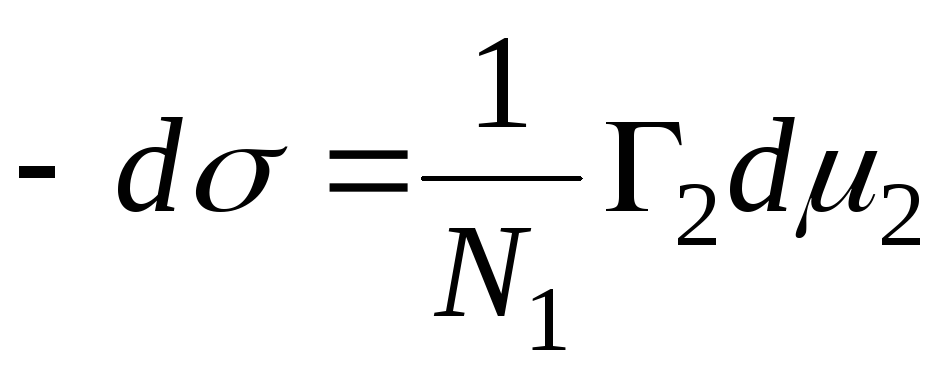 ,
=>
,
=>
 , tada je adsorpciona jednačina za sučelje čvrsta i tečnost.
, tada je adsorpciona jednačina za sučelje čvrsta i tečnost.
Adsorpcija (G) > 0 at  <
0
<
0
Ako vrijednosti  za komponentu i rastvarač su veoma različite, u ovom slučaju zavisnost G od N ima ekstrem na vrijednosti N
~ 0,5.
za komponentu i rastvarač su veoma različite, u ovom slučaju zavisnost G od N ima ekstrem na vrijednosti N
~ 0,5.
E  ako
ako  imaju bliske vrijednosti, u ovom slučaju se može promijeniti znak adsorpcije. Ovisnost G od N prelazi x-osu
imaju bliske vrijednosti, u ovom slučaju se može promijeniti znak adsorpcije. Ovisnost G od N prelazi x-osu
Točka presjeka funkcije G(N) sa x-osom se zove adsorpcijski azeotrop. To znači da se dvije komponente ne mogu razdvojiti na datom adsorbentu.
Jednadžba izoterme adsorpcije sa konstantom izmjene.
Tokom adsorpcije na granici čvrstog i tekućeg, dolazi do stalne preraspodjele komponenti između površine adsorbenta i volumena otopine.
 - komponente (- - odnosi se na površinu)
- komponente (- - odnosi se na površinu)

 ,
,
 ,
, .
.
 ,
,


Adsorpcija na granici tečnost-gas
R  Razmotrimo promjenu profila koncentracije kako se prelazi granica tekućina-gas. Neka komponenta 2 bude promjenjiva.
Razmotrimo promjenu profila koncentracije kako se prelazi granica tekućina-gas. Neka komponenta 2 bude promjenjiva.
Cs – koncentracija u površinskom sloju.
Na osnovu definicije viška adsorpcije

Ako komponenta nije hlapljiva, tada će adsorpcijska vrijednost biti zapisana na sljedeći način:
P  ri
ri 

U Eq.  priroda supstance je opisana njenim derivatom
priroda supstance je opisana njenim derivatom  .
.
Izoterma površinskog napona može biti oblika 1 ili 2:
1 – surfaktanti
2 – surfaktanti
Površinska aktivnost g je sposobnost tvari da smanje površinsku napetost u sistemu.

 - debljina površinskog sloja
- debljina površinskog sloja
C s– koncentracija komponente u površinskom sloju
WITH– volumna koncentracija
Za homologni niz postoji pravilo:
 - Traubo Duclos pravilo
- Traubo Duclos pravilo
Za homologni niz, izoterma adsorpcije izgleda ovako:
Umjesto A pišemo G, jer je adsorpcija prekomjerna u površinskom sloju.
Izoterma površinskog napona:

 - površinski napon čistog rastvarača.
- površinski napon čistog rastvarača.
 - osnovna adsorpciona jednačina;
- osnovna adsorpciona jednačina;
 - Langmuir jednačina.
- Langmuir jednačina.
Hajde da ih rešimo zajedno:

- Šiškovskog jednačina.
B– konstanta za homologni niz.
A- pri prelasku s jednog homologa na drugi povećava se za 3-3,5 puta 
![]()
1 – područje niskih koncentracija
![]()
2 – prosječna koncentracija
3 – monomolekularni sloj
Surfaktanti su difilne molekule, tj. uključuju polarnu grupu i nepolarni ugljikovodični radikal.
o je polarni dio molekula.
| - nepolarni dio molekule.
U polarnom otapalu, molekule surfaktanta su orijentirane na takav način da je polarni dio molekule okrenut prema rastvaraču, a nepolarni dio je gurnut u plinsku fazu.
U jednačini Šiškovskog  , ona je konstantna za homološki niz.
, ona je konstantna za homološki niz.
Počinje da se javlja efekat surfaktanta n>5. Pri koncentracijama većim od koncentracije monomolekularnog sloja, u otopinama surfaktanata dolazi do micelizacije.
Micelle– naziva se agregat amfifilnih molekula surfaktanta, čiji ugljikovodični radikali formiraju jezgro, a polarne grupe se pretvaraju u vodenu fazu.
Micelna masa – micelarna masa.
H  broj molekula – broj agregacije.
broj molekula – broj agregacije.
Sferične micele
U slučaju micelizacije, u rastvoru se uspostavlja ravnoteža
CMC – kritična koncentracija formiranja micela.
Pošto micelu smatramo zasebnom fazom:
Za homološki niz postoji empirijska jednačina:
a– energija rastvaranja funkcionalne grupe.
b – povećanje adsorpcionog potencijala, rad adsorpcije po jedinici metilena.
– povećanje adsorpcionog potencijala, rad adsorpcije po jedinici metilena.
Prisustvo ugljovodonične jezgre u micelama stvara mogućnost da se jedinjenja koja su netopiva u vodi rastvore u vodenim rastvorima tenzida; ovaj fenomen se naziva solubilizacija (ono što se rastvara je solubilizat, surfaktant je solubilizator).
Blato može biti potpuno nepolarno, može sadržavati i polarne i nepolarne dijelove i bit će orijentirano poput molekula surfaktanta.
U svakom slučaju, tokom solubilizacije dolazi do povećanja micelarne mase i broja agregacije ne samo zbog uključivanja solubilizata, već i zbog povećanja broja molekula surfaktanta neophodnih za održavanje ravnotežnog stanja.
Solubilizacija je efikasnija, što je manja molekulska težina solubilizata.

 ~ 72 mN\m.
~ 72 mN\m.
 ~ 33 mN\m.
~ 33 mN\m.
Efikasnost surfaktanata zavisi od vrednosti CMC.
2D Pritisak površinskog sloja

→ -sile površinskog napona.
- dvodimenzionalni pritisak.
Površinski sloj je sila jednaka razlici površinske napetosti rastvora surfaktanta i čistog otapala, usmerena ka čistoj površini.
Uspostavljena je ravnoteža između rastvora i površinskog sloja



At  postoji oblast u kojoj
postoji oblast u kojoj  linearno zavisi od koncentracije.
linearno zavisi od koncentracije.
G [mol/m2].
 -površina koju zauzima jedan mol supstance
-površina koju zauzima jedan mol supstance
Tada će dvodimenzionalna izoterma pritiska imati oblik 
 - dvodimenzionalna izoterma pritiska.
- dvodimenzionalna izoterma pritiska.
Ovisnost  od S M:
od S M:

At  - dvodimenzionalni pritisak naglo raste. At
- dvodimenzionalni pritisak naglo raste. At  dvodimenzionalni je deformisan, uzrokujući nagli rast
dvodimenzionalni je deformisan, uzrokujući nagli rast  .
.
Film omeđen identičnim fazama s obje strane naziva se dvostrani. U takvim filmovima se opaža stalno kretanje matične tekućine.
Filmovi debljine manje od 5 nm nazivaju se crnim filmovima.

Adsorpcijski slojevi moraju imati dvije karakteristike: viskoznost i laku pokretljivost, fluidnost i elastičnost.
Marangoni efekat je samoizlječiv.
Gibbsov trougao,  - nadpritisak.
- nadpritisak.
Film se rastegnuo i zbog činjenice da je dio tekućine otišao, površinski aktivne tvari jure u slobodni prostor. Gibbsov trougao.
Efekat adsorpcione snage tela.
Na površini filma uvijek postoji sloj adsorpcije, za koji onda
Langmuir jednadžba:


 u dvodimenzionalni pritisak
u dvodimenzionalni pritisak
 - analog jednadžbe Šiškovskog
- analog jednadžbe Šiškovskog
Elektrokinetički fenomeni. Električni dvoslojni (EDL).
Gelemholtz model. Gouy-Chapmanova teorija.
1808 Flight

U – oblikovanu cijev, uronite 2 elektrode u nju. Narušava se zakon komunikacionih sudova i dolazi do promene nivoa tečnosti u cevi - elektrokinetičke pojave.
Kinetički fenomeni:
Elektroforeza
Elektroosmoza
Potencijal protoka (protoka).
Potencijal sedimentacije
1 i 2 nastaju kada se primijeni razlika potencijala; 3 i 4, probijanje i sedimentacija koloidnih čestica uzrokuju pojavu razlike potencijala.
Elektroosmoza je kretanje disperzione sredine u odnosu na stacionarnu disperziranu fazu pod uticajem električne struje.
Elektroforeza – to je kretanje čestica dispergirane faze u odnosu na stacionarni disperzioni medij pod uticajem električne struje.
P  Razlog za pojavu elektrokinetičkih pojava je prostorno razdvajanje naelektrisanja i pojava dvostrukog električnog sloja.
Razlog za pojavu elektrokinetičkih pojava je prostorno razdvajanje naelektrisanja i pojava dvostrukog električnog sloja.
Električni dvostruki sloj je ravan kondenzator, jednu ploču čine joni koji određuju potencijal, a drugu kontrajoni. Joni su kontaminirani na isti način na koji se kojoni koji određuju potencijal guraju u volumen otopine. Udaljenost između ploča  . Potencijal opada linearno, razlika potencijala
. Potencijal opada linearno, razlika potencijala  .
.
Eksterna razlika potencijala uzrokuje pojavu modula smicanja  je par sila po jedinici površine koje djeluju duž površine čvrstog tijela.
je par sila po jedinici površine koje djeluju duž površine čvrstog tijela.

U ravnoteži, modul smicanja jednak je modulu viskoznog trenja (  ).
).

U našim uslovima  ,
,

 - Gelemholc-Smalukovski jednačina
- Gelemholc-Smalukovski jednačina
 - linearna brzina pomaka faze.
- linearna brzina pomaka faze.
E– jačina električnog polja.
 - razlika potencijala između ploča
- razlika potencijala između ploča
 - elektroforetsku pokretljivost [m 2 /(V*s)].
- elektroforetsku pokretljivost [m 2 /(V*s)].
Helemholtzov model ne uzima u obzir toplinsko kretanje molekula. U stvarnosti, distribucija jona u dvostrukom sloju je složenija.
Gui i Chapman su identificirali sljedeće uzroke DES-a:
Prijelaz jona iz jedne faze u drugu kada se uspostavi ravnoteža.
Jonizacija čvrste faze.
Završetak površine ionima prisutnim u disperzijskom mediju.
Polarizacija iz vanjskog izvora struje.
Električni dvostruki sloj ima nejasnu ili difuznu strukturu. Joni imaju tendenciju da budu ravnomjerno raspoređeni kroz difuzni sloj.
Difuzni sloj se sastoji od kontrainona; dužina sloja je određena njihovom kinetičkom energijom. Na temperaturama koje se približavaju apsolutnoj nuli, protujoni su što je moguće bliži ionima koji određuju potencijal.
Danyina teorija se zasniva na dvije jednačine:
Boltzmannova jednadžba

 - rad protiv sila elektrostatičke interakcije.
- rad protiv sila elektrostatičke interakcije.
 - volumetrijska gustina naboja.
- volumetrijska gustina naboja.

Poissonova jednadžba 
Budući da je debljina EDL-a mnogo manja od veličine čestice, a za ravan EDL derivat u odnosu na koordinate  I
I  je ukinut.
je ukinut. 
Za e y na y<<1 функцию можно разложить в ряд Маклорена:

Ograničimo se onda na dva pojma serije:


 - Debljina DEL je udaljenost na kojoj se DEL potencijal smanjuje e jednom.
- Debljina DEL je udaljenost na kojoj se DEL potencijal smanjuje e jednom.
Što je temperatura niža, to je manje  . Na T→0 – ravan DEL. Što je veća koncentracija, što sam više, to manje
. Na T→0 – ravan DEL. Što je veća koncentracija, što sam više, to manje  .
.





 “–” znači da potencijal opada s rastojanjem. =>
“–” znači da potencijal opada s rastojanjem. =>
=>

 ,
,
 - potencijal opada eksponencijalno.
- potencijal opada eksponencijalno.
Potencijal za površinsku gustinu naboja: 
Površinski naboj je zapreminski naboj sa suprotnim predznakom, integrisan na udaljenosti.




=>


Gdje se potencijal smanjuje za 2,7 puta - 
Kapacitet dvostrukog sloja 
Nedostatak teorije je što se ne uzima u obzir prisustvo Helemholtzovog sloja, tj. ne uzima u obzir  , otuda i greške u određivanju glavnih parametara. Takođe ne objašnjava uticaj jona različite prirode na debljinu električnog dvostrukog sloja.
, otuda i greške u određivanju glavnih parametara. Takođe ne objašnjava uticaj jona različite prirode na debljinu električnog dvostrukog sloja.
Sternova teorija. Struktura koloidne micele.
Električni dvostruki sloj sastoji se od dva dijela: gustog i difuznog. Gusti sloj nastaje kao rezultat interakcije jona koji stvaraju potencijal sa specifično adsorbiranim. Ovi ioni su, u pravilu, djelomično ili potpuno dehidrirani i mogu imati ili isti ili suprotan naboj od jona koji određuju potencijal. Zavisi od omjera energije elektrostatičke interakcije  i specifični adsorpcijski potencijal
i specifični adsorpcijski potencijal  . Joni gustog sloja su fiksirani. Drugi dio jona nalazi se u difuznom sloju, ti joni su slobodni i mogu se kretati dublje u rastvor, tj. iz područja veće koncentracije u područje niže koncentracije. Ukupna gustina naelektrisanja sastoji se od dva dela.
. Joni gustog sloja su fiksirani. Drugi dio jona nalazi se u difuznom sloju, ti joni su slobodni i mogu se kretati dublje u rastvor, tj. iz područja veće koncentracije u područje niže koncentracije. Ukupna gustina naelektrisanja sastoji se od dva dela.

 -naboj Helmholcovog sloja
-naboj Helmholcovog sloja
 - Difuzni sloj naboja
- Difuzni sloj naboja
Površina ima određeni broj adsorpcijskih centara, od kojih svaki stupa u interakciju s jednim protujonom. Konstanta takve kvazihemijske reakcije jednaka je:

 , Gdje
, Gdje  - molni udio protujona u otopini
- molni udio protujona u otopini
Helmholtzova distribucija
Potencijal opada linearno
Gouy potencijalna distribucija. Nema gustog sloja, potencijal opada eksponencijalno od vrijednosti 
Stern distribucija.
U početku je smanjenje potencijala linearno, a zatim eksponencijalno.
Kada se u slučaju elektroforeze primeni električno polje, ne kreće se direktno čestica čvrste faze, već čestica čvrste faze sa slojem jona koji je okružuje. DES ponavlja oblik čestice dispergirane faze. Kada se primijeni potencijal, dio difuznog sloja se otkine. Poziva se linija prekida klizna granica.
Potencijal koji nastaje na kliznoj granici kao rezultat odvajanja dijela difuznog sloja naziva se elektrokinetički potencijal(Zeta potencijal  ).
).
Čestica dispergirane faze s okolnim slojem protujona i dvostrukim električnim slojem naziva se micelle.
Pravila za pisanje koloidnih micela:


1-1 elektrolit za punjenje
T – čestica dispergirane faze.
AA je granica između gustog i difuznog dijela.
BB – klizna granica.
Klizna granica se može ili ne mora podudarati s linijom AA.
Naziva se pH vrijednost pri kojoj je zeta potencijal nula izoelektrična tačka.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2NaCl
1. Višak CaCl 2
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n - x)Cl - ) 2 x + x Cl - - notacija micela.
CaSO 4 m – agregat.
CaSO 4 m∙nCa 2+ – jezgro.
CaSO 4 m∙nCa 2+ 2( n - x)Cl - - čestica.
2. Višak Na 2 SO 4
Na 2 SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - micela
CaSO 4 m – agregat.
CaSO 4 m∙nSO 4 2 + – jezgro.
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - čestica
Gelemholtz-Smoluchowski jednadžba

 - linearna brzina pomaka granice (u elektroosmozi).
- linearna brzina pomaka granice (u elektroosmozi).
 - razlika potencijala na pločama kondenzatora (u elektroosmozi).
- razlika potencijala na pločama kondenzatora (u elektroosmozi).


 - volumetrijski protok rastvora, S– površina poprečnog presjeka ćelije.
- volumetrijski protok rastvora, S– površina poprečnog presjeka ćelije.

E– jačina električnog polja.


 (za elektroosmozu).
(za elektroosmozu).
Za potencijal protoka:

 - potencijal
- potencijal
 - pritisak na membranu
- pritisak na membranu
U pravilu su vrijednosti elektroforetskih pokretljivosti i elektroosmotske pokretljivosti manje od izračunatih. Ovo se dešava zbog:
Relaksacijski efekat (kada se čestica dispergirane faze pomjera, simetrija jonske atmosfere je narušena).
Elektroforetska inhibicija (pojava dodatnog trenja kao rezultat kretanja protujona).
Izobličenje strujnih vodova u slučaju električno vodljivih čestica.
Odnos između površinske napetosti i potencijala. Lippmannova jednadžba.
Do stvaranja EDL dolazi spontano zbog želje sistema da smanji svoju površinsku energiju. U uslovima konstante T I str generalizovana jednadžba prvog i drugog zakona termodinamike izgleda ovako:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1. Lippmannova jednačina.
- 1. Lippmannova jednačina.
 - površinska gustina naboja.
- površinska gustina naboja.
 - diferencijalni kapacitet.
- diferencijalni kapacitet.
 - 2. Lippmannova jednačina.
- 2. Lippmannova jednačina.
WITH– kapacitet.
Rešimo prvu Lippmannovu jednačinu i osnovnu adsorpcionu jednačinu:
 ,
,


 , Onda
, Onda
 - Nernstova jednačina
- Nernstova jednačina
 ,
,
 ,
,




 - jednadžba elektrokapilarne krive (ECC).
- jednadžba elektrokapilarne krive (ECC).
IN  :
: , Ali
, Ali 
Kationski surfaktanti (CPAS) smanjuju katodnu granu EKC-a.
Anionski surfaktanti (APS) smanjuju anodnu granu EKC-a.
Nejonski surfaktanti (NSAS) smanjuju srednji dio ECC-a.
Stabilnost dispergovanih sistema. Disjoining pressure.
Disperzovani sistemi se mogu podeliti na:
Sistemi koji su termodinamički nestabilni mogu biti kinetički stabilni zbog prelaska u metastabilno stanje.
Postoje dvije vrste stabilnosti:
Stabilnost sedimentacije (u odnosu na gravitaciju).
Agregatna stabilnost. (u odnosu na adheziju)
Koagulacija je proces adhezije čestica, što dovodi do gubitka agregativne stabilnosti. Koagulacija može biti uzrokovana promjenama temperature, pH vrijednosti, miješanjem i ultrazvukom.
Koagulacija se razlikuje:
Reverzibilno.
Nepovratno.
Koagulacija se javlja uvođenjem elektrolita.
Pravila koagulacije:

Film- ovo je dio sistema koji se nalazi između dvije međufazne površine.
Disjoining pressure nastaje kada se debljina filma naglo smanji kao rezultat interakcije površinskih slojeva koji se približavaju.

“-” - kako se debljina filma smanjuje, pritisak razdvajanja se povećava.
P 0 je pritisak u masnoj fazi, koja je nastavak međusloja.
P 1 – pritisak u filmu.
Teorija stabilnosti. DLFO (Deryagin, Landau, Fairway, Overbeck).
Prema DLFO teoriji, razdvajajući pritisak ima dvije komponente:
Elektrostatički P E (pozitivan, to je zbog sila elektrostatičkog odbijanja). Odgovara smanjenju Gibbsove energije sa povećanjem debljine filma.
Molekularno P M (negativno, zbog djelovanja privlačnih sila). Nastaje kompresijom filma zbog hemijskih površinskih sila, radijus djelovanja sila je desetinki nm sa energijom od oko 400 kJ/mol.
Ukupna energija interakcije:

 - sistem je agregatno stabilan
- sistem je agregatno stabilan
 - nestabilan sistem
- nestabilan sistem
P  pozitivna komponenta.
pozitivna komponenta.
Povećanje je zbog povećanja potencijalne energije kada se tanki filmovi kompresuju. Za filmove velike debljine, višak energije jona se kompenzira i jednak je energetskoj interakciji u volumenu disperzijskog medija.
Ako  (
( - debljina filma,
- debljina filma,  - radijus jona) stanjivanje filma dovodi do nestanka i redukcije molekula i jona sa minimalnom površinskom energijom u njemu. Broj susjednih čestica se smanjuje, zbog čega se povećava potencijalna energija čestica preostalih u filmu.
- radijus jona) stanjivanje filma dovodi do nestanka i redukcije molekula i jona sa minimalnom površinskom energijom u njemu. Broj susjednih čestica se smanjuje, zbog čega se povećava potencijalna energija čestica preostalih u filmu.


DLVO teorija razmatra interakciju čestica kao interakciju ploča.

Čestice ne stupaju u interakciju



 - Laplaceova jednačina,
- Laplaceova jednačina,  ,
,


Za slabo nabijene površine
Za visoko napunjene površine:

Molekularna komponenta je interakcija dva atoma:
 ~
~
Interakcija atoma s površinom:

Uzmimo dva rekorda:
D  Da bi se dobila molekularna komponenta, potrebno je sabrati sve interakcijske energije atoma desne i lijeve ploče.
Da bi se dobila molekularna komponenta, potrebno je sabrati sve interakcijske energije atoma desne i lijeve ploče.
Gdje  - Hamakerova konstanta (uzima u obzir prirodu tijela u interakciji).
- Hamakerova konstanta (uzima u obzir prirodu tijela u interakciji).
To. energija interakcije čestica u sistemu može se izraziti pomoću potencijalnih krivulja.
I – minimum primarnog potencijala. Ovo je zona nepovratne koagulacije, sile privlačenja prevladavaju.
II – zona agregatne stabilnosti, preovlađuju odbojne sile.
III – minimum sekundarnog potencijala (ili zona flokulacije). Između čestica dispergirane faze nalazi se sloj elektrolita, a čestice se mogu odvojiti i prenijeti u zonu stabilnosti agregacije.

Kriva 1 – sistem je agregatno stabilan.
Kriva 2 – stabilna u zoni I, nestabilna u zoni II.
Kriva 3 – došlo je do koagulacije u sistemu.
Kriva 4 – u tački 4 ukupna energija interakcije U=0,  , ova tačka ekstrema odgovara početku brze koagulacije.
, ova tačka ekstrema odgovara početku brze koagulacije.
Postoje dva slučaja:
1. Blago nabijene površine:
U = U E + U M = 0
 (1)
(1)
2)

 (2)
(2)



 - ovo je debljina sloja koja odgovara početku procesa koagulacije.
- ovo je debljina sloja koja odgovara početku procesa koagulacije.






 - za slabo nabijene površine
- za slabo nabijene površine
 Onda
Onda 
2. Za visoko nabijene površine:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
Hajdemo na kvadrat (3)

koagulacija:
U specifičnoj adsorpciji, ioni se mogu adsorbirati u superekvivalentnim količinama tako da površina može promijeniti svoj naboj. Površina se puni.
U slučaju specifične adsorpcije mogu se adsorbirati ioni ne samo suprotnih predznaka, već i istog predznaka.
Ako se adsorbiraju ioni istog znaka kao i površina, tada u površinskom sloju neće doći do pada potencijala, već njegovog povećanja.

Koagulacija neutralizacije (nastaje uz učešće slabo nabijenih čestica i ovisi ne samo o naboju elektrolita-koagulatora, već i o potencijalu na granici gustih i difuznih slojeva).
Teorija brze koagulacije Smoluchowskog.

Ovisnost brzine koagulacije o koncentraciji elektrolita.
I – stopa koagulacije je niska,
II – brzina koagulacije je skoro proporcionalna koncentraciji elektrolita.
III – oblast brze koagulacije, brzina je praktično nezavisna od koncentracije.
Osnovne odredbe:
Početni sol je monodisperzan, slične čestice imaju sferni oblik.
Svi sudari čestica su efikasni.
Kada se dvije primarne čestice sudare, nastaje sekundarna čestica. Sekundarni + primarni = tercijarni. Primarni, sekundarni, tercijarni – višestrukost.
U smislu hemijske kinetike, proces koagulacije se može opisati jednadžbom:
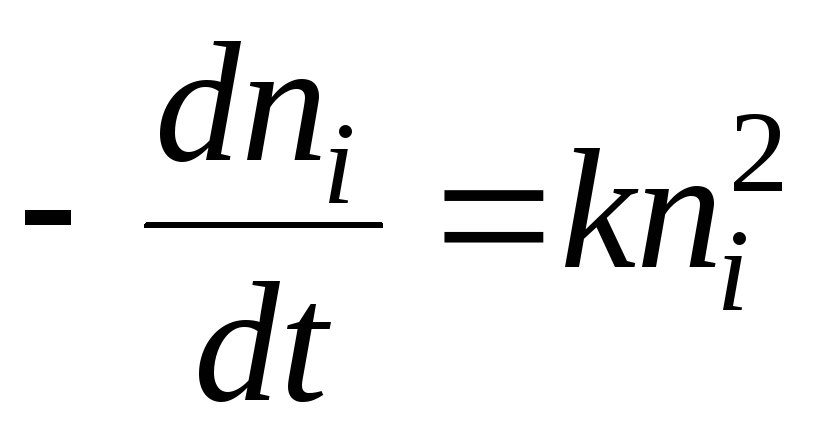
Rješenje će biti jednačina: 
 - pola vremena koagulacije. Ovo je vrijeme tokom kojeg se broj čestica sol smanjuje za 2 puta.
- pola vremena koagulacije. Ovo je vrijeme tokom kojeg se broj čestica sol smanjuje za 2 puta.

 ,
,
 ,
,
 ,
,


Kako se multiplicitet povećava, maksimum koagulacionih krivulja se pomiče prema većim vrijednostima  .
.
Nedostaci:
Pretpostavka monodisperznosti.
Pretpostavka o efektivnosti svih kolizija.




 - sfera,
- sfera, ,
,





