Alkenler kimyasal olarak aktiftir. Kimyasal özellikleri büyük ölçüde bir çift bağın varlığı ile belirlenir. Alkenler için elektrofilik katılma reaksiyonları ve radikal katılma reaksiyonları en karakteristiktir. Nükleofilik katılma reaksiyonları genellikle güçlü bir nükleofil gerektirir ve tipik alkenler değildir. Alkenler kolayca oksidasyon, ekleme reaksiyonlarına girerler ve ayrıca alil radikal ikamesi yapabilirler.
Ekleme reaksiyonları
Hidrojenasyon Alkenlere hidrojen ilavesi (hidrojenasyon reaksiyonu), katalizörlerin varlığında gerçekleştirilir. Çoğu zaman ezilmiş metaller kullanılır - platin, nikel, paladyum vb. Sonuç olarak, karşılık gelen alkanlar (doymuş hidrokarbonlar) oluşur.
$CH_2=CH_2 + H2 → CH_3–CH_3$
halojenlerin eklenmesi. Alkenler, halojen atomlarının komşu karbon atomlarında bulunduğu karşılık gelen dihaloalkanları oluşturmak için normal koşullar altında klor ve brom ile kolayca reaksiyona girer.
1. açıklama
Alkenler brom ile etkileşime girdiğinde, bromun sarı-kahverengi rengi bozulur. Bu, doymamış hidrokarbonlar için en eski ve en basit kalitatif reaksiyonlardan biridir, çünkü alkinler ve alkadienler de benzer şekilde reaksiyona girer.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
hidrojen halojenürlerin eklenmesi. Etilen hidrokarbonlar hidrojen halojenürlerle ($HCl$, $HBr$) reaksiyona girdiğinde haloalkanlar oluşur, reaksiyonun yönü alkenlerin yapısına bağlıdır.
Etilen veya simetrik alkenler söz konusu olduğunda, ekleme reaksiyonu açık bir şekilde gerçekleşir ve yalnızca bir ürünün oluşumuna yol açar:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
Simetrik olmayan alkenler söz konusu olduğunda, iki farklı ilave reaksiyon ürününün oluşması mümkündür:
2. açıklama
Aslında, temelde sadece bir reaksiyon ürünü oluşur. Bu tür reaksiyonların geçiş yönünün düzenliliği, Rus kimyager V.V. 1869'da Markovnikov Buna Markovnikov kuralı denir. Hidrojen halojenürlerin simetrik olmayan alkenlerle etkileşmesinde, hidrojen atomu en çok hidrojene olan karbon atomunda çift bağın koptuğu yerde, yani çok sayıda hidrojen atomuna bağlanmadan önce birleşir.
Markovnikov bu kuralı deneysel verilere dayanarak formüle etti ve ancak çok sonraları teorik bir gerekçe aldı. Propilenin hidrojen klorür ile reaksiyonunu düşünün.
$p$ bağının özelliklerinden biri de kolayca polarize olabilmesidir. Propen molekülündeki metil grubunun (pozitif endüktif etki + $I$) etkisi altında, $p$ bağının elektron yoğunluğu karbon atomlarından birine (= $CH_2$) kaydırılır. Sonuç olarak, üzerinde kısmi bir negatif yük ($\delta -$) belirir. Çift bağın diğer karbon atomunda kısmi bir pozitif yük oluşur ($\delta +$).
Propilen molekülündeki elektron yoğunluğunun bu dağılımı, protonun gelecekteki saldırısının yerini belirler. Bu, kısmi bir negatif yük $\delta-$ taşıyan metilen grubunun (= $CH_2$) karbon atomudur. Ve buna göre klor, karbon atomuna kısmi bir pozitif yük $\delta+$ ile saldırır.
Sonuç olarak, propilenin hidrojen klorür ile ana reaksiyon ürünü 2-kloropropandır.
Hidrasyon
Alkenlerin hidrasyonu, mineral asitlerin varlığında meydana gelir ve Markovnikov kuralına uyar. Reaksiyon ürünleri alkollerdir.
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
alkilasyon
Düşük sıcaklıklarda bir asit katalizörü ($HF$ veya $H_2SO_4$) varlığında alkenlere alkanların eklenmesi, daha yüksek moleküler ağırlığa sahip hidrokarbonların oluşumuna yol açar ve genellikle endüstride motor yakıtı üretmek için kullanılır.
$R–CH_2=CH_2 + R'–H → R–CH_2–CH_2–R'$
oksidasyon reaksiyonları
Alkenlerin oksidasyonu, hem çift bağın kırılması hem de karbon iskeletinin korunması ile oksitleyici reaktiflerin koşullarına ve türlerine bağlı olarak meydana gelebilir:
polimerizasyon reaksiyonları
Alken molekülleri, $\pi$-bağlarının açılması ve dimerler, trimerler veya yüksek moleküler bileşikler - polimerler oluşumu ile belirli koşullar altında birbirlerine ekleme yeteneğine sahiptir. Alkenlerin polimerizasyonu hem serbest radikal hem de katyon-anyon mekanizmalarıyla ilerleyebilir. Asitler, peroksitler, metaller, vb. Tipik bir örnek, polietilen oluşturmak için etilenin polimerizasyonudur.
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
ikame reaksiyonları
Alkenler için ikame reaksiyonları tipik değildir. Bununla birlikte, yüksek sıcaklıklarda (400 °C'nin üzerinde), geri dönüşümlü olan radikal katılma reaksiyonları bastırılır. Bu durumda, çift bağı korurken alil pozisyonundaki hidrojen atomunun ikamesini gerçekleştirmek mümkün hale gelir.
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Bilgi Hipermarketi >>Kimya >>Kimya 10. Sınıf >> Kimya: Alkenler
Doymamış hidrokarbonlar, moleküllerdeki karbon atomları arasında çok sayıda bağ içeren hidrokarbonları içerir. Doymamış alkenler, alkinler, alkadienler (polienler). Döngüde çift bağ içeren siklik hidrokarbonlar (sikloalkenler) ve döngüde az sayıda karbon atomu (üç veya dört atom) bulunan sikloalkanlar da doymamış bir karaktere sahiptir. "Doymamışlık" özelliği, bu maddelerin, doymuş veya doymuş hidrokarbonlar - alkanların oluşumu ile başta hidrojen olmak üzere ekleme reaksiyonlarına girme kabiliyeti ile ilişkilidir.
Yapı
Alkenler, molekülde tekli bağlara ek olarak karbon atomları arasında bir çift bağ içeren ve CnH2n genel formülüne karşılık gelen asikliktir.
Alkenler, kalıntıları sıvı yağların - yağların (İngiliz yağından - yağından) bir parçası olan doymamış yağ asitlerine (oleik, linoleik) benzetilerek ikinci adlarını - "olefinler" aldı.
Bildiğiniz gibi aralarında çift bağ bulunan karbon atomları sp 2 hibridizasyonu halindedir. Bu, bir s- ve iki p-orbitalin hibritleşmeye katıldığı, bir p-orbitalin ise hibritleşmeden kaldığı anlamına gelir. Hibrit orbitallerin üst üste binmesi, bir a-bağının oluşumuna yol açar ve komşu etilen moleküllerinin hibritleşmemiş a-orbitalleri nedeniyle, karbon atomları bir saniye oluşturur, P-bağlantı. Böylece, bir çift bağ bir z- ve bir p-bağından oluşur.
Çift bağı oluşturan atomların hibrit orbitalleri aynı düzlemde, n-bağını oluşturan orbitalleri ise molekül düzlemine diktir (bkz. Şekil 5).
Çift bağ (0,132 nm) tek bağdan daha kısadır ve enerjisi daha fazladır, yani daha dayanıklıdır. Bununla birlikte, hareketli, kolayca polarize olabilen bir 7r bağının varlığı, alkenlerin kimyasal olarak alkanlardan daha aktif olmalarına ve katılma reaksiyonlarına girebilmelerine yol açar.
Homolog eten serisi
Dallanmamış alkenler, homolog eten (etilen) serisini oluşturur.
C2H4 - eten, C3H6 - propen, C4H8 - büten, C5H10 - penten, C6H12 - heksen, vb.
İzomerizm ve isimlendirme
Alkenler için olduğu kadar alkanlar için de yapısal izomerizm karakteristiktir. Yapısal izomerler, hatırladığınız gibi, karbon iskeletinin yapısında birbirinden farklıdır. Yapısal izomerlerle karakterize edilen en basit alken butendir.
CH3-CH2-CH=CH2CH3-C=CH2
ben
CH3
büten-1 metilpropen
Özel bir yapısal izomerizm türü, çift bağ konum izomerizmidir:
CH3-CH2-CH=CH2CH3-CH=CH-CH3
büten-1 büten-2
Tek bir karbon-karbon bağı etrafında karbon atomlarının neredeyse serbest dönüşü mümkündür, bu nedenle alkan molekülleri çok çeşitli şekiller alabilir. Çift bağ etrafında dönüş imkansızdır, bu da alkenlerde başka bir tür izomerizmin ortaya çıkmasına neden olur - geometrik veya cis-trans izomerizmi.
Cis-izomerler, düzleme göre moleküler fragmanların (bu durumda metil grupları) uzamsal düzenlemesi ile toraks izomerlerinden farklılık gösterir. P ilişkiler ve dolayısıyla özellikler.
Alkenler, sikloalkanlara izomeriktir (sınıflar arası izomerizm), örneğin:
ch2=ch-ch2-ch2-ch2-ch3
heksen-1 sikloheksan
terminoloji alkenler IUPAC tarafından geliştirilen, alkanların terminolojisine benzer.
1. Ana devre seçimi
Bir hidrokarbon adının oluşumu, bir moleküldeki en uzun karbon atomları zinciri olan ana zincirin tanımıyla başlar. Alkenler söz konusu olduğunda, ana zincir bir çift bağ içermelidir.
2. Ana zincirin atomlarının numaralandırılması
Ana zincirin atomlarının numaralandırılması çift bağın en yakın olduğu uçtan başlar. Örneğin, doğru bağlantı adı
ch3-chn-ch2-ch=ch-ch3 ch3
5-metilheksen-2, beklendiği gibi 2-metilheksen-4 değil.
Zincirdeki atomların numaralandırılmasının başlangıcını çift bağın konumuna göre belirlemek mümkün değilse, doymuş hidrokarbonlarla aynı şekilde ikame edicilerin konumuna göre belirlenir.
CH3-CH2-CH=CH-CH-CH3
ben
CH3
2-metilheksen-3
3. İsim oluşumu
Alkenlerin adları, alkanların adlarıyla aynı şekilde oluşturulur. Adın sonunda, çift bağın başladığı karbon atomunun numarası ve bileşiğin -ene alken sınıfına ait olduğunu gösteren son ek belirtilir.
Fiş
1. Petrol ürünlerinin kırılması. Alkan oluşumu ile birlikte doymuş hidrokarbonların termal kraking sürecinde alken oluşumu meydana gelir.
2. Doymuş hidrokarbonların dehidrojenasyonu. Alkanlar yüksek sıcaklıkta (400-600 °C) bir katalizör üzerinden geçirildiğinde, bir hidrojen molekülü ayrılır ve bir alken oluşur: 
3. Alkollerin dehidrasyonu (suyun bölünmesi). Su giderici maddelerin (H2804, Al203) yüksek sıcaklıklarda monohidrik alkoller üzerindeki etkisi, bir su molekülünün ortadan kaldırılmasına ve bir çift bağın oluşmasına yol açar:
Bu reaksiyona molekül içi dehidrasyon denir (eter oluşumuna yol açan ve § 16 "Alkoller" bölümünde incelenecek olan moleküller arası dehidrasyonun aksine).
4. Dehidrohalojenasyon (hidrojen halojenürün ortadan kaldırılması).
Bir haloalkan, alkollü bir çözeltide bir alkali ile reaksiyona girdiğinde, bir hidrojen halojenür molekülünün ortadan kaldırılmasının bir sonucu olarak bir çift bağ oluşur.
Bu reaksiyonun, büten-1 yerine ağırlıklı olarak büten-2 ürettiğine dikkat edin. Zaitsev'in kuralı:
Bir hidrojen halojenür, ikincil ve üçüncül haloalkanlardan ayrıldığında, en az hidrojenlenmiş karbon atomundan bir hidrojen atomu ayrılır.
5. Halojen giderme. Bir alkanın bir dibromo türevi üzerindeki çinkonun etkisi altında, halojen atomları komşu karbon atomlarından ayrılır ve bir çift bağ oluşur: 
Fiziki ozellikleri
Homolog alken serisinin ilk üç temsilcisi gazlardır, C5H10-C16H32 bileşimindeki maddeler sıvıdır, daha yüksek alkenler katıdır.
Kaynama ve erime noktaları, bileşiklerin moleküler ağırlıklarındaki artışla doğal olarak artar.
Kimyasal özellikler
Ekleme reaksiyonları
Doymamış hidrokarbonların - alkenlerin temsilcilerinin ayırt edici bir özelliğinin, ilave reaksiyonlara girme yeteneği olduğunu hatırlayın. Bu reaksiyonların çoğu elektrofilik ekleme mekanizmasıyla ilerler.
1. Alkenlerin hidrojenasyonu. Alkenler, hidrojenasyon katalizörleri - metaller - platin, paladyum, nikel varlığında hidrojen ekleyebilir:
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
Bu reaksiyon hem atmosferik hem de yüksek basınçta gerçekleşir ve ekzotermik olduğundan yüksek sıcaklık gerektirmez. Aynı katalizörlerde sıcaklığın artmasıyla ters reaksiyon, dehidrojenasyon meydana gelebilir.
2. Halojenasyon (halojenlerin eklenmesi). Bir alkenin brom suyu veya organik bir çözücü (CCl4) içindeki bir brom çözeltisi ile etkileşimi, alkene bir halojen molekülünün eklenmesi ve dihaloalkanların oluşumu sonucunda bu çözeltilerin hızlı bir şekilde renk değiştirmesine yol açar.
Markovnikov Vladimir Vasilyeviç
(1837-1904)
Rus organik kimyager. Kimyasal yapıya bağlı olarak ikame, eliminasyon, çift bağ ilavesi ve izomerizasyon reaksiyonlarının yönü hakkında formüle edilmiş (1869) kuralları. Petrolün bileşimini araştıran (1880'den beri), bağımsız bir bilim olarak petrokimyanın temellerini attı. Yeni bir organik madde sınıfı açıldı (1883) - siklo-parafinler (naftenler).
3. Hidrohalojenasyon (hidrojen halojenür ilavesi).
Hidrojen halojenür ekleme reaksiyonu aşağıda daha ayrıntılı olarak tartışılacaktır. Bu reaksiyon Markovnikov'un kuralına uyar:
Bir alkene bir hidrojen halojenür eklendiğinde, hidrojen daha fazla hidrojenlenmiş bir karbon atomuna, yani daha fazla hidrojen atomunun bulunduğu bir atoma ve bir halojen daha az hidrojenlenmiş bir atoma bağlanır.
4. Hidrasyon (su ilavesi). Alkenlerin hidrasyonu alkollerin oluşumuna yol açar. Örneğin, etene su eklenmesi, etil alkol üretimine yönelik endüstriyel yöntemlerden birinin temelini oluşturur:
CH2=CH2 + H2O -> CH3-CH2OH
eten etanol
Bir birincil alkolün (birincil karbonda bir hidroksil grubu ile) yalnızca eten hidratlandığında oluştuğuna dikkat edin. Propen veya diğer alkenler hidratlandığında ikincil alkoller oluşur. 
Bu reaksiyon ayrıca Markovnikov'un kuralına göre ilerler - hidrojen katyonu daha fazla hidrojenlenmiş karbon atomuna eklenir ve daha az hidrojenlenmiş olana hidroksi grubu eklenir.
5. Polimerizasyon. Özel bir ekleme durumu, alkenlerin polimerizasyon reaksiyonudur:
Bu ekleme reaksiyonu, bir serbest radikal mekanizması ile ilerler.
oksidasyon reaksiyonları
Herhangi bir organik bileşik gibi, alkenler de CO2 ve H20 oluşturmak için oksijende yanar.
Çözeltilerde oksidasyona dirençli olan alkanların aksine, alkenler sulu potasyum permanganat çözeltileri ile kolayca oksitlenir. Nötr veya hafif alkali çözeltilerde, alkenler diollere (dihidrik alkoller) oksitlenir ve oksidasyondan önce aralarında çift bağ bulunan atomlara hidroksil grupları bağlanır.
Bildiğiniz gibi, doymamış hidrokarbonlar - alkenler katılma reaksiyonlarına girebilirler. Bu reaksiyonların çoğu elektrofilik ekleme mekanizmasıyla ilerler.
elektrofilik ekleme
Elektrofilik reaksiyonlar, elektrofillerin - örneğin doldurulmamış bir yörünge gibi elektron yoğunluğu olmayan parçacıklar - etkisi altında meydana gelen reaksiyonlardır. En basit elektrofilik parçacık hidrojen katyonudur. Hidrojen atomunun yörüngedeki 3'ü başına bir elektrona sahip olduğu bilinmektedir. Bir atom bu elektronu kaybettiğinde bir hidrojen katyonu oluşur, bu nedenle hidrojen katyonunun hiç elektronu yoktur:
H - 1e - -> H +
Bu durumda, katyon oldukça yüksek bir elektron ilgisine sahiptir. Bu faktörlerin kombinasyonu, hidrojen katyonunu oldukça güçlü bir elektrofilik parçacık yapar.
Asitlerin elektrolitik ayrışması sırasında bir hidrojen katyonunun oluşumu mümkündür:
HBr -> H + + Br -
Bu nedenle asitlerin varlığında ve katılımıyla birçok elektrofilik reaksiyon meydana gelir.
Elektrofilik parçacıklar, daha önce belirtildiği gibi, artan elektron yoğunluğuna sahip bölgeleri içeren sistemler üzerinde hareket eder. Böyle bir sistemin bir örneği, çoklu (ikili veya üçlü) bir karbon-karbon bağı olabilir.
Aralarında bir çift bağın oluştuğu karbon atomlarının sp2 hibridizasyonu halinde olduğunu zaten biliyorsunuz. Aynı düzlemde bulunan komşu karbon atomlarının hibritleşmemiş p-orbitalleri üst üste binerek oluşur. P z-bağından daha az güçlü olan ve en önemlisi, harici bir elektrik alanının etkisi altında kolayca polarize olan -bağ. Bu, pozitif yüklü bir parçacık yaklaştığında, TC bağının elektronlarının onun yönünde yer değiştirdiği ve sözde P- karmaşık.
ortaya çıktı P-kompleks ve bir hidrojen katyonunun eklenmesi üzerine P-bağlantılar. Hidrojen katyonu, olduğu gibi, molekül düzleminden çıkıntı yapan bir elektron yoğunluğuna rastlar. P-bağlar ve ona katılır. ![]()
Bir sonraki aşamada, elektron çiftinin tamamen yer değiştirmesi gerçekleşir. P-karbon atomlarından birine bağlanır, bu da üzerinde yalnız bir elektron çiftinin görünmesine yol açar. Bu çiftin üzerinde bulunduğu karbon atomunun yörüngesi ve hidrojen katyonunun doldurulmamış yörüngesi üst üste biner, bu da verici-alıcı mekanizma tarafından bir kovalent bağ oluşumuna yol açar. Aynı zamanda, ikinci karbon atomu doldurulmamış bir yörünge, yani pozitif bir yük olarak kalır.
Ortaya çıkan parçacık, karbon atomu üzerinde pozitif bir yük içerdiğinden karbokatyon olarak adlandırılır. Bu parçacık, ortaklanmamış bir elektron çiftine, yani bir nükleofile sahip bir parçacık olan herhangi bir anyonla birleşebilir.
Etenin hidrobrominasyon (hidrojen bromür ilavesi) örneğini kullanarak elektrofilik ilave reaksiyonunun mekanizmasını düşünün:
CH2= CH2 + HBr --> CHBr-CH3
Reaksiyon, bir hidrojen bromür molekülünün ayrışmasının bir sonucu olarak ortaya çıkan bir hidrojen katyonu olan elektrofilik bir partikül oluşumu ile başlar.
hidrojen katyon saldırıları P- bağlantı, biçimlendirme P- hızla karbonhidrata dönüşen bir kompleks: 
Şimdi daha karmaşık bir durumu ele alalım.
Hidrojen bromürün etene katılma reaksiyonu açık bir şekilde ilerler ve hidrojen bromürün propen ile etkileşimi teorik olarak iki ürün verebilir: 1-bromopropan ve 2-bromopropan. Deneysel veriler esas olarak 2-bromopropanın elde edildiğini göstermektedir.
Bunu açıklamak için, bir ara parçacığı - bir karbokasyonu - ele almamız gerekecek.
Propene bir hidrojen katyonunun eklenmesi, iki karbokatyonun oluşumuna yol açabilir: eğer hidrojen katyonu, zincirin sonundaki atoma, birinci karbon atomuna, ardından ikincisi, yani molekülün merkezi (1), pozitif bir yüke sahip olacaktır; ikinciye katılırsa, birinci atom (2) pozitif bir yüke sahip olacaktır. 
Reaksiyonun tercih edilen yönü, reaksiyon ortamında hangi karbokasyonun daha fazla olacağına bağlı olacaktır ve bu da karbokasyonun stabilitesi ile belirlenir. Deney, 2-bromopropanın baskın oluşumunu göstermektedir. Bu, merkez atomda pozitif bir yük ile karbokatyon (1) oluşumunun daha büyük ölçüde gerçekleştiği anlamına gelir.
Bu karbokatyonun daha fazla kararlılığı, merkezi karbon atomundaki pozitif yükün, toplam etkisi bir etil grubunun +/- etkisinden daha yüksek olan iki metil grubunun pozitif endüktif etkisi ile telafi edilmesi gerçeğiyle açıklanmaktadır:
Alkenlerin hidrohalojenlenmesinin reaksiyon kalıpları, yukarıda bahsedildiği gibi kendi adını taşıyan kuralı formüle eden A. M. Butlerov'un öğrencisi olan ünlü Rus kimyager V. V. Markovnikov tarafından incelenmiştir.
Bu kural ampirik olarak, yani ampirik olarak kurulmuştur. Şu anda, tamamen ikna edici bir açıklama yapabiliriz.
İlginç bir şekilde, diğer elektrofilik katılma reaksiyonları da Markovnikov kuralına uyar, bu nedenle onu daha genel bir biçimde formüle etmek doğru olur.
Elektrofilik katılma reaksiyonlarında, daha fazla hidrojenlenmiş bir karbon atomuna bir elektrofil (doldurulmamış bir yörüngeye sahip bir parçacık) ve daha az hidrojenlenmiş bir karbon atomuna bir nükleofil (yalnız bir elektron çiftine sahip bir parçacık) bağlanır.
polimerizasyon
Ekleme reaksiyonunun özel bir durumu, alkenlerin ve türevlerinin polimerizasyonudur. Bu reaksiyon, serbest radikal ekleme mekanizması ile ilerler:
Polimerizasyon, bir serbest radikal kaynağı olan başlatıcılar - peroksit bileşikleri varlığında gerçekleştirilir. Peroksit bileşikleri, molekülleri -O-O- grubunu içeren maddeler olarak adlandırılır. En basit peroksit bileşiği, hidrojen peroksit HOOH'dir.
100 °C'lik bir sıcaklıkta ve 100 MPa'lık bir basınçta, kararsız bir oksijen-oksijen bağının homolizi meydana gelir ve polimerizasyon başlatıcıları olan radikallerin oluşumu meydana gelir. KO- radikallerinin etkisi altında, bir serbest radikal katılma reaksiyonu olarak gelişen polimerizasyon başlatılır. Zincir büyümesi, reaksiyon karışımı radikalleri yeniden birleştirdiğinde durur - polimer zinciri ve radikaller veya KOCH2CH2-.
Çift bağ içeren maddelerin serbest radikal polimerizasyon reaksiyonu kullanılarak çok sayıda makromoleküler bileşik elde edilir: 
Alkenlerin çeşitli sübstitüentlerle kullanılması, çok çeşitli özelliklere sahip çok çeşitli polimerik malzemelerin sentezlenmesini mümkün kılar. 
Tüm bu polimerik bileşikler, insan faaliyetinin çeşitli alanlarında yaygın olarak kullanılmaktadır - endüstri, tıp, biyokimyasal laboratuvarlar için ekipman imalatında kullanılır, bazıları diğer makromoleküler bileşiklerin sentezi için ara maddelerdir.
Oksidasyon
Nötr veya hafif alkali çözeltilerde alkenlerin diollere (dihidrik alkoller) oksitlendiğini zaten biliyorsunuz. Asidik bir ortamda (sülfürik asitle asitleştirilmiş bir çözelti), çift bağ tamamen yok edilir ve aralarında çift bağ bulunan karbon atomları, karboksil grubunun karbon atomlarına dönüştürülür: 
Alkenlerin yıkıcı oksidasyonu, yapılarını belirlemek için kullanılabilir. Yani, örneğin, bazı alkenlerin oksidasyonu sırasında asetik ve propiyonik asitler elde edilirse, bu, penten-2'nin oksidasyona uğradığı anlamına gelir ve butirik (bütanoik) asit ve karbondioksit elde edilirse, o zaman ilk hidrokarbon pentendir. -1.
Başvuru
Alkenler, kimya endüstrisinde çeşitli organik madde ve malzemelerin üretimi için hammadde olarak yaygın olarak kullanılmaktadır.
Örneğin, eten, etanol, etilen glikol, epoksitler, dikloroetan üretimi için başlangıç materyalidir.
Ambalaj filmlerinin, tabakların, boruların ve elektrik yalıtım malzemelerinin üretiminde kullanılan polietilene büyük miktarda eten işlenir.
Gliserin, aseton, izopropanol, propenden çözücüler elde edilir. Propenin polimerizasyonu, birçok açıdan polietilenden üstün olan polipropilen üretir: daha yüksek bir erime noktasına ve kimyasal dirence sahiptir.
Şu anda, benzersiz özelliklere sahip lifler, polietilen analogları olan polimerlerden üretilmektedir. Örneğin, polipropilen elyaf, bilinen tüm sentetik elyaflardan daha güçlüdür.
Bu liflerden yapılan malzemeler umut vericidir ve insan faaliyetinin çeşitli alanlarında giderek daha fazla kullanılmaktadır.

1. Alkenlerin karakteristiği ne tür izomerizmdir? Penten-1'in olası izomerlerinin formüllerini yazın.
2. Aşağıdakilerden hangi bileşikler elde edilebilir: a) izobuten (2-metilpropen); b) buten-2; c) büten-1? Karşılık gelen reaksiyonlar için denklemleri yazın.
3. Aşağıdaki dönüşüm zincirini deşifre edin. A, B, C bileşiklerini adlandırın. 4. 1-kloro-propandan 2-kloropropan elde etmek için bir yöntem önerin. Karşılık gelen reaksiyonlar için denklemleri yazın.
5. Etan'ı etilen safsızlıklarından arındırmak için bir yöntem önerin. Karşılık gelen reaksiyonlar için denklemleri yazın.
6. Doymuş ve doymamış hidrokarbonları ayırt etmek için kullanılabilecek reaksiyonlara örnekler verin.
7. 2,8 g alkenin tam hidrojenasyonu, 0,896 1 hidrojen (n.a.) tüketmiştir. Normal bir karbon atomu zincirine sahip olan bu bileşiğin moleküler ağırlığı ve yapısal formülü nedir?
8. Bu gazın 20 cm3'ünü tamamen yakmak için 90 cm3 (n.a.) oksijen gerektiği biliniyorsa, silindirde hangi gaz vardır (eten veya propen)?
9*. Bir alken karanlıkta klor ile tepkimeye girdiğinde 25,4 g diklorür, aynı kütledeki bu alken karbon tetraklorürde bromla tepkimeye girdiğinde 43,2 g dibromür oluşur. Başlangıç alkeninin tüm olası yapısal formüllerini ayarlayın.
keşif geçmişi
Yukarıdaki malzemeden, etilenin, bir çift bağı olan homolog doymamış hidrokarbon serisinin atası olduğunu zaten anladık. Formülleri C n H 2n'dir ve alkenler olarak adlandırılırlar.
1669'da Alman doktor ve kimyager Becher, sülfürik asidin etil alkol üzerindeki etkisiyle etileni elde eden ilk kişi oldu. Becher, etilenin metandan daha reaktif olduğunu buldu. Ancak ne yazık ki o dönemde bilim adamı alınan gazı tanımlayamadı, bu nedenle ona herhangi bir isim vermedi.
Kısa bir süre sonra Hollandalı kimyagerler de aynı yöntemi etilen elde etmek için kullandılar. Ve klor ile etkileşime girdiğinde yağlı bir sıvı oluşturma yeteneğine sahip olduğu için buna göre "oksijen gazı" adını aldı. Daha sonra bu sıvının dikloroetan olduğu anlaşıldı.
Fransızca'da "yağlı" terimi kulağa oléfiant gibi geliyor. Ve bu türden diğer hidrokarbonlar keşfedildikten sonra, bir Fransız kimyacı ve bilim adamı olan Antoine Fourcroix, tüm olefinler veya alkenler sınıfı için ortak hale gelen yeni bir terim ortaya koydu.
Ancak daha on dokuzuncu yüzyılın başında, Fransız kimyager J. Gay-Lussac, etanolün yalnızca "yağlı" gazdan değil, aynı zamanda sudan da oluştuğunu gösterdi. Ayrıca etil klorürde de aynı gaz bulundu.
Ve kimyagerler, etilenin hidrojen ve karbondan oluştuğunu belirlemelerine ve maddelerin bileşimini zaten bilmelerine rağmen, gerçek formülünü uzun süre bulamadılar. Ve sadece 1862'de E. Erlenmeyer, etilen molekülünde bir çift bağın varlığını kanıtlamayı başardı. Bu, Rus bilim adamı A. M. Butlerov tarafından da kabul edildi ve bu bakış açısının doğruluğunu deneysel olarak doğruladı.
Alkenlerin doğada bulunması ve fizyolojik rolü
Birçoğu, alkenlerin doğada nerede bulunabileceği sorusuyla ilgileniyor. Dolayısıyla, en basit temsilcisi olan etilen bitkiler için bir hormon olduğundan ve içlerinde yalnızca küçük miktarlarda sentezlendiğinden, doğada pratik olarak oluşmadıkları ortaya çıktı.
Doğru, doğada muscalur gibi bir alken var. Bu doğal alkenlerden biri, dişi ev sineğinin cinsel çekicisidir.
Yüksek konsantrasyona sahip olan düşük alkenlerin, mukoza zarının kasılmalarına ve tahrişine neden olabilecek narkotik bir etkiye sahip olduğuna dikkat etmeye değer.
alkenlerin uygulanması
Modern toplumun yaşamını bugün polimerik malzemeler kullanılmadan hayal etmek zor. Doğal malzemelerden farklı olarak polimerler farklı özelliklere sahip olduklarından, işlenmeleri kolaydır ve fiyatlarına bakarsanız nispeten ucuzdurlar. Polimerlerin lehine olan bir diğer önemli husus da birçoğunun geri dönüştürülebilir olmasıdır.
Alkenler, uygulamalarını plastik, kauçuk, film, teflon, etil alkol, asetaldehit ve diğer organik bileşiklerin üretiminde bulmuştur.

Tarımda meyve olgunlaşma sürecini hızlandıran bir araç olarak kullanılır. Propilen ve bütilenler, çeşitli polimerler ve alkoller üretmek için kullanılır. Ancak sentetik kauçuk üretiminde izobutilen kullanılır. Bu nedenle, en önemli kimyasal hammaddeler oldukları için alkenlerden vazgeçilemeyeceği sonucuna varabiliriz.
Etilenin endüstriyel kullanımı
Endüstriyel ölçekte, propilen genellikle polipropilen sentezi ve izopropanol, gliserol, bütirik aldehitler vb. üretimi için kullanılır. Her yıl propilen ihtiyacı artar.

4.3.b. Hidrojen halojenürlerin eklenmesi (hidrohalojenasyon)
Alkenlere elektrofilik ilavenin bir diğer önemli reaksiyonu, alkenlerin uzun süredir bilinen hidrohalojenasyonudur.
Aşağıdakiler, çeşitli alkenlere HCI, HBr ve HI ilavesinin tipik örnekleridir.


Alkil sübstitüentlerinin çift bağ üzerindeki ilave oranı üzerindeki etkisi aşağıdaki sırayla açıklanmaktadır:
R2C=CHR > RCH=CHR > RCH=CH2
Bu, reaksiyonun hız belirleyici adımının bir karbokatyon oluşumu olduğu mekanizma ile tutarlıdır, çünkü alkil katyonlarının stabilitesi üçüncül > ikincil > birincil serilerde azalır. Bu nedenle, ekleme mekanizması, ya nadir görülen bir serbest karbokatyonun ya da karbokatyonik karaktere sahip bir ara maddenin ara oluşumunu içermelidir. Son durum en tipik olanıdır.
Ekleme bir "serbest karbokatyon" yoluyla gerçekleştiyse, alkil katyonları düzlemsel bir yapıya sahip olduğundan, reaksiyon tamamen stereoselektif olmayacaktır. Bununla birlikte, hidrohalojenasyon, kural olarak, stereoseçici olarak ilerler ve alken tipine bağlı olarak, seçici anti- bağlantı, seçici eş- veya karışık eş-anti- katılım.
Çift bağın bir aromatik halka ile konjuge olmadığı alkenler için karakteristiktir. anti- bir hidrojen halojenürün eklenmesi. Anti- sikloheksen, siklopenten, 1,2-dimetilheksen, 1,2-dimetilpenten için hidrojen klorür ve hidrojen bromür, döteryum klorür ve bromür ilavesi gözlenir, cis- Ve trans-büten-2, heksen-3 ve diğer birçok basit alken ve sikloalken.

Ekleme ürününde, aynı ikame ediciler (metil grupları), sikloheksan halkasının orta düzleminin zıt taraflarında bulunur, bu nedenle aittir. trans-sıra. Anti-ekleme, ayrı bir karbokasyon oluşumunun varsayıldığı mekanizma ile pek uyumlu değildir. Düzlemsel bir karbonhidrat için, halojenür iyonunun nükleofilik saldırısı, bir ürün karışımının oluşumuna yol açması gereken düzlemin her iki tarafında eşit derecede olasıdır. eş- Ve anti- bağlantılar. Alken hidrohalojenasyonunun kinetiği ayrıca daha karmaşık bir ekleme mekanizmasına işaret eder. Konjuge olmayan alkenler için reaksiyon hızı, üçüncü dereceden bir denklem ile ikinci dereceden hidrojen halojenür cinsinden tanımlanır, yani Ad E3 mekanizmasına karşılık gelir.
v = k [alken] 2
Hidrojen halojenüre ilişkin anti-adisyon ve ikinci dereceden reaksiyon, bir alkenin, biri elektrofilik ve diğeri nükleofilik bir ajan olarak işlev gören iki hidrojen halojenür molekülü ile reaksiyona girdiği Ad E3 mekanizması ile iyi bir uyum içindedir.

Böyle bir trimoleküler mekanizma, başlangıçta bir alken ve bir hidrojen halojenür molekülünden oluşan bir kompleksin oluştuğunu, ardından bu komplekse ikinci bir HX molekülünün anti-ayrık bir karbokasyon oluşumu olmadan taraflar. Üç molekülün aynı anda çarpışması son derece olası olmadığından, herhangi bir trimoleküler mekanizmanın iki ardışık aşamadan oluşması gerektiğine özellikle dikkat edilmelidir.

Anti-addition, alkenin protonlandığı tarafın karşısındaki taraftan hidrojen halojenürün tercihli bir nükleofilik saldırısını gösterir. Hidrojen halojenür yerine nükleofilik ajanın son aşamadaki işlevi halojenür iyonu tarafından da gerçekleştirilebilir. Gerçekte, reaksiyon hızı genellikle reaksiyon karışımına tetraalkilamonyum halojenürler NR 4+ X formunda katılan halojenür iyonunun konsantrasyonuyla doğru orantılı olarak artar. - veya lityum LiX. Bu durumda, stereospesifik anti- katılım.
Çift bağın bir aromatik halka ile konjuge olduğu alkanlar için karakteristiktir. eş- bağlantı veya karışık eş-anti-bir hidrojen halojenürün eklenmesi, örneğin:

Syn-attachment, baskın olan süreçtir. cis- Ve trans-1-fenilpropen, 1-fenil-4-alkilsikloheksen, asenaftilen, inden izomerleri. Bu tür alkenlerin protonasyonu, geleneksel alkenlerin ve sikloalkenlerin protonasyonundan kaynaklanan saf alkil katyonlarından daha kararlı olan benzil tipi karbokatyonların oluşumuyla sonuçlanır. Bu durumda reaksiyon kinetiği genellikle daha basit bir ikinci dereceden denklem v = k[alken] ile tanımlanır, yani bimoleküler Ad E2 mekanizmasına karşılık gelir. Ad E2 mekanizması, bir karbokatyon ve bir halojenür iyonu içeren bir iyon çiftinin oluşumunu içerir.

İyon çiftlerini içeren ekleme mekanizmasının oldukça stereoselektif olması beklenemez. İyon çifti, basit bir karbon-karbon bağı etrafındaki dönüşten daha hızlı nihai ürüne dönüşürse, sonuç şu olacaktır: eş-ekleme, çift bağın aynı tarafına bir proton ve bir halojenür iyonunun bağlandığı yer. Aksi halde ürünlerin oluşumu şu şekilde gözlenir: eş- yani ve anti- HX bağlantıları. Böyle bir durum hidrohalojenasyon sırasında gerçekleşir. çift-ikameli stirenler Z-C6H4 -CH=CH2. Burada gözlemlenen model, eş-ekleme, yalnızca protonlandığında nispeten kararlı bir karbokatyon veren olefinler için tipiktir, yani donör sübstitüentleri Z durumunda.
Ad E2 mekanizmasına göre ilerleyen hidrohalojenasyon reaksiyonları, bir ara madde olarak bir karbokatyon veya bir iyon çifti oluştuğundan, konjuge ekleme ve yeniden düzenleme süreçleri arasındaki rekabet ile karakterize edilir.

Bir alkil grubu ve bir hidrit iyonunun 1,2 göçü ile yeniden düzenlemelerin bir örneği olarak, sırasıyla tert-bütiletilen ve izopropiletilenin hidrohalojenasyon reaksiyonlarını sunuyoruz.

Soğukta (-78 0 C) aynı reaksiyon solventsiz yapıldığında %33 normal ve %67 anormal (yeniden düzenlenmiş) ilave ürünlerden oluşan bir karışım oluşur.

4.3.c. Oryantasyon. Markovnikov'un kuralı
Simetrik elektrofillerin (Hal 2) aksine, hidrojen halojenürler simetrik olmayan elektrofilik reaktiflerdir. Simetrik olmayan bir alkene herhangi bir simetrik olmayan elektrofilin (HBr, ICl, H20, Hg(OAc)2, vb.) eklenmesi prensipte iki alternatif ürünün bir karışımını verebilir, ancak pratikte genellikle bunlardan yalnızca biri oluşur. Örnek olarak, propilene hidrojen bromür eklenmesini düşünün.

1870'de V.V. Markovnikov, simetrik olmayan alkenlerin HX'i, ağırlıklı olarak hidrojenin çift bağın en az ikame edilen ucuna ve X'in en çok ikame edilen ucuna eklendiği bir ürün oluşturacak şekilde eklediği ampirik bir kural formüle etti.
Genellikle Markovnikov'un kuralı, iki alternatif karbonhidratın stabilitesindeki farkla açıklanır. Örneğin, yukarıdaki örnekte, normal N-propil katyon, izopropil katyondan çok daha az kararlıdır ve bu nedenle reaksiyon ikinci yol boyunca ilerler.
Markovnikov kuralı başlangıçta yalnızca HX'in hidrokarbon substratlara eklenmesi için kullanıldı, ancak prensipte diğer ikame edilmiş alkenlerin reaksiyonlarına genişletilebilir. Yani, CF3CH=CH2'ye HCl eklenmesi " anti-Markovnikov "ürün CF 3 CH 2 CH 2 Cl. CF 3 CH + CH 3 katyonu, güçlü (-I) etkisi nedeniyle CF 3 CH 2 CH 2+ katyonundan daha az kararlı olduğu için bu beklenebilirdi. CF 3 -grubu Katyon CF 3 CH 2 CH 2+ ağırlıklı olarak oluşur, fakat aynı zamanda, daha az ölçüde de olsa, CF 3 grubunun endüktif etkisi ile kararsız hale gelir, bunun sonucunda HCI ilavesi triflorometiletilen, sübstitüe edilmemiş etilene ilaveden çok daha yavaştır.
Benzer bir nedenle, viniltrialkilamonyum katyonları da Markovnikov kuralına karşı HBr ekler:
Güçlü (-I) ve (-M) sübstitüentli alkenlere, örneğin akrilonitril veya nitroetilene HX ilavesi de Markovnikov kuralına aykırı olmalıdır. Bununla birlikte, bu durumda çift bağ, elektrofilik reaktiflere göre o kadar güçlü bir şekilde devre dışı bırakılır ki, bu reaksiyonlar yalnızca çok şiddetli koşullar altında gerçekleşir. Vinil klorür CH2=CHCl her zaman münhasıran "Markovnikov eklentileri" verir. Örneğin HCI ile reaksiyona girdiğinde sadece 1,1-dikloroetan (geminal diklorür) CH3CHCl2 oluşur. Klor, CF 3 grubuna benzer şekilde, güçlü bir (-I) etkiye sahiptir ve ilk bakışta, katyon + CH2CH2Cl olması gerektiğinden, bu nedenle eklemenin anti-Markovnikov yönelimine sahip olması gerektiği görülmektedir. katyon CH3CH + Cl'den daha kararlı. Bununla birlikte, CF 3 grubundan farklı olarak, klor, (-I) etkisine ek olarak, onu etkisiz hale getiren (+ M) bir etkiye de sahiptir (çünkü yalnız çiftleri vardır). Deneyimler, mezomerik etkinin büyüklüğünün, 1-kloroetil katyonun enerjisini, +M etkisinin kendini göstermediği 2-kloroetil katyonun enerji seviyesinin altına düşürmek için oldukça yeterli olduğunu göstermektedir.
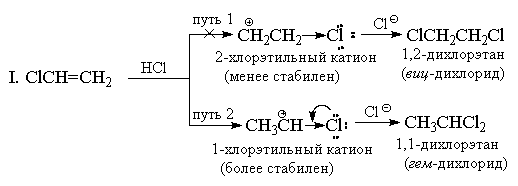
II. Rezonans teorisi açısından, 1-kloroetil katyonun yapısı aşağıdaki gibi temsil edilebilir:
Bununla birlikte, aynı koşullar altında, yani toplam etkiye (-I> +M) göre, vinil klorüre ekleme etilenden daha yavaş gerçekleşir, klor, hidrojene kıyasla elektron çeken bir ikame edici olarak kalır ve 1-kloroetil katyonu C2H5+'dan daha az kararlı. Diğer vinil halojenürler, HX ile benzer şekilde reaksiyona girer.
Vinil eterler CH2=CHOR, Markovnikov kuralına göre yukarıda listelenen tüm ikame edilmiş alkenlerden çok daha yüksek oranda HX (X=Hal) ekler. Bu, RO grubunun önemli +M etkisinden kaynaklanmaktadır. Klor atomunun aksine, toplam elektronik etki (+M > -I) açısından RO grubu, komşu karbokatyonik merkezi etkili bir şekilde stabilize eden güçlü bir elektron veren ikame edicidir. Bu durumda karbokasyonun yapısı, iki rezonans yapısından oluşan bir set olarak da temsil edilebilir.
Oksonyum katyonunun bir halojenür anyonu ile saldırısı, CH3CH(Hal)OR tipi a-haloesterlerin oluşumuna yol açar.
4.3.d. alkenlerin hidrasyonu
Alkenlerin asit katalizli hidrasyonu alkollerin oluşumuna yol açar. Alkenlerin hidrasyon yönü Markovnikov kuralı ile belirlenir, bu nedenle bu reaksiyonda bir ara parçacık olarak bir karbonhidratın oluştuğu varsayılır.
İkincil alkil karbokatyonların kendilerini yeniden düzenleme eğilimi, ikincil alkoller elde etmek için alkenlerin hidrasyonunun kullanılmasını engeller.

Laboratuvardaki bu yöntem, yalnızca üçüncül alkollerin hazırlanması için sınırlı bir kapsam bulmuştur. Bu durumda hidrasyon reaksiyonu büyük ölçüde tersine çevrilebilir ve düşük verimle (%40-45) tersiyer alkoller oluşur.


En basit alkenlerin - etilen ve propilen - hidrasyonu, etil ve izopropil alkollerin elde edilmesi için önemli bir endüstriyel yöntemdir.

Laboratuvar uygulamasında, alkenlerin doğrudan hidrasyonu, hem zorlu koşullar nedeniyle hem de önemli miktarda izomerik alkol oluşumu nedeniyle geniş uygulama alanı bulmamıştır. Şu anda, ilgili hidroksimerkürasyon-demerkürasyon reaksiyonu, alkenlerden alkollerin bölgesel seçici üretimi için yaygın olarak kullanılmaktadır.
4.3.e. Hidroksimerkürasyon-demerkürasyon
Bir alkenin çift bağına elektrofilik saldırı, aralarında cıva (II) katyonunun özel bir konuma sahip olduğu metal iyonları tarafından gerçekleştirilebilir. 20 0 C'de çok yumuşak koşullar altında cıva asetat, organcıva bileşikleri oluşturmak için sulu tetrahidrofuran (THF) veya sulu asetik asit içindeki alkenlere eklenir. Çift bağa cıva asetatın eklenmesi, bölgesel olarak Markovnikov kuralına tam olarak uygun olarak ilerler, yani cıva katyonu en az ikame edilmiş karbon atomuna bağlanır.
Organcıva bileşiklerindeki C-Hg bağı, cıva ve yeni bir C-H bağı oluşturmak için sodyum borohidrit NaBH4 ile kolaylıkla parçalanabilir. Alkil cıva hidrürün kararsız bir ara madde olarak elde edildiği ve bunun da radikal bir mekanizma ile metalik cıvanın salınmasıyla ayrıştığı varsayılmaktadır.

Özetle, bu iki aşamalı hidroksimerkürasyon-demerkürasyon işlemi, nihai olarak, yan ürünlerin oluşumu mümkün olan maksimum minimuma indirildiğinde, son derece yumuşak koşullar altında Markovnikov kuralına göre bölgeye özgü alken hidrasyonunu temsil eder. Bu, reaksiyon ürünlerinin toplam veriminin %90-98 olduğu aşağıdaki örneklerle açıkça gösterilebilir. Bu durumda verilen sayısal veriler, oluşan bileşiklerin verimlerini değil, karışım içindeki oranlarını gösterir.




Yukarıdaki örneklerden görülebileceği gibi, çoğu durumda alkenlerin hidroksimerkürasyon-demerkürasyonu, pratik olarak iki izomerik alkolden yalnızca birinin oluşumu ile alkenlerin bölgeye özgü hidrasyonunu sağlar. Organcıva bileşiğini izole etmeye gerek olmadığı ve her iki işlemin de doğrudan birbiri ardına gerçekleştirilebileceği belirtilmelidir.
Simetrik olmayan alkenlerin hidroksimerkürasyonu, görünüşe göre AcOHg + katyonunun saldırısı ve bir ara madde olarak simetrik olmayan bir siklik merkürinyum katyonunun (simetrik olmayan halonyum iyonuna benzer) oluşumu ile başlar ve daha sonra en fazla su tarafından nükleofilik bir saldırı sonucu açılır. daha büyük bir pozitif yük taşıyan ikame edilmiş karbon atomu.

Köprü oluşturan cıva iyonu, florosülfonik asit ve antimon pentaflorür karışımı içinde daha güçlü bir elektrofilik ajan olan cıva trifloroasetat eklenerek 20 0 C'de bile nükleofilik olmayan kuvvetli asidik bir ortamda sabitlenebilir.

Cıva katyonu yalnızca suyun etkisiyle değil, aynı zamanda diğer elektron veren çözücülerle de ayrılabilir: alkoller, asetik asit, asetonitril, vb. Bu durumda nihai reaksiyon ürünü eterler, asetatlar veya N-ikameli amidler olacaktır. sırasıyla asetik asit, örneğin:


Alkoksimerkürasyon-demerkürasyon reaksiyonunda dallanmış ikincil veya üçüncül alkoller kullanıldığında, Hg(OCOCF 3) 2 trifloroasetat veya Hg(OSO 2 CF 3) 2 trifloroasetat, cıva asetattan daha etkilidir.

Bu nedenle, hidroksi- ve alkoksimerkürasyon-demerkürasyon, dallı alkil radikalleri ile alkollerin ve eterlerin sentezi için en iyi hazırlama yöntemlerinden biridir.
Alkenlere cıva tuzlarının eklenmesi, çözücünün dış nükleofilik ajan rolünü oynadığı bir çift bağa konjuge katılma reaksiyonunun en çarpıcı örneğidir. İkili hidroksimerkürasyon-demerkürasyon işleminin stereokimyası, her bir adımın stereokimyasal sonucuna bağlıdır. Hidroksimerkürasyon ile karakterize edilir anti-ekleme, bir siklik katyon içeren diğer reaksiyonlarda olduğu gibi. Bununla birlikte, radikal demerkürasyon, yüksek stereoselektivite ile karakterize edilmez. Bu nedenle, bir bütün olarak tüm süreç de stereospesifik değildir.
4.3.f. Alkenlerin eklenmesi (alkenlerin katyonik dimerizasyonu ve polimerizasyonu)
Bu tip reaksiyonların en ilginç örneği izobutilenin sülfürik asit varlığında dimerizasyonu ve polimerizasyonudur.

Bu alken karışımının teknik adı "diizobütilen"dir. Bu reaksiyon, alkenlerin çift bağına mineral asitlerin eklenmesi mekanizmasına benzer bir katyonik mekanizmaya göre ilerler. İlk adımda, nispeten kararlı bir molekül oluşturmak için bir izobütilen molekülüne bir proton eklenir. tert-bütil katyon. Daha fazla biçimlendirilmiş tert-bütil katyon (Lewis asidi), yeni bir kararlı üçüncül oktil katyon oluşturmak için bir izobütilen molekülü (Lewis bazı) ile reaksiyona girer.

Bu koşullar altında, bazların (H20, HSO4 - iyonlar) etkisi altında, oktil karbokasyonu hızla bir proton kaybeder ve proton ayrılması iki farklı pozisyondan meydana geldiğinden izomerik pentenlerin bir karışımına dönüşür:

Termodinamik olarak daha az kararlı alken - 2,4,4-trimetilpenten-1'in (reaksiyon karışımında %80) tercihli oluşumu, hidrojen atomlarına kıyasla metil gruplarının hidrojen atomlarının baz atağı için daha büyük bir uzamsal erişilebilirlik ile ilişkilidir. metilen grubundandır. Endüstride, "diizobütilen", içten yanmalı motorlar için yüksek oktanlı bir yakıt olarak kullanılan "izooktan" (hidrokarbon 2,2,4-trimetilpentan için teknik ad) üretmek üzere Ni-Raney üzerinde hidrojenlenir.
Yüksek sülfürik asit konsantrasyonlarında (%80'den fazla), izobütilenin katyonik polimerizasyonu, poliizobütilen (-CH2C(CH3)2-)n adı verilen bir polimer oluşturmak üzere meydana gelir. Bu kauçuk benzeri polimer, korozyon önleyici ve su geçirmez kaplamalar, sızdırmazlık malzemeleri vb. elde etmek için kullanılır.
İzobütilene ek olarak, 3-metilbüten-1, vinil eterler ve nispeten kararlı karbokatyonlar oluşturabilen bazı stiren türevleri katyonik mekanizmaya göre polimerize edilir. Katyonik polimerizasyon için katalizör olarak hidrojen florür ve Lewis asitleri de kullanılır: BF3 , AlCl3 , AlBr3 ve diğerleri çok az miktarda su varlığında.
4.3.g. Alkanların eklenmesi (alkenlerin alkilasyonu)
"İzooktan" sentezi için başka bir endüstriyel yöntem, konsantre sülfürik asit veya susuz hidrojen florür varlığında 0 10 0 C'de izobutilenin fazla izobütan ile etkileşimine dayanır.

Bu reaksiyon aynı zamanda katyonik mekanizma yoluyla da ilerler ve özellikle ilgi çekici olan, katyonik zincir sürecine bir örnektir. İlk olarak, izobütilen reaksiyon koşulları altında tersiyer bir oktil katyon (CH3)3CCH2C+ (CH3)2 oluşturmak üzere dimerize olur. Oluşum mekanizması önceki bölümde ayrıntılı olarak açıklanmıştır. Daha sonra, bir "izooktan" molekülünün ve yeni bir tert-bütil katyonun oluşumuyla izobütandan oktil katyona hızlı bir hidrojen transferi (bir hidrit iyonu şeklinde) vardır ve bu da izobütilen ile hızla reaksiyona girerek oluşturmak için yeni bir oktil katyon vb.

"İzooktan" sentezine ek olarak, bu alkilasyon yöntemi, petrokimya endüstrisinde, dallı alkenlerden yüksek kaynama noktalı dallı hidrokarbonların ve termal parçalama fraksiyonuna sahip düşük kaynama noktalı alkanların sentezi için kullanılır.
ALKENLER
Molekülünde basit karbon-karbon ve karbon-hidrojen σ-bağlarına ek olarak karbon-karbon π-bağları bulunan hidrokarbonlara hidrokarbonlar denir. sınırsız. Bir π bağının oluşumu resmen bir molekül tarafından iki hidrojen atomunun kaybına eşdeğer olduğundan, doymamış hidrokarbonlar şunları içerir: 2p sınırdan daha az hidrojen atomu, burada P -π-bağlarının sayısı:
Üyeleri birbirinden (2H)n farklı olan seriye denir. izolojik taraf. Bu nedenle, yukarıdaki şemada, izologlar heksanlar, heksenler, heksadienler, heksinler, heksatrienler vb.'dir.
Bir π-bağı (yani çift bağ) içeren hidrokarbonlar alkenler (olefinler) veya serinin ilk üyesine göre - etilen, etilen hidrokarbonlar. Homolog serileri için genel formül C p H 2n.
1. İsimlendirme
IUPAC kurallarına uygun olarak, alkenlerin isimlerini oluştururken, çift bağ içeren en uzun karbon zinciri, karşılık gelen alkanın adını alır; -tr olarak değiştirildi -tr. Bu zincir, bir çift bağın oluşumunda yer alan karbon atomları mümkün olan en küçük sayıyı alacak şekilde numaralandırılmıştır:

Radikaller, alkanlarda olduğu gibi adlandırılır ve numaralandırılır.
Nispeten basit yapıya sahip alkenler için daha basit isimlere izin verilir. Bu nedenle, en yaygın alkenlerden bazıları sonek eklenerek çağrılır. -tr aynı karbon iskeletine sahip bir hidrokarbon radikalinin adına:
Alkenlerden oluşan hidrokarbon radikalleri son eki alır. -enil. Radikaldeki numaralandırma, serbest değerliğe sahip karbon atomundan başlar. Bununla birlikte, en basit alkenil radikalleri için sistematik isimler yerine önemsiz isimlerin kullanılmasına izin verilir:

Çift bağ oluşturan doymamış karbon atomlarına doğrudan bağlanan hidrojen atomlarına genellikle hidrojen atomları denir. vinil hidrojen atomları,
2. İzomerizm
Alken dizilerinde karbon iskeletinin izomerizmine ek olarak, çift bağın pozisyonunun izomerizmi de vardır. Genel olarak, bu tip izomerizm - ikame konum izomerizmi (fonksiyonlar)- molekülde herhangi bir fonksiyonel grup olduğunda her durumda gözlenir. Alkan C4H10 için iki yapısal izomer mümkündür:
Alken C4H8 (büten) için üç izomer mümkündür:

Butene-1 ve butene-2 , fonksiyonun pozisyonunun izomerleridir (bu durumda rolü bir çift bağ tarafından oynanır).
Uzamsal izomerler, sübstitüentlerin birbirine göre uzamsal düzenlemesinde farklılık gösterir ve buna denir. cis izomerleri, sübstitüentler çift bağın aynı tarafındaysa ve trans izomerler, karşı taraflarda ise:

3. Çift bağ yapısı
Bir molekülün C=C çift bağındaki kırılma enerjisi 611 kJ/mol'dür; σ-bağ C-C'nin enerjisi 339 kJ/mol olduğundan, π bağını kırma enerjisi sadece 611-339 = 272 kJ/mol'dür. π-elektronları, σ-elektronlarından, örneğin polarize edici çözücüler veya herhangi bir saldıran reaktif tarafından etkilenmekten çok daha kolaydır. Bu, σ- ve π-elektronlarının elektron bulutunun dağılımının simetrisindeki farkla açıklanır. P-orbitallerinin maksimum üst üste binmesi ve sonuç olarak molekülün minimum serbest enerjisi, yalnızca vinil parçasının düzlemsel bir yapısı ve 0.134 nm'ye eşit kısaltılmış bir C-C mesafesi ile gerçekleştirilir, yani. tek bir bağla bağlanan karbon atomları arasındaki mesafeden (0,154 nm) çok daha küçüktür. Molekülün "yarılarının" çift bağın ekseni boyunca birbirine göre dönmesiyle, enerji harcamasıyla ilişkili olan orbitallerin üst üste binme derecesi azalır. Bunun sonucu, çift bağın ekseni boyunca serbest dönüşün olmaması ve karbon atomlarında karşılık gelen ikame ile geometrik izomerlerin varlığıdır.
alkenler- bir çift bağ içeren doymamış hidrokarbonlar. Alken örnekleri:

Alken elde etme yöntemleri.
1. Alkanların 400-700°C'de parçalanması. Reaksiyon, serbest radikal mekanizmasına göre ilerler:

2. Alkanların dehidrojenasyonu:
3. Eliminasyon reaksiyonu (bölünme): 2 atom veya 2 atom grubu, komşu karbon atomlarından ayrılır ve bir çift bağ oluşur. Bu reaksiyonlar şunları içerir:
A) Alkollerin dehidrasyonu (su giderici bir reaktif olarak sülfürik asidin katılımıyla 150 ° C'nin üzerinde ısıtma):
B) Alkolik bir alkali çözeltisine maruz kaldığında hidrojen halojenürlerin bölünmesi:

Hidrojen atomu, esas olarak daha az sayıda hidrojen atomuyla (en az hidrojenlenmiş atom) ilişkili olan karbon atomundan ayrılır - Zaitsev'in kuralı.
B) Halojen giderme:

Alkenlerin kimyasal özellikleri.
Alkenlerin özellikleri, çoklu bir bağın varlığıyla belirlenir, bu nedenle alkenler, birkaç aşamada ilerleyen elektrofilik ekleme reaksiyonlarına girerler (H-X - reaktif):
1. aşama:

2. aşama:
 .
.
Bu tür reaksiyonlarda hidrojen iyonu daha negatif yüklü olan karbon atomuna aittir. Yoğunluk dağılımı:

+I-etkisi olarak kendini gösteren bir sübstitüent donör varsa, o zaman elektron yoğunluğu en hidrojene karbon atomuna doğru kayar ve onun üzerinde kısmen negatif bir yük oluşturur. Tepkiler devam ediyor Markovnikov'un kuralı: tipteki polar molekülleri bağlarken HX (HCI, HCN, HOH vb.) simetrik olmayan alkenler için hidrojen tercihen çift bağda daha fazla hidrojenlenmiş karbon atomuna eklenir.
A) Katılma reaksiyonları:
1) Hidrohalojenasyon:
Tepkime Markovnikov kuralına göre ilerler. Ancak reaksiyonda peroksit varsa, kural dikkate alınmaz:
2) Hidrasyon. Reaksiyon, fosforik veya sülfürik asit varlığında Markovnikov kuralına göre ilerler:

3) Halojenasyon. Sonuç olarak, brom suyunun rengi giderilir - bu, çoklu bağa yönelik niteliksel bir reaksiyondur:
4) Hidrojenasyon. Reaksiyon, katalizörlerin varlığında ilerler.



