Η προσρόφηση λαμβάνει χώρα στο όριο της φάσης. Ως εκ τούτου, είναι σκόπιμο να θεωρηθεί η θερμοδυναμική περιγραφή των επιφανειακών φαινομένων ως μια ιδιαίτερη περίπτωση της θερμοδυναμικής των ετερογενών συστημάτων.
Ρύζι. 3.4. Προσρόφηση Gibbs: 1- σύστημα αναφοράς δύο φάσεων, 2- πραγματικό σύστημα δύο φάσεων με ανομοιογενή περιοχή
Η θερμοδυναμική ετερογενών συστημάτων χρήσεις αρχή της προσθετικότητας, που έχει ως εξής: όλες οι εκτεταμένες ιδιότητες ενός ετερογενούς συστήματος είναι ίσες με το άθροισμα των αντίστοιχων εκτεταμένων ιδιοτήτων που θα είχαν οι φάσεις πριν έρθουν σε επαφή.Ας συμβολίσουμε τις φάσεις με α και β (Εικ. 4). Στη συνέχεια, για ένα ιδανικό σύστημα, έτσι ώστε οι ιδιότητες των φάσεων κοντά στη διεπιφάνεια να συμπίπτουν με τις ιδιότητες του όγκου τους, για την εσωτερική ενέργεια U, όγκος V, μάζα (αριθμός moles) n, η εντροπία S μετά την ισορροπία εδραιώνεται σε ένα ετερογενές σύστημα, οι σχέσεις ισχύουν:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
Αυτό προϋποθέτει ότι η θερμοκρασία και η πίεση και στις δύο φάσεις είναι ίδιες.
Για πραγματικά ετερογενή συστήματα, η περιοχή μετάβασης στη διεπαφή μεταξύ δύο φάσεων συμβάλλει επιπλέον στις εκτεταμένες ιδιότητες του συστήματος. Εάν συμβαίνουν επιφανειακά φαινόμενα, θα πρέπει να ληφθεί υπόψη η διαφορά μεταξύ των εκτεταμένων ιδιοτήτων ενός πραγματικού ετερογενούς συστήματος και των εκτεταμένων ιδιοτήτων ενός μοντέλου συστήματος στο οποίο δεν υπάρχουν επιφανειακά φαινόμενα. Ένα τέτοιο σύστημα ονομάζεται σύστημα σύγκρισης. Το σύστημα σύγκρισης έχει τις ίδιες εντατικές παραμέτρους (T, P, C i…) και τον ίδιο όγκο V με το πραγματικό σύστημα (Εικ. 4).
Από θερμοδυναμική άποψη, η τιμή προσρόφησης G νοείται ως η περίσσεια ποσότητα της ουσίας n s, εκφρασμένη σε moles ή γραμμάρια, την οποία έχει ένα πραγματικό ετερογενές σύστημα σε σύγκριση με το σύστημα αναφοράς, σε σχέση με την επιφάνεια της φάσης διαχωρισμός ή στην επιφάνεια του προσροφητικού Α. Θεωρείται ότι το σύστημα σύγκρισης έχει τις ίδιες έντονες παραμέτρους (T, P, C i) και τον ίδιο όγκο (V = V α + V β) με το πραγματικό σύστημα (Εικ. 4).
G \u003d (n - n α - n β) / A \u003d n s / A 3.11
Οι πλεονάζουσες θερμοδυναμικές συναρτήσεις της περιοχής μετάβασης ενός πραγματικού συστήματος (που συμβολίζονται με τον δείκτη s) μπορούν να γραφτούν ως
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S βκαι τα λοιπά.
Οι πειραματικές μετρήσεις της προσρόφησης δίνουν πάντα την προσρόφηση ακριβώς ως περίσσεια ενός συστατικού σε ένα πραγματικό σύστημα σε σύγκριση με το επιλεγμένο σύστημα αναφοράς. Για παράδειγμα, όταν προσροφάται ένα αέριο σε στερεό προσροφητικό ή όταν προσροφάται συστατικά σε στερεά φάση, για να βρεθούν οι τιμές προσρόφησης, η αλλαγή στις αρχικές συγκεντρώσεις του προσροφητικού προσδιορίζεται μετά την επαφή των φάσεων α και β.
n i s = V(C i o - C i),
Οπου C i o– αρχική συγκέντρωση του i-ου συστατικού, Γ iείναι η συγκέντρωση του i-ου συστατικού μετά την αποκατάσταση της ισορροπίας μεταξύ των συνεχόμενων φάσεων. Υποτίθεται ότι ο όγκος Vδεν αλλάζει. Ωστόσο, η συγκέντρωση Εγώ-ο συστατικό Γ i, που λαμβάνεται πειραματικά, προσδιορίζεται στον όγκο V'πάνω από τη διεπαφή χωρίς να λαμβάνεται υπόψη ο όγκος της ανομοιογενούς περιοχής του μεταβατικού στρώματος Vaστη διεπαφή όπου βρίσκεται η συγκέντρωση C i α. Έτσι, λόγω της ύπαρξης μιας ανομοιογενούς περιοχής σε ένα πραγματικό σύστημα, ο συνολικός όγκος του συστήματος μπορεί να αναπαρασταθεί ως V = V' + Vα. Ολόκληρη ποσότητα Εγώ-ο συστατικό C i oκατανέμεται μεταξύ αυτών των δύο τόμων:
V C i o = V' C i + V α C i α,
και τον αριθμό των mol του συστατικού Εγώ, που προσροφάται στη διεπαφή, θα ισούται με
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (C i α – C i) 3.12
Εκείνοι. Η προσρόφηση που προσδιορίζεται πειραματικά είναι μια περίσσεια του i-ου συστατικού στον όγκο V α σε σύγκριση με την ποσότητα αυτού του συστατικού στον ίδιο όγκο μακριά από τη διεπαφή. Αυτός ο τύπος προσρόφησης ονομάζεται προσρόφηση Gibbs. .
V α C i αονομάζεται πλήρες περιεχόμενο Εγώ-ου συστατικού στο στρώμα προσρόφησης. Στην περιοχή πολύ χαμηλών συγκεντρώσεων Γ iσε όγκο V'τροπολογία V α C iΗ εξίσωση (3.2) μπορεί να αγνοηθεί και να ληφθεί υπόψη η μετρούμενη τιμή V α C i απλήρες περιεχόμενο Εγώ-το συστατικό στο στρώμα προσρόφησης, για παράδειγμα, στην προσρόφηση αερίου σε ένα στερεό προσροφητικό σε χαμηλές πιέσεις.
Θερμοδυναμική διεργασιών προσρόφησης.
| Όνομα παραμέτρου | Εννοια |
| Θέμα άρθρου: | Θερμοδυναμική διεργασιών προσρόφησης. |
| Ρουμπρίκα (θεματική κατηγορία) | Εκπαίδευση |
Βασικοί ορισμοί και μέθοδοι ταξινόμησης διεργασιών προσρόφησης.
Η προσρόφηση αναφέρεται σε φαινόμενα που συμβαίνουν ως αποτέλεσμα της αυθόρμητης μείωσης της επιφανειακής ενέργειας.
Προσρόφηση- η διαδικασία της αυθόρμητης αναστρέψιμης ή μη αναστρέψιμης ανακατανομής των συστατικών ενός ετερογενούς συστήματος μεταξύ του επιφανειακού στρώματος και του όγκου μιας ομοιογενούς φάσης.
Σε συστήματα πολλαπλών συστατικών, το εξάρτημα που μειώνει τη διεπιφανειακή τάση είναι προτιμότερο από το επιφανειακό στρώμα. Στα μονοσυστατικά συστήματα, κατά το σχηματισμό ενός επιφανειακού στρώματος, η δομή του αλλάζει (ορισμένος προσανατολισμός ατόμων και μορίων, πόλωση), που ονομάζεται αυτοπροσρόφηση.
Η πυκνότερη φάση στην οποία εντοπίζονται οι αλληλεπιδράσεις προσρόφησης ονομάζεται προσροφητικόν. Η ουσία που ανακατανέμεται μεταξύ του όγκου της ομοιογενούς φάσης και του επιφανειακού στρώματος υποδηλώνεται με τον όρο ʼʼ προσροφώʼʼ.
Σε ορισμένες περιπτώσεις, η διαδικασία προσρόφησης είναι αναστρέψιμη. Σε αυτήν την περίπτωση, υπό ορισμένες συνθήκες, μέρος των προσροφημένων μορίων μπορεί να περάσει από το επιφανειακό στρώμα στον όγκο της φάσης ως αποτέλεσμα μοριακών κινητικών φαινομένων. Η αντίστροφη διαδικασία προσρόφησης ονομάζεται εκρόφηση.
Μέθοδοι ταξινόμησης διεργασιών προσρόφησης.
Ταξινόμηση των διεργασιών προσρόφησης σύμφωνα με την κατάσταση συσσωμάτωσης των φάσεων που αλληλεπιδρούν.Λαμβάνοντας υπόψη την εξάρτηση από τη συνολική κατάσταση των παρακείμενων φάσεων, διακρίνονται οι ακόλουθοι τύποι διαδικασιών προσρόφησης:
Προσρόφηση αερίων σε στερεά προσροφητικά.
Προσρόφηση διαλυμένων ουσιών στις διεπιφάνειες ʼʼστερεό-υγρόʼʼ και ʼʼυγρό-υγρόʼ.
Προσρόφηση επιφανειοδραστικών ουσιών στη διεπιφάνεια ʼʼυγρού-αερίουʼʼ.
Ταξινόμηση των διεργασιών προσρόφησης σύμφωνα με τον μηχανισμό αλληλεπίδρασης του προσροφητικού και του προσροφητικού.Η προσρόφηση μπορεί να θεωρηθεί ως η αλληλεπίδραση των μορίων του προσροφητικού με τα ενεργά κέντρα του προσροφητικού. Σύμφωνα με τον μηχανισμό της αλληλεπίδρασής τους, υποδιαιρούνται οι ακόλουθοι τύποι προσρόφησης:
1) φυσική (μοριακή) προσρόφηση- η αλληλεπίδραση μεταξύ των μορίων του προσροφητικού και του προσροφητικού πραγματοποιείται λόγω των δυνάμεων van der Waals, των δεσμών υδρογόνου (χωρίς την εμφάνιση χημικών αντιδράσεων).
2) χημική προσρόφηση (χημειορρόφηση)– η προσκόλληση μορίων προσροφητικού στις ενεργές θέσεις του προσροφητικού συμβαίνει ως αποτέλεσμα χημικών αντιδράσεων διαφόρων τύπων (με εξαίρεση τις αντιδράσεις ανταλλαγής ιόντων).
3) προσρόφηση ανταλλαγής ιόντων (ιοντοανταλλαγή) - η ανακατανομή της προσροφημένης ουσίας μεταξύ του διαλύματος και της στερεάς φάσης (ιοντοανταλλάκτης) σύμφωνα με τον μηχανισμό των αντιδράσεων ανταλλαγής ιόντων.
Για μια ποσοτική περιγραφή των διαδικασιών προσρόφησης, χρησιμοποιούνται δύο ποσότητες.
1) Απόλυτη προσρόφησηείναι η ποσότητα (mol) ή η μάζα (kg) του προσροφητικού υλικού ανά μονάδα επιφάνειας ή μάζα του προσροφητικού. Ονομασία - A; διάσταση: mol / m 2, mol / kg, kg / m 2, kg / kᴦ.
2) Gibbs (υπερβολική) προσρόφησηείναι η περίσσεια της προσροφητικής ουσίας στο επιφανειακό στρώμα ορισμένου πάχους σε σύγκριση με την ποσότητα της στον όγκο της ομοιογενούς φάσης, ανά μονάδα επιφάνειας ή μάζα του προσροφητικού. Ονομασία - G; μονάδα: mol/m 2 , mol/kᴦ.
Η σχέση μεταξύ απόλυτης και περίσσειας προσρόφησης μπορεί να απεικονιστεί χρησιμοποιώντας την εξίσωση:
G \u003d A - c * h (3.1)
όπου c είναι η συγκέντρωση ισορροπίας της ουσίας στον όγκο της φάσης, mol/m3.
h είναι το πάχος του επιφανειακού στρώματος, υπό όρους ίσο με 10 -9 m.
Σε ετερογενή συστήματα πολλαπλών συστατικών, όταν ένα ή άλλο συστατικό ανακατανέμεται μεταξύ του όγκου μιας ομοιογενούς φάσης και του επιφανειακού στρώματος, ισχύει η εξίσωση για την περίσσεια εσωτερική ενέργεια της επιφάνειας:
U = T * S + s * s + Sm i * n i (3.2)
Φέρνοντας όλους τους όρους της εξίσωσης στη μονάδα επιφάνειας της επιφανειακής επιφάνειας, λαμβάνουμε:
U s = T * S s + s + Sm i * Г i (3.3)
όπου Г i = n i / s είναι η περίσσεια του i-ου συστατικού στο επιφανειακό στρώμα, δηλαδή η προσρόφηση Gibbs.
Για ένα σύστημα ενός συστατικού, η εξίσωση (3.3) έχει τη μορφή:
G s = s + m * Г (3.4)
όπου G s = U s - T * S s είναι η ενέργεια Gibbs της επιφάνειας ή το έργο δημιουργίας μιας μονάδας επιφάνειας της επιφάνειας.
m * G - συμπίεση της ουσίας της προσροφημένης ουσίας στο επιφανειακό στρώμα.
Με βάση την εξίσωση (3.4), μπορούμε να συμπεράνουμε ότι κατά τη διάρκεια της προσρόφησης, η εργασία για τη δημιουργία μιας διεπιφανειακής επιφάνειας αποτελείται από το έργο του σχηματισμού μιας επιφάνειας (σπάσιμο συνεκτικών δεσμών στο μεγαλύτερο μέρος της προσροφητικής φάσης) και τη συμπίεση της ουσίας στο επιφανειακό στρώμα.
Σε μια κατάσταση δυναμικής ισορροπίας μεταξύ του προσροφητικού και του προσροφητικού, η μεταβολή της ενέργειας Gibbs ενός ετερογενούς συστήματος ΔG = 0, η θερμοδυναμική της διαδικασίας προσρόφησης περιγράφεται από μια εξίσωση που ονομάζεται Θεμελιώδης εξίσωση προσρόφησης Gibbs:
Ds = SГ i * dm i (3,5)
Αυτή η εξίσωση είναι καθολική, καθώς ισχύει για όλους τους τύπους διεργασιών προσρόφησης
Ειδικές περιπτώσεις της εξίσωσης προσρόφησης Gibbs.
1) Προσρόφηση από διαλύματα.
Για το χημικό δυναμικό του i-ου συστατικού του συστήματος κατά την προσρόφηση στις διεπαφές «υγρό - στερεό προσροφητικό» και «υγρό - αέριο» ισχύουν οι εξισώσεις:
m i = m i 0 + R*T*ln a i (3.6)
dm i = R*T* d ln a i (3.7)
όπου m i 0 είναι το χημικό δυναμικό του i-ου συστατικού του συστήματος υπό τυπικές συνθήκες.
a i – δραστηριότητα της i-ης συνιστώσας του συστήματος υπό τυπικές συνθήκες.
Με βάση αυτό, η εξίσωση προσρόφησης Gibbs θα πάρει τη μορφή:
Г i = - a i / R*T * (ds / da i) (3.8)
Για διαλύματα χωρίς ηλεκτρολύτη, λαμβάνουμε ένα i \u003d c i, στη συνέχεια:
Г i \u003d - s / R * T * (ds / ds) (3.9)
Για διαλύματα ηλεκτρολυτών:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
όπου c ± είναι η μέση ιοντική συγκέντρωση του διαλύματος.
n είναι ο στοιχειομετρικός συντελεστής.
2) Προσρόφηση ουσιών από την αέρια φάση.
Σύμφωνα με την εξίσωση Mendeleev-Claiperon:
P \u003d c * R * T (3.11)
Από αυτή την άποψη, η εξίσωση Gibbs για την προσρόφηση αερίων σε στερεά προσροφητικά γράφεται με την ακόλουθη μορφή:
Г i = - Р / R*T * (ds / dР) (3.12)
Στην πράξη, η εξίσωση προσρόφησης Gibbs καθιστά δυνατό τον υπολογισμό της ποσότητας προσρόφησης ουσιών στη διεπιφανειακή στρώση, για την οποία προσδιορίζεται η επιφανειακή τάση, με βάση τη μέτρηση της επιφανειακής τάσης σε διάφορες τιμές συγκέντρωσης υγρού ή πίεσης αερίου ισορροπίας .
Θερμοδυναμική διεργασιών προσρόφησης. - έννοια και τύποι. Ταξινόμηση και χαρακτηριστικά της κατηγορίας «Θερμοδυναμική διεργασιών προσρόφησης». 2017, 2018.
Η προσρόφηση ως αυθόρμητη συγκέντρωση μορίων στην επιφάνεια συνοδεύεται από μείωση της εντροπίας του συστήματος. Αφού το κριτήριο για τον αυθορμητισμό της διαδικασίας είναι
∆N - T · ∆S = ∆G< 0,
τότε η προσρόφηση είναι δυνατή μόνο στο ΔΝ< 0 (экзотермический процесс). Равновесие определяется условием ∆Н = T· ∆S. Με την αύξηση της θερμοκρασίας, η ισορροπία μετατοπίζεται προς την ενδόθερμη διαδικασία, δηλαδή την εκρόφηση.
Προσρόφηση σε στερεή επιφάνεια
1. μονομοριακή προσρόφηση.
Σύμφωνα με τη θεωρία του Langmuir, τα προσροφητικά μόρια αλληλεπιδρούν με την επιφάνεια του προσροφητή, σχηματίζοντας τελικά ένα μονομοριακό στρώμα. Σε αυτή την περίπτωση, ο βαθμός πλήρωσης () της επιφάνειας με την προσροφημένη ουσία κατά την προσρόφηση από την αέρια φάση
από υγρό
όπου K είναι η σταθερά ισορροπίας (σταθερά προσρόφησης).
p είναι η μερική πίεση του προσροφημένου αερίου.
c είναι η συγκέντρωση της προσροφημένης ουσίας.
Η εξάρτηση του β από το p (ή c) αντιπροσωπεύεται από ένα γράφημα (ισόθερμη προσρόφησης, Т = const) στο Σχήμα 1. 1.3.

Ρύζι. 1.3. Βαθμός πλήρωσης της επιφάνειας με προσροφημένη ουσία
Σε χαμηλές συγκεντρώσεις και μερικές πιέσεις, η προσρόφηση είναι ανάλογη με τη συγκέντρωση ή τη μερική πίεση:
R<< 1, β ≈ К· r oris<< 1, β ≈ К· s, δηλ. το αρχικό τμήμα της ισόθερμης είναι περίπου γραμμικό και tan α \u003d K (το tg α καθορίζεται από την κλίση της καμπύλης στο p (ή c) → 0: ή ).
Εάν - ο αριθμός των mol της προσροφημένης ουσίας ανά 1 g του προσροφητικού. - ο μέγιστος δυνατός αριθμός γραμμομορίων της προσροφημένης ουσίας ανά 1 g του προσροφητικού ("χωρητικότητα μονοστοιβάδας"), τότε
Αντικατάσταση του β στην εξίσωση (1.3) (για την περίπτωση προσρόφησης από την αέρια φάση, η συγκέντρωση Μεστις εξισώσεις θα πρέπει να αντικατασταθεί από την πίεση R), παίρνουμε:
 (1.6)
(1.6)
Εφόσον και το Κ σε αυτό το ζεύγος προσροφητικού-προσροφητικού είναι σταθερές (στο Τ= const), τότε μπορεί να βρεθεί η εξάρτηση και ΠΡΟΣ ΤΗΝ(Εικ. 1.4).

Ρύζι. 1.4. Γραφική λύση της εξίσωσης προσρόφησης
που προκύπτει με παρέκταση της πειραματικής γραμμικής εξάρτησης σε () = 0; και απο τοτε , .
Η τιμή μπορεί να χρησιμοποιηθεί για τον προσδιορισμό της ειδικής επιφάνειας του προσροφητικού UD (σε m 2 ανά 1 g προσροφητικού), εάν είναι γνωστή η περιοχή ω που καταλαμβάνει στην επιφάνεια ένα μόριο του προσροφητικού (καθορίζεται από το μέγεθος του μορίου):
UD = · ω · Na, (1,7)
όπου Na είναι ο αριθμός του Avogadro (Na = 6,02 10 23).
Με τη σειρά του, η γνωστή τιμή του SD μπορεί να χρησιμοποιηθεί για τον υπολογισμό ή το ω οποιασδήποτε ουσίας με την προσρόφησή της σε ένα δεδομένο προσροφητικό.
2. Πολυμοριακή προσρόφηση.
Η εξίσωση (1.5) περιγράφει μια καμπύλη με κορεσμό, δηλ. στο
p (ή c) → ∞ τείνει στην οριακή τιμή ίση με (Εικ. 1.5, α).

Εικ.1.5. Ισόθερμες προσρόφησης:
α – προσρόφηση με κορεσμό. β – πολυμοριακή προσρόφηση
Ωστόσο, σε ορισμένες περιπτώσεις οι ισόθερμες προσρόφησης μοιάζουν με αυτές που φαίνονται στο Σχ. 1.5b, δηλ. δεν φτάνει το όριο ακόμη και σε υψηλό p (ή c).
Εξαρτήσεις του τύπου που φαίνεται στο σχ. Το 1,5b αντιστοιχεί στην πολυμοριακή προσρόφηση. Κατά κανόνα, τέτοιες ισόθερμες είναι χαρακτηριστικές ουσιών με ισχυρές διαμοριακές αλληλεπιδράσεις (για παράδειγμα, νερό). Όταν τα κέντρα προσρόφησης στην επιφάνεια του προσροφητικού είναι κατειλημμένα (η μονομοριακή στιβάδα είναι κορεσμένη), η «προσγείωση» των επόμενων μορίων προσρόφησης συμβαίνει λόγω διαμοριακών αλληλεπιδράσεων με ήδη προσροφημένα μόρια (Εικ. 1.6). Η θερμότητα μιας τέτοιας προσρόφησης είναι κοντά σε απόλυτη τιμή, αλλά αντίθετη σε πρόσημο, προς τη θερμότητα εξάτμισης του αντίστοιχου υγρού (σκέψου γιατί).

Εικ.1.6. Σχέδιο προσρόφησης:
α - μονομοριακή προσρόφηση. β - πολυμοριακή προσρόφηση
Όσο πλησιάζεις Rστην πίεση κορεσμένων ατμών της προσροφημένης ουσίας, αρχίζει να συμπυκνώνεται στην επιφάνεια του προσροφητικού με αποτέλεσμα να αυξάνεται γρήγορα με την αύξηση R.
Στην περίπτωση της αλληλεπίδρασης δύο ατόμων:
U είναι η ενέργεια αλληλεπίδρασης.
U = U + U ΤΡΑΒΕ.
 - Εξίσωση Lennard-Jones
, c, b, m = κστ
- Εξίσωση Lennard-Jones
, c, b, m = κστ
Σε περιπτώσεις αλληλεπίδρασης ατόμων με στερεά επιφάνεια, είναι απαραίτητο να συνοψιστούν όλες οι αλληλεπιδράσεις.
x είναι η απόσταση από την επιφάνεια
r - η ακτίνα δράσης των δυνάμεων έλξης
dV - ένταση
n είναι ο αριθμός των επιφανειακών μορίων
U ADS. είναι η ενέργεια αλληλεπίδρασης προσρόφησης



Στην περίπτωση της προσρόφησης, η έλξη ενισχύεται. Και στην περίπτωση αλληλεπίδρασης του μη πολικού-μηπολικού τύπου, η προσρόφηση εντοπίζεται κυρίως στις εσοχές.
ηλεκτροστατική αλληλεπίδραση.
Πολικό προσροφητικό - μη πολικό προσροφητικό
Μη πολικό προσροφητικό - πολικό προσροφητικό
Ένα πολικό προσροφητικό είναι ένα πολικό προσροφητικό.
Μ  το προσροφητικό μόριο αναπαρίσταται ως δίπολο και το προσροφητικό ως αγωγός, στον οποίο το προσροφητικό μόριο επάγει ένα δίπολο καθρέφτη συμμετρικά σε σχέση με το δεδομένο.
το προσροφητικό μόριο αναπαρίσταται ως δίπολο και το προσροφητικό ως αγωγός, στον οποίο το προσροφητικό μόριο επάγει ένα δίπολο καθρέφτη συμμετρικά σε σχέση με το δεδομένο.
X - απόσταση από τη μέση
Κατά την αλληλεπίδραση, προκύπτει το δυναμικό:
 ,
,
 είναι η διπολική στιγμή.
είναι η διπολική στιγμή.
Το δυναμικό τείνει να λάβει τη μέγιστη τιμή, δηλ. τα δίπολα τείνουν να προσανατολίζονται κάθετα στην επιφάνεια.
Εφόσον η αύξηση της θερμοκρασίας προάγει την ανάπτυξη της κίνησης Brown, οδηγεί σε επιβράδυνση της διαδικασίας προσρόφησης.
Στην περίπτωση της ηλεκτροστατικής αλληλεπίδρασης, το προσροφητικό υλικό εντοπίζεται κυρίως στις προεξοχές.
Θεμελιώδης εξίσωση προσρόφησης.
Στην περίπτωση της προσρόφησης, το συστατικό ανακατανέμεται, πράγμα που σημαίνει ότι το χημικό δυναμικό αλλάζει. Η διαδικασία της προσρόφησης μπορεί να θεωρηθεί ως η μετάβαση της επιφανειακής ενέργειας σε χημική ενέργεια.
Όγκος στρώματος = 0, τότε η γενικευμένη εξίσωση I και II του νόμου της θερμοδυναμικής:
T = const; (1) = (2) => 

Για ένα σύστημα δύο συστατικών:
,
 ,
,
 =>
=>
=>
 - Εξίσωση προσρόφησης Gibbs
.
- Εξίσωση προσρόφησης Gibbs
.
Για την περίπτωση προσρόφησης TV. σώμα - αέριο:, 
 ,
,

 - ισόθερμος
- ισόθερμος
 - ισοβαρή
- ισοβαρή
 - ισόπυκνη
- ισόπυκνη
 - ισόστερος
- ισόστερος
Η ισόθερμη, η ισόπυκνη, η ισοστερή σχετίζονται μεταξύ τους.
Επειδή λειτουργία προσρόφησης 



Ισόθερμος Henry Ισόθερμος Langmuir



Θερμοδυναμική. Προσρόφηση.
Για συμπυκνωμένα μέσα:
 ,
,
 ,
,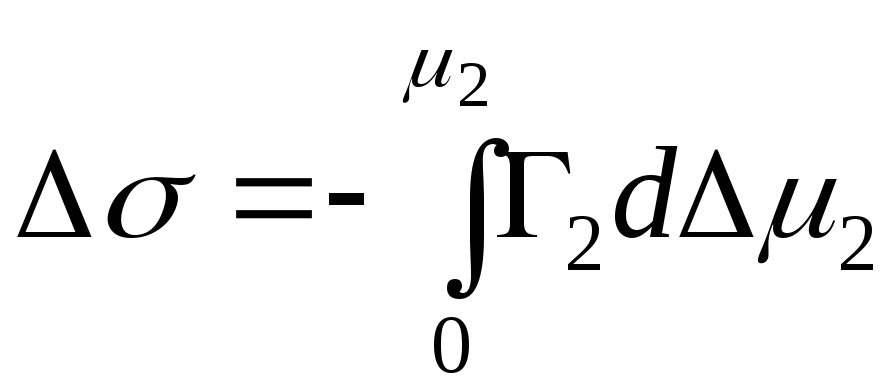
 - αναπόσπαστη αλλαγή στην ενέργεια Gibbs
.
- αναπόσπαστη αλλαγή στην ενέργεια Gibbs
.

P-πίεση σε μια καμπύλη επιφάνεια, P-πίεση S σε μια επίπεδη επιφάνεια
 - δυνατότητα προσρόφησης
- δυνατότητα προσρόφησης
Διαφορική αλλαγή στην παγίδευση 
 , Г = συνεχ
, Г = συνεχ
- μεταβολή διαφορικής εντροπίας
- διαφορική ενθαλπία προσρόφησης
 - ισοστερική θερμότητα προσρόφησης
- ισοστερική θερμότητα προσρόφησης
 - θερμότητα συμπύκνωσης
- θερμότητα συμπύκνωσης
 - καθαρή θερμότητα προσρόφησης
- καθαρή θερμότητα προσρόφησης

 ,
,




Το Qa είναι η αναπόσπαστη θερμότητα της προσρόφησης, 
Το Qra είναι η αναπόσπαστη καθαρή θερμότητα της προσρόφησης,

Η εξίσωση του Henry
Η μελέτη της προσρόφησης παρεμποδίζεται από την ανομοιογένεια της επιφάνειας, επομένως οι απλούστερες κανονικότητες λαμβάνονται για ομοιογενείς επιφάνειες.
Ας εξετάσουμε την αλληλεπίδραση αερίων με μια στερεή επιφάνεια, όταν ένα αέριο περνά από κατάσταση ισορροπίας στον όγκο σε κατάσταση ισορροπίας στην επιφάνεια. Αυτή η περίπτωση είναι ανάλογη με την ισορροπία των αερίων σε ένα βαρυτικό πεδίο.
 ,
,
 ,
=>
,
=> -Η εξίσωση του Henry
-Η εξίσωση του Henry
 - συντελεστής κατανομής
- συντελεστής κατανομής
Κατά τη διαδικασία της προσρόφησης, εμφανίζεται μια αλλαγή στα χημικά δυναμικά.
Για μαζική φάση: 
Για επιφανειακό αέριο: 
Σε κατάσταση ισορροπίας  , δηλ.
, δηλ.

Στην εξίσωση Henry, η σταθερά δεν εξαρτάται από τη συγκέντρωση
Η εξίσωση Henry ισχύει στην περιοχή των χαμηλών πιέσεων και συγκεντρώσεων. Καθώς η συγκέντρωση αυξάνεται, είναι δυνατοί 2 τύποι αποκλίσεων από το νόμο του Henry:
1 - θετικές αποκλίσεις, D μειώνεται, Α μειώνεται
2 - αρνητικές αποκλίσεις, D - αυξάνεται, A - αυξάνεται.
Ο τύπος της απόκλισης καθορίζεται από την επικράτηση ενός ή άλλου τύπου αλληλεπίδρασης προσροφητικού-προσροφητικού.
Με μια ισχυρή αλληλεπίδραση κόλλας, οι συντελεστές δραστηριότητας αυξάνονται - μια θετική απόκλιση. Στην περίπτωση συνεκτικών αλληλεπιδράσεων, παρατηρούνται αρνητικές αποκλίσεις.
μονομοριακή προσρόφηση.
Ισόθερμη Langmuir.
Οι απλούστερες κανονικότητες αποκτήθηκαν στη θεωρία του Henry. Ο Langmuir πρότεινε μια θεωρία σύμφωνα με την οποία η προσρόφηση θεωρείται ως μια οιονεί χημική αντίδραση. Εν:
Η επιφάνεια είναι ενεργειακά ομοιόμορφη.
Η προσρόφηση είναι εντοπισμένη, κάθε κέντρο προσρόφησης αλληλεπιδρά με ένα προσροφητικό μόριο.
Τα προσροφητικά μόρια δεν αλληλεπιδρούν μεταξύ τους.
Η προσρόφηση είναι μονοστρωματική.

 - επιφάνεια,
- επιφάνεια,  - προσροφάται,
- προσροφάται,  - σύμπλεγμα προσρόφησης.
- σύμπλεγμα προσρόφησης.
 , στη συνέχεια η συγκέντρωση των θέσεων προσρόφησης:
, στη συνέχεια η συγκέντρωση των θέσεων προσρόφησης:  ,
, - περιορισμός της προσρόφησης.
- περιορισμός της προσρόφησης.
 , τότε η σταθερά της αντίδρασης:
, τότε η σταθερά της αντίδρασης: 

 - Εξίσωση Langmuir.
- Εξίσωση Langmuir.
Προσρόφηση έναντι συγκέντρωσης
1 )
)
 ,
,

2) περιοχή υψηλών συγκεντρώσεων
 - περιορισμός της προσρόφησης, σχηματισμός μονομοριακού στρώματος
- περιορισμός της προσρόφησης, σχηματισμός μονομοριακού στρώματος
Για την ενέργεια Gibbs: .
g είναι ο συντελεστής εντροπίας.
Στην περίπτωση της ισόθερμης Henry, η ενέργεια Gibbs χαρακτηρίζει τη μετάβαση του προσροφημένου υλικού από τη βασική κατάσταση στην τυπική κατάσταση στην επιφάνεια. Στην περίπτωση της ισόθερμης Langmuir  χαρακτηρίζει τον βαθμό συγγένειας του προσροφητικού και του προσροφητικού.
χαρακτηρίζει τον βαθμό συγγένειας του προσροφητικού και του προσροφητικού.
 βρέθηκε από το van't Hoff isobar.
βρέθηκε από το van't Hoff isobar.

 , Επειτα
, Επειτα  , ως εκ τούτου
, ως εκ τούτου  .
.

 - βαθμός πλήρωσης της επιφάνειας.
- βαθμός πλήρωσης της επιφάνειας.




 - τον αριθμό των κενών θέσεων,
- τον αριθμό των κενών θέσεων,  - τον αριθμό των κατειλημμένων θέσεων.
- τον αριθμό των κατειλημμένων θέσεων.
 ,
,

Εκείνοι. Στην περιοχή των υψηλών συγκεντρώσεων, ο αριθμός των ελεύθερων θέσεων είναι αντιστρόφως ανάλογος με την ποσότητα του προσροφητικού.
Προσρόφηση μίγματος αερίων σε ομοιογενή επιφάνεια.
Σε αυτή την περίπτωση, η διαδικασία προσρόφησης θεωρείται ως δύο παράλληλες αντιδράσεις.
 (1)
(1)

 (2)
(2)


Προσρόφηση μείγματος αερίων σε ανομοιογενή επιφάνεια.
Στην περίπτωση μιας μη ομοιογενούς επιφάνειας, δεν πρέπει να περιορίζεται κανείς σε μεσαία γεμίσματα.
Ως αποτέλεσμα του ανταγωνισμού, είναι δυνατός ο εντοπισμός διαφόρων προσροφημένων σε διαφορετικούς τύπους τοποθεσιών.
Σε αυτή την περίπτωση, η σχέση  .
.
 ,
,
 είναι η τάση κορεσμού των ατμών του προσροφημένου υλικού.
είναι η τάση κορεσμού των ατμών του προσροφημένου υλικού.
 ,
,
 είναι η θερμότητα της προσρόφησης.
είναι η θερμότητα της προσρόφησης.
"+" - συμβατική εξάρτηση, "-" - αντιβατική εξάρτηση, "Η" - καμία συσχέτιση.
"+" - η προσρόφηση προχωρά σύμφωνα με τον ίδιο μηχανισμό. Στις πιο ενεργειακά ευνοϊκές περιοχές, προσροφάται κυρίως ένα αέριο με υψηλή συγγένεια με την επιφάνεια.
"-" - η προσρόφηση προχωρά με διάφορους μηχανισμούς και μέχρι ένα ορισμένο χρονικό σημείο δεν υπάρχει ανταγωνισμός για την επιφάνεια.
Η μονομοριακή προσρόφηση πραγματοποιείται κυρίως κατά τη φυσική προσρόφηση αερίων σε χαμηλές τιμές Π, καθώς και στη διεπαφή υγρού/αερίου.
Πολυμοριακή προσρόφηση.
Θεωρία ΣΤΟΙΧΗΜΑΤΟΣ(Brunauer, Emmet, Teller).
Στην περίπτωση που ο σχηματισμός μιας μονοστιβάδας είναι ανεπαρκής για να αντισταθμίσει την επιφανειακή ενέργεια, η προσρόφηση είναι πολυμοριακή και μπορεί να θεωρηθεί ως αποτέλεσμα εξαναγκασμένης συμπύκνωσης υπό τη δράση επιφανειακών δυνάμεων.
Βασικές διατάξεις:
Όταν ένα προσροφημένο μόριο χτυπά στην κατειλημμένη θέση, σχηματίζεται ένα πολλαπλό σύνολο.
Όσο πλησιάζεις ΠΠρος την Π μικρόο αριθμός των ελεύθερων θέσεων προσρόφησης μειώνεται. Αρχικά αυξάνεται και μετά μειώνεται ο αριθμός των θέσεων που καταλαμβάνουν μονά, διπλά κ.λπ. κιτ.
Στο Π =Π μικρό η προσρόφηση μετατρέπεται σε συμπύκνωση.
Δεν υπάρχουν οριζόντιες αλληλεπιδράσεις.
Για το πρώτο στρώμα εκτελείται η ισόθερμη Langmuir.
Η επιφάνεια θεωρείται ως ένα σύνολο θέσεων προσρόφησης. Ισχύει η συνθήκη της δυναμικής ισορροπίας: ο ρυθμός συμπύκνωσης σε ελεύθερες θέσεις είναι ίσος με τον ρυθμό εξάτμισης από κατειλημμένες.
α είναι ο συντελεστής συμπύκνωσης (το κλάσμα των μορίων που συμπυκνώνονται στην επιφάνεια).
 ,
,
Zm είναι ο μέγιστος αριθμός ελεύθερων θέσεων.
 - συχνότητα δονήσεων ατόμων στην κατεύθυνση κάθετη προς την επιφάνεια.
- συχνότητα δονήσεων ατόμων στην κατεύθυνση κάθετη προς την επιφάνεια.
Για το πρώτο στρώμα, οι συνθήκες δυναμικής ισορροπίας είναι:



 , Επειτα
, Επειτα
 - Εξίσωση Langmuir.
- Εξίσωση Langmuir.
Για το δεύτερο επίπεδο θα ισχύει: 
Για το i-ο στρώμα: 
Για απλότητα, υποτίθεται ότι τα a και ν είναι τα ίδια για όλα τα επίπεδα εκτός από το πρώτο. Για όλα τα στρώματα εκτός από το πρώτο, η θερμότητα προσρόφησης είναι σταθερή. Για το τελευταίο στρώμα, η θερμότητα της προσρόφησης είναι ίση με τη θερμότητα της συμπύκνωσης. Ως αποτέλεσμα, η εξίσωση
 (*)
(*)
ντο- σταθερό,
Στην περίπτωση της θεωρίας BET, η σταθερά ΜΕχαρακτηρίζει την ενέργεια Gibbs της καθαρής προσρόφησης. Η εξίσωση περιέχει μόνο μία σταθερά και αυτή η εξίσωση είναι επίσης πολύ σημαντική για τον προσδιορισμό της ειδικής επιφάνειας του προσροφητικού.
Δεδομένου ότι η θερμότητα απελευθερώνεται ως αποτέλεσμα της προσρόφησης, ο προσδιορισμός συγκεκριμένων επιφανειών πραγματοποιείται σε χαμηλές θερμοκρασίες.
 ????????????
????????????


Το κύριο ελάττωμα της θεωρίας– Παραμέληση οριζόντιων αλληλεπιδράσεων υπέρ των κάθετων.
Η εξίσωση είναι στο εύρος  από 0,05 έως 0,3.
από 0,05 έως 0,3.
Οπου  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0,3 - η αλληλεπίδραση προσροφητικού - προσροφητικού επηρεάζει.
> 0,3 - η αλληλεπίδραση προσροφητικού - προσροφητικού επηρεάζει.
Λογιστική για τις αλληλεπιδράσεις προσροφητικού-προσροφήματος.
Οι αλληλεπιδράσεις εμφανίζονται κατά την προσρόφηση σε μια μη πολική επιφάνεια διακλαδισμένων μορίων ή μορίων. ικανοί να σχηματίσουν συλλόγους. Σε αυτή την περίπτωση, το σχήμα των ισοθερμών προσρόφησης αλλάζει.
ΕΝΑ  το ροφητικό δεν είναι πολικό.
το ροφητικό δεν είναι πολικό.
Το γράφημα 1 αντιστοιχεί σε ασθενείς αλληλεπιδράσεις προσροφητικό-προσροφητικό, ισχυρό προσροφητικό-προσροφητικό.
Το γράφημα 2 αντιστοιχεί σε μια ισχυρή αλληλεπίδραση προσροφητή-προσροφητή, μια ισχυρή αλληλεπίδραση προσροφητικού-προσροφητικού.
Το γράφημα 3 αντιστοιχεί σε μια ισχυρή αλληλεπίδραση προσροφητικού-προσροφητικού, σε μια ασθενή αλληλεπίδραση προσροφητικού-προσροφητικού.
 ,
,

Στην περίπτωση αλληλεπίδρασης μεταξύ προσροφημένων μορίων, είναι απαραίτητο να ληφθούν υπόψη οι αλλαγές στους συντελεστές δραστικότητας. Και αυτή η εξίσωση γράφεται ως:
 - η εξίσωση των Frunkin, Fowler, Guggenheim.
- η εξίσωση των Frunkin, Fowler, Guggenheim.
κείναι η σταθερά έλξης.
Η πιθανή θεωρία του Polan.
Αυτή η θεωρία δεν εξάγει κανενός είδους ισόθερμο προσρόφησης, αλλά καθιστά δυνατό τον υπολογισμό των ισοθερμών σε διαφορετική θερμοκρασία.
Προσρόφησηείναι το αποτέλεσμα της έλξης του προσροφητικού στην επιφάνεια του προσροφητικού λόγω της δράσης του δυναμικού προσρόφησης, το οποίο δεν εξαρτάται από την παρουσία άλλων μορίων και εξαρτάται από την απόσταση μεταξύ της επιφάνειας και του μορίου του προσροφητικού.
 ,
,
 - δυνατότητα προσρόφησης.
- δυνατότητα προσρόφησης.
Δεδομένου ότι η επιφάνεια είναι ανομοιογενής, η απόσταση αντικαθίσταται από τον όγκο προσρόφησης  .όγκος προσρόφησηςείναι ο όγκος που περικλείεται μεταξύ της επιφάνειας και του σημείου που αντιστοιχεί στη δεδομένη τιμή
.όγκος προσρόφησηςείναι ο όγκος που περικλείεται μεταξύ της επιφάνειας και του σημείου που αντιστοιχεί στη δεδομένη τιμή  .
.
Δυνατότητα προσρόφησηςείναι το έργο μεταφοράς 1 mol του προσροφητικού εκτός του δεδομένου όγκου προσρόφησης σε ένα δεδομένο σημείο του όγκου προσρόφησης (ή το έργο μεταφοράς 1 mol κορεσμένου ατμού του προσροφητικού υλικού, το οποίο βρίσκεται σε ισορροπία με το υγρό προσροφητικό υλικό απουσία το προσροφητικό, στη φάση ατμού σε ισορροπία με το προσροφητικό).

Χαρακτηριστική καμπύλη
 - δυνατότητα προσρόφησης,
- δυνατότητα προσρόφησης, 
Για ένα δεδομένο προσροφητικό και διάφορα προσροφητικά, ισχύει το εξής: 
Για διαφορετικούς τύπους προσροφημένων  ,
,
Οπου  δυνατότητες για ισοθερμικές προσρόφησης σε σχετικές πιέσεις
δυνατότητες για ισοθερμικές προσρόφησης σε σχετικές πιέσεις  για το προσροφημένο 1 και για το προσροφημένο 2. Αυτή η αναλογία είναι σταθερή τιμή.
για το προσροφημένο 1 και για το προσροφημένο 2. Αυτή η αναλογία είναι σταθερή τιμή.
 - συντελεστής συγγένειας
- συντελεστής συγγένειας
Θεωρία τριχοειδούς συμπύκνωσης.
Η πορεία της διαδικασίας προσρόφησης εξαρτάται σε μεγάλο βαθμό από τη δομή του πορώδους σώματος.
|
μικροπορώδης | |
|
Μεταβατικό πορώδες | |
|
Μακροπορώδης |
Στην περίπτωση των μικροπορωδών ροφητών, τα πεδία των δυνάμεων προσρόφησης επικαλύπτονται. Στην περίπτωση των μακροπορωδών ροφητών, οι πόροι λειτουργούν ως κανάλια μεταφοράς. Οι διαδικασίες συμπύκνωσης είναι πιο σημαντικές σε παροδικά πορώδη σώματα. Η τριχοειδική συμπύκνωση ξεκινά σε ορισμένες τιμές ΠΚαι  όταν μέρος της επιφανειακής ενέργειας έχει ήδη αντισταθμιστεί. Απαραίτητη προϋπόθεση είναι η επιφάνεια να είναι αυτοφερόμενη. Η διαδικασία περιγράφεται Εξίσωση Thompson-Kelvin.
όταν μέρος της επιφανειακής ενέργειας έχει ήδη αντισταθμιστεί. Απαραίτητη προϋπόθεση είναι η επιφάνεια να είναι αυτοφερόμενη. Η διαδικασία περιγράφεται Εξίσωση Thompson-Kelvin.

 - για την περίπτωση διαβροχής, το κέντρο καμπυλότητας βρίσκεται στην αέρια φάση.
- για την περίπτωση διαβροχής, το κέντρο καμπυλότητας βρίσκεται στην αέρια φάση.
Στην περίπτωση της τριχοειδούς συμπύκνωσης, η ισόθερμη προσρόφησης έχει μορφή υστέρησης. Ο κάτω κλάδος αντιστοιχεί στη διαδικασία προσρόφησης και ο άνω κλάδος αντιστοιχεί στη διαδικασία εκρόφησης.
Όλοι οι τύποι πόρων μπορούν να μειωθούν σε τρεις τύπους:
|
κωνικός |
Κυλινδρικό με ένα κλειστό άκρο |
Κυλινδρικό με δύο ανοιχτά άκρα |
|
Η διαδικασία πλήρωσης πραγματοποιείται από το κάτω μέρος του πόρου. Η ισθερμία προσρόφησης και η ισόθερμη εκρόφησης σε αυτή την περίπτωση συμπίπτουν, αφού η διαδικασία προσρόφησης ξεκινά με μια σφαίρα και η διαδικασία εκρόφησης ξεκινά επίσης με την εξαφάνιση ορισμένων σφαιρών.
↓ |
Δεν υπάρχει υστέρηση. Η εμπρόσθια και η αντίστροφη διαδρομή περιγράφονται από την εξίσωση:
|
Δεν υπάρχει πάτος πουθενά, το γέμισμα του πόρου θα πάει κατά μήκος των τοιχωμάτων του κυλίνδρου.
κύλινδρος: Ισόθερμο και θα έχει μορφή υστέρησης.
↓ |
ΣΕ  συνθήκες διαβροχής, συμβαίνει συμπύκνωση σε χαμηλότερες πιέσεις, κάτι που είναι ενεργειακά ευνοϊκό. Από τον κλάδο εκρόφησης, λαμβάνονται καμπύλες κατανομής μεγέθους πόρων.
συνθήκες διαβροχής, συμβαίνει συμπύκνωση σε χαμηλότερες πιέσεις, κάτι που είναι ενεργειακά ευνοϊκό. Από τον κλάδο εκρόφησης, λαμβάνονται καμπύλες κατανομής μεγέθους πόρων.
Το μέγιστο της διαφορικής καμπύλης μετατοπίζεται προς τα αριστερά σε σχέση με το σημείο καμπής του ολοκληρώματος. Ο συνολικός όγκος των μικρών πόρων είναι μικρός, αλλά έχει μεγάλες επιφάνειες. Καθώς το μέγεθος των πόρων αυξάνεται, ο όγκος τους αυξάνεται όσο  , και η περιοχή ως
, και η περιοχή ως  , λόγω αυτού, παρατηρείται μετατόπιση του μέγιστου της διαφορικής καμπύλης.
, λόγω αυτού, παρατηρείται μετατόπιση του μέγιστου της διαφορικής καμπύλης.
Προσρόφηση στη διεπαφή στερεού-υγρού.
Στην περίπτωση της προσρόφησης στη διεπαφή στερεού-αερίου, παραμελήσαμε ένα συστατικό. Στην περίπτωση της προσρόφησης στη διεπιφάνεια στερεού-υγρού, το προσροφητικό εκτοπίζει τα μόρια του διαλύτη από την επιφάνεια του προσροφητικού.
 ,
,
Η σωστή εξίσωση είναι:

 ,
,
N 1, N 2 - μοριακά κλάσματα του διαλύτη και του συστατικού, N 1 + N 2 \u003d 1, στη συνέχεια
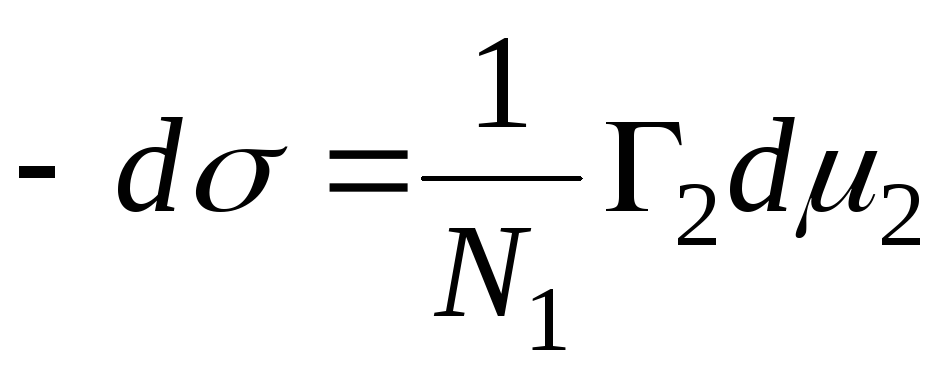 ,
=>
,
=>
 , τότε - η εξίσωση προσρόφησης για το όριο φάσης στερεό - υγρό.
, τότε - η εξίσωση προσρόφησης για το όριο φάσης στερεό - υγρό.
Προσρόφηση (G) > 0 στο  <
0
<
0
Αν οι τιμές  για το συστατικό και τον διαλύτη είναι πολύ διαφορετικά, σε αυτήν την περίπτωση η εξάρτηση σολαπό Νέχει ακρότατο στην τιμή Ν
~ 0,5.
για το συστατικό και τον διαλύτη είναι πολύ διαφορετικά, σε αυτήν την περίπτωση η εξάρτηση σολαπό Νέχει ακρότατο στην τιμή Ν
~ 0,5.
μι  αν
αν  έχουν παρόμοιες τιμές, στην περίπτωση αυτή το πρόσημο της προσρόφησης μπορεί να αλλάξει. Εθισμός σολαπό Νδιασχίζει τον άξονα x
έχουν παρόμοιες τιμές, στην περίπτωση αυτή το πρόσημο της προσρόφησης μπορεί να αλλάξει. Εθισμός σολαπό Νδιασχίζει τον άξονα x
Συνάρτηση Διασταύρωση σολ(Ν) με τον άξονα της τετμημένης ονομάζεται αζεότροπο προσρόφησης. Αυτό σημαίνει ότι τα δύο συστατικά δεν μπορούν να διαχωριστούν σε αυτό το προσροφητικό.
Ισόθερμη εξίσωση προσρόφησης με σταθερά ανταλλαγής.
Κατά τη διάρκεια της προσρόφησης στη διεπιφάνεια στερεού-υγρού, τα συστατικά ανακατανέμονται συνεχώς μεταξύ της επιφάνειας του προσροφητικού και του όγκου του διαλύματος.
 - εξαρτήματα (- - ανατρέξτε στην επιφάνεια)
- εξαρτήματα (- - ανατρέξτε στην επιφάνεια)

 ,
,
 ,
, .
.
 ,
,


Προσρόφηση στη διεπαφή υγρού-αερίου
R  Ας εξετάσουμε την αλλαγή στο προφίλ συγκέντρωσης καθώς διασταυρώνεται η διεπαφή υγρού-αερίου. Αφήστε το συστατικό 2 να είναι πτητικό.
Ας εξετάσουμε την αλλαγή στο προφίλ συγκέντρωσης καθώς διασταυρώνεται η διεπαφή υγρού-αερίου. Αφήστε το συστατικό 2 να είναι πτητικό.
Cs είναι η συγκέντρωση στο επιφανειακό στρώμα.
Με βάση τον ορισμό της περίσσειας προσρόφησης

Εάν το συστατικό δεν είναι πτητικό, τότε η τιμή προσρόφησης θα γραφεί ως εξής:
Π  ri
ri 

Στην εξίσωση  η φύση της ύλης περιγράφεται από το παράγωγο
η φύση της ύλης περιγράφεται από το παράγωγο  .
.
Η ισόθερμη επιφανειακή τάση μπορεί να είναι της μορφής 1 ή 2:
1 - τασιενεργά
2 - τασιενεργά
Η επιφανειακή δραστηριότητα g είναι η ικανότητα των ουσιών να μειώνουν την επιφανειακή τάση στο σύστημα.

 - πάχος του επιφανειακού στρώματος
- πάχος του επιφανειακού στρώματος
ντο μικρόείναι η συγκέντρωση του συστατικού στο επιφανειακό στρώμα
ΜΕ– συγκέντρωση όγκου
Για μια ομόλογη σειρά υπάρχει ένας κανόνας:
 - Κανόνας Traubeau Duclos
- Κανόνας Traubeau Duclos
Για την ομόλογη σειρά, η ισόθερμη προσρόφησης μοιάζει με αυτό:
Γράφουμε Δ αντί για Α, αφού η προσρόφηση είναι υπερβολική στο επιφανειακό στρώμα.
Ισόθερμος επιφανειακής τάσης:

 είναι η επιφανειακή τάση του καθαρού διαλύτη.
είναι η επιφανειακή τάση του καθαρού διαλύτη.
 - θεμελιώδης εξίσωση προσρόφησης.
- θεμελιώδης εξίσωση προσρόφησης.
 - Εξίσωση Langmuir.
- Εξίσωση Langmuir.
Ας τα λύσουμε μαζί:

- Η εξίσωση του Shishkovsky.
σιείναι σταθερά για την ομόλογη σειρά.
ΕΝΑ- όταν μετακινείται από το ένα ομόλογο στο άλλο, αυξάνεται κατά 3-3,5 φορές 
![]()
1 - περιοχή χαμηλών συγκεντρώσεων
![]()
2 - μέση συγκέντρωση
3 - μονομοριακό στρώμα
Τα επιφανειοδραστικά είναι αμφίφιλα μόρια, δηλ. περιλαμβάνουν μια πολική ομάδα και μια μη πολική ρίζα υδρογονάνθρακα.
o είναι το πολικό μέρος του μορίου.
| είναι το μη πολικό μέρος του μορίου.
Σε έναν πολικό διαλύτη, τα μόρια τασιενεργού προσανατολίζονται με τέτοιο τρόπο ώστε το πολικό μέρος του μορίου να βλέπει προς τον διαλύτη, ενώ το μη πολικό τμήμα ωθείται στην αέρια φάση.
Στην εξίσωση Shishkovsky  , είναι σταθερό για την ομόλογη σειρά.
, είναι σταθερό για την ομόλογη σειρά.
Η επιφανειακή δράση αρχίζει να εμφανίζεται με n>5. Σε συγκεντρώσεις υψηλότερες από τη συγκέντρωση της μονομοριακής στιβάδας, η μικκυλοποίηση λαμβάνει χώρα σε διαλύματα επιφανειοδραστικών.
Micelle- ονομάζεται το σύνολο των μορίων αμφιφιλικών επιφανειοδραστικών, οι ρίζες υδρογονάνθρακα των οποίων σχηματίζουν τον πυρήνα και οι πολικές ομάδες μετατρέπονται στην υδατική φάση.
Μικκυλική μάζα - μικκυλιακή μάζα.
H  ο αριθμός των μορίων είναι ο αριθμός της συσσωμάτωσης.
ο αριθμός των μορίων είναι ο αριθμός της συσσωμάτωσης.
Σφαιρικά μικκύλια
Στην περίπτωση της μικκυλοποίησης, δημιουργείται μια ισορροπία στο διάλυμα
Το CMC είναι η κρίσιμη συγκέντρωση μικκυλίου.
Εφόσον θεωρούμε ότι το μικκύλιο είναι μια ξεχωριστή φάση:
Για την ομολογική σειρά, υπάρχει μια εμπειρική εξίσωση:
έναείναι η ενέργεια διάλυσης της λειτουργικής ομάδας.
σι είναι η αύξηση του δυναμικού προσρόφησης, το έργο της προσρόφησης ανά μονάδα μεθυλενίου.
είναι η αύξηση του δυναμικού προσρόφησης, το έργο της προσρόφησης ανά μονάδα μεθυλενίου.
Η παρουσία ενός πυρήνα υδρογονάνθρακα στα μικκύλια επιτρέπει σε ενώσεις που είναι αδιάλυτες στο νερό να διαλύονται σε υδατικά διαλύματα επιφανειοδραστικών ουσιών, αυτό το φαινόμενο ονομάζεται διαλυτοποίηση (ό,τι διαλύεται είναι διαλυτοποιητής, επιφανειοδραστικό είναι διαλυτοποιητής).
Η λάσπη μπορεί να είναι εντελώς μη πολική, μπορεί να περιέχει τόσο πολικά όσο και μη πολικά μέρη και θα είναι προσανατολισμένη σαν μόριο τασιενεργού.
Σε κάθε περίπτωση, κατά τη διάρκεια της διαλυτοποίησης, μια αύξηση στη μικκυλιακή μάζα και τον αριθμό συσσωμάτωσης συμβαίνει όχι μόνο λόγω της συμπερίληψης του διαλυτοποιημένου προϊόντος, αλλά και λόγω της αύξησης του αριθμού των μορίων τασιενεργού που είναι απαραίτητα για τη διατήρηση της κατάστασης ισορροπίας.
Όσο πιο αποτελεσματική είναι η διαλυτοποίηση, τόσο χαμηλότερο είναι το μοριακό βάρος του διαλυτοποιημένου προϊόντος.

 ~ 72 mN/m.
~ 72 mN/m.
 ~ 33 mN/m.
~ 33 mN/m.
Η αποτελεσματικότητα των επιφανειοδραστικών ουσιών εξαρτάται από το μέγεθος του CMC.
Πίεση επιφανειακής στρώσης 2D

→ -δυνάμεις επιφανειακής τάσης.
- δισδιάστατη πίεση.
Το επιφανειακό στρώμα είναι μια δύναμη ίση με τη διαφορά μεταξύ των επιφανειακών τάσεων ενός διαλύματος τασιενεργού και ενός καθαρού διαλύτη, που κατευθύνεται προς μια καθαρή επιφάνεια.
Επικρατεί μια ισορροπία μεταξύ του διαλύματος και του επιφανειακού στρώματος



Στο  υπάρχει μια περιοχή όπου
υπάρχει μια περιοχή όπου  γραμμικά εξαρτάται από τη συγκέντρωση.
γραμμικά εξαρτάται από τη συγκέντρωση.
G [mol/m2].
 περιοχή που καταλαμβάνεται από ένα mole μιας ουσίας
περιοχή που καταλαμβάνεται από ένα mole μιας ουσίας
Τότε η δισδιάστατη ισόθερμη πίεση θα έχει τη μορφή 
 είναι η δισδιάστατη ισόθερμη πίεση.
είναι η δισδιάστατη ισόθερμη πίεση.
Εθισμός  από S M:
από S M:

Στο  - η δισδιάστατη πίεση αυξάνεται απότομα. Στο
- η δισδιάστατη πίεση αυξάνεται απότομα. Στο  δισδιάστατη παραμορφώνεται, γεγονός που προκαλεί απότομη ανάπτυξη
δισδιάστατη παραμορφώνεται, γεγονός που προκαλεί απότομη ανάπτυξη  .
.
Το φιλμ και στις δύο πλευρές που περιορίζεται από τις ίδιες φάσεις ονομάζεται διπλής όψης. Σε τέτοια φιλμ παρατηρείται μια συνεχής κίνηση του μητρικού υγρού.
Οι μεμβράνες με πάχος μικρότερο από 5 nm ονομάζονται μαύρες μεμβράνες.

Τα στρώματα προσρόφησης πρέπει να έχουν δύο χαρακτηριστικά: ιξώδες και εύκολη κινητικότητα, ρευστότητα και ελαστικότητα.
Το φαινόμενο Marangoni είναι αυτοθεραπεία.
Τρίγωνο Γκιμπς,  - υπερπίεση.
- υπερπίεση.
Η μεμβράνη τεντώνεται και λόγω του γεγονότος ότι έχει φύγει μέρος του υγρού, οι επιφανειοδραστικές ουσίες ορμούν στον ελεύθερο χώρο. τρίγωνο Gibbs.
Επίδραση της δύναμης προσρόφησης των σωμάτων.
Υπάρχει πάντα ένα στρώμα προσρόφησης στην επιφάνεια του φιλμ, για το οποίο, τότε
Εξίσωση Langmuir:


 σε δισδιάστατη πίεση
σε δισδιάστατη πίεση
 - ανάλογο της εξίσωσης Shishkovsky
- ανάλογο της εξίσωσης Shishkovsky
ηλεκτροκινητικά φαινόμενα. Διπλή ηλεκτρική στρώση (DES).
Μοντέλο Helemholtz. Θεωρία Gouy-Chapman.
1808 Πτήση

U – διαμορφωμένος σωλήνας, βυθισμένος σε αυτό 2 ηλεκτρόδια. Παραβιάζεται ο νόμος των συγκοινωνούντων δοχείων και παρατηρείται μεταβολή της στάθμης του υγρού στο σωλήνα - ηλεκτροκινητικά φαινόμενα.
Κινητικά φαινόμενα:
ηλεκτροφόρηση
Ηλεκτροόσμωση
Ροή (ροή) δυναμικό
Δυνατότητα καθίζησης
Τα 1 και 2 προκύπτουν όταν εφαρμόζεται διαφορά δυναμικού, 3 και 4 η διάτρηση και η καθίζηση κολλοειδών σωματιδίων προκαλούν την εμφάνιση διαφοράς δυναμικού.
Ηλεκτροόσμωση είναι η κίνηση ενός μέσου διασποράς σε σχέση με μια σταθερή διασκορπισμένη φάση υπό τη δράση ηλεκτρικού ρεύματος.
ηλεκτροφόρηση είναι η κίνηση των σωματιδίων της διεσπαρμένης φάσης σε σχέση με ένα σταθερό μέσο διασποράς υπό την επίδραση ηλεκτρικού ρεύματος.
Π  Ο λόγος για την εμφάνιση ηλεκτροκινητικών φαινομένων είναι ο χωρικός διαχωρισμός των φορτίων και η εμφάνιση διπλού ηλεκτρικού στρώματος.
Ο λόγος για την εμφάνιση ηλεκτροκινητικών φαινομένων είναι ο χωρικός διαχωρισμός των φορτίων και η εμφάνιση διπλού ηλεκτρικού στρώματος.
Το ηλεκτρικό διπλό στρώμα είναι ένας επίπεδος πυκνωτής, η μία πλάκα σχηματίζεται από ιόντα που καθορίζουν το δυναμικό και η άλλη από αντίθετα. Τα ιόντα είναι επίσης μολυσμένα καθώς ιόντα προσδιορισμού του δυναμικού ωθούνται στον κύριο όγκο του διαλύματος. Απόσταση μεταξύ των πιάτων  . Το δυναμικό πέφτει γραμμικά, η διαφορά δυναμικού
. Το δυναμικό πέφτει γραμμικά, η διαφορά δυναμικού  .
.
Μια εξωτερική διαφορά δυναμικού προκαλεί την εμφάνιση ενός συντελεστή διάτμησης  είναι ένα ζεύγος δυνάμεων ανά μονάδα επιφάνειας που δρουν κατά μήκος της επιφάνειας ενός στερεού σώματος.
είναι ένα ζεύγος δυνάμεων ανά μονάδα επιφάνειας που δρουν κατά μήκος της επιφάνειας ενός στερεού σώματος.

Στην ισορροπία, ο συντελεστής διάτμησης είναι ίσος με τον συντελεστή ιξώδους τριβής (  ).
).

Στις συνθήκες μας  ,
,

 - Εξίσωση Helemholtz-Smalukovsky
- Εξίσωση Helemholtz-Smalukovsky
 - γραμμική μετατόπιση ταχύτητας i φάσεις.
- γραμμική μετατόπιση ταχύτητας i φάσεις.
μιείναι η ένταση του ηλεκτρικού πεδίου.
 - διαφορά δυναμικού μεταξύ των πλακών
- διαφορά δυναμικού μεταξύ των πλακών
 - ηλεκτροφορητική κινητικότητα [m 2 /(V * s)].
- ηλεκτροφορητική κινητικότητα [m 2 /(V * s)].
Το μοντέλο Helemholtz δεν λαμβάνει υπόψη τη θερμική κίνηση των μορίων. Στην πραγματικότητα, η κατανομή των ιόντων στο διπλό στρώμα είναι πιο περίπλοκη.
Οι Gouy και Chapman εντόπισαν τις ακόλουθες αιτίες του DES:
Η μετάβαση ενός ιόντος από τη μια φάση στην άλλη όταν επιτευχθεί ισορροπία.
Ιοντισμός ύλης στερεάς φάσης.
Συμπλήρωση της επιφάνειας από ιόντα που υπάρχουν στο μέσο διασποράς.
Πόλωση από εξωτερική πηγή ρεύματος.
Το ηλεκτρικό διπλό στρώμα έχει θολή ή διάχυτη δομή. Τα ιόντα τείνουν να κατανέμονται ομοιόμορφα σε όλο το διάχυτο στρώμα.
Το διάχυτο στρώμα αποτελείται από αντίθετα ιόντα, το μήκος του στρώματος καθορίζεται από την κινητική τους ενέργεια. Σε μια θερμοκρασία που τείνει στο απόλυτο μηδέν, τα αντίθετα είναι όσο το δυνατόν πιο κοντά στα ιόντα που καθορίζουν το δυναμικό.
Αυτή η θεωρία βασίζεται σε δύο εξισώσεις:
εξίσωση Boltzmann

 - εργασία ενάντια στις δυνάμεις της ηλεκτροστατικής αλληλεπίδρασης.
- εργασία ενάντια στις δυνάμεις της ηλεκτροστατικής αλληλεπίδρασης.
 είναι η χύδην πυκνότητα φορτίου.
είναι η χύδην πυκνότητα φορτίου.

Εξίσωση Poisson 
Δεδομένου ότι το πάχος DEL είναι πολύ μικρότερο από το μέγεθος των σωματιδίων, και για ένα επίπεδο DEL, η παράγωγος σε σχέση με τις συντεταγμένες  Και
Και  καταργείται.
καταργείται. 
Για ε υ με υ<<1 функцию можно разложить в ряд Маклорена:

Περιοριζόμαστε σε δύο μέλη της σειράς, τότε:


 - Το πάχος DEL είναι η απόσταση στην οποία μειώνεται το δυναμικό DEL μιμια φορά.
- Το πάχος DEL είναι η απόσταση στην οποία μειώνεται το δυναμικό DEL μιμια φορά.
Όσο χαμηλότερη είναι η θερμοκρασία, τόσο λιγότερο  . Στο Т→0 – επίπεδο DES. Όσο μεγαλύτερη είναι η συγκέντρωση, τόσο περισσότερο εγώ, τόσο λιγότερο
. Στο Т→0 – επίπεδο DES. Όσο μεγαλύτερη είναι η συγκέντρωση, τόσο περισσότερο εγώ, τόσο λιγότερο  .
.





 «–» σημαίνει ότι το δυναμικό μειώνεται με την απόσταση. =>
«–» σημαίνει ότι το δυναμικό μειώνεται με την απόσταση. =>
=>

 ,
,
 - το δυναμικό μειώνεται εκθετικά.
- το δυναμικό μειώνεται εκθετικά.
Δυνατότητα για πυκνότητα επιφανειακής φόρτισης: 
Το επιφανειακό φορτίο είναι ένα φορτίο χώρου με το αντίθετο πρόσημο, ενσωματωμένο σε απόσταση.




=>


Όπου το δυναμικό μειώνεται κατά 2,7 φορές - 
Χωρητικότητα διπλής στρώσης 
Το μειονέκτημα της θεωρίας είναι ότι δεν λαμβάνεται υπόψη η παρουσία του στρώματος Helemholtz, δηλ. δεν λαμβάνει υπόψη  , εξ ου και τα σφάλματα στον προσδιορισμό των κύριων παραμέτρων. Επίσης, δεν εξηγεί την επίδραση ιόντων διαφορετικής φύσης στο πάχος του ηλεκτρικού διπλού στρώματος.
, εξ ου και τα σφάλματα στον προσδιορισμό των κύριων παραμέτρων. Επίσης, δεν εξηγεί την επίδραση ιόντων διαφορετικής φύσης στο πάχος του ηλεκτρικού διπλού στρώματος.
Η θεωρία του Στερν. Η δομή ενός κολλοειδούς μικκυλίου.
Το ηλεκτρικό διπλό στρώμα αποτελείται από δύο μέρη: πυκνό και διάχυτο. Ένα πυκνό στρώμα σχηματίζεται ως αποτέλεσμα της αλληλεπίδρασης των ιόντων που σχηματίζουν δυναμικό με ειδικά προσροφημένα. Αυτά τα ιόντα, κατά κανόνα, είναι εν μέρει ή πλήρως αφυδατωμένα και μπορούν να έχουν είτε το ίδιο είτε το αντίθετο φορτίο με τα ιόντα που καθορίζουν το δυναμικό. Εξαρτάται από την αναλογία της ενέργειας της ηλεκτροστατικής αλληλεπίδρασης  και συγκεκριμένη δυνατότητα προσρόφησης
και συγκεκριμένη δυνατότητα προσρόφησης  . Τα ιόντα του πυκνού στρώματος είναι σταθερά. Το άλλο μέρος των ιόντων βρίσκεται στο διάχυτο στρώμα· αυτά τα ιόντα είναι ελεύθερα και μπορούν να κινηθούν βαθιά μέσα στο διάλυμα, δηλ. από μια περιοχή υψηλότερης συγκέντρωσης σε μια περιοχή χαμηλότερης συγκέντρωσης. Η συνολική πυκνότητα φορτίου αποτελείται από δύο μέρη.
. Τα ιόντα του πυκνού στρώματος είναι σταθερά. Το άλλο μέρος των ιόντων βρίσκεται στο διάχυτο στρώμα· αυτά τα ιόντα είναι ελεύθερα και μπορούν να κινηθούν βαθιά μέσα στο διάλυμα, δηλ. από μια περιοχή υψηλότερης συγκέντρωσης σε μια περιοχή χαμηλότερης συγκέντρωσης. Η συνολική πυκνότητα φορτίου αποτελείται από δύο μέρη.

 - Φόρτιση στρώσης Helmholtz
- Φόρτιση στρώσης Helmholtz
 - Διάχυτη φόρτιση στρώσης
- Διάχυτη φόρτιση στρώσης
Η επιφάνεια έχει έναν ορισμένο αριθμό κέντρων προσρόφησης, καθένα από τα οποία αλληλεπιδρά με ένα αντίθετο ιόν. Η σταθερά μιας τέτοιας οιονεί χημικής αντίδρασης είναι:

 , Οπου
, Οπου  - μοριακό κλάσμα αντίθετων ιόντων σε διάλυμα
- μοριακό κλάσμα αντίθετων ιόντων σε διάλυμα
Κατανομή Helmholtz
Το δυναμικό μειώνεται γραμμικά
Διανομή δυναμικού Gouy. Δεν υπάρχει πυκνό στρώμα, το δυναμικό μειώνεται εκθετικά από την τιμή 
Κατανομή πρύμνης.
Αρχικά, η μείωση του δυναμικού είναι γραμμική και στη συνέχεια εκθετική.
Όταν εφαρμόζεται ένα ηλεκτρικό πεδίο στην περίπτωση της ηλεκτροφόρησης, δεν κινείται άμεσα το σωματίδιο της στερεάς φάσης, αλλά το σωματίδιο της στερεάς φάσης με ένα στρώμα από περιβάλλοντα ιόντα. Το DES επαναλαμβάνει το σχήμα του σωματιδίου της διεσπαρμένης φάσης. Όταν εφαρμόζεται ένα δυναμικό, ένα μέρος του διάχυτου στρώματος αποκόπτεται. Η γραμμή διακοπής ονομάζεται συρόμενο όριο.
Το δυναμικό που προκύπτει στο όριο της ολίσθησης ως αποτέλεσμα της αποκόλλησης ενός τμήματος του διάχυτου στρώματος ονομάζεται ηλεκτροκινητικό δυναμικό(Ζήτα δυναμικό  ).
).
Ένα σωματίδιο μιας διεσπαρμένης φάσης, με ένα στρώμα αντίθετων ιόντων που το περιβάλλει και ένα διπλό ηλεκτρικό στρώμα, ονομάζεται μικκύλια.
Κανόνες για τη γραφή κολλοειδών μικκυλίων:


1-1 ηλεκτρολύτης φόρτισης
Το T είναι ένα σωματίδιο της διεσπαρμένης φάσης.
Το AA είναι το όριο μεταξύ των πυκνών και διάχυτων μερών.
Το BB είναι το όριο της ολίσθησης.
Το όριο ολίσθησης μπορεί να συμπίπτει ή να μην συμπίπτει με τη γραμμή AA.
Η τιμή pH στην οποία το δυναμικό ζήτα είναι μηδέν ονομάζεται ισοηλεκτρικό σημείο.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2 NaCl
1. Σε περίσσεια CaCl 2
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n-x)Cl - ) 2 Χ + Χ Cl - - καταγράφει μικκύλια.
CaSO 4 m - αδρανή.
CaSO 4 m∙nCa 2+ είναι ο πυρήνας.
CaSO 4 m∙nCa 2+ 2( n-x)Cl - σωματίδιο.
2. Σε περίσσεια Na 2 SO 4
Na 2 SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - μικκύλια
CaSO 4 m - αδρανή.
CaSO 4 m∙nSO 4 2 + είναι ο πυρήνας.
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - σωματίδιο
Εξίσωση Helemholtz-Smoluchowski

 - γραμμική ταχύτητα μετατόπισης ορίων (σε ηλεκτροόσμωση).
- γραμμική ταχύτητα μετατόπισης ορίων (σε ηλεκτροόσμωση).
 - διαφορά δυναμικού στις πλάκες πυκνωτών (σε ηλεκτροόσμωση).
- διαφορά δυναμικού στις πλάκες πυκνωτών (σε ηλεκτροόσμωση).


 - ογκομετρική ροή του διαλύματος, μικρόείναι η περιοχή διατομής του κελιού.
- ογκομετρική ροή του διαλύματος, μικρόείναι η περιοχή διατομής του κελιού.

μιείναι η ένταση του ηλεκτρικού πεδίου.


 (για ηλεκτροόσμωση).
(για ηλεκτροόσμωση).
Για το δυναμικό ροής:

 - δυνητικός
- δυνητικός
 - πίεση μεμβράνης
- πίεση μεμβράνης
Κατά κανόνα, η τιμή των ηλεκτροφορητικών και ηλεκτροωσμωτικών κινητικοτήτων είναι μικρότερη από τις υπολογιζόμενες. Αυτό οφείλεται σε:
Φαινόμενο χαλάρωσης (κατά την κίνηση ενός σωματιδίου της διεσπαρμένης φάσης παραβιάζεται η συμμετρία της ιοντικής ατμόσφαιρας).
Ηλεκτροφορητική πέδηση (η εμφάνιση πρόσθετης τριβής ως αποτέλεσμα της κίνησης των αντίθετων ιόντων).
Παραμόρφωση των γραμμών ροής στην περίπτωση ηλεκτρικά αγώγιμων σωματιδίων.
Σχέση επιφανειακής τάσης και δυναμικού. Εξίσωση Lippmann.
Ο σχηματισμός του DEL συμβαίνει αυθόρμητα λόγω της επιθυμίας του συστήματος να μειώσει την επιφανειακή του ενέργεια. Στα πλαίσια της σταθερότητας ΤΚαι Πη γενικευμένη εξίσωση του πρώτου και του δεύτερου νόμου της θερμοδυναμικής μοιάζει με:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1η εξίσωση Lippmann.
- 1η εξίσωση Lippmann.
 είναι η πυκνότητα του επιφανειακού φορτίου.
είναι η πυκνότητα του επιφανειακού φορτίου.
 - διαφορική χωρητικότητα.
- διαφορική χωρητικότητα.
 - 2η εξίσωση Lippmann.
- 2η εξίσωση Lippmann.
ΜΕ- χωρητικότητα.
Λύνουμε την 1η εξίσωση Lippmann και τη θεμελιώδη εξίσωση προσρόφησης:
 ,
,


 , Επειτα
, Επειτα
 - Εξίσωση Nernst
- Εξίσωση Nernst
 ,
,
 ,
,




 - η εξίσωση της ηλεκτροτριχοειδούς καμπύλης (ECC).
- η εξίσωση της ηλεκτροτριχοειδούς καμπύλης (ECC).
ΣΕ  :
: , Αλλά
, Αλλά 
Οι κατιονικές επιφανειοδραστικές ουσίες (CSAS) μειώνουν τον καθοδικό κλάδο του ECC.
Τα ανιονικά επιφανειοδραστικά (ASS) μειώνουν τον ανοδικό κλάδο του ECC.
Οι μη ιοντικές επιφανειοδραστικές ουσίες (NSA) μειώνουν το μεσαίο τμήμα του ECC.
Σταθερότητα διασκορπισμένων συστημάτων. Πίεση σφήνωσης.
Τα διασκορπισμένα συστήματα μπορούν να χωριστούν:
Τα θερμοδυναμικά ασταθή συστήματα μπορεί να είναι κινητικά σταθερά λόγω της μετάβασης σε μια μετασταθερή κατάσταση.
Υπάρχουν δύο τύποι σταθερότητας:
Σταθερότητα καθίζησης (σε σχέση με τη βαρύτητα).
Αθροιστική σταθερότητα. (σε σχέση με το κόλλημα)
Πήξηείναι η διαδικασία της συγκόλλησης των σωματιδίων μεταξύ τους, που οδηγεί στην απώλεια της σταθερότητας των συσσωματωμάτων. Η πήξη μπορεί να προκληθεί από αλλαγές στη θερμοκρασία, το pH, την ανάδευση, τον υπέρηχο.
Διάκριση πήξης:
Αναστρεπτός.
Μη αναστρεψιμο.
Η πήξη προχωρά με την εισαγωγή ηλεκτρολυτών.
Κανόνες πήξης:

Ταινία- αυτό είναι το τμήμα του συστήματος που βρίσκεται μεταξύ δύο διεπαφών.
αποσυνδεόμενη πίεσηεμφανίζεται με απότομη μείωση του πάχους του φιλμ ως αποτέλεσμα της αλληλεπίδρασης των επιφανειακών στρωμάτων που πλησιάζουν.

«-» - όταν το πάχος της μεμβράνης μειώνεται, η πίεση διάσπασης αυξάνεται.
P 0 είναι η πίεση στη φάση όγκου, η οποία είναι συνέχεια του ενδιάμεσου στρώματος.
P 1 είναι η πίεση στο φιλμ.
Θεωρία σταθερότητας. DLFO (Deryagin, Landau, Fairway, Overbeck).
Σύμφωνα με τη θεωρία DLVO, δύο στοιχεία διακρίνονται στην πίεση διάσπασης:
ηλεκτροστατική P E (θετικό, οφείλεται στις δυνάμεις της ηλεκτροστατικής απώθησης). Αντιστοιχεί σε μείωση της ενέργειας Gibbs με την αύξηση του πάχους του φιλμ.
Μοριακός PM (αρνητικό, λόγω της δράσης ελκτικών δυνάμεων). Προκαλείται από τη συμπίεση του φιλμ λόγω χημικών επιφανειακών δυνάμεων, η ακτίνα δράσης των δυνάμεων είναι δέκατα του nm με ενέργεια της τάξης των 400 kJ/mol.
Ολική ενέργεια αλληλεπίδρασης:

 - το σύστημα είναι αθροιστικά σταθερό
- το σύστημα είναι αθροιστικά σταθερό
 - ασταθές σύστημα
- ασταθές σύστημα
Π  θετικό συστατικό.
θετικό συστατικό.
Η αύξηση οφείλεται στην αύξηση της δυναμικής ενέργειας κατά τη συμπίεση λεπτών υμενίων. Για παχιές μεμβράνες, η περίσσεια ενέργειας ιόντων αντισταθμίζεται και είναι ίση με την ενεργειακή αλληλεπίδραση στον κύριο όγκο του μέσου διασποράς.
Αν  (
( - πάχος φιλμ,
- πάχος φιλμ,  - ακτίνα του ιόντος) η λέπτυνση του φιλμ οδηγεί στην εξαφάνιση και τη μείωση σε αυτό μορίων και ιόντων με ελάχιστη επιφανειακή ενέργεια. Ο αριθμός των γειτονικών σωματιδίων μειώνεται, με αποτέλεσμα να αυξάνεται η δυναμική ενέργεια των σωματιδίων που παραμένουν στο φιλμ.
- ακτίνα του ιόντος) η λέπτυνση του φιλμ οδηγεί στην εξαφάνιση και τη μείωση σε αυτό μορίων και ιόντων με ελάχιστη επιφανειακή ενέργεια. Ο αριθμός των γειτονικών σωματιδίων μειώνεται, με αποτέλεσμα να αυξάνεται η δυναμική ενέργεια των σωματιδίων που παραμένουν στο φιλμ.


Η θεωρία DLVO θεωρεί την αλληλεπίδραση των σωματιδίων ως την αλληλεπίδραση των πλακών.

Τα σωματίδια δεν αλληλεπιδρούν



 - Εξίσωση Laplace,
- Εξίσωση Laplace,  ,
,


Για ασθενώς φορτισμένες επιφάνειες
Για πολύ φορτισμένες επιφάνειες:

Το μοριακό συστατικό είναι η αλληλεπίδραση δύο ατόμων:
 ~
~
Αλληλεπίδραση ατόμου με επιφάνεια:

Ας πάρουμε δύο ρεκόρ:
ρε  Για να ληφθεί το μοριακό συστατικό, είναι απαραίτητο να αθροιστούν όλες οι ενέργειες αλληλεπίδρασης των ατόμων της δεξιάς και της αριστερής πλάκας.
Για να ληφθεί το μοριακό συστατικό, είναι απαραίτητο να αθροιστούν όλες οι ενέργειες αλληλεπίδρασης των ατόμων της δεξιάς και της αριστερής πλάκας.
Οπου  - Η σταθερά του Hamaker (λαμβάνει υπόψη τη φύση των σωμάτων που αλληλεπιδρούν).
- Η σταθερά του Hamaker (λαμβάνει υπόψη τη φύση των σωμάτων που αλληλεπιδρούν).
Οτι. η ενέργεια αλληλεπίδρασης των σωματιδίων σε ένα σύστημα μπορεί να εκφραστεί χρησιμοποιώντας καμπύλες δυναμικού.
Το I είναι το πρωταρχικό δυνητικό ελάχιστο. Αυτή είναι μια ζώνη μη αναστρέψιμης πήξης, κυριαρχούν οι δυνάμεις έλξης.
II - ζώνη αθροιστικής σταθερότητας, επικρατούν απωθητικές δυνάμεις.
III - δευτερεύον ελάχιστο δυναμικό (ή ζώνη κροκίδωσης). Μεταξύ των σωματιδίων της διεσπαρμένης φάσης υπάρχει ένα στρώμα ηλεκτρολύτη και τα σωματίδια μπορούν να διαχωριστούν και να μεταφερθούν στη ζώνη σταθερότητας συσσωματώματος.

Καμπύλη 1 – το σύστημα είναι αθροιστικά σταθερό.
Η καμπύλη 2 είναι σταθερή στη ζώνη I, όχι σταθερή στη ζώνη II.
Καμπύλη 3 - σημειώθηκε πήξη στο σύστημα.
Καμπύλη 4 - στο σημείο 4, η συνολική ενέργεια αλληλεπίδρασης U=0,  , αυτό το ακραίο σημείο αντιστοιχεί στην έναρξη της ταχείας πήξης.
, αυτό το ακραίο σημείο αντιστοιχεί στην έναρξη της ταχείας πήξης.
Υπάρχουν δύο περιπτώσεις:
1. Οι επιφάνειες είναι ασθενώς φορτισμένες:
U \u003d U E + U M \u003d 0
 (1)
(1)
2)

 (2)
(2)



 - αυτό είναι το πάχος του στρώματος που αντιστοιχεί στην αρχή της διαδικασίας πήξης.
- αυτό είναι το πάχος του στρώματος που αντιστοιχεί στην αρχή της διαδικασίας πήξης.






 - για ασθενώς φορτισμένες επιφάνειες
- για ασθενώς φορτισμένες επιφάνειες
 Επειτα
Επειτα 
2. Για πολύ φορτισμένες επιφάνειες:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
Ας τετραγωνίσουμε (3)

Πήξη:
Σε ειδική προσρόφηση, τα ιόντα μπορούν να προσροφηθούν σε υπερϊσοδύναμη ποσότητα με τέτοιο τρόπο ώστε η επιφάνεια να μπορεί να αλλάξει το φορτίο της. Η επιφάνεια επαναφορτίζεται.
Στην περίπτωση ειδικής προσρόφησης, μπορούν να προσροφηθούν όχι μόνο ιόντα αντίθετου πρόσημου, αλλά και ενός ιόντος.
Εάν προσροφηθούν ιόντα του ίδιου σημείου με την επιφάνεια, τότε στο επιφανειακό στρώμα δεν θα υπάρξει πτώση του δυναμικού, αλλά ανάπτυξή του.

Πήξη εξουδετέρωσης (συμβαίνει με τη συμμετοχή ασθενώς φορτισμένων σωματιδίων και εξαρτάται όχι μόνο από το φορτίο του ηλεκτρολύτη πήξης, αλλά και από το δυναμικό στα όρια των πυκνών και διάχυτων στρωμάτων).
Η θεωρία της ταχείας πήξης του Smoluchowski.

Εξάρτηση του ρυθμού πήξης από τη συγκέντρωση ηλεκτρολυτών.
I – ο ρυθμός πήξης είναι χαμηλός,
II - ο ρυθμός πήξης είναι πρακτικά ανάλογος με τη συγκέντρωση του ηλεκτρολύτη.
III - η περιοχή της ταχείας πήξης, ο ρυθμός είναι πρακτικά ανεξάρτητος από τη συγκέντρωση.
Βασικά σημεία:
Το αρχικό κολλοειδές είναι μονοδιασπαρμένο, παρόμοια σωματίδια έχουν σφαιρικό σχήμα.
Όλες οι συγκρούσεις σωματιδίων είναι αποτελεσματικές.
Όταν δύο πρωτεύοντα σωματίδια συγκρούονται, σχηματίζεται ένα δευτερεύον σωματίδιο. Δευτεροβάθμια + πρωτοβάθμια = τριτοβάθμια. Πρωτοβάθμια, δευτερεύουσα, τριτογενής - πολλαπλότητα.
Όσον αφορά τη χημική κινητική, η διαδικασία πήξης μπορεί να περιγραφεί από την εξίσωση:
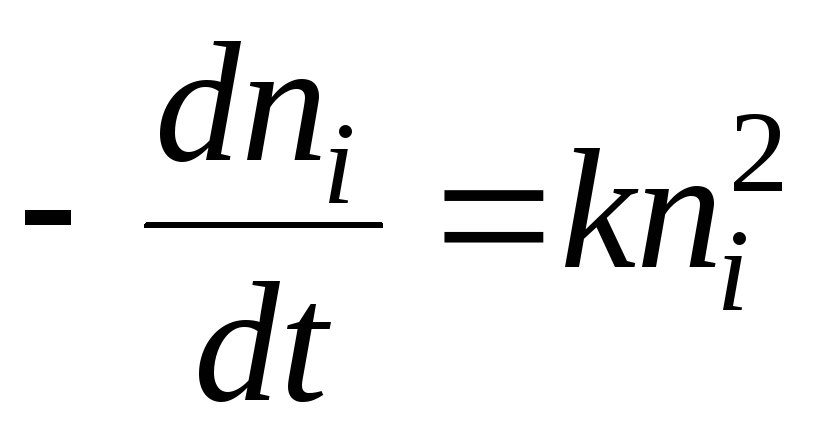
Η λύση θα είναι η εξίσωση: 
 - χρόνος μισής πήξης. Αυτός είναι ο χρόνος κατά τον οποίο ο αριθμός των σωματιδίων κολλοειδούς μειώνεται κατά 2 φορές.
- χρόνος μισής πήξης. Αυτός είναι ο χρόνος κατά τον οποίο ο αριθμός των σωματιδίων κολλοειδούς μειώνεται κατά 2 φορές.

 ,
,
 ,
,
 ,
,


Καθώς αυξάνεται η πολλαπλότητα, το μέγιστο των καμπυλών πήξης μετατοπίζεται προς μεγαλύτερες τιμές  .
.
Ελαττώματα:
Υπόθεση μονοδιασποράς.
Η υπόθεση για την αποτελεσματικότητα όλων των συγκρούσεων.




 - σφαίρα,
- σφαίρα, ,
,





