Τα αλκένια είναι χημικά ενεργά. Οι χημικές τους ιδιότητες καθορίζονται σε μεγάλο βαθμό από την παρουσία διπλού δεσμού. Οι πιο κοινές αντιδράσεις για τα αλκένια είναι οι αντιδράσεις ηλεκτρόφιλης προσθήκης και ριζικής προσθήκης. Οι πυρηνόφιλες αντιδράσεις προσθήκης απαιτούν συνήθως την παρουσία ενός ισχυρού πυρηνόφιλου και δεν είναι τυπικές για τα αλκένια. Τα αλκένια υφίστανται εύκολα αντιδράσεις οξείδωσης και προσθήκης και είναι επίσης ικανά για υποκατάσταση ριζών αλυλίου.
Αντιδράσεις προσθήκης
Υδρογόνωση Η προσθήκη υδρογόνου (αντίδραση υδρογόνωσης) στα αλκένια πραγματοποιείται παρουσία καταλυτών. Τις περισσότερες φορές, χρησιμοποιούνται θρυμματισμένα μέταλλα - πλατίνα, νικέλιο, παλλάδιο κ.λπ. Ως αποτέλεσμα, σχηματίζονται τα αντίστοιχα αλκάνια (κορεσμένοι υδρογονάνθρακες).
$CH_2=CH_2 + H2 → CH_3–CH_3$
Προσθήκη αλογόνων. Τα αλκένια εύκολα, υπό συνήθεις συνθήκες, αντιδρούν με χλώριο και βρώμιο για να σχηματίσουν τα αντίστοιχα διαλογονοαλκάνια, στα οποία άτομα αλογόνου βρίσκονται σε γειτονικά άτομα άνθρακα.
Σημείωση 1
Όταν τα αλκένια αλληλεπιδρούν με το βρώμιο, το βρώμιο αποχρωματίζεται σε κίτρινο-καφέ χρώμα. Αυτή είναι μια από τις παλαιότερες και απλούστερες ποιοτικές αντιδράσεις για ακόρεστους υδρογονάνθρακες, καθώς τα αλκίνια και τα αλκαδιένια αντιδρούν επίσης παρόμοια.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
Προσθήκη υδραλογονιδίων. Όταν οι υδρογονάνθρακες του αιθυλενίου αντιδρούν με υδραλογονίδια ($HCl$, $HBr$), σχηματίζονται αλογονοαλκάνια· η κατεύθυνση της αντίδρασης εξαρτάται από τη δομή των αλκενίων.
Στην περίπτωση του αιθυλενίου ή των συμμετρικών αλκενίων, η αντίδραση προσθήκης λαμβάνει χώρα αναμφίβολα και οδηγεί στον σχηματισμό μόνο ενός προϊόντος:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
Στην περίπτωση ασύμμετρων αλκενίων, είναι δυνατός ο σχηματισμός δύο διαφορετικών προϊόντων αντίδρασης προσθήκης:
Σημείωση 2
Στην πραγματικότητα, σχηματίζεται κυρίως μόνο ένα προϊόν αντίδρασης. Το μοτίβο προς την κατεύθυνση τέτοιων αντιδράσεων καθιερώθηκε από τον Ρώσο χημικό V.V. Markovnikov το 1869 Ονομάζεται κανόνας Markovnikov. Όταν τα υδραλογονίδια αντιδρούν με ασύμμετρα αλκένια, ένα άτομο υδρογόνου προστίθεται στη θέση της διάσπασης του διπλού δεσμού στο πιο υδρογονωμένο άτομο άνθρακα, δηλαδή πριν συνδεθεί με μεγάλο αριθμό ατόμων υδρογόνου.
Ο Markovnikov διατύπωσε αυτόν τον κανόνα με βάση πειραματικά δεδομένα και μόνο πολύ αργότερα έλαβε μια θεωρητική αιτιολόγηση. Εξετάστε την αντίδραση του προπυλενίου με το υδροχλώριο.
Ένα από τα χαρακτηριστικά του ομολόγου $p$ είναι η ικανότητά του να πολώνεται εύκολα. Υπό την επίδραση της ομάδας μεθυλίου (θετική επαγωγική επίδραση + $I$) στο μόριο του προπενίου, η πυκνότητα ηλεκτρονίων του δεσμού $p$ μετατοπίζεται σε ένα από τα άτομα άνθρακα (= $CH_2$). Ως αποτέλεσμα, εμφανίζεται ένα μερικό αρνητικό φορτίο ($\δέλτα -$). Ένα μερικό θετικό φορτίο ($\δέλτα +$) εμφανίζεται στο άλλο άτομο άνθρακα του διπλού δεσμού.
Αυτή η κατανομή της πυκνότητας ηλεκτρονίων στο μόριο του προπυλενίου καθορίζει τη θέση της μελλοντικής επίθεσης πρωτονίων. Αυτό είναι το άτομο άνθρακα της ομάδας μεθυλενίου (= $CH_2$), η οποία φέρει ένα μερικό αρνητικό φορτίο $\δέλτα-$. Και το χλώριο, κατά συνέπεια, προσβάλλει ένα άτομο άνθρακα με μερικό θετικό φορτίο $\δέλτα+$.
Κατά συνέπεια, το κύριο προϊόν της αντίδρασης του προπυλενίου με το υδροχλώριο είναι το 2-χλωροπροπάνιο.
Ενυδάτωση
Η ενυδάτωση των αλκενίων συμβαίνει παρουσία ορυκτών οξέων και υπακούει στον κανόνα του Markovnikov. Τα προϊόντα της αντίδρασης είναι αλκοόλες
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Αλκυλίωση
Η προσθήκη αλκανίων σε αλκένια παρουσία ενός όξινου καταλύτη ($HF$ ή $H_2SO_4$) σε χαμηλές θερμοκρασίες οδηγεί στον σχηματισμό υδρογονανθράκων με υψηλότερο μοριακό βάρος και χρησιμοποιείται συχνά στη βιομηχανία για την παραγωγή καυσίμου κινητήρα
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Αντιδράσεις οξείδωσης
Η οξείδωση των αλκενίων μπορεί να συμβεί, ανάλογα με τις συνθήκες και τους τύπους των οξειδωτικών αντιδραστηρίων, τόσο με τη διάσπαση του διπλού δεσμού όσο και με τη διατήρηση του σκελετού άνθρακα:
Αντιδράσεις πολυμερισμού
Τα μόρια αλκενίου είναι ικανά να προστίθενται μεταξύ τους κάτω από ορισμένες συνθήκες με το άνοιγμα δεσμών $\pi$ και το σχηματισμό διμερών, τριμερών ή ενώσεων - πολυμερών υψηλού μοριακού βάρους. Ο πολυμερισμός των αλκενίων μπορεί να γίνει είτε με ελεύθερη ρίζα είτε με μηχανισμό κατιόντων-ανιόντων. Ως εκκινητές πολυμερισμού χρησιμοποιούνται οξέα, υπεροξείδια, μέταλλα κ.λπ.. Η αντίδραση πολυμερισμού πραγματοποιείται επίσης υπό την επίδραση της θερμοκρασίας, της ακτινοβολίας και της πίεσης. Χαρακτηριστικό παράδειγμα είναι ο πολυμερισμός του αιθυλενίου για να σχηματιστεί πολυαιθυλένιο
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Αντιδράσεις υποκατάστασης
Οι αντιδράσεις υποκατάστασης δεν είναι τυπικές για τα αλκένια. Ωστόσο, σε υψηλές θερμοκρασίες (πάνω από 400 ° C), οι αντιδράσεις προσθήκης ριζών, οι οποίες είναι αναστρέψιμες, καταστέλλονται. Σε αυτή την περίπτωση, καθίσταται δυνατή η αντικατάσταση του ατόμου υδρογόνου που βρίσκεται στην αλλυλική θέση διατηρώντας τον διπλό δεσμό
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Υπερμάρκετ Γνώσεων >>Χημεία >>Χημεία 10η τάξη >> Χημεία: Αλκένια
Οι ακόρεστοι περιλαμβάνουν υδρογονάνθρακες που περιέχουν πολλαπλούς δεσμούς μεταξύ ατόμων άνθρακα στα μόριά τους. Ακόρεστα είναι τα αλκένια, τα αλκίνια, τα αλκαδιένια (πολυένια). Οι κυκλικοί υδρογονάνθρακες που περιέχουν διπλό δεσμό στον δακτύλιο (κυκλοαλκένια), καθώς και τα κυκλοαλκάνια με μικρό αριθμό ατόμων άνθρακα στον δακτύλιο (τρία ή τέσσερα άτομα) έχουν επίσης ακόρεστο χαρακτήρα. Η ιδιότητα του «ακόρεστου» σχετίζεται με την ικανότητα αυτών των ουσιών να εισέρχονται σε αντιδράσεις προσθήκης, κυρίως υδρογόνου, με το σχηματισμό κορεσμένων ή κορεσμένων υδρογονανθράκων - αλκανίων.
Δομή
Τα αλκένια είναι άκυκλα, περιέχουν στο μόριο, εκτός από απλούς δεσμούς, έναν διπλό δεσμό μεταξύ ατόμων άνθρακα και αντιστοιχούν στον γενικό τύπο C n H 2n.
Τα αλκένια έλαβαν το δεύτερο όνομά τους - "ολεφίνες" κατ' αναλογία με ακόρεστα λιπαρά οξέα (ελαϊκό, λινολεϊκό), τα υπολείμματα των οποίων αποτελούν μέρος υγρών λιπών - ελαίων (από το αγγλικό λάδι - λάδι).
Τα άτομα άνθρακα που έχουν διπλό δεσμό μεταξύ τους, όπως γνωρίζετε, βρίσκονται σε κατάσταση υβριδισμού sp 2. Αυτό σημαίνει ότι ένα s και δύο p τροχιακά εμπλέκονται στον υβριδισμό και ένα p τροχιακό παραμένει μη υβριδοποιημένο. Η επικάλυψη των υβριδικών τροχιακών οδηγεί στο σχηματισμό ενός δεσμού α και λόγω των μη υβριδισμένων τροχιακών των γειτονικών ατόμων άνθρακα του μορίου του αιθυλενίου, σχηματίζεται ένας δεύτερος, Π-σύνδεση. Έτσι, ένας διπλός δεσμός αποτελείται από έναν δεσμό Þ και έναν δεσμό p.
Τα υβριδικά τροχιακά των ατόμων που σχηματίζουν διπλό δεσμό βρίσκονται στο ίδιο επίπεδο και τα τροχιακά που σχηματίζουν έναν δεσμό n βρίσκονται κάθετα στο επίπεδο του μορίου (βλ. Εικ. 5).
Ο διπλός δεσμός (0,132 nm) είναι βραχύτερος από τον απλό δεσμό και η ενέργειά του είναι υψηλότερη, δηλαδή είναι ισχυρότερος. Ωστόσο, η παρουσία ενός κινητού, εύκολα πολωμένου δεσμού 7g οδηγεί στο γεγονός ότι τα αλκένια είναι χημικά πιο δραστικά από τα αλκάνια και είναι ικανά να υποστούν αντιδράσεις προσθήκης.
Ομόλογη σειρά αιθενίου
Τα αλκένια ευθείας αλυσίδας σχηματίζουν την ομόλογη σειρά του αιθενίου (αιθυλένιο).
C2H4 - αιθένιο, C3H6 - προπένιο, C4H8 - βουτένιο, C5H10 - πεντένιο, C6H12 - εξένιο κ.λπ.
Ισομερισμός και ονοματολογία
Τα αλκένια, όπως και τα αλκάνια, χαρακτηρίζονται από δομικό ισομερισμό. Τα δομικά ισομερή, όπως θυμάστε, διαφέρουν μεταξύ τους στη δομή του σκελετού άνθρακα. Το απλούστερο αλκένιο, που χαρακτηρίζεται από δομικά ισομερή, είναι το βουτένιο.
CH3-CH2-CH=CH2 CH3-C=CH2
μεγάλο
CH3
βουτένιο-1 μεθυλπροπένιο
Ένας ειδικός τύπος δομικής ισομέρειας είναι η ισομέρεια της θέσης του διπλού δεσμού:
CH3-CH2-CH=CH2 CH3-CH=CH-CH3
βουτένιο-1 βουτένιο-2
Η σχεδόν ελεύθερη περιστροφή των ατόμων άνθρακα είναι δυνατή γύρω από έναν μόνο δεσμό άνθρακα-άνθρακα, έτσι τα μόρια των αλκανίων μπορούν να λάβουν μια μεγάλη ποικιλία σχημάτων. Η περιστροφή γύρω από τον διπλό δεσμό είναι αδύνατη, γεγονός που οδηγεί στην εμφάνιση ενός άλλου τύπου ισομερισμού στα αλκένια - γεωμετρικά ή cis-trans ισομέρεια.
Τα ισομερή Cis διαφέρουν από τα ισομερή του θώρακα ως προς τη χωρική διάταξη των μοριακών θραυσμάτων (σε αυτή την περίπτωση, ομάδες μεθυλίου) σε σχέση με το επίπεδο Π-συνδέσεις, άρα ιδιότητες.
Τα αλκένια είναι ισομερή ως προς τα κυκλοαλκάνια (interclass ισομέρεια), για παράδειγμα:
CH2 = CH-CH2-CH2-CH2-CH3
εξένιο-1 κυκλοεξάνιο
Ονοματολογία αλκένια, που αναπτύχθηκε από την IUPAC, είναι παρόμοια με την ονοματολογία των αλκανίων.
1. Επιλογή κύριου κυκλώματος
Ο σχηματισμός του ονόματος ενός υδρογονάνθρακα ξεκινά με τον ορισμό της κύριας αλυσίδας - της μεγαλύτερης αλυσίδας ατόμων άνθρακα στο μόριο. Στην περίπτωση των αλκενίων, η κύρια αλυσίδα πρέπει να περιέχει διπλό δεσμό.
2. Αρίθμηση ατόμων της κύριας αλυσίδας
Η αρίθμηση των ατόμων της κύριας αλυσίδας ξεκινά από το άκρο στο οποίο είναι πλησιέστερος ο διπλός δεσμός. Για παράδειγμα, το σωστό όνομα σύνδεσης είναι
dn3-dn-dn2-dn=dn-dn3 dn3
5-μεθυλεξένιο-2, όχι 2-μεθυλεξένιο-4, όπως θα περίμενε κανείς.
Εάν η θέση του διπλού δεσμού δεν μπορεί να καθορίσει την αρχή της αρίθμησης των ατόμων στην αλυσίδα, τότε προσδιορίζεται από τη θέση των υποκαταστατών με τον ίδιο τρόπο όπως για τους κορεσμένους υδρογονάνθρακες.
CH3- CH2-CH=CH-CH-CH3
μεγάλο
CH3
2-μεθυλεξένιο-3
3. Σχηματισμός του ονόματος
Τα ονόματα των αλκενίων σχηματίζονται με τον ίδιο τρόπο όπως τα ονόματα των αλκανίων. Στο τέλος του ονόματος, να αναφέρετε τον αριθμό του ατόμου άνθρακα από το οποίο ξεκινά ο διπλός δεσμός και το επίθημα που δείχνει ότι η ένωση ανήκει στην κατηγορία των αλκενίων, -ene.
Παραλαβή
1. Πυρόλυση προϊόντων πετρελαίου. Στη διαδικασία της θερμικής πυρόλυσης κορεσμένων υδρογονανθράκων, μαζί με το σχηματισμό αλκανίων, εμφανίζεται ο σχηματισμός αλκενίων.
2. Αφυδρογόνωση κορεσμένων υδρογονανθράκων. Όταν τα αλκάνια περνούν πάνω από έναν καταλύτη σε υψηλές θερμοκρασίες (400-600 °C), ένα μόριο υδρογόνου αποβάλλεται και ένα αλκένιο σχηματίζεται: 
3. Αφυδάτωση αλκοολών (αποβολή νερού). Η επίδραση των παραγόντων αφαίρεσης νερού (H2804, Al203) στις μονοϋδρικές αλκοόλες σε υψηλές θερμοκρασίες οδηγεί στην εξάλειψη ενός μορίου νερού και στο σχηματισμό διπλού δεσμού:
Η αντίδραση αυτή ονομάζεται ενδομοριακή αφυδάτωση (σε αντίθεση με τη διαμοριακή αφυδάτωση, η οποία οδηγεί στο σχηματισμό αιθέρων και θα μελετηθεί στην § 16 «Αλκοόλες»).
4. Αφυδροαλογόνωση (αποβολή υδραλογονιδίου).
Όταν ένα αλογονοαλκάνιο αντιδρά με ένα αλκάλιο σε διάλυμα αλκοόλης, σχηματίζεται διπλός δεσμός ως αποτέλεσμα της εξάλειψης ενός μορίου υδραλογόνου.
Σημειώστε ότι αυτή η αντίδραση παράγει κυρίως βουτένιο-2 αντί βουτένιο-1, το οποίο αντιστοιχεί σε Ο κανόνας του Zaitsev:
Όταν ένα υδραλογόνο εξαλείφεται από δευτεροταγή και τριτοταγή αλογονοαλκάνια, ένα άτομο υδρογόνου εξαλείφεται από το λιγότερο υδρογονωμένο άτομο άνθρακα.
5. Αποαλογόνωση. Όταν ο ψευδάργυρος δρα σε ένα διβρωμοπαράγωγο ενός αλκανίου, τα άτομα αλογόνου που βρίσκονται σε γειτονικά άτομα άνθρακα εξαλείφονται και σχηματίζεται διπλός δεσμός: 
Φυσικές ιδιότητες
Οι τρεις πρώτοι εκπρόσωποι της ομόλογης σειράς αλκενίων είναι αέρια, οι ουσίες της σύνθεσης C5H10-C16H32 είναι υγρές και τα ανώτερα αλκένια είναι στερεά.
Τα σημεία βρασμού και τήξης αυξάνονται φυσικά με την αύξηση του μοριακού βάρους των ενώσεων.
Χημικές ιδιότητες
Αντιδράσεις προσθήκης
Ας υπενθυμίσουμε ότι ένα χαρακτηριστικό γνώρισμα των εκπροσώπων των ακόρεστων υδρογονανθράκων - αλκενίων είναι η ικανότητα να εισέρχονται σε αντιδράσεις προσθήκης. Οι περισσότερες από αυτές τις αντιδράσεις προχωρούν με τον μηχανισμό ηλεκτρόφιλης προσθήκης.
1. Υδρογόνωση αλκενίων. Τα αλκένια είναι ικανά να προσθέτουν υδρογόνο παρουσία καταλυτών υδρογόνωσης - μετάλλων - πλατίνας, παλλαδίου, νικελίου:
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
Αυτή η αντίδραση συμβαίνει τόσο σε ατμοσφαιρική όσο και σε υψηλή πίεση και δεν απαιτεί υψηλή θερμοκρασία, καθώς είναι εξώθερμη. Όταν η θερμοκρασία αυξάνεται, οι ίδιοι καταλύτες μπορούν να προκαλέσουν αντίστροφη αντίδραση - αφυδρογόνωση.
2. Αλογόνωση (προσθήκη αλογόνων). Η αλληλεπίδραση ενός αλκενίου με βρωμιούχο νερό ή ένα διάλυμα βρωμίου σε έναν οργανικό διαλύτη (CCl4) οδηγεί σε γρήγορο αποχρωματισμό αυτών των διαλυμάτων ως αποτέλεσμα της προσθήκης ενός μορίου αλογόνου στο αλκένιο και του σχηματισμού διαλογονοαλκανίων.
Μαρκόβνικοφ Βλαντιμίρ Βασίλιεβιτς
(1837-1904)
Ρώσος οργανικός χημικός. Διατυπώθηκαν (1869) κανόνες για την κατεύθυνση της υποκατάστασης, της απομάκρυνσης, της προσθήκης σε διπλό δεσμό και των αντιδράσεων ισομερισμού ανάλογα με τη χημική δομή. Σπούδασε (από το 1880) τη σύνθεση του λαδιού και έθεσε τα θεμέλια της πετροχημείας ως ανεξάρτητης επιστήμης. Ανακαλύφθηκε (1883) μια νέα κατηγορία οργανικών ουσιών - κυκλο-παραφίνες (ναφθένια).
3. Υδροαλογόνωση (προσθήκη υδραλογόνου).
Η αντίδραση προσθήκης υδραλογόνου θα συζητηθεί λεπτομερέστερα παρακάτω. Αυτή η αντίδραση υπακούει στον κανόνα του Markovnikov:
Όταν ένα υδραλογόνο προσκολλάται σε ένα αλκένιο, το υδρογόνο προσκολλάται στο πιο υδρογονωμένο άτομο άνθρακα, δηλ. στο άτομο στο οποίο υπάρχουν περισσότερα άτομα υδρογόνου, και το αλογόνο στο λιγότερο υδρογονωμένο.
4. Ενυδάτωση (προσθήκη νερού). Η ενυδάτωση των αλκενίων οδηγεί στο σχηματισμό αλκοολών. Για παράδειγμα, η προσθήκη νερού σε αιθένιο αποτελεί τη βάση μιας από τις βιομηχανικές μεθόδους για την παραγωγή αιθυλικής αλκοόλης:
CH2=CH2 + H2O -> CH3-CH2OH
αιθανόλη
Σημειώστε ότι μια πρωτοταγής αλκοόλη (με μια ομάδα υδροξυλίου στον πρωτογενή άνθρακα) σχηματίζεται μόνο όταν το αιθένιο ενυδατώνεται. Όταν το προπένιο ή άλλα αλκένια ενυδατώνονται, σχηματίζονται δευτεροταγείς αλκοόλες. 
Αυτή η αντίδραση προχωρά επίσης σύμφωνα με τον κανόνα του Markovnikov - ένα κατιόν υδρογόνου προσκολλάται σε ένα πιο υδρογονωμένο άτομο άνθρακα και μια ομάδα υδροξυλίου προσκολλάται σε ένα λιγότερο υδρογονωμένο.
5. Πολυμερισμός. Μια ειδική περίπτωση προσθήκης είναι η αντίδραση πολυμερισμού αλκενίων:
Αυτή η αντίδραση προσθήκης λαμβάνει χώρα μέσω ενός μηχανισμού ελεύθερων ριζών.
Αντιδράσεις οξείδωσης
Όπως κάθε οργανική ένωση, τα αλκένια καίγονται σε οξυγόνο για να σχηματίσουν CO2 και H20.
Σε αντίθεση με τα αλκάνια, τα οποία είναι ανθεκτικά στην οξείδωση στα διαλύματα, τα αλκένια οξειδώνονται εύκολα με τη δράση υδατικών διαλυμάτων υπερμαγγανικού καλίου. Σε ουδέτερα ή ελαφρώς αλκαλικά διαλύματα, τα αλκένια οξειδώνονται σε διόλες (διυδρικές αλκοόλες) και υδροξυλομάδες προστίθενται σε εκείνα τα άτομα μεταξύ των οποίων υπήρχε διπλός δεσμός πριν από την οξείδωση.
Όπως ήδη γνωρίζετε, οι ακόρεστοι υδρογονάνθρακες - αλκένια είναι ικανοί να εισέλθουν σε αντιδράσεις προσθήκης. Οι περισσότερες από αυτές τις αντιδράσεις προχωρούν με τον μηχανισμό ηλεκτρόφιλης προσθήκης.
Ηλεκτροφιλική σύνδεση
Οι ηλεκτρόφιλες αντιδράσεις είναι αντιδράσεις που συμβαίνουν υπό την επίδραση ηλεκτρόφιλων - σωματιδίων που έχουν έλλειψη πυκνότητας ηλεκτρονίων, για παράδειγμα, ένα μη γεμάτο τροχιακό. Το απλούστερο ηλεκτροφιλικό σωματίδιο είναι το κατιόν υδρογόνου. Είναι γνωστό ότι το άτομο υδρογόνου έχει ένα ηλεκτρόνιο στο 3ο τροχιακό. Ένα κατιόν υδρογόνου σχηματίζεται όταν ένα άτομο χάνει αυτό το ηλεκτρόνιο, επομένως το κατιόν υδρογόνου δεν έχει καθόλου ηλεκτρόνια:
Н· - 1е - -> Н +
Σε αυτή την περίπτωση, το κατιόν έχει αρκετά υψηλή συγγένεια ηλεκτρονίων. Ο συνδυασμός αυτών των παραγόντων καθιστά το κατιόν υδρογόνου ένα αρκετά ισχυρό ηλεκτροφιλικό σωματίδιο.
Ο σχηματισμός κατιόντος υδρογόνου είναι δυνατός κατά την ηλεκτρολυτική διάσταση οξέων:
НВr -> Н + + Вr -
Αυτός είναι ο λόγος που πολλές ηλεκτροφιλικές αντιδράσεις συμβαίνουν παρουσία και συμμετοχή οξέων.
Τα ηλεκτροφιλικά σωματίδια, όπως αναφέρθηκε προηγουμένως, δρουν σε συστήματα που περιέχουν περιοχές αυξημένης πυκνότητας ηλεκτρονίων. Ένα παράδειγμα τέτοιου συστήματος είναι ένας πολλαπλός (διπλός ή τριπλός) δεσμός άνθρακα-άνθρακα.
Γνωρίζετε ήδη ότι τα άτομα άνθρακα μεταξύ των οποίων σχηματίζεται διπλός δεσμός βρίσκονται σε κατάσταση υβριδισμού sp 2. Τα μη υβριδισμένα ρ-τροχιακά γειτονικών ατόμων άνθρακα που βρίσκονται στο ίδιο επίπεδο επικαλύπτονται, σχηματίζοντας Π-δεσμός, ο οποίος είναι λιγότερο ισχυρός από τον δεσμό Þ, και, το πιο σημαντικό, πολώνεται εύκολα υπό την επίδραση ενός εξωτερικού ηλεκτρικού πεδίου. Αυτό σημαίνει ότι όταν πλησιάζει ένα θετικά φορτισμένο σωματίδιο, τα ηλεκτρόνια του δεσμού CS μετατοπίζονται προς αυτό και το λεγόμενο Π-συγκρότημα.
Αποδεικνύεται Π- σύμπλοκο και με προσθήκη κατιόντος υδρογόνου σε Π- συνδέσεις. Το κατιόν υδρογόνου φαίνεται να προσκρούει στην πυκνότητα ηλεκτρονίων που προεξέχει από το επίπεδο του μορίου Π-σύνδεση και την ενώνει. ![]()
Στο επόμενο στάδιο, εμφανίζεται μια πλήρης μετατόπιση του ζεύγους ηλεκτρονίων Π-δεσμός με ένα από τα άτομα άνθρακα, που οδηγεί στην εμφάνιση ενός μοναχικού ζεύγους ηλεκτρονίων πάνω του. Το τροχιακό του ατόμου άνθρακα στο οποίο βρίσκεται αυτό το ζεύγος και το μη κατειλημμένο τροχιακό του κατιόντος υδρογόνου επικαλύπτονται, γεγονός που οδηγεί στο σχηματισμό ενός ομοιοπολικού δεσμού μέσω του μηχανισμού δότη-δέκτη. Το δεύτερο άτομο άνθρακα εξακολουθεί να έχει ένα μη γεμάτο τροχιακό, δηλ. ένα θετικό φορτίο.
Το σωματίδιο που προκύπτει ονομάζεται καρβοκατιόν επειδή περιέχει θετικό φορτίο στο άτομο άνθρακα. Αυτό το σωματίδιο μπορεί να συνδυαστεί με οποιοδήποτε ανιόν, ένα σωματίδιο που έχει ένα μόνο ζεύγος ηλεκτρονίων, δηλαδή ένα πυρηνόφιλο.
Ας εξετάσουμε τον μηχανισμό της αντίδρασης ηλεκτροφιλικής προσθήκης χρησιμοποιώντας το παράδειγμα της υδροβρωμίωσης (προσθήκη υδροβρωμίου) του αιθενίου:
СН2= СН2 + НВг --> СНВr-СН3
Η αντίδραση ξεκινά με το σχηματισμό ενός ηλεκτρόφιλου σωματιδίου - ενός κατιόντος υδρογόνου, το οποίο συμβαίνει ως αποτέλεσμα της διάστασης ενός μορίου υδροβρωμίου.
Επιθέσεις κατιόντων υδρογόνου Π- σύνδεση, διαμόρφωση Π- ένα σύμπλεγμα που μετατρέπεται γρήγορα σε καρβοκατιόν: 
Ας δούμε τώρα μια πιο περίπλοκη υπόθεση.
Η αντίδραση της προσθήκης υδροβρωμιούχου στο αιθένιο προχωρά αναμφίβολα και η αλληλεπίδραση του υδροβρωμίου με το προπένιο μπορεί θεωρητικά να δώσει δύο προϊόντα: 1-βρωμοπροπάνιο και 2-βρωμοπροπάνιο. Πειραματικά δεδομένα δείχνουν ότι παράγεται κυρίως 2-βρωμοπροπάνιο.
Για να το εξηγήσουμε αυτό, θα πρέπει να εξετάσουμε το ενδιάμεσο σωματίδιο - το καρβοκατιόν.
Η προσθήκη ενός κατιόντος υδρογόνου στο προπένιο μπορεί να οδηγήσει στο σχηματισμό δύο καρβοκατιόντων: εάν ένα κατιόν υδρογόνου ενώσει το πρώτο άτομο άνθρακα, το άτομο που βρίσκεται στο τέλος της αλυσίδας, τότε το δεύτερο θα έχει θετικό φορτίο, δηλ. το κέντρο του μορίου (1). αν ενωθεί με το δεύτερο, τότε το πρώτο άτομο θα έχει θετικό φορτίο (2). 
Η προτιμώμενη κατεύθυνση της αντίδρασης θα εξαρτηθεί από το ποιο καρβοκατιόν είναι πιο άφθονο στο μέσο αντίδρασης, το οποίο, με τη σειρά του, καθορίζεται από τη σταθερότητα του καρβοκατιόντος. Το πείραμα δείχνει τον κυρίαρχο σχηματισμό του 2-βρωμοπροπανίου. Αυτό σημαίνει ότι ο σχηματισμός καρβοκατιόντος (1) με θετικό φορτίο στο κεντρικό άτομο συμβαίνει σε μεγαλύτερο βαθμό.
Η μεγαλύτερη σταθερότητα αυτού του καρβοκατιόντος εξηγείται από το γεγονός ότι το θετικό φορτίο στο κεντρικό άτομο άνθρακα αντισταθμίζεται από τη θετική επαγωγική επίδραση δύο μεθυλομάδων, η συνολική επίδραση των οποίων είναι υψηλότερη από την επίδραση +/- μιας αιθυλομάδας:
Οι νόμοι των αντιδράσεων υδροαλογόνωσης των αλκενίων μελετήθηκαν από τον διάσημο Ρώσο χημικό V.V. Markovnikov, μαθητή του A.M. Butlerov, ο οποίος, όπως προαναφέρθηκε, διατύπωσε τον κανόνα που φέρει το όνομά του.
Ο κανόνας αυτός θεσπίστηκε εμπειρικά, δηλαδή πειραματικά. Προς το παρόν, μπορούμε να δώσουμε μια απολύτως πειστική εξήγηση για αυτό.
Είναι ενδιαφέρον ότι και άλλες ηλεκτροφιλικές αντιδράσεις προσθήκης υπακούουν στον κανόνα του Markovnikov, επομένως θα ήταν σωστό να διατυπωθεί σε μια πιο γενική μορφή.
Στις αντιδράσεις ηλεκτρόφιλης προσθήκης, ένα ηλεκτρόφιλο (ένα σωματίδιο με ένα μη γεμάτο τροχιακό) προστίθεται σε ένα πιο υδρογονωμένο άτομο άνθρακα και ένα πυρηνόφιλο (ένα σωματίδιο με ένα μόνο ζεύγος ηλεκτρονίων) προσθέτει σε ένα λιγότερο υδρογονωμένο.
Πολυμερισμός
Μια ειδική περίπτωση αντίδρασης προσθήκης είναι η αντίδραση πολυμερισμού των αλκενίων και των παραγώγων τους. Αυτή η αντίδραση προχωρά με τον μηχανισμό προσθήκης ελεύθερων ριζών:
Ο πολυμερισμός πραγματοποιείται παρουσία εκκινητών - ενώσεων υπεροξειδίου, οι οποίες αποτελούν πηγή ελεύθερων ριζών. Οι ενώσεις υπεροξειδίου είναι ουσίες των οποίων τα μόρια περιλαμβάνουν την ομάδα -Ο-Ο-. Η απλούστερη ένωση υπεροξειδίου είναι το υπεροξείδιο του υδρογόνου HOOH.
Σε θερμοκρασία 100 °C και πίεση 100 MPa, συμβαίνει ομόλυση του ασταθούς δεσμού οξυγόνου-οξυγόνου και σχηματισμός ριζών - εκκινητών πολυμερισμού. Υπό την επίδραση των ριζών ΚΟ, ξεκινά ο πολυμερισμός, ο οποίος αναπτύσσεται ως αντίδραση προσθήκης ελεύθερων ριζών. Η ανάπτυξη της αλυσίδας σταματά όταν λαμβάνει χώρα ανασυνδυασμός ριζών στο μείγμα αντίδρασης - η αλυσίδα και οι ρίζες πολυμερούς ή COCH2CH2-.
Χρησιμοποιώντας την αντίδραση πολυμερισμού ελεύθερων ριζών ουσιών που περιέχουν διπλό δεσμό, προκύπτει ένας μεγάλος αριθμός ενώσεων υψηλού μοριακού βάρους: 
Η χρήση αλκενίων με διάφορους υποκαταστάτες καθιστά δυνατή τη σύνθεση ενός ευρέος φάσματος πολυμερών υλικών με ένα ευρύ φάσμα ιδιοτήτων. 
Όλες αυτές οι πολυμερείς ενώσεις χρησιμοποιούνται ευρέως σε διάφορους τομείς της ανθρώπινης δραστηριότητας - βιομηχανία, ιατρική, που χρησιμοποιούνται για την κατασκευή εξοπλισμού για βιοχημικά εργαστήρια, μερικές είναι ενδιάμεσες ουσίες για τη σύνθεση άλλων υψηλού μοριακών ενώσεων.
Οξείδωση
Γνωρίζετε ήδη ότι σε ουδέτερα ή ελαφρώς αλκαλικά διαλύματα, συμβαίνει οξείδωση αλκενίων σε διόλες (διυδρικές αλκοόλες). Σε όξινο περιβάλλον (διάλυμα οξινισμένο με θειικό οξύ), ο διπλός δεσμός καταστρέφεται εντελώς και τα άτομα άνθρακα μεταξύ των οποίων υπήρχε ο διπλός δεσμός μετατρέπονται σε άτομα άνθρακα της καρβοξυλικής ομάδας: 
Η καταστροφική οξείδωση των αλκενίων μπορεί να χρησιμοποιηθεί για τον προσδιορισμό της δομής τους. Έτσι, για παράδειγμα, εάν ληφθούν οξικό και προπιονικό οξύ κατά την οξείδωση ενός συγκεκριμένου αλκενίου, αυτό σημαίνει ότι το πεντένιο-2 έχει υποστεί οξείδωση και εάν ληφθεί βουτυρικό οξύ και διοξείδιο του άνθρακα, τότε ο αρχικός υδρογονάνθρακας είναι το πεντένιο-1 .
Εφαρμογή
Τα αλκένια χρησιμοποιούνται ευρέως στη χημική βιομηχανία ως πρώτες ύλες για την παραγωγή ποικίλων οργανικών ουσιών και υλικών.
Για παράδειγμα, το αιθένιο είναι η πρώτη ύλη για την παραγωγή αιθανόλης, αιθυλενογλυκόλης, εποξειδίων και διχλωροαιθανίου.
Μεγάλη ποσότητα αιθενίου μετατρέπεται σε πολυαιθυλένιο, το οποίο χρησιμοποιείται για την κατασκευή φιλμ συσκευασίας, επιτραπέζιων σκευών, σωλήνων και ηλεκτρικών μονωτικών υλικών.
Η γλυκερίνη, η ακετόνη, η ισοπροπανόλη και οι διαλύτες λαμβάνονται από το προπένιο. Με τον πολυμερισμό του προπενίου, λαμβάνεται το πολυπροπυλένιο, το οποίο είναι ανώτερο από το πολυαιθυλένιο από πολλές απόψεις: έχει υψηλότερο σημείο τήξης και χημική αντοχή.
Επί του παρόντος, ίνες με μοναδικές ιδιότητες παράγονται από πολυμερή - ανάλογα πολυαιθυλενίου. Για παράδειγμα, οι ίνες πολυπροπυλενίου είναι ισχυρότερες από όλες τις γνωστές συνθετικές ίνες.
Τα υλικά που κατασκευάζονται από αυτές τις ίνες είναι πολλά υποσχόμενα και χρησιμοποιούνται όλο και περισσότερο σε διάφορους τομείς της ανθρώπινης δραστηριότητας.

1. Ποιοι τύποι ισομερισμού είναι χαρακτηριστικά των αλκενίων; Γράψτε τους τύπους για πιθανά ισομερή του πεντενίου-1.
2. Από ποιες ενώσεις μπορούν να ληφθούν: α) ισοβουτένιο (2-μεθυλοπροπένιο); β) βουτένιο-2; γ) βουτένιο-1; Να γράψετε τις εξισώσεις για τις αντίστοιχες αντιδράσεις.
3. Αποκρυπτογραφήστε την ακόλουθη αλυσίδα μετασχηματισμών. Ονομάστε τις ενώσεις A, B, C. 4. Προτείνετε μια μέθοδο για τη λήψη 2-χλωροπροπανίου από 1-χλωροπροπάνιο. Να γράψετε τις εξισώσεις για τις αντίστοιχες αντιδράσεις.
5. Προτείνετε μια μέθοδο για τον καθαρισμό του αιθανίου από προσμίξεις αιθυλενίου. Να γράψετε τις εξισώσεις για τις αντίστοιχες αντιδράσεις.
6. Δώστε παραδείγματα αντιδράσεων που μπορούν να χρησιμοποιηθούν για τη διάκριση μεταξύ κορεσμένων και ακόρεστων υδρογονανθράκων.
7. Για πλήρη υδρογόνωση 2,8 g αλκενίου, καταναλώθηκαν 0,896 λίτρα υδρογόνου (n.e.). Ποιο είναι το μοριακό βάρος και ο δομικός τύπος αυτής της ένωσης, η οποία έχει μια κανονική αλυσίδα ατόμων άνθρακα;
8. Τι αέριο βρίσκεται στον κύλινδρο (αιθένιο ή προπένιο), αν είναι γνωστό ότι η πλήρης καύση 20 cm3 αυτού του αερίου απαιτούσε 90 cm3 (n.s.) οξυγόνο;
9*. Όταν ένα αλκένιο αντιδρά με το χλώριο στο σκοτάδι, σχηματίζονται 25,4 g διχλωριούχου και όταν αυτό το αλκένιο της ίδιας μάζας αντιδρά με βρώμιο σε τετραχλωράνθρακα, σχηματίζονται 43,2 g διβρωμιδίου. Προσδιορίστε όλους τους πιθανούς συντακτικούς τύπους του αρχικού αλκενίου.
Ιστορία της ανακάλυψης
Από το παραπάνω υλικό, έχουμε ήδη καταλάβει ότι το αιθυλένιο είναι ο πρόγονος της ομόλογης σειράς ακόρεστων υδρογονανθράκων, η οποία έχει έναν διπλό δεσμό. Ο τύπος τους είναι C n H 2n και ονομάζονται αλκένια.
Το 1669, ο Γερμανός γιατρός και χημικός Becher ήταν ο πρώτος που έλαβε αιθυλένιο αντιδρώντας θειικό οξύ με αιθυλική αλκοόλη. Ο Becher διαπίστωσε ότι το αιθυλένιο είναι πιο χημικά δραστικό από το μεθάνιο. Αλλά, δυστυχώς, εκείνη την εποχή ο επιστήμονας δεν μπορούσε να αναγνωρίσει το προκύπτον αέριο και ως εκ τούτου δεν του έδωσε κανένα όνομα.
Λίγο αργότερα, οι Ολλανδοί χημικοί χρησιμοποίησαν την ίδια μέθοδο για την παραγωγή αιθυλενίου. Και επειδή, όταν αλληλεπιδρούσε με το χλώριο, έτεινε να σχηματίζει ένα ελαιώδες υγρό, έλαβε αναλόγως την ονομασία «αέριο πετρελαίου». Αργότερα έγινε γνωστό ότι αυτό το υγρό ήταν διχλωροαιθάνιο.
Στα γαλλικά, ο όρος «λάδι» είναι oléfiant. Και αφού ανακαλύφθηκαν άλλοι υδρογονάνθρακες αυτού του τύπου, ο Antoine Fourcroix, Γάλλος χημικός και επιστήμονας, εισήγαγε έναν νέο όρο που έγινε κοινός σε ολόκληρη την κατηγορία ολεφινών ή αλκενίων.
Αλλά ήδη στις αρχές του δέκατου ένατου αιώνα, ο Γάλλος χημικός J. Gay-Lussac ανακάλυψε ότι η αιθανόλη δεν αποτελείται μόνο από αέριο «πετρελαίου», αλλά και από νερό. Επιπλέον, το ίδιο αέριο ανακαλύφθηκε στο χλωριούχο αιθυλεστέρα.
Και παρόλο που οι χημικοί προσδιόρισαν ότι το αιθυλένιο αποτελείται από υδρογόνο και άνθρακα και γνώριζαν ήδη τη σύνθεση των ουσιών, δεν μπορούσαν να βρουν την πραγματική του φόρμουλα για πολύ καιρό. Και μόνο το 1862 ο E. Erlenmeyer κατάφερε να αποδείξει την παρουσία διπλού δεσμού στο μόριο αιθυλενίου. Αυτό αναγνώρισε και ο Ρώσος επιστήμονας A.M. Butlerov και επιβεβαίωσε πειραματικά την ορθότητα αυτής της άποψης.
Εμφάνιση στη φύση και φυσιολογικός ρόλος των αλκενίων
Πολλοί άνθρωποι ενδιαφέρονται για το ερώτημα πού μπορούν να βρεθούν τα αλκένια στη φύση. Έτσι, αποδεικνύεται ότι πρακτικά δεν εμφανίζονται στη φύση, καθώς ο απλούστερος αντιπρόσωπός του, το αιθυλένιο, είναι μια ορμόνη για τα φυτά και συντίθεται σε αυτά μόνο σε μικρές ποσότητες.
Είναι αλήθεια ότι στη φύση υπάρχει ένα τέτοιο αλκένιο όπως το muskalur. Αυτό ένα από τα φυσικά αλκένια είναι ένα σεξουαλικό ελκυστικό της θηλυκής οικιακής μύγας.
Αξίζει να δοθεί προσοχή στο γεγονός ότι, έχοντας υψηλή συγκέντρωση, τα κατώτερα αλκένια έχουν ναρκωτική δράση που μπορεί να προκαλέσει σπασμούς και ερεθισμό των βλεννογόνων.
Εφαρμογές αλκενίων
Είναι δύσκολο να φανταστεί κανείς τη ζωή της σύγχρονης κοινωνίας σήμερα χωρίς τη χρήση πολυμερών υλικών. Δεδομένου ότι, σε αντίθεση με τα φυσικά υλικά, τα πολυμερή έχουν διαφορετικές ιδιότητες, είναι εύκολο να επεξεργαστούν και αν κοιτάξετε την τιμή, είναι σχετικά φθηνά. Μια άλλη σημαντική πτυχή υπέρ των πολυμερών είναι ότι πολλά από αυτά μπορούν να ανακυκλωθούν.
Τα αλκένια έχουν βρει τη χρήση τους στην παραγωγή πλαστικών, καουτσούκ, μεμβρανών, τεφλόν, αιθυλικής αλκοόλης, ακεταλδεΰδης και άλλων οργανικών ενώσεων.

Στη γεωργία, χρησιμοποιείται ως μέσο που επιταχύνει τη διαδικασία ωρίμανσης των καρπών. Το προπυλένιο και τα βουτυλένια χρησιμοποιούνται για την παραγωγή διαφόρων πολυμερών και αλκοολών. Αλλά στην παραγωγή συνθετικού καουτσούκ, χρησιμοποιείται ισοβουτυλένιο. Επομένως, μπορούμε να συμπεράνουμε ότι είναι αδύνατο να γίνει χωρίς αλκένια, καθώς είναι οι πιο σημαντικές χημικές πρώτες ύλες.
Βιομηχανικές χρήσεις αιθυλενίου
Σε βιομηχανική κλίμακα, το προπυλένιο χρησιμοποιείται συνήθως για τη σύνθεση πολυπροπυλενίου και για την παραγωγή ισοπροπανόλης, γλυκερίνης, βουτυραλδεΰδων κ.λπ. Κάθε χρόνο η ζήτηση για προπυλένιο αυξάνεται.

4.3.β. Προσθήκη υδραλογονιδίων (υδροαλογόνωση)
Μια άλλη σημαντική ηλεκτροφιλική αντίδραση προσθήκης στα αλκένια είναι η από καιρό γνωστή υδροαλογόνωση των αλκενίων.
Παρακάτω είναι χαρακτηριστικά παραδείγματα προσθήκης HCl, HBr και HI σε διάφορα αλκένια.


Η επίδραση των αλκυλικών υποκαταστατών στον διπλό δεσμό στον ρυθμό προσθήκης περιγράφεται από την ακόλουθη αλληλουχία:
R 2 C=CHR > RCH=CHR > RCH=CH 2
Αυτό είναι σύμφωνο με έναν μηχανισμό στον οποίο το στάδιο προσδιορισμού της ταχύτητας της αντίδρασης περιλαμβάνει το σχηματισμό ενός καρβοκατιόντος καθώς η σταθερότητα των κατιόντων αλκυλίου μειώνεται στην τάξη τριτοταγών > δευτεροταγών > πρωτογενών. Έτσι, ο μηχανισμός προσθήκης πρέπει να περιλαμβάνει το σχηματισμό είτε ενός ελεύθερου καρβοκατιονικού ενδιάμεσου, το οποίο παρατηρείται σπάνια, είτε ενός ενδιάμεσου με καρβοκατιονικό χαρακτήρα. Η τελευταία περίπτωση είναι η πιο χαρακτηριστική.
Εάν η προσθήκη γινόταν μέσω ενός «ελεύθερου καρβοκατιόντος», τότε η αντίδραση θα ήταν εντελώς μη στερεοεκλεκτική, καθώς τα αλκυλικά κατιόντα έχουν επίπεδη δομή. Ωστόσο, η υδροαλογόνωση, κατά κανόνα, προχωρά στερεοεκλεκτικά και ανάλογα με τον τύπο του αλκενίου, επιλεκτική αντι-προσκόλληση, επιλεκτική συν- ή μικτή συν-αντι- προσχώρηση.
Για τα αλκένια στα οποία ο διπλός δεσμός δεν είναι συζευγμένος με έναν αρωματικό δακτύλιο, είναι χαρακτηριστικό αντι-προσθήκη υδραλογόνου. Αντι-η προσθήκη υδροχλωρίου και βρωμιδίου, χλωριούχου δευτέριου και βρωμιδίου παρατηρείται για κυκλοεξένιο, κυκλοπεντένιο, 1,2-διμεθυλεξένιο, 1,2-διμεθυλπεντένιο, cis- Και έκσταση-βουτένιο-2, εξένιο-3 και πολλά άλλα απλά αλκένια και κυκλοαλκένια.

Στο προϊόν προσθήκης, πανομοιότυποι υποκαταστάτες (ομάδες μεθυλίου) βρίσκονται σε διαφορετικές πλευρές του μεσαίου επιπέδου του δακτυλίου κυκλοεξανίου, επομένως ανήκει έκσταση-σειρά. Αντι-η προσθήκη είναι δύσκολο να συμβιβαστεί με έναν μηχανισμό στον οποίο υποτίθεται ο σχηματισμός ενός διακριτού καρβοκατιόντος. Για ένα επίπεδο καρβοκατιόν, η πυρηνόφιλη επίθεση από το ιόν αλογονιδίου είναι εξίσου πιθανή και στις δύο πλευρές του επιπέδου, η οποία θα πρέπει να οδηγήσει στον σχηματισμό ενός μείγματος προϊόντων συν- Και αντι- προσχωρήσεις. Η κινητική της υδροαλογονώσεως αλκενίου υποδεικνύει επίσης έναν πιο πολύπλοκο μηχανισμό προσθήκης. Για μη συζευγμένα αλκένια, ο ρυθμός αντίδρασης περιγράφεται από μια εξίσωση τρίτης τάξης με δεύτερη τάξη στο υδραλογόνο, δηλαδή αντιστοιχεί στον μηχανισμό Ad E 3.
v = k [αλκένιο] 2
Η αντίδραση κατά της προσθήκης και δεύτερης τάξης στο υδραλογόνο συμφωνεί καλά με τον μηχανισμό Ad E 3, στον οποίο ένα αλκένιο αντιδρά με δύο μόρια υδραλογόνου, το ένα από τα οποία δρα ως ηλεκτρόφιλος παράγοντας και το άλλο ως πυρηνόφιλος παράγοντας.

Αυτός ο τριμοριακός μηχανισμός υποθέτει ότι αρχικά σχηματίζεται ένα σύμπλοκο ενός μορίου αλκενίου και ενός μορίου υδραλογόνου, ακολουθούμενο από την επίθεση ενός δεύτερου μορίου HX σε αυτό το σύμπλοκο με αντι-πλευρές χωρίς σχηματισμό διακριτού καρβοκατιόντος. Πρέπει να σημειωθεί ιδιαίτερα ότι οποιοσδήποτε τριμοριακός μηχανισμός πρέπει να αποτελείται από δύο διαδοχικά στάδια, αφού η σύγκρουση τριών μορίων ταυτόχρονα είναι εξαιρετικά απίθανη.

Η αντι-προσθήκη υποδηλώνει μια προτιμώμενη πυρηνόφιλη επίθεση από το υδραλογόνο από την πλευρά που βρίσκεται απέναντι από το σημείο όπου πρωτονιώνεται το αλκένιο. Αντί για υδραλογόνο, η λειτουργία ενός πυρηνόφιλου παράγοντα στο τελικό στάδιο μπορεί επίσης να εκτελεστεί από ένα ιόν αλογονιδίου. Πράγματι, ο ρυθμός αντίδρασης συνήθως αυξάνεται σε ευθεία αναλογία με τη συγκέντρωση του ιόντος αλογονιδίου που εισάγεται στο μείγμα αντίδρασης με τη μορφή αλογονιδίων τετρααλκυλαμμωνίου NR 4+ X - ή λιθίου LiX. Σε αυτή την περίπτωση, στερεοειδική αντι- προσχώρηση.
Για τα αλκάνια στα οποία ο διπλός δεσμός είναι συζευγμένος με έναν αρωματικό δακτύλιο, είναι χαρακτηριστικό συν- προσχώρηση ή μικτή συν-αντι-προσθήκη υδραλογόνου, για παράδειγμα:

Η προσθήκη Syn είναι η κυρίαρχη διαδικασία για cis- Και έκσταση-ισομερή 1-φαινυλοπροπενίου, 1-φαινυλο-4-αλκυλοκυκλοεξενίων, ακεναφθυλενίου, ινδενίου. Όταν τέτοια αλκένια πρωτονιώνονται, σχηματίζονται καρβοκατιόντα τύπου βενζυλίου, τα οποία είναι πιο σταθερά από τα καθαρά αλκυλικά κατιόντα που προκύπτουν κατά την πρωτονίωση των συνηθισμένων αλκενίων και κυκλοαλκενίων. Η κινητική της αντίδρασης σε αυτή την περίπτωση συνήθως περιγράφεται από μια απλούστερη εξίσωση δεύτερης τάξης v = k[αλκένιο], δηλ. αντιστοιχεί στον διμοριακό μηχανισμό Ad E 2. Ad E 2-Μηχανισμός περιλαμβάνει το σχηματισμό ενός ζεύγους ιόντων που περιλαμβάνει ένα καρβοκατιόν και ένα ιόν αλογονιδίου.

Ο μηχανισμός προσθήκης που περιλαμβάνει ζεύγη ιόντων δεν μπορεί να αναμένεται να είναι πολύ στερεοεκλεκτικός. Εάν ένα ζεύγος ιόντων μετατραπεί στο τελικό προϊόν πιο γρήγορα από ό,τι μπορεί να περιστραφεί γύρω από έναν μόνο δεσμό άνθρακα-άνθρακα, το τελικό αποτέλεσμα θα είναι συν-προσθήκη, όπου ένα πρωτόνιο και ένα ιόν αλογονιδίου προστίθενται στην ίδια πλευρά του διπλού δεσμού. Σε αντίθετη περίπτωση, ο σχηματισμός προϊόντων όπως π.χ συν- Έτσι αντι- σύνδεση ΝΗ. Αυτή η περίπτωση συμβαίνει κατά την υδροαλογόνωση ζεύγος-υποκατεστημένο στυρόλιο Z-C6H4-CH=CH2. Το μοτίβο που παρατηρείται εδώ είναι αυτό συν-η προσθήκη είναι χαρακτηριστική μόνο για εκείνες τις ολεφίνες που, όταν πρωτονιωθούν, δίνουν ένα σχετικά σταθερό καρβοκατιόν, δηλ. στην περίπτωση των υποκαταστατών Ζ δότη.
Οι αντιδράσεις υδροαλογόνωσης που πραγματοποιούνται με τον μηχανισμό Ad E 2 χαρακτηρίζονται από ανταγωνισμό μεταξύ των διεργασιών προσθήκης συζυγούς και αναδιάταξης, καθώς ένα ζεύγος καρβοκατιόν ή ιόντων σχηματίζεται ως ενδιάμεσο.

Ως παράδειγμα αναδιατάξεων με 1,2-μετανάστευση μιας αλκυλομάδας και ενός ιόντος υδριδίου, παρουσιάζουμε τις αντιδράσεις υδροαλογόνωσης τριτ-βουτυλαιθυλενίου και ισοπροπυλαιθυλενίου, αντίστοιχα.

Όταν η ίδια αντίδραση διεξάγεται χωρίς διαλύτη στο κρύο (-78 0 C), σχηματίζεται ένα μίγμα από 33% κανονικά και 67% μη φυσιολογικά (ανασυγκροτημένα) προϊόντα προσθήκης.

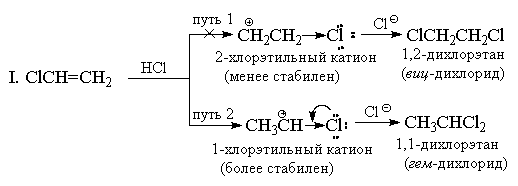
4.3.γ. Προσανατολισμός. Ο κανόνας του Markovnikov
Σε αντίθεση με τα συμμετρικά ηλεκτρόφιλα (Hal 2), τα υδραλογονίδια είναι ασύμμετρα ηλεκτροφιλικά αντιδραστήρια. Η προσθήκη οποιουδήποτε ασύμμετρου ηλεκτροφίλου (HBr, ICl, H2O, Hg(OAc)2, κ.λπ.) σε ένα ασύμμετρο αλκένιο θα μπορούσε κατ' αρχήν να παράγει ένα μείγμα δύο εναλλακτικών προϊόντων, αλλά στην πράξη συνήθως σχηματίζεται μόνο ένα από αυτά. Ως παράδειγμα, εξετάστε την προσθήκη υδροβρωμίου στο προπυλένιο.

Πίσω στο 1870 V.V. Ο Markovnikov διατύπωσε έναν εμπειρικό κανόνα σύμφωνα με τον οποίο τα ασύμμετρα αλκένια προσθέτουν ΗΧ με τέτοιο τρόπο ώστε να σχηματίζεται κατά προτίμηση ένα προϊόν στο οποίο προστίθεται υδρογόνο στο λιγότερο υποκατεστημένο άκρο και Χ στο πιο υποκατεστημένο άκρο του διπλού δεσμού.
Ο κανόνας του Markovnikov εξηγείται συνήθως από τη διαφορά στη σταθερότητα δύο εναλλακτικών καρβοκατιόντων. Για παράδειγμα, στο παραπάνω παράδειγμα, κανονικό n-Το κατιόν προπυλίου είναι πολύ λιγότερο σταθερό από το κατιόν ισοπροπυλίου και επομένως η αντίδραση προχωρά κατά μήκος της δεύτερης διαδρομής.
Ο κανόνας του Markovnikov χρησιμοποιήθηκε αρχικά μόνο για περιπτώσεις προσθήκης ΗΧ σε υποστρώματα υδρογονανθράκων, αλλά κατ' αρχήν μπορεί να επεκταθεί σε αντιδράσεις άλλων υποκατεστημένα αλκενίων. Έτσι, η προσθήκη HCl στο CF 3 CH=CH 2 δίνει " αντι-Markovnikov" προϊόν CF 3 CH 2 CH 2 Cl. Αυτό ήταν αναμενόμενο, καθώς το κατιόν CF 3 CH + CH 3 είναι λιγότερο σταθερό από το κατιόν CF 3 CH 2 CH 2 + λόγω της ισχυρής (-I) επίδρασης του Ομάδα CF 3 Το κατιόν CF 3 CH 2 CH 2 + σχηματίζεται κυρίως, αλλά επίσης, αν και σε μικρότερο βαθμό, αποσταθεροποιείται από την επαγωγική δράση της ομάδας CF 3, ως αποτέλεσμα της οποίας η προσθήκη HCl στο τριφθορομεθυλαιθυλένιο πολύ πιο αργή από την προσθήκη σε μη υποκατεστημένο αιθυλένιο.
Για παρόμοιο λόγο, τα κατιόντα βινυλοτριαλκυλαμμωνίου προσθέτουν HBr επίσης ενάντια στον κανόνα του Markovnikov:
Η προσθήκη ΗΧ σε αλκένια που έχουν ισχυρούς (-Ι) και (-Μ) υποκαταστάτες, για παράδειγμα, στο ακρυλονιτρίλιο ή το νιτροαιθυλένιο, θα πρέπει επίσης να αντίκειται στον κανόνα του Markovnikov. Ωστόσο, σε αυτή την περίπτωση, ο διπλός δεσμός απενεργοποιείται τόσο έντονα σε σχέση με τα ηλεκτρόφιλα αντιδραστήρια που αυτές οι αντιδράσεις συμβαίνουν μόνο κάτω από πολύ αυστηρές συνθήκες. Το βινυλοχλωρίδιο CH 2 =CHCl δίνει πάντα αποκλειστικά «προσαγωγές Markovnikov». Για παράδειγμα, όταν αντιδρά με HCl, σχηματίζεται μόνο 1,1-διχλωροαιθάνιο (διχλωριούχο διχλωρίδιο) CH 3 CHCl 2. Το χλώριο, παρόμοιο με την ομάδα CF 3, έχει ισχυρό (-I) αποτέλεσμα και με την πρώτη ματιά, φαίνεται ότι για το λόγο αυτό η προσθήκη θα πρέπει να έχει αντι-Markovnikov προσανατολισμό, καθώς το κατιόν + CH 2 CH 2 Cl θα πρέπει να είναι πιο σταθερό από το κατιόν CH 3 CH + Cl. Ωστόσο, σε αντίθεση με την ομάδα CF 3, το χλώριο, εκτός από το φαινόμενο (-I), έχει και ένα αντίθετο (+M) αποτέλεσμα (αφού έχει μεμονωμένα ζεύγη). Η εμπειρία δείχνει ότι το μέγεθος του μεσομερικού φαινομένου είναι αρκετά αρκετό για να μειώσει την ενέργεια του κατιόντος 1-χλωροαιθυλίου κάτω από το ενεργειακό επίπεδο του κατιόντος 2-χλωροαιθυλίου, στο οποίο το φαινόμενο +M δεν εκδηλώνεται.
II. Από την άποψη της θεωρίας συντονισμού, η δομή του κατιόντος 1-χλωροαιθυλίου μπορεί να αναπαρασταθεί ως εξής:
Ωστόσο, η προσθήκη στο χλωριούχο βινύλιο γίνεται πιο αργά από ό,τι στο αιθυλένιο υπό τις ίδιες συνθήκες, δηλαδή, σύμφωνα με τη συνολική επίδραση (-I > +M), το χλώριο παραμένει ένας υποκαταστάτης που αφαιρεί ηλεκτρόνια σε σύγκριση με το υδρογόνο και το κατιόν 1-χλωροαιθυλίου είναι λιγότερο σταθερό από το C 2 H 5 + . Άλλα αλογονίδια βινυλίου αντιδρούν με παρόμοιο τρόπο με το HX.
Οι βινυλαιθέρες CH2 =CHOR προσθέτουν HX (X=Hal) σύμφωνα με τον κανόνα του Markovnikov σε πολύ υψηλότερο ρυθμό από όλα τα υποκατεστημένα αλκένια που αναφέρονται παραπάνω. Αυτό οφείλεται στη σημαντική επίδραση +M της ομάδας RO. Σε αντίθεση με το άτομο χλωρίου, η ομάδα RO, όσον αφορά το συνολικό ηλεκτρονικό αποτέλεσμα (+M > -I), είναι ένας ισχυρός υποκαταστάτης που δίνει ηλεκτρόνια που σταθεροποιεί αποτελεσματικά το γειτονικό κέντρο καρβοκατιόντος. Η δομή του καρβοκατιόντος σε αυτή την περίπτωση μπορεί επίσης να αναπαρασταθεί ως ένα σύνολο δύο δομών συντονισμού
Η προσβολή του κατιόντος οξονίου από ένα ανιόν αλογονιδίου οδηγεί στο σχηματισμό α-αλογόνων αιθέρων του τύπου CH 3 CH(Hal)OR.
4.3.ζ. Ενυδάτωση αλκενίων
Η καταλυόμενη από οξύ ενυδάτωση των αλκενίων οδηγεί στο σχηματισμό αλκοολών. Η κατεύθυνση της ενυδάτωσης των αλκενίων καθορίζεται από τον κανόνα του Markovnikov, επομένως θεωρείται ότι ένα καρβοκατιόν σχηματίζεται ως ενδιάμεσο σωματίδιο σε αυτή την αντίδραση.
Η τάση των δευτερογενών αλκυλοκαρβοκατιόντων να αναδιατάσσονται αποτρέπει τη χρήση ενυδάτωσης αλκενίων για την παραγωγή δευτεροταγών αλκοολών.

Αυτή η μέθοδος έχει βρει περιορισμένη εφαρμογή στο εργαστήριο μόνο για την παρασκευή τριτοταγών αλκοολών. Η αντίδραση ενυδάτωσης σε αυτή την περίπτωση είναι σε μεγάλο βαθμό αναστρέψιμη και οι τριτοταγείς αλκοόλες σχηματίζονται σε χαμηλές αποδόσεις (40-45%).


Η ενυδάτωση των απλούστερων αλκενίων - αιθυλενίου και προπυλενίου - είναι μια σημαντική βιομηχανική μέθοδος για την παραγωγή αιθυλικών και ισοπροπυλικών αλκοολών.

Στην εργαστηριακή πρακτική, η άμεση ενυδάτωση των αλκενίων δεν έχει βρει ευρεία χρήση, τόσο λόγω σκληρών συνθηκών όσο και λόγω του σχηματισμού σημαντικής ποσότητας ισομερών αλκοολών. Επί του παρόντος, η σχετική αντίδραση υδροξυυδράρματος - αφυδάτωση - χρησιμοποιείται συνήθως για την τοποεκλεκτική παραγωγή αλκοολών από αλκένια.
4.3.δ. Υδροξυυδράρισμα-απουδατοποίηση
Μια ηλεκτροφιλική επίθεση στον διπλό δεσμό ενός αλκενίου μπορεί να πραγματοποιηθεί από μεταλλικά ιόντα, μεταξύ των οποίων το κατιόν υδραργύρου (II) κατέχει ειδική θέση. Ο οξικός υδράργυρος σε πολύ ήπιες συνθήκες στους 20 0 C προστίθεται σε αλκένια σε υδατικό τετραϋδροφουράνιο (THF) ή υδατικό οξικό οξύ για να σχηματίσει οργανοϋδράργυρες ενώσεις. Η προσθήκη οξικού υδραργύρου στον διπλό δεσμό προχωρά τοπικά ειδικά σύμφωνα με τον κανόνα του Markovnikov, δηλαδή, το κατιόν υδραργύρου προσκολλάται στο λιγότερο υποκατεστημένο άτομο άνθρακα.
Ο δεσμός C-Hg στις οργανοϋδράργυρες ενώσεις μπορεί εύκολα να διασπαστεί με τη δράση του βοροϋδριδίου του νατρίου NaBH 4, σχηματίζοντας υδράργυρο και έναν νέο δεσμό C-H. Υποτίθεται ότι το υδρίδιο του αλκυλυδραργύρου λαμβάνεται ως ασταθές ενδιάμεσο, το οποίο περαιτέρω αποσυντίθεται για να απελευθερώσει μεταλλικό υδράργυρο μέσω ενός ριζικού μηχανισμού.

Συνολικά, αυτή η διεργασία δύο σταδίων υδροξυυδράρματος-απουδατοποίησης αντιπροσωπεύει τελικά μια τοποειδική ενυδάτωση ενός αλκενίου σύμφωνα με τον κανόνα του Markovnikov υπό εξαιρετικά ήπιες συνθήκες, όταν ο σχηματισμός παραπροϊόντων μειώνεται στο μέγιστο δυνατό ελάχιστο. Αυτό μπορεί να διευκρινιστεί καθαρά χρησιμοποιώντας τα ακόλουθα παραδείγματα, στα οποία η συνολική απόδοση των προϊόντων αντίδρασης είναι 90-98%. Τα ψηφιακά δεδομένα που δίνονται σε αυτή την περίπτωση δεν υποδεικνύουν τις αποδόσεις των ενώσεων που προκύπτουν, αλλά την αναλογία τους στο μείγμα.




Όπως μπορεί να φανεί από τα παραπάνω παραδείγματα, ο υδροξυυδράρισμα-απουδατοποίηση των αλκενίων στις περισσότερες περιπτώσεις παρέχει τοπική ειδική ενυδάτωση των αλκενίων με το σχηματισμό σχεδόν μόνο μιας από τις δύο ισομερείς αλκοόλες. Πρέπει να σημειωθεί ότι δεν υπάρχει ανάγκη απομόνωσης της ένωσης οργανοϋδράργυρου και και οι δύο διαδικασίες μπορούν να πραγματοποιηθούν απευθείας η μία μετά την άλλη.
Ο υδροξυ-υδράρισμα των ασύμμετρων αλκενίων ξεκινά προφανώς με την προσβολή του κατιόντος AcOHg + και το σχηματισμό ως ενδιάμεσου ενός ασύμμετρου κυκλικού κατιόντος υδραργύρου (ανάλογο του ασύμμετρου ιόντος αλογόνου), το οποίο στη συνέχεια ανοίγεται ως αποτέλεσμα της πυρηνόφιλης επίθεσης από το νερό στο υποκατεστημένο άτομο άνθρακα, το οποίο φέρει μεγαλύτερο θετικό φορτίο.

Το γεφυρωμένο ιόν υδραργύρου μπορεί να σταθεροποιηθεί σε ένα μη πυρηνόφιλο έντονα όξινο περιβάλλον ακόμη και στους 20 0 C με την προσθήκη ενός ισχυρότερου ηλεκτροφιλικού παράγοντα - τριφθοροξικού υδραργύρου σε ένα μείγμα φθοριοσουλφονικού οξέος και πενταφθοριούχου αντιμονίου.

Το κατιόν υδραργύρου μπορεί να αποσυντεθεί όχι μόνο από τη δράση του νερού, αλλά και από άλλους διαλύτες που δότες ηλεκτρονίων: αλκοόλες, οξικό οξύ, ακετονιτρίλιο, κ.λπ. Το τελικό προϊόν αντίδρασης σε αυτή την περίπτωση θα είναι αιθέρες, οξικά ή Ν-υποκατεστημένα αμίδια του οξικό οξύ, αντίστοιχα, για παράδειγμα:


Όταν χρησιμοποιούνται διακλαδισμένες δευτεροταγείς ή τριτοταγείς αλκοόλες στην αντίδραση αλκοξυ-υδράρματος-απουδατοποίησης, το τριφθοροξικό Hg(OCOCF 3) 2 ή ο τριφλικός υδράργυρος Hg (OSO 2 CF 3) 2 είναι πιο αποτελεσματικά από τον οξικό υδράργυρο.

Έτσι, η υδροξυ- και αλκοξυ-υδράρισμα-απουδατοποίηση είναι μια από τις καλύτερες παρασκευαστικές μεθόδους για τη σύνθεση αλκοολών και αιθέρων με διακλαδισμένες ρίζες αλκυλίου.
Η προσθήκη αλάτων υδραργύρου σε αλκένια είναι το πιο εντυπωσιακό παράδειγμα αντίδρασης συζυγούς προσθήκης σε διπλό δεσμό, όπου ο ρόλος ενός εξωτερικού πυρηνόφιλου παράγοντα διαδραματίζεται από έναν διαλύτη. Η στερεοχημεία της διεργασίας διπλού υδροξυυδράρματος-απουδατοποίησης εξαρτάται από το στερεοχημικό αποτέλεσμα κάθε μεμονωμένου βήματος. Ο υδροξυυδράρισμα χαρακτηρίζεται από αντι-προσθήκη, όπως και για άλλες αντιδράσεις που περιλαμβάνουν ένα κυκλικό κατιόν. Ωστόσο, ο ριζικός αφυδάτωση δεν είναι ιδιαίτερα στερεοεκλεκτικός. Επομένως, η όλη διαδικασία στο σύνολό της είναι επίσης μη στερεοειδική.
4.3.ε. Προσθήκη αλκενίων (κατιονικός διμερισμός και πολυμερισμός αλκενίων)
Το πιο ενδιαφέρον παράδειγμα αυτού του τύπου αντίδρασης είναι ο διμερισμός και ο πολυμερισμός του ισοβουτυλενίου παρουσία θειικού οξέος.

Η τεχνική ονομασία για αυτό το μείγμα αλκενίων είναι "διισοβουτυλένιο". Αυτή η αντίδραση προχωρά με έναν κατιονικό μηχανισμό, παρόμοιο με τον μηχανισμό προσθήκης ανόργανων οξέων στον διπλό δεσμό των αλκενίων. Στο πρώτο στάδιο, ένα πρωτόνιο προσκολλάται σε ένα μόριο ισοβουτυλενίου για να σχηματίσει ένα σχετικά σταθερό τρίβει- κατιόν βουτυλίου. Περαιτέρω σχηματίζεται τρίβειΤο κατιόν βουτυλίου (οξύ Lewis) αντιδρά με ένα μόριο ισοβουτυλενίου (βάση Lewis) για να σχηματίσει ένα νέο σταθερό τριτοταγές οκτυλοκατιόν.

Κάτω από αυτές τις συνθήκες, υπό τη δράση βάσεων (ιόντα H 2 O, HSO 4 -), το οκτυλο καρβοκατιόν χάνει γρήγορα ένα πρωτόνιο και μετατρέπεται σε ένα μείγμα ισομερών πεντενίων, καθώς η αφαίρεση πρωτονίων γίνεται από δύο διαφορετικές θέσεις:

Ο προτιμώμενος σχηματισμός ενός θερμοδυναμικά λιγότερο σταθερού αλκενίου - 2,4,4-τριμεθυλοπεντένιο-1 (80% στο μείγμα αντίδρασης) σχετίζεται με μεγαλύτερη χωρική προσβασιμότητα για προσβολή από τη βάση των ατόμων υδρογόνου των ομάδων μεθυλίου, σε σύγκριση με το υδρογόνο άτομα της ομάδας του μεθυλενίου. Βιομηχανικά, το «διισοβουτυλένιο» υδρογονώνεται με Ni-Raney για να παραχθεί «ισοκτάνιο» (η τεχνική ονομασία για τον υδρογονάνθρακα 2,2,4-τριμεθυλοπεντάνιο), που χρησιμοποιείται ως καύσιμο υψηλού οκτανίου για κινητήρες εσωτερικής καύσης.
Σε υψηλές συγκεντρώσεις θειικού οξέος (πάνω από 80%), ο κατιονικός πολυμερισμός του ισοβουτυλενίου συμβαίνει για να σχηματιστεί ένα πολυμερές που ονομάζεται πολυισοβουτυλένιο (-CH 2 C(CH 3) 2 -) n. Αυτό το πολυμερές που μοιάζει με καουτσούκ χρησιμοποιείται για την παραγωγή αντιδιαβρωτικών και στεγανωτικών επιστρώσεων, στεγανωτικών κ.λπ.
Εκτός από το ισοβουτυλένιο, το 3-μεθυλοβουτένιο-1, οι βινυλαιθέρες και ορισμένα παράγωγα στυρολίου, ικανά να σχηματίζουν σχετικά σταθερά καρβοκατιόντα, πολυμερίζονται με τον κατιονικό μηχανισμό. Το υδροφθόριο και τα οξέα Lewis χρησιμοποιούνται επίσης ως καταλύτες για κατιονικό πολυμερισμό: BF 3, AlCl 3, AlBr 3 κ.λπ. παρουσία πολύ μικρών ποσοτήτων νερού.
4.3.ζ. Προσθήκη αλκανίων (αλκυλίωση αλκενίων)
Μια άλλη βιομηχανική μέθοδος για τη σύνθεση του «ισοοκτανίου» βασίζεται στην αντίδραση ισοβουτυλενίου με περίσσεια ισοβουτανίου παρουσία πυκνού θειικού οξέος ή σε άνυδρο υδροφθόριο στους 0 10 0 C.

Αυτή η αντίδραση προχωρά επίσης με έναν κατιονικό μηχανισμό και, αυτό που είναι ιδιαίτερα ενδιαφέρον, είναι ένα παράδειγμα μιας αλυσιδωτής κατιονικής διαδικασίας. Πρώτον, το ισοβουτυλένιο διμερίζεται κάτω από τις συνθήκες αντίδρασης για να σχηματίσει ένα τριτοταγές οκτυλ κατιόν (CH 3) 3 CCH 2 C + (CH 3) 2. Ο μηχανισμός σχηματισμού του περιγράφεται αναλυτικά στην προηγούμενη ενότητα. Στη συνέχεια, υπάρχει μια ταχεία μεταφορά υδρογόνου (με τη μορφή ενός ιόντος υδριδίου) από το ισοβουτάνιο στο οκτυλικό κατιόν για να σχηματιστεί ένα μόριο «ισοοκτανίου» και ένα νέο κατιόν τριτ-βουτυλίου, το οποίο με τη σειρά του αντιδρά γρήγορα με το ισοβουτυλένιο για να σχηματίσει ένα νέο κατιόν οκτυλίου κ.λπ.

Εκτός από τη σύνθεση "ισοοκτανίου", αυτή η μέθοδος αλκυλίωσης χρησιμοποιείται στην πετροχημική βιομηχανία για τη σύνθεση διακλαδισμένων υδρογονανθράκων υψηλού σημείου βρασμού από διακλαδισμένα αλκένια και αλκάνια χαμηλού σημείου βρασμού χρησιμοποιώντας το κλάσμα θερμικής πυρόλυσης.
ΑΛΚΕΝΙΑ
Οι υδρογονάνθρακες, στο μόριο των οποίων, εκτός από απλούς δεσμούς σ άνθρακα-άνθρακα και άνθρακα-υδρογόνου, υπάρχουν δεσμοί π άνθρακα-άνθρακα, ονομάζονται απεριόριστος.Δεδομένου ότι ο σχηματισμός ενός δεσμού π είναι τυπικά ισοδύναμος με την απώλεια δύο ατόμων υδρογόνου από το μόριο, οι ακόρεστοι υδρογονάνθρακες περιέχουν 2πυπάρχουν λιγότερα άτομα υδρογόνου από τα περιοριστικά, όπου Π -αριθμός π δεσμών:
Μια σειρά της οποίας τα μέλη διαφέρουν μεταξύ τους κατά (2Η) n ονομάζεται ισολογική σειρά.Έτσι, στο παραπάνω σχήμα, τα ισόλογα είναι εξάνια, εξένια, εξαδιένια, εξίνες, εξατριένια κ.λπ.
Οι υδρογονάνθρακες που περιέχουν έναν π δεσμό (δηλαδή διπλό δεσμό) ονομάζονται αλκένια (ολεφίνες)ή, σύμφωνα με το πρώτο μέλος της σειράς - αιθυλένιο, υδρογονάνθρακες αιθυλενίου.Ο γενικός τύπος της ομόλογης σειράς τους είναι C p H 2l.
1. Ονοματολογία
Σύμφωνα με τους κανόνες της IUPAC, κατά την κατασκευή των ονομάτων των αλκενίων, η μεγαλύτερη ανθρακική αλυσίδα που περιέχει διπλό δεσμό δίδεται το όνομα του αντίστοιχου αλκανίου στο οποίο η κατάληξη -ένααντικαταστάθηκε από -en.Αυτή η αλυσίδα αριθμείται με τέτοιο τρόπο ώστε τα άτομα άνθρακα που συμμετέχουν στο σχηματισμό του διπλού δεσμού να λαμβάνουν τους μικρότερους δυνατούς αριθμούς:

Οι ρίζες ονομάζονται και αριθμούνται όπως στην περίπτωση των αλκανίων.
Για αλκένια σχετικά απλής δομής, επιτρέπονται απλούστερες ονομασίες. Έτσι, μερικά από τα πιο συχνά εμφανιζόμενα αλκένια ονομάζονται προσθέτοντας το επίθημα -enστο όνομα μιας ρίζας υδρογονάνθρακα με τον ίδιο σκελετό άνθρακα:
Οι ρίζες υδρογονάνθρακα που σχηματίζονται από αλκένια λαμβάνουν το επίθημα -ενίλ.Η αρίθμηση στη ρίζα ξεκινά από το άτομο άνθρακα που έχει ελεύθερο σθένος. Ωστόσο, για τις απλούστερες ρίζες αλκενυλίου, αντί για συστηματικά ονόματα, επιτρέπεται η χρήση ασήμαντων:

Συχνά ονομάζονται άτομα υδρογόνου που συνδέονται άμεσα με ακόρεστα άτομα άνθρακα που σχηματίζουν διπλό δεσμό άτομα υδρογόνου βινυλίου,
2. Ισομέρεια
Εκτός από την ισομέρεια του ανθρακικού σκελετού, η ισομέρεια της θέσης του διπλού δεσμού εμφανίζεται και στη σειρά των αλκενίων. Γενικά, αυτός ο τύπος ισομέρειας είναι ισομέρεια θέσης υποκαταστάτη (συνάρτηση)- παρατηρείται σε όλες τις περιπτώσεις που το μόριο περιέχει οποιεσδήποτε λειτουργικές ομάδες. Για το αλκάνιο C4H10, είναι δυνατά δύο δομικά ισομερή:
Για το αλκένιο C4H8 (βουτένιο), είναι δυνατά τρία ισομερή:

Το βουτένιο-1 και το βουτένιο-2 είναι ισομερή της θέσης της συνάρτησης (σε αυτή την περίπτωση, ο ρόλος του διαδραματίζεται από έναν διπλό δεσμό).
Τα χωρικά ισομερή διαφέρουν ως προς τη χωρική διάταξη των υποκαταστατών σε σχέση μεταξύ τους και ονομάζονται cis ισομερή,εάν οι υποκαταστάτες βρίσκονται στην ίδια πλευρά του διπλού δεσμού, και trans ισομερή,αν βρίσκονται σε αντίθετες πλευρές:

3. Δομή διπλού δεσμού
Η ενέργεια διάσπασης ενός μορίου στον διπλό δεσμό C=C είναι 611 kJ/mol. αφού η ενέργεια του δεσμού C-C σ είναι 339 kJ/mol, η ενέργεια διάσπασης του δεσμού π είναι μόνο 611-339 = 272 kJ/mol. Τα π-ηλεκτρόνια είναι πολύ ελαφρύτερα από τα σ-ηλεκτρόνια και είναι ευαίσθητα στην επίδραση, για παράδειγμα, πολωτικών διαλυτών ή στην επίδραση οποιωνδήποτε επιθετικών αντιδραστηρίων. Αυτό εξηγείται από τη διαφορά στη συμμετρία της κατανομής του νέφους ηλεκτρονίων των σ- και π-ηλεκτρονίων. Η μέγιστη επικάλυψη των ρ-τροχιακών και, επομένως, η ελάχιστη ελεύθερη ενέργεια του μορίου επιτυγχάνονται μόνο με μια επίπεδη δομή του θραύσματος βινυλίου και με μια συντομευμένη απόσταση C-C ίση με 0,134 nm, δηλ. σημαντικά μικρότερη από την απόσταση μεταξύ των ατόμων άνθρακα που συνδέονται με έναν απλό δεσμό (0,154 nm). Καθώς τα «μισά» του μορίου περιστρέφονται μεταξύ τους κατά μήκος του άξονα διπλού δεσμού, ο βαθμός της τροχιακής επικάλυψης μειώνεται, γεγονός που σχετίζεται με την κατανάλωση ενέργειας. Συνέπεια αυτού είναι η απουσία ελεύθερης περιστροφής κατά μήκος του άξονα του διπλού δεσμού και η ύπαρξη γεωμετρικών ισομερών με κατάλληλη υποκατάσταση στα άτομα άνθρακα.
Αλκένια- ακόρεστους υδρογονάνθρακες, που περιέχουν έναν διπλό δεσμό. Παραδείγματα αλκενίων:

Μέθοδοι λήψης αλκενίων.
1. Πυρόλυση αλκανίων στους 400-700°C. Η αντίδραση λαμβάνει χώρα μέσω ενός μηχανισμού ελεύθερων ριζών:

2. Αφυδρογόνωση αλκανίων:
3. Αντίδραση εξάλειψης (εξάλειψη): 2 άτομα ή 2 ομάδες ατόμων εξαλείφονται από γειτονικά άτομα άνθρακα και σχηματίζεται διπλός δεσμός. Τέτοιες αντιδράσεις περιλαμβάνουν:
Α) Αφυδάτωση αλκοολών (θέρμανση άνω των 150°C, με τη συμμετοχή θειικού οξέος ως αντιδραστηρίου αφαίρεσης νερού):
Β) Απομάκρυνση υδραλογονιδίων όταν εκτεθούν σε αλκοολικό αλκαλικό διάλυμα:

Το άτομο υδρογόνου χωρίζεται κατά προτίμηση από το άτομο άνθρακα που είναι συνδεδεμένο με λιγότερα άτομα υδρογόνου (το λιγότερο υδρογονωμένο άτομο) - Ο κανόνας του Ζάιτσεφ.
Β) Αποαλογόνωση:

Χημικές ιδιότητες αλκενίων.
Οι ιδιότητες των αλκενίων καθορίζονται από την παρουσία ενός πολλαπλού δεσμού, επομένως τα αλκένια εισέρχονται σε ηλεκτροφιλικές αντιδράσεις προσθήκης, οι οποίες συμβαίνουν σε διάφορα στάδια (H-X - αντιδραστήριο):
1ο στάδιο:

2ο στάδιο:
 .
.
Το ιόν υδρογόνου σε αυτόν τον τύπο αντίδρασης ανήκει στο άτομο άνθρακα που έχει πιο αρνητικό φορτίο. Η κατανομή της πυκνότητας είναι:

Εάν ο υποκαταστάτης είναι δότης, ο οποίος εκδηλώνει το φαινόμενο +I-, τότε η πυκνότητα του ηλεκτρονίου μετατοπίζεται προς το πιο υδρογονωμένο άτομο άνθρακα, δημιουργώντας ένα μερικώς αρνητικό φορτίο σε αυτό. Οι αντιδράσεις πάνε ανάλογα Ο κανόνας του Markovnikov: κατά την ένωση πολικών μορίων όπως NH (HCl, HCN, HOHκ.λπ.) σε ασύμμετρα αλκένια, το υδρογόνο προσκολλάται κατά προτίμηση στο πιο υδρογονωμένο άτομο άνθρακα στον διπλό δεσμό.
Α) Αντιδράσεις προσθήκης:
1) Υδροαλογόνωση:
Η αντίδραση ακολουθεί τον κανόνα του Markovnikov. Αλλά εάν υπάρχει υπεροξείδιο στην αντίδραση, τότε ο κανόνας δεν λαμβάνεται υπόψη:
2) Ενυδάτωση. Η αντίδραση ακολουθεί τον κανόνα του Markovnikov παρουσία φωσφορικού ή θειικού οξέος:

3) Αλογόνωση. Ως αποτέλεσμα, το νερό βρωμίου αποχρωματίζεται - αυτή είναι μια ποιοτική αντίδραση σε έναν πολλαπλό δεσμό:
4) Υδρογόνωση. Η αντίδραση λαμβάνει χώρα παρουσία καταλυτών.



