Ալկենները քիմիապես ակտիվ են։ Նրանց քիմիական հատկությունները մեծապես որոշվում են կրկնակի կապի առկայությամբ։ Ալկենների համար առավել բնորոշ են էլեկտրոֆիլ միացման ռեակցիաները և արմատական ավելացման ռեակցիաները։ Նուկլեոֆիլային ավելացման ռեակցիաները սովորաբար պահանջում են ուժեղ նուկլեոֆիլ և բնորոշ չեն ալկեններին։ Ալկենները հեշտությամբ մտնում են օքսիդացման, ավելացման ռեակցիաներ և կարող են նաև փոխարինել ալիլ ռադիկալներով։
Ավելացման ռեակցիաներ
Ջրածինացում Ալկեններին ջրածնի ավելացումը (ջրածինացման ռեակցիան) իրականացվում է կատալիզատորների առկայությամբ։ Առավել հաճախ օգտագործվում են մանրացված մետաղներ՝ պլատին, նիկել, պալադիում և այլն, արդյունքում առաջանում են համապատասխան ալկաններ (հագեցած ածխաջրածիններ)։
$CH_2=CH_2 + H2 → CH_3–CH_3$
հալոգենների ավելացում. Ալկենները նորմալ պայմաններում հեշտությամբ փոխազդում են քլորի և բրոմի հետ՝ ձևավորելով համապատասխան դիհալոալկաններ, որոնցում հալոգենի ատոմները գտնվում են հարևան ածխածնի ատոմներում։
Դիտողություն 1
Երբ ալկենները փոխազդում են բրոմի հետ, բրոմի դեղնադարչնագույն գույնը գունաթափվում է։ Սա չհագեցած ածխաջրածինների համար ամենահին և ամենապարզ որակական ռեակցիաներից մեկն է, քանի որ ալկիններն ու ալկադիենները նույնպես արձագանքում են նույն կերպ։
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
ջրածնի հալոգենիդների ավելացում. Երբ էթիլենի ածխաջրածինները փոխազդում են ջրածնի հալոգենիդների հետ ($HCl$, $HBr$), առաջանում են հալոալկաններ, ռեակցիայի ուղղությունը կախված է ալկենների կառուցվածքից։
Էթիլենի կամ սիմետրիկ ալկենների դեպքում ավելացման ռեակցիան տեղի է ունենում միանշանակորեն և հանգեցնում է միայն մեկ արտադրանքի ձևավորմանը.
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
Անհամաչափ ալկենների դեպքում հնարավոր է երկու տարբեր ավելացման ռեակցիայի արտադրանքի ձևավորում.
Դիտողություն 2
Փաստորեն, հիմնականում ձևավորվում է միայն մեկ ռեակցիայի արտադրանք: Նման ռեակցիաների անցման ուղղության օրինաչափությունը հաստատել է ռուս քիմիկոս Վ.Վ. Մարկովնիկովը 1869 թվականին Այն կոչվում է Մարկովնիկովի իշխանություն։ Անհամաչափ ալկենների հետ ջրածնի հալոգենիդների փոխազդեցության ժամանակ ջրածնի ատոմը միանում է այն վայրում, որտեղ կրկնակի կապը խզվում է ամենաջրածնային ածխածնի ատոմում, այսինքն՝ նախքան այն միանալը մեծ թվով ջրածնի ատոմների։
Մարկովնիկովն այս կանոնը ձևակերպեց փորձարարական տվյալների հիման վրա և միայն շատ ավելի ուշ ստացավ տեսական հիմնավորում։ Դիտարկենք պրոպիլենի ռեակցիան քլորաջրածնի հետ։
$p$ պարտատոմսի առանձնահատկություններից մեկն այն է, որ հեշտությամբ բևեռացվելու է: Պրոպենի մոլեկուլում մեթիլ խմբի (դրական ինդուկտիվ ազդեցություն + $I$) ազդեցության տակ $p$ կապի էլեկտրոնային խտությունը տեղափոխվում է ածխածնի ատոմներից մեկը (= $CH_2$)։ Արդյունքում դրա վրա հայտնվում է մասնակի բացասական լիցք ($\delta -$): Կրկնակի կապի մյուս ածխածնի ատոմի վրա առաջանում է մասնակի դրական լիցք ($\դելտա +$):
Էլեկտրոնների խտության այս բաշխումը պրոպիլենի մոլեկուլում որոշում է պրոտոնի կողմից ապագա հարձակման վայրը։ Սա մեթիլենի խմբի ածխածնի ատոմն է (= $CH_2$), որը կրում է մասնակի բացասական լիցք $\դելտա-$։ Իսկ քլորը, համապատասխանաբար, հարձակվում է ածխածնի ատոմի վրա մասնակի դրական լիցքով $\դելտա+$։
Արդյունքում, պրոպիլենի հիմնական ռեակցիան ջրածնի քլորիդով 2-քլորոպրոպանն է։
Խոնավեցում
Ալկենների խոնավացումը տեղի է ունենում հանքային թթուների առկայության դեպքում և ենթարկվում է Մարկովնիկովի կանոնին։ Ռեակցիայի արտադրանքը սպիրտներ են
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Ալկիլացում
Ալկանների ավելացումը ալկեններին թթվային կատալիզատորի ($HF$ կամ $H_2SO_4$) առկայության դեպքում ցածր ջերմաստիճաններում հանգեցնում է ավելի բարձր մոլեկուլային քաշով ածխաջրածինների առաջացմանը և հաճախ օգտագործվում է արդյունաբերության մեջ՝ շարժիչային վառելիք արտադրելու համար։
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Օքսիդացման ռեակցիաներ
Ալկենների օքսիդացումը կարող է տեղի ունենալ՝ կախված օքսիդացնող ռեակտիվների պայմաններից և տեսակներից, ինչպես կրկնակի կապի խզման, այնպես էլ ածխածնի կմախքի պահպանման դեպքում.
պոլիմերացման ռեակցիաներ
Ալկենի մոլեկուլներն ունակ են որոշակի պայմաններում միանալ միմյանց $\pi$-կապերի բացմամբ և դիմերների, տրիմերների կամ բարձր մոլեկուլային միացությունների՝ պոլիմերների առաջացմամբ։ Ալկենների պոլիմերացումը կարող է ընթանալ ինչպես ազատ ռադիկալների, այնպես էլ կատիոն-անիոնների մեխանիզմներով։ Որպես պոլիմերացման նախաձեռնողներ օգտագործվում են թթուներ, պերօքսիդներ, մետաղներ և այլն։Պոլիմերացման ռեակցիան նույնպես իրականացվում է ջերմաստիճանի, ճառագայթման և ճնշման ազդեցության տակ։ Տիպիկ օրինակ է էթիլենի պոլիմերացումը պոլիէթիլենի ձևավորման համար
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Փոխարինման ռեակցիաներ
Ալկենների փոխարինման ռեակցիաները բնորոշ չեն։ Այնուամենայնիվ, բարձր ջերմաստիճաններում (400 °C-ից բարձր) ճնշվում են արմատական հավելումների ռեակցիաները, որոնք շրջելի են։ Այս դեպքում հնարավոր է դառնում ջրածնի ատոմի փոխարինումը ալիլային դիրքում՝ պահպանելով կրկնակի կապը։
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
Գիտելիքների հիպերմարկետ >>Քիմիա >>Քիմիա 10-րդ դասարան >> Քիմիա՝ ալկեններ
Չհագեցած ածխաջրածինները ներառում են ածխաջրածիններ, որոնք պարունակում են բազմաթիվ կապեր մոլեկուլներում ածխածնի ատոմների միջև: Չհագեցած են ալկենները, ալկինները, ալկադիենները (պոլիենները)։ Չհագեցված բնույթ ունեն նաև ցիկլային ածխաջրածինները, որոնք պարունակում են կրկնակի կապ ցիկլում (ցիկլոալկեններ), ինչպես նաև ցիկլային փոքր քանակությամբ ածխածնի ատոմներով (երեք կամ չորս ատոմներ): «Անհագեցվածության» հատկությունը կապված է այս նյութերի` ավելացման ռեակցիաների մեջ մտնելու ունակության հետ, առաջին հերթին ջրածնի, հագեցած կամ հագեցած ածխաջրածինների` ալկանների ձևավորման հետ:
Կառուցվածք
Ալկենները ացիկլիկ են, որոնք մոլեկուլում, բացի միայնակ կապերից, պարունակում են մեկ կրկնակի կապ ածխածնի ատոմների միջև և համապատասխանում են C n H 2n ընդհանուր բանաձևին:
Ալկենները ստացել են իրենց երկրորդ անունը՝ «օլեֆիններ»՝ անալոգիայով չհագեցած ճարպաթթուների հետ (օլեին, լինոլիկ), որոնց մնացորդները հեղուկ ճարպերի մի մասն են՝ յուղեր (անգլերեն նավթից՝ նավթ):
Ածխածնի ատոմները, որոնց միջև կա կրկնակի կապ, ինչպես գիտեք, գտնվում են sp 2 հիբրիդացման վիճակում։ Սա նշանակում է, որ մեկ s- և երկու p-օրբիտալներ մասնակցում են հիբրիդացմանը, մինչդեռ մեկ p-օրբիտալը մնում է չհիբրիդացված: Հիբրիդային օրբիտալների համընկնումը հանգեցնում է α-կապերի ձևավորմանը, իսկ հարևան էթիլենի մոլեկուլների չհիբրիդացված α-օրբիտալների պատճառով ածխածնի ատոմները ձևավորում են երկրորդ, Պ- կապ. Այսպիսով, կրկնակի կապը բաղկացած է մեկ z- և մեկ p-կապից:
Կրկնակի կապը կազմող ատոմների հիբրիդային ուղեծրերը գտնվում են նույն հարթության վրա, մինչդեռ n-կապը կազմող ուղեծրերը ուղղահայաց են մոլեկուլի հարթությանը (տե՛ս նկ. 5):
Կրկնակի կապը (0,132 նմ) ավելի կարճ է, քան մեկ կապը, և դրա էներգիան ավելի մեծ է, այսինքն՝ ավելի դիմացկուն։ Այնուամենայնիվ, շարժական, հեշտությամբ բևեռացվող 7r կապի առկայությունը հանգեցնում է նրան, որ ալկենները քիմիապես ավելի ակտիվ են, քան ալկանները և կարող են մտնել հավելման ռեակցիաների մեջ:
Էթենի հոմոլոգ շարք
Չճյուղավորված ալկենները կազմում են էթենի (էթիլենի) հոմոլոգ շարքը։
C2H4 - էթեն, C3H6 - պրոպեն, C4H8 - բութեն, C5H10 - պենտեն, C6H12 - հեքսեն և այլն:
Իզոմերիզմ և նոմենկլատուրա
Ալկենների, ինչպես նաև ալկանների համար բնորոշ է կառուցվածքային իզոմերիզմը։ Կառուցվածքային իզոմերները, ինչպես հիշում եք, տարբերվում են միմյանցից ածխածնային կմախքի կառուցվածքով։ Ամենապարզ ալկենը, որը բնութագրվում է կառուցվածքային իզոմերներով, բութենն է։
CH3-CH2-CH=CH2 CH3-C=CH2
լ
CH3
բութեն-1 մեթիլպրոպեն
Կառուցվածքային իզոմերիզմի հատուկ տեսակ է կրկնակի կապի դիրքի իզոմերիզմը.
CH3-CH2-CH=CH2 CH3-CH=CH-CH3
բութեն-1 բութեն-2
Ածխածնի ատոմների գրեթե ազատ պտույտը հնարավոր է մեկ ածխածին-ածխածին կապի շուրջ, այնպես որ ալկանների մոլեկուլները կարող են ստանալ տարբեր ձևեր: Կրկնակի կապի շուրջ պտույտը անհնար է, ինչը հանգեցնում է ալկենների մեկ այլ տեսակի իզոմերիզմի առաջացմանը՝ երկրաչափական կամ ցիս-տրանս իզոմերիզմ.
Սիս-իզոմերները կրծքավանդակի իզոմերներից տարբերվում են հարթության նկատմամբ մոլեկուլային բեկորների (այս դեպքում՝ մեթիլ խմբերի) տարածական դասավորությամբ։ Պհարաբերությունները և, հետևաբար, հատկությունները:
Ալկենները իզոմեր են ցիկլոալկանների նկատմամբ (միջդասակարգային իզոմերիզմ), օրինակ.
ch2=ch-ch2-ch2-ch2-ch3
հեքսեն-1 ցիկլոհեքսան
Անվանակարգ ալկեններ IUPAC-ի կողմից մշակված, նման է ալկանների անվանակարգին։
1. Հիմնական շղթայի ընտրություն
Ածխաջրածնի անվան առաջացումը սկսվում է հիմնական շղթայի սահմանմամբ՝ մոլեկուլում ածխածնի ատոմների ամենաերկար շղթայով։ Ալկենների դեպքում հիմնական շղթան պետք է պարունակի կրկնակի կապ։
2. Հիմնական շղթայի ատոմների համարակալում
Հիմնական շղթայի ատոմների համարակալումը սկսվում է այն ծայրից, որին ամենամոտ է կրկնակի կապը։ Օրինակ, կապի ճիշտ անվանումն է
ch3-chn-ch2-ch=ch-ch3 ch3
5-մեթիլհեքսեն-2, ոչ թե 2-մեթիլհեքսեն-4, ինչպես կարելի էր սպասել:
Եթե անհնար է որոշել շղթայում ատոմների համարակալման սկիզբը կրկնակի կապի տեղակայմամբ, ապա այն որոշվում է փոխարինողների դիրքով այնպես, ինչպես հագեցած ածխաջրածինների դեպքում։
CH3-CH2-CH=CH-CH-CH3
լ
CH3
2-մեթիլհեքսեն-3
3. Անվանման ձևավորում
Ալկենների անվանումները կազմվում են այնպես, ինչպես ալկանների անունները։ Անվան վերջում նշվում է ածխածնի ատոմի թիվը, որից սկսվում է կրկնակի կապը, իսկ վերջածանցը, որը ցույց է տալիս, որ միացությունը պատկանում է ալկենների դասին՝ -ene։
Անդորրագիր
1. Նավթամթերքի ճեղքում. Հագեցած ածխաջրածինների ջերմային ճեղքման գործընթացում ալկանների առաջացման հետ մեկտեղ տեղի է ունենում ալկենների առաջացում։
2. Հագեցած ածխաջրածինների ջրազրկում. Երբ ալկանները կատալիզատորի վրայով անցնում են բարձր ջերմաստիճանում (400-600 °C), ջրածնի մոլեկուլը բաժանվում է և առաջանում է ալկեն. 
3. Սպիրտների ջրազրկում (ջրի պառակտում). Ջուր հեռացնող նյութերի (H2804, Al203) ազդեցությունը մոնոհիդային սպիրտների վրա բարձր ջերմաստիճաններում հանգեցնում է ջրի մոլեկուլի վերացման և կրկնակի կապի ձևավորմանը.
Այս ռեակցիան կոչվում է ներմոլեկուլային ջրազրկում (ի տարբերություն միջմոլեկուլային ջրազրկման, որը հանգեցնում է եթերների առաջացմանը և կուսումնասիրվի «Ալկոհոլներ» § 16-ում):
4. Դեհիդրոհալոգենացում (ջրածնի հալոգենրիդի վերացում):
Երբ հալոալկանը ալկոհոլային լուծույթում փոխազդում է ալկալիի հետ, ջրածնի հալոգենրիդի մոլեկուլի վերացման արդյունքում առաջանում է կրկնակի կապ։
Նկատի ունեցեք, որ այս ռեակցիան արտադրում է հիմնականում բութեն-2, այլ ոչ թե բութեն-1, որը համապատասխանում է Զայցևի կանոն.
Երբ ջրածնի հալոգենը բաժանվում է երկրորդական և երրորդային հալոալկաններից, ջրածնի ատոմը բաժանվում է ամենաքիչ հիդրոգենացված ածխածնի ատոմից:
5. Դեհալոգենացում. Ալկանի երկբրոմ ածանցյալի վրա ցինկի ազդեցության տակ հալոգենի ատոմները բաժանվում են հարևան ածխածնի ատոմներից և ձևավորվում է կրկնակի կապ. 
Ֆիզիկական հատկություններ
Ալկենների հոմոլոգ շարքի առաջին երեք ներկայացուցիչները գազերն են, C5H10-C16H32 բաղադրության նյութերը՝ հեղուկներ, բարձր ալկենները՝ պինդ։
Եռման և հալման կետերը բնականաբար մեծանում են միացությունների մոլեկուլային քաշի աճով:
Քիմիական հատկություններ
Ավելացման ռեակցիաներ
Հիշեցնենք, որ չհագեցած ածխաջրածինների՝ ալկենների ներկայացուցիչների տարբերակիչ առանձնահատկությունն ավելացման ռեակցիաների մեջ մտնելու ունակությունն է։ Այս ռեակցիաների մեծ մասն ընթանում է էլեկտրոֆիլ հավելման մեխանիզմով։
1. Ալկենների հիդրոգենացում. Ալկեններն ի վիճակի են ջրածին ավելացնել հիդրոգենացման կատալիզատորների առկայության դեպքում՝ մետաղներ՝ պլատին, պալադիում, նիկել.
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
Այս ռեակցիան ընթանում է ինչպես մթնոլորտային, այնպես էլ բարձր ճնշման դեպքում և չի պահանջում բարձր ջերմաստիճան, քանի որ այն էկզոթերմիկ է: Նույն կատալիզատորների վրա ջերմաստիճանի բարձրացմամբ կարող է առաջանալ հակադարձ ռեակցիա՝ ջրազրկում։
2. Հալոգենացում (հալոգենների ավելացում). Ալկենի փոխազդեցությունը բրոմ ջրի կամ բրոմի լուծույթի հետ օրգանական լուծիչում (СCl4) հանգեցնում է այդ լուծույթների արագ գունաթափման՝ ալկենին հալոգեն մոլեկուլի ավելացման և դիհալոալկանների առաջացման արդյունքում։
Մարկովնիկով Վլադիմիր Վասիլևիչ
(1837-1904)
Ռուս օրգանական քիմիկոս. Ձևակերպել է (1869) կանոններ փոխարինման, վերացման, կրկնակի կապի ավելացման և իզոմերացման ռեակցիաների ուղղության վերաբերյալ՝ կախված քիմիական կառուցվածքից։ Հետազոտել է (1880-ից) նավթի բաղադրությունը, հիմք է դրել նավթաքիմիայի՝ որպես ինքնուրույն գիտության։ Բացվել է (1883) օրգանական նյութերի նոր դաս՝ ցիկլոպարաֆիններ (նաֆթեններ)։
3. Հիդրոհալոգենացում (հալոգենաջրածնի ավելացում):
Ջրածնի հալոգենիդային ավելացման ռեակցիան ավելի մանրամասն կքննարկվի ստորև: Այս արձագանքը ենթարկվում է Մարկովնիկովի կանոնին.
Երբ ալկենին ավելացվում է ջրածնի հալոգեն, ջրածինը կցվում է ավելի հիդրոգենացված ածխածնի ատոմին, այսինքն՝ այն ատոմին, որտեղ ավելի շատ ջրածնի ատոմներ կան, իսկ հալոգենը՝ ավելի քիչ ջրածնի:
4. Խոնավացում (ջրի ավելացում): Ալկենների խոնավացումը հանգեցնում է սպիրտների առաջացման։ Օրինակ, էթենին ջրի ավելացումը ընկած է էթիլային սպիրտ ստանալու արդյունաբերական մեթոդներից մեկի հիմքում.
CH2=CH2 + H2O -> CH3-CH2OH
էթեն էթանոլ
Նկատի ունեցեք, որ առաջնային սպիրտ (առաջնային ածխածնի մոտ հիդրօքսիլ խմբով) ձևավորվում է միայն այն դեպքում, երբ էթինը հիդրացվում է: Երբ պրոպենը կամ այլ ալկենները խոնավացվում են, առաջանում են երկրորդային սպիրտներ։ 
Այս ռեակցիան նույնպես ընթանում է Մարկովնիկովի կանոնին համապատասխան՝ ջրածնի կատիոնը ավելացվում է ավելի հիդրոգենացված ածխածնի ատոմին, իսկ հիդրօքսի խումբը՝ ավելի քիչ հիդրոգենացվածին։
5. Պոլիմերացում. Ավելացման հատուկ դեպք է ալկենների պոլիմերացման ռեակցիան.
Այս ավելացման ռեակցիան ընթանում է ազատ ռադիկալների մեխանիզմով:
Օքսիդացման ռեակցիաներ
Ինչպես ցանկացած օրգանական միացություն, ալկեններն այրվում են թթվածնի մեջ՝ առաջացնելով CO2 և H20:
Ի տարբերություն ալկանների, որոնք դիմացկուն են լուծույթներում օքսիդացմանը, ալկենները հեշտությամբ օքսիդանում են կալիումի պերմանգանատի ջրային լուծույթներով։ Չեզոք կամ թեթևակի ալկալային լուծույթներում ալկենները օքսիդացվում են դիոլների (երկհիդրիկ սպիրտներ), իսկ հիդրօքսիլային խմբերը կցվում են այն ատոմներին, որոնց միջև եղել է կրկնակի կապ մինչև օքսիդացումը։
Ինչպես արդեն գիտեք, չհագեցած ածխաջրածինները՝ ալկենները ի վիճակի են մտնել հավելման ռեակցիաների մեջ: Այս ռեակցիաների մեծ մասն ընթանում է էլեկտրոֆիլ հավելման մեխանիզմով։
էլեկտրոֆիլային հավելում
Էլեկտրաֆիլ ռեակցիաները ռեակցիաներ են, որոնք տեղի են ունենում էլեկտրոֆիլների գործողության ներքո՝ մասնիկներ, որոնք ունեն էլեկտրոնային խտության պակաս, օրինակ՝ չլցված ուղեծրը։ Ամենապարզ էլեկտրոֆիլ մասնիկը ջրածնի կատիոնն է։ Հայտնի է, որ ջրածնի ատոմն ունի մեկ էլեկտրոն 3-ի ուղեծրում։ Ջրածնի կատիոնը ձևավորվում է, երբ ատոմը կորցնում է այդ էլեկտրոնը, ուստի ջրածնի կատիոնն ընդհանրապես էլեկտրոններ չունի.
H - 1e - -> H +
Այս դեպքում կատիոնն ունի բավականին բարձր էլեկտրոնային կապ։ Այս գործոնների համակցությունը ջրածնի կատիոնը դարձնում է բավականին ուժեղ էլեկտրոֆիլ մասնիկ։
Ջրածնի կատիոնի ձևավորումը հնարավոր է թթուների էլեկտրոլիտիկ տարանջատման ժամանակ.
HBr -> H + + Br -
Այս պատճառով է, որ շատ էլեկտրոֆիլ ռեակցիաներ տեղի են ունենում թթուների ներկայությամբ և մասնակցությամբ։
Էլեկտրաֆիլ մասնիկները, ինչպես նշվեց ավելի վաղ, գործում են համակարգերի վրա, որոնք պարունակում են էլեկտրոնների ավելացված խտության շրջաններ: Նման համակարգի օրինակ կարող է լինել բազմակի (կրկնակի կամ եռակի) ածխածին-ածխածին կապը։
Դուք արդեն գիտեք, որ ածխածնի ատոմները, որոնց միջև առաջանում է կրկնակի կապ, գտնվում են sp 2 հիբրիդացման վիճակում։ Հարևան ածխածնի ատոմների չհիբրիդացված p-օրբիտալները, որոնք գտնվում են նույն հարթության վրա, համընկնում են և առաջանում Պ-կապը, որն ավելի քիչ ամուր է, քան z-կապը, և, որ ամենակարևորն է, հեշտությամբ բևեռացվում է արտաքին էլեկտրական դաշտի ազդեցության տակ: Սա նշանակում է, որ երբ դրական լիցքավորված մասնիկը մոտենում է, TC կապի էլեկտրոնները տեղահանվում են նրա ուղղությամբ և այսպես կոչված. Պ-համալիր.
Պարզվում է Պ- բարդ և ջրածնի կատիոնի ավելացումից հետո Պ- կապեր. Ջրածնի կատիոնը, այսպես ասած, պատահում է էլեկտրոնի խտության վրա, որը դուրս է ցցված մոլեկուլի հարթությունից Պ- կապում և միանում է դրան: ![]()
Հաջորդ փուլում տեղի է ունենում էլեկտրոնային զույգի ամբողջական տեղաշարժը: Պ-կապում է ածխածնի ատոմներից մեկին, ինչը հանգեցնում է նրա վրա էլեկտրոնների միայնակ զույգի առաջացմանը: Ածխածնի ատոմի ուղեծիրը, որի վրա գտնվում է այս զույգը, և ջրածնի կատիոնի չլցված ուղեծիրը համընկնում են, ինչը հանգեցնում է դոնոր-ընդունիչ մեխանիզմի միջոցով կովալենտային կապի ձևավորմանը։ Միևնույն ժամանակ, երկրորդ ածխածնի ատոմը մնում է չլրացված ուղեծր, այսինքն՝ դրական լիցք:
Ստացված մասնիկը կոչվում է կարբոկացիա, քանի որ այն պարունակում է դրական լիցք ածխածնի ատոմի վրա։ Այս մասնիկը կարող է միավորվել ցանկացած անիոնի հետ, մասնիկ, որն ունի չկիսված էլեկտրոնային զույգ, այսինքն՝ նուկլեոֆիլ:
Դիտարկենք էլեկտրոֆիլային ավելացման ռեակցիայի մեխանիզմը՝ օգտագործելով էթենի հիդրոբրոմինացման (բրոմաջրածնի ավելացում) օրինակը.
CH2= CH2 + HBr --> CHBr-CH3
Ռեակցիան սկսվում է էլեկտրոֆիլ մասնիկի՝ ջրածնի կատիոնի առաջացմամբ, որն առաջանում է բրոմաջրածնի մոլեկուլի տարանջատման արդյունքում։
Ջրածնի կատիոնների հարձակումները Պ- միացում, ձևավորում Պ- համալիր, որն արագ վերածվում է կարբոկացիայի. 
Հիմա հաշվի առեք ավելի բարդ դեպք.
Բրոմաջրածնի ավելացման ռեակցիան էթենին ընթանում է միանշանակ, և ջրածնի բրոմիդի փոխազդեցությունը պրոպենի հետ տեսականորեն կարող է տալ երկու արտադրանք՝ 1-բրոմպրոպան և 2-բրոմպրոպան։ Փորձարարական տվյալները ցույց են տալիս, որ հիմնականում ստացվում է 2-բրոմպրոպան։
Դա բացատրելու համար մենք ստիպված կլինենք դիտարկել միջանկյալ մասնիկ՝ կարբոկացիա։
Ջրածնի կատիոնի ավելացումը պրոպենին կարող է հանգեցնել երկու կարբոկատիոնների առաջացման. եթե ջրածնի կատիոնը կցված է ածխածնի առաջին ատոմին, այն ատոմին, որը գտնվում է շղթայի վերջում, ապա երկրորդը, այսինքն. մոլեկուլի կենտրոնը (1), կունենա դրական լիցք. եթե այն միանա երկրորդին, ապա առաջին ատոմը (2) դրական լիցք կունենա։ 
Ռեակցիայի նախընտրելի ուղղությունը կախված կլինի նրանից, թե որ կարբոկատիոնն ավելի շատ կլինի ռեակցիայի միջավայրում, որն, իր հերթին, որոշվում է կարբոկացիայի կայունությամբ։ Փորձը ցույց է տալիս 2-բրոմպրոպանի գերակշռող ձևավորումը։ Սա նշանակում է, որ կենտրոնական ատոմի վրա դրական լիցքով կարբոկատիոն (1) առաջանում է ավելի մեծ չափով։
Այս կարբոկատիոնի ավելի մեծ կայունությունը բացատրվում է նրանով, որ կենտրոնական ածխածնի ատոմի դրական լիցքը փոխհատուցվում է երկու մեթիլ խմբերի դրական ինդուկտիվ ազդեցությամբ, որոնց ընդհանուր ազդեցությունը ավելի բարձր է, քան մեկ էթիլ խմբի +/- ազդեցությունը.
Ալկենների հիդրոհալոգենացման ռեակցիաների օրինաչափությունները ուսումնասիրել է հայտնի ռուս քիմիկոս Վ.Վ.Մարկովնիկովը՝ Ա.Մ.Բուտլերովի աշակերտը, ով, ինչպես նշվեց վերևում, ձևակերպել է նրա անունը կրող կանոնը։
Այս կանոնը հաստատվել է էմպիրիկ, այսինքն՝ էմպիրիկ։ Ներկայում դրա միանգամայն համոզիչ բացատրությունը կարող ենք տալ։
Հետաքրքիր է, որ էլեկտրոֆիլ հավելման այլ ռեակցիաները նույնպես ենթարկվում են Մարկովնիկովի կանոնին, ուստի ճիշտ կլինի այն ձևակերպել ավելի ընդհանուր ձևով։
Էլեկտրաֆիլային հավելման ռեակցիաներում էլեկտրոֆիլը (չլցված ուղեծրով մասնիկը) կցվում է ավելի հիդրոգենացված ածխածնի ատոմին, իսկ նուկլեոֆիլը (մասնիկը միայնակ զույգ էլեկտրոններով) կցվում է ավելի քիչ հիդրոգենացվածին։
Պոլիմերացում
Ավելացման ռեակցիայի հատուկ դեպք է ալկենների և դրանց ածանցյալների պոլիմերացումը։ Այս ռեակցիան ընթանում է ազատ ռադիկալների ավելացման մեխանիզմով.
Պոլիմերացումն իրականացվում է նախաձեռնողների՝ պերօքսիդային միացությունների առկայությամբ, որոնք ազատ ռադիկալների աղբյուր են։ Պերօքսիդի միացությունները կոչվում են նյութեր, որոնց մոլեկուլները ներառում են -O-O- խումբը: Ամենապարզ պերօքսիդ միացությունը ջրածնի պերօքսիդ HOOH է:
100 °C ջերմաստիճանի և 100 ՄՊա ճնշման դեպքում տեղի է ունենում անկայուն թթվածին-թթվածին կապի հոմոլիզ և առաջանում են ռադիկալներ՝ պոլիմերացման նախաձեռնիչներ։ KO- ռադիկալների ազդեցության տակ սկսվում է պոլիմերացում, որը զարգանում է որպես ազատ ռադիկալների ավելացման ռեակցիա: Շղթայի աճը դադարում է, երբ ռեակցիայի խառնուրդը վերամիավորվում է ռադիկալների՝ պոլիմերային շղթայի և ռադիկալների կամ KOCH2CH2-ի հետ:
Օգտագործելով կրկնակի կապ պարունակող նյութերի ազատ ռադիկալների պոլիմերացման ռեակցիան՝ ստացվում են մեծ թվով մակրոմոլեկուլային միացություններ. 
Տարբեր փոխարինիչներով ալկենների օգտագործումը հնարավորություն է տալիս սինթեզել պոլիմերային նյութերի լայն տեսականի՝ հատկությունների լայն տեսականիով։ 
Այս բոլոր պոլիմերային միացությունները լայնորեն օգտագործվում են մարդու գործունեության տարբեր ոլորտներում՝ արդյունաբերություն, բժշկություն, օգտագործվում են կենսաքիմիական լաբորատորիաների սարքավորումների արտադրության համար, որոշները միջանկյալ են այլ մակրոմոլեկուլային միացությունների սինթեզի համար:
Օքսիդացում
Դուք արդեն գիտեք, որ չեզոք կամ թեթևակի ալկալային լուծույթներում ալկենները օքսիդացվում են դիոլների (դիհիդրային սպիրտներ): Թթվային միջավայրում (ծծմբաթթվով թթվացված լուծույթ) կրկնակի կապն ամբողջությամբ քայքայվում է, և ածխածնի ատոմները, որոնց միջև գոյություն է ունեցել կրկնակի կապը, վերածվում են կարբոքսիլ խմբի ածխածնի ատոմների. 
Ալկենների կործանարար օքսիդացումը կարող է օգտագործվել դրանց կառուցվածքը որոշելու համար։ Այսպիսով, օրինակ, եթե որոշ ալկենի օքսիդացման ժամանակ ստացվում են քացախաթթուներ և պրոպիոնաթթուներ, դա նշանակում է, որ պենտեն-2-ը ենթարկվել է օքսիդացման, իսկ եթե ստացվել են բուտիրային (բուտանային) թթու և ածխածնի երկօքսիդ, ապա սկզբնական ածխաջրածինը պենտենն է: -1.
Դիմում
Ալկենները լայնորեն օգտագործվում են քիմիական արդյունաբերության մեջ՝ որպես հումք տարբեր օրգանական նյութերի և նյութերի արտադրության համար։
Այսպիսով, օրինակ, էթենը էթանոլի, էթիլենգլիկոլի, էպօքսիդների, դիքլորէթանի արտադրության մեկնարկային նյութն է։
Մեծ քանակությամբ էթենը վերամշակվում է պոլիէթիլենի, որն օգտագործվում է փաթեթավորման թաղանթների, սպասքի, խողովակների և էլեկտրամեկուսիչ նյութերի արտադրության համար։
Պրոպենից ստանում են գլիցերին, ացետոն, իզոպրոպանոլ, լուծիչներ։ Պրոպենի պոլիմերացումից ստացվում է պոլիպրոպիլեն, որը շատ առումներով գերազանցում է պոլիէթիլենին. այն ունի ավելի բարձր հալման կետ և քիմիական դիմադրություն:
Ներկայումս յուրահատուկ հատկություններով մանրաթելեր են արտադրվում պոլիմերներից՝ պոլիէթիլենի անալոգներից։ Օրինակ, պոլիպրոպիլենային մանրաթելն ավելի ամուր է, քան բոլոր հայտնի սինթետիկ մանրաթելերը:
Այս մանրաթելերից պատրաստված նյութերը խոստումնալից են և ավելի ու ավելի են օգտագործվում մարդկային գործունեության տարբեր ոլորտներում:

1. Իզոմերիզմի ո՞ր տեսակներն են բնորոշ ալկեններին. Գրե՛ք պենտեն-1-ի հնարավոր իզոմերների բանաձևերը.
2. Ի՞նչ միացություններ կարելի է ստանալ՝ ա) իզոբուտենից (2-մեթիլպրոպեն); բ) բութեն-2; գ) բութեն-1. Գրի՛ր համապատասխան ռեակցիաների հավասարումները:
3. Վերծանի՛ր փոխակերպումների հետևյալ շղթան. Անվանե՛ք A, B, C միացությունները: 4. Առաջարկե՛ք 1-քլորպրոպանից 2-քլորպրոպան ստանալու մեթոդ: Գրի՛ր համապատասխան ռեակցիաների հավասարումները:
5. Առաջարկեք էթանը էթիլենի կեղտից մաքրելու մեթոդ: Գրի՛ր համապատասխան ռեակցիաների հավասարումները:
6. Բերե՛ք ռեակցիաների օրինակներ, որոնց միջոցով կարելի է տարբերակել հագեցած և չհագեցած ածխաջրածինները:
7. 2,8 գ ալկենի ամբողջական հիդրոգենացումը սպառել է 0,896 լ ջրածին (n.a.): Որքա՞ն է այս միացության մոլեկուլային քաշը և կառուցվածքային բանաձևը, որն ունի ածխածնի ատոմների նորմալ շղթա:
8. Ի՞նչ գազ կա բալոնում (եթեն կամ պրոպեն), եթե հայտնի է, որ 20 սմ3 այս գազն ամբողջությամբ այրելու համար պահանջվել է 90 սմ3 (ն.ա.) թթվածին։
9*. Երբ մթության մեջ ալկենը քլորի հետ փոխազդում է, առաջանում է 25,4 գ երկքլորիդ, իսկ երբ նույն զանգվածի այս ալկենը փոխազդում է ածխածնի քառաքլորիդում գտնվող բրոմի հետ, առաջանում է 43,2 գ դիբրոմիդ։ Սահմանեք մեկնարկային ալկենի բոլոր հնարավոր կառուցվածքային բանաձևերը:
Հայտնաբերման պատմություն
Վերոնշյալ նյութից մենք արդեն հասկացանք, որ էթիլենը չհագեցած ածխաջրածինների հոմոլոգ շարքի նախահայրն է, որն ունի մեկ կրկնակի կապ։ Նրանց բանաձևը C n H 2n է, և դրանք կոչվում են ալկեններ:
Գերմանացի բժիշկ և քիմիկոս Բեխերը 1669 թվականին առաջինն էր, ով ստացավ էթիլեն էթիլային սպիրտի վրա ծծմբաթթվի ազդեցությամբ։ Բեչերը պարզել է, որ էթիլենն ավելի ռեակտիվ է, քան մեթանը: Բայց, ցավոք, այն ժամանակ գիտնականը չկարողացավ նույնականացնել ստացված գազը, դրա համար էլ ոչ մի անուն չտվեց։
Քիչ ավելի ուշ էթիլենի ստացման նույն մեթոդը կիրառեցին նաև հոլանդացի քիմիկոսները։ Եվ քանի որ քլորի հետ շփվելիս այն ուներ յուղոտ հեղուկ ձևավորելու հատկություն, համապատասխանաբար ստացել է «թթվածին գազ» անվանումը։ Ավելի ուշ հայտնի դարձավ, որ այդ հեղուկը դիքլորէթան է։
Ֆրանսերենում «յուղոտ» տերմինը հնչում է որպես oléfiant: Եվ այն բանից հետո, երբ հայտնաբերվեցին այս տեսակի այլ ածխաջրածիններ, ֆրանսիացի քիմիկոս և գիտնական Անտուան Ֆուրկրուան ներկայացրեց նոր տերմին, որը սովորական դարձավ օլեֆինների կամ ալկենների ամբողջ դասի համար։
Բայց արդեն տասնիններորդ դարի սկզբին ֆրանսիացի քիմիկոս Ջ.Գեյ-Լյուսակը ցույց տվեց, որ էթանոլը բաղկացած է ոչ միայն «յուղոտ» գազից, այլև ջրից։ Բացի այդ, նույն գազը հայտնաբերվել է էթիլ քլորիդում։
Եվ չնայած քիմիկոսները որոշել են, որ էթիլենը բաղկացած է ջրածնից և ածխածնից, և արդեն գիտեին նյութերի բաղադրությունը, նրանք երկար ժամանակ չէին կարողանում գտնել դրա իրական բանաձևը։ Եվ միայն 1862 թվականին Է.Էրլենմայերին հաջողվեց ապացուցել էթիլենի մոլեկուլում կրկնակի կապի առկայությունը։ Սա ճանաչեց նաև ռուս գիտնական Ա.
Բնության մեջ գտնելը և ալկենների ֆիզիոլոգիական դերը
Շատերին հետաքրքրում է այն հարցը, թե որտեղ կարելի է գտնել ալկեններ բնության մեջ: Այսպիսով, պարզվում է, որ դրանք գործնականում չեն հանդիպում բնության մեջ, քանի որ դրա ամենապարզ ներկայացուցիչը՝ էթիլենը, բույսերի հորմոն է և սինթեզվում է նրանց մեջ միայն փոքր քանակությամբ։
Ճիշտ է, բնության մեջ կա այնպիսի ալկեն, ինչպիսին է մուսկալուրը: Բնական ալկեններից այս մեկը տնային ճանճի սեռական գրավիչն է:
Արժե ուշադրություն դարձնել այն փաստին, որ, ունենալով բարձր կոնցենտրացիա, ցածր ալկենները թմրադեղային ազդեցություն ունեն, ինչը կարող է առաջացնել ցնցումներ և լորձաթաղանթների գրգռում:
Ալկենների կիրառում
Ժամանակակից հասարակության կյանքն այսօր դժվար է պատկերացնել առանց պոլիմերային նյութերի օգտագործման: Քանի որ, ի տարբերություն բնական նյութերի, պոլիմերներն ունեն տարբեր հատկություններ, դրանք հեշտ է մշակվում, և եթե նայենք գնին, ապա դրանք համեմատաբար էժան են։ Պոլիմերների օգտին մեկ այլ կարևոր կողմն այն է, որ դրանցից շատերը կարող են վերամշակվել:
Ալկեններն իրենց կիրառությունը գտել են պլաստմասսաների, կաուչուկների, թաղանթների, տեֆլոնի, էթիլային սպիրտի, ացետալդեհիդի և այլ օրգանական միացությունների արտադրության մեջ։

Գյուղատնտեսության մեջ այն օգտագործվում է որպես մրգի հասունացման գործընթացն արագացնող միջոց։ Պրոպիլենը և բուտիլենը օգտագործվում են տարբեր պոլիմերներ և սպիրտներ արտադրելու համար։ Բայց սինթետիկ կաուչուկի արտադրության մեջ օգտագործվում է իզոբուտիլեն։ Հետևաբար, մենք կարող ենք եզրակացնել, որ ալկենները չեն կարող հրաժարվել, քանի որ դրանք ամենակարևոր քիմիական հումքն են:
Էթիլենի արդյունաբերական օգտագործում
Արդյունաբերական մասշտաբով պրոպիլենը սովորաբար օգտագործվում է պոլիպրոպիլենի սինթեզի և իզոպրոպանոլի, գլիցերինի, բութիրալդեհիդների և այլնի արտադրության համար։ Ամեն տարի ավելանում է պրոպիլենի կարիքը։

4.3.բ. Ջրածնի հալոգենների ավելացում (հիդրոհալոգենացում)
Ալկեններին էլեկտրոֆիլ հավելումների մեկ այլ կարևոր ռեակցիա ալկենների վաղուց հայտնի հիդրոհալոգենացումն է։
Ստորև բերված են տարբեր ալկեններում HCl, HBr և HI-ի ավելացման բնորոշ օրինակներ:


Ալկիլ փոխարինիչների ազդեցությունը կրկնակի կապի վրա ավելացման արագության վրա նկարագրվում է հետևյալ հաջորդականությամբ.
R 2 C = CHR > RCH = CHR > RCH = CH 2
Սա համահունչ է այն մեխանիզմին, որով ռեակցիայի արագությունը որոշող քայլը կարբոկատիոնի ձևավորումն է, քանի որ ալկիլ կատիոնների կայունությունը նվազում է երրորդական > երկրորդային > առաջնային շարքում: Այսպիսով, ավելացման մեխանիզմը պետք է ներառի կա՛մ ազատ կարբոկատիոնի միջանկյալ ձևավորումը, որը հազվադեպ է, կա՛մ կարբոկատիոնային բնույթ ունեցող միջանկյալ նյութի: Վերջին դեպքն ամենաբնորոշն է.
Եթե հավելումը տեղի է ունենում «ազատ կարբոկացիայի» միջոցով, ապա ռեակցիան լիովին ոչ ստերեոսելեկտիվ կլիներ, քանի որ ալկիլային կատիոնները հարթ կառուցվածք ունեն։ Այնուամենայնիվ, հիդրոհալոգենացումը, որպես կանոն, ընթանում է ստերեոսելեկտիվ, և կախված ալկենի տեսակից՝ ընտրովի. հակա- միացում, ընտրովի համ- կամ խառը համ-հակա- միացում.
Ալկենների համար, որոնցում կրկնակի կապը միացված չէ արոմատիկ օղակի հետ, բնորոշ է. հակա- հալոգենաջրածնի ավելացում. Հակա- քլորաջրածնի և ջրածնի բրոմիդի, դեյտերիումի քլորիդի և բրոմի ավելացում նկատվում է ցիկլոհեքսենի, ցիկլոպենտենի, 1,2-դիմեթիլհեքսենի, 1,2-դիմեթիլպենտենի համար, cis- Եվ տրանս-բութեն-2, հեքսեն-3 և շատ այլ պարզ ալկեններ և ցիկլոալկեններ:

Լրացուցիչ արտադրանքում նույն փոխարինիչները (մեթիլ խմբերը) գտնվում են ցիկլոհեքսանային օղակի միջին հարթության հակառակ կողմերում, հետևաբար այն պատկանում է. տրանս- շարք. Հակա- հավելումը հազիվ թե համատեղելի լինի այն մեխանիզմի հետ, որով ենթադրվում է դիսկրետ կարբոկացիայի ձևավորում: Հարթ կարբոկացիայի դեպքում հալոգենային իոնի նուկլեոֆիլ հարձակումը հավասարապես հավանական է հարթության երկու կողմերում, ինչը պետք է հանգեցնի արտադրանքների խառնուրդի ձևավորմանը: համ- Եվ հակա- կապեր. Ալկենի հիդրոհալոգենացման կինետիկան մատնանշում է նաև ավելացման ավելի բարդ մեխանիզմ: Ոչ կոնյուգացված ալկենների համար ռեակցիայի արագությունը նկարագրվում է երրորդ կարգի հավասարմամբ երկրորդ կարգով ջրածնի հալոգենիդով, այսինքն՝ այն համապատասխանում է Ad E 3 մեխանիզմին:
v = k [ալկեն] 2
Հակաավելացման և երկրորդ կարգի ռեակցիան ջրածնի հալոգենիկի նկատմամբ լավ համընկնում է Ad E 3 մեխանիզմի հետ, որտեղ ալկենը փոխազդում է ջրածնի հալոգենրիդի երկու մոլեկուլների հետ, որոնցից մեկը գործում է որպես էլեկտրոֆիլ, իսկ մյուսը՝ որպես նուկլեոֆիլ նյութ։

Նման եռամոլեկուլային մեխանիզմը ենթադրում է, որ սկզբում ձևավորվում է ալկենի և ջրածնի հալոգենրիդի մի մոլեկուլ, որին հաջորդում է երկրորդ HX մոլեկուլի հարձակումը այս համալիրի վրա: հակա-կողմերն առանց դիսկրետ կարբոկացիայի ձևավորման: Հարկ է հատուկ նշել, որ ցանկացած եռամոլեկուլային մեխանիզմ պետք է բաղկացած լինի երկու հաջորդական փուլից, քանի որ երեք մոլեկուլների միաժամանակյա բախումը չափազանց քիչ հավանական է։

Հակաավելացումը ցույց է տալիս ջրածնի հալոգենրիդի նախընտրելի նուկլեոֆիլ հարձակումը այն կողմից, որից հակառակ է ալկենը պրոտոնացված: Ջրածնի հալոգենրիդի փոխարեն վերջնական փուլում նուկլեոֆիլ նյութի ֆունկցիան կարող է կատարել նաև հալոգեն իոնը։ Իրոք, ռեակցիայի արագությունը սովորաբար մեծանում է ուղիղ համամասնությամբ ռեակցիոն խառնուրդի մեջ ներմուծված հալոգեն իոնի կոնցենտրացիայի՝ քառալկիլամոնիումի հալոգենիդների NR 4+ X տեսքով։ - կամ լիթիում LiX: Այս դեպքում՝ ստերեոսպեցիֆիկ հակա- միացում.
Ալկանների համար, որոնցում կրկնակի կապը միացված է անուշաբույր օղակի հետ, բնորոշ է. համ- միացում կամ խառը համ-հակա- հալոգենաջրածնի ավելացում, օրինակ.

Syn-կցումը գերիշխող գործընթաց է cis- Եվ տրանս-1-ֆենիլպրոպենի, 1-ֆենիլ-4-ալկիլցիկլոհեքսենների, ացենաֆթիլենի, ինդենի իզոմերները: Նման ալկենների պրոտոնավորումը հանգեցնում է բենզիլ տիպի կարբոկատիոնների առաջացմանը, որոնք ավելի կայուն են, քան սովորական ալկենների և ցիկլոալկենների պրոտոնավորման արդյունքում առաջացող մաքուր ալկիլ կատիոնները։ Ռեակցիայի կինետիկան այս դեպքում սովորաբար նկարագրվում է ավելի պարզ երկրորդ կարգի v = k[ալկեն] հավասարմամբ, այսինքն՝ այն համապատասխանում է երկմոլեկուլային Ad E 2 մեխանիզմին։ Ad E 2 մեխանիզմը ներառում է իոնային զույգի ձևավորում, որը ներառում է կարբոկացիա և հալոգեն իոն:

Չի կարելի ակնկալել, որ ավելացման մեխանիզմը, որը ներառում է իոնային զույգեր, կլինի խիստ ստերեոսելեկտիվ: Եթե իոնային զույգը վերջնական արդյունքի վերածվի ավելի արագ, քան ածխածին-ածխածին պարզ կապի շուրջ պտույտը, ապա վերջնական արդյունքը կլինի. համ- հավելում, որտեղ պրոտոնը և հալոգենիկ իոնը կցված են կրկնակի կապի նույն կողմում: Հակառակ դեպքում արտադրանքի ձևավորումը դիտվում է որպես համ- այսպես և հակա- HX միացումներ: Նման դեպք իրականացվում է հիդրոհալոգենացման ժամանակ զույգ-փոխարինված ստիրեններ Z-C 6 H 4 -CH=CH2: Այստեղ նկատվող օրինաչափությունն այն է համ- հավելումը բնորոշ է միայն այն օլեֆիններին, որոնք պրոտոնավորվելիս տալիս են համեմատաբար կայուն կարբոկացիա, այսինքն՝ դոնորային փոխարինող Z-ի դեպքում։
Հիդրոհալոգենացման ռեակցիաները, որոնք ընթանում են Ad E 2 մեխանիզմի համաձայն, բնութագրվում են խոնարհված ավելացման և վերադասավորումների գործընթացների միջև մրցակցությամբ, քանի որ որպես միջանկյալ ձևավորվում է կարբոկացիա կամ իոնային զույգ:

Որպես ալկիլ խմբի 1,2-միգրացիայի և հիդրիդ իոնի վերադասավորումների օրինակ՝ ներկայացնում ենք համապատասխանաբար տերտ-բութիլէթիլենի և իզոպրոպիլէթիլենի հիդրոհալոգենացման ռեակցիաները։

Սառը (-78 0 C) առանց լուծիչի նույն ռեակցիան իրականացնելիս առաջանում է 33% նորմալ և 67% անոմալ (վերադասավորված) հավելանյութերի խառնուրդ։

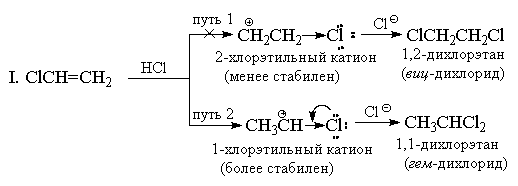
4.3.c. Կողմնորոշում. Մարկովնիկովի կանոնը
Ի տարբերություն սիմետրիկ էլեկտրոֆիլների (Hal 2), ջրածնի հալոգենիդները անհամաչափ էլեկտրոֆիլ ռեակտիվներ են։ Ցանկացած անհամաչափ էլեկտրոֆիլի (HBr, ICl, H 2 O, Hg (OAc) 2 և այլն) ավելացումը անհամաչափ ալկենին սկզբունքորեն կարող է տալ երկու այլընտրանքային արտադրանքի խառնուրդ, բայց գործնականում սովորաբար ձևավորվում է դրանցից միայն մեկը: Որպես օրինակ, դիտարկենք պրոպիլենում ջրածնի բրոմիդի ավելացումը:

Դեռևս 1870 թվականին Վ.Վ. Մարկովնիկովը ձևակերպեց էմպիրիկ կանոն, ըստ որի՝ անհամաչափ ալկենները ավելացնում են HX այնպես, որ հիմնականում ձևավորվում է մի արդյունք, որտեղ ջրածինը ավելացվում է ամենաքիչ փոխարինվածին, իսկ X՝ կրկնակի կապի ամենափոխարինված ծայրին։
Սովորաբար Մարկովնիկովի կանոնը բացատրվում է երկու այլընտրանքային կարբոկացիաների կայունության տարբերությամբ։ Օրինակ, վերը նշված օրինակում նորմալը n-պրոպիլային կատիոնը շատ ավելի քիչ կայուն է, քան իզոպրոպիլ կատիոնը, և հետևաբար ռեակցիան ընթանում է երկրորդ ճանապարհով:
Մարկովնիկովի կանոնն ի սկզբանե օգտագործվել է միայն ածխաջրածնային սուբստրատներին HX-ի ավելացման համար, սակայն սկզբունքորեն այն կարող է տարածվել այլ փոխարինված ալկենների ռեակցիաների վրա։ Այսպիսով, HCl-ի ավելացումը CF 3 CH=CH 2-ին տալիս է « հակա- Markovnikov «արտադրանք CF 3 CH 2 CH 2 Cl: Սա սպասելի էր, քանի որ CF 3 CH + CH 3 կատիոնը ավելի քիչ կայուն է, քան CF 3 CH 2 CH 2 + կատիոնը ՝ ուժեղ (-I) - ազդեցության պատճառով: CF 3 - խումբը CF 3 CH 2 CH 2+ կատիոնը հիմնականում ձևավորվում է, բայց այն նաև, թեև ավելի փոքր չափով, ապակայունացված է CF 3 խմբի ինդուկտիվ ազդեցությամբ, որի արդյունքում HCl-ի ավելացումը տրիֆտորմեթիլէթիլենը շատ ավելի դանդաղ է, քան չփոխարինված էթիլենի ավելացումը:
Նմանատիպ պատճառով վինիլտրիալկիլամոնիումի կատիոնները ավելացնում են HBr նաև Մարկովնիկովի կանոնին հակառակ.
HX-ի ավելացումը ուժեղ (-I) և (-M) փոխարինիչներ ունեցող ալկեններին, օրինակ՝ ակրիլոնիտրիլին կամ նիտրոէթիլենին, նույնպես պետք է հակադրվի Մարկովնիկովի կանոնին։ Այնուամենայնիվ, այս դեպքում կրկնակի կապը այնքան ուժեղ է անջատված էլեկտրոֆիլ ռեակտիվների նկատմամբ, որ այդ ռեակցիաները տեղի են ունենում միայն շատ ծանր պայմաններում: Վինիլքլորիդ CH 2 =CHCl միշտ տալիս է բացառապես «Markovnikov addducts»: Օրինակ, երբ այն փոխազդում է HCl-ի հետ, ձևավորվում է միայն 1,1-դիքլորէթան (երկվորյակ երկքլորիդ) CH 3 CHCl 2: Քլորը, CF 3 խմբի նման, ունի ուժեղ (-I) ազդեցություն, և առաջին հայացքից թվում է, որ այդ պատճառով հավելումը պետք է ունենա հակամարկովնիկովի ուղղվածություն, քանի որ կատիոն + CH 2 CH 2 Cl պետք է լինի. ավելի կայուն, քան CH 3 CH + Cl կատիոնը: Այնուամենայնիվ, ի տարբերություն CF 3 խմբի, քլորը, բացի (-I) էֆեկտից, ունի նաև (+ M) ազդեցություն, որը հակադրում է դրան (քանի որ այն ունի միայնակ զույգեր): Փորձը ցույց է տալիս, որ մեզոմերային էֆեկտի մեծությունը բավական է 1-քլորէթիլ կատիոնի էներգիան 2-քլորէթիլ կատիոնի էներգիայի մակարդակից ցածր իջեցնելու համար, որի դեպքում +M էֆեկտը չի դրսևորվում:
II. Ռեզոնանսային տեսության տեսանկյունից 1-քլորէթիլ կատիոնի կառուցվածքը կարելի է ներկայացնել հետևյալ կերպ.
Այնուամենայնիվ, վինիլքլորիդին ավելացումն ավելի դանդաղ է տեղի ունենում, քան էթիլենին նույն պայմաններում, այսինքն՝ ըստ ընդհանուր ազդեցության (-I> +M), քլորը մնում է էլեկտրոն քաշող փոխարինող՝ համեմատած ջրածնի հետ, իսկ 1-քլորէթիլ կատիոնը՝ պակաս կայուն, քան C 2 H 5 + . Այլ վինիլ հալոգենիդներ նմանապես արձագանքում են HX-ի հետ:
Վինիլային եթերները CH 2 =CHOR ավելացնում են HX (X=Hal) ըստ Մարկովնիկովի կանոնի շատ ավելի բարձր արագությամբ, քան վերը թվարկված բոլոր փոխարինված ալկենները: Դա պայմանավորված է RO խմբի զգալի +M էֆեկտով: Ի տարբերություն քլորի ատոմի, RO խումբը ընդհանուր էլեկտրոնային էֆեկտի առումով (+M > -I) ուժեղ էլեկտրոն նվիրաբերող փոխարինող է, որն արդյունավետորեն կայունացնում է հարևան կարբոկատիոնային կենտրոնը։ Կարբոկատիոնի կառուցվածքն այս դեպքում կարող է ներկայացվել նաև որպես երկու ռեզոնանսային կառուցվածքների հավաքածու
Օքսոնիումի կատիոնի հարձակումը հալոգենիկ անիոնով հանգեցնում է CH 3 CH(Hal)OR տիպի α-հալոեսթերների առաջացմանը։
4.3.d. Ալկենների խոնավացում
Ալկենների թթվային կատալիզացված խոնավացումը հանգեցնում է սպիրտների առաջացման։ Ալկենների հիդրացման ուղղությունը որոշվում է Մարկովնիկովի կանոնով, ուստի ենթադրվում է, որ այս ռեակցիայում որպես միջանկյալ մասնիկ առաջանում է կարբոկատիոն։
Երկրորդային ալկիլ կարբոկատիոնների՝ իրենց վերադասավորվելու միտումը խոչընդոտում է ալկենների հիդրացման օգտագործումը՝ երկրորդական սպիրտներ ստանալու համար։

Այս մեթոդը լաբորատորիայում սահմանափակ շրջանակ է գտել միայն երրորդական սպիրտների պատրաստման համար: Հիդրացիոն ռեակցիան այս դեպքում մեծապես շրջելի է և երրորդական սպիրտները ձևավորվում են ցածր ելքով (40-45%)։


Ամենապարզ ալկենների՝ էթիլենի և պրոպիլենի խոնավացումը կարևոր արդյունաբերական մեթոդ է էթիլային և իզոպրոպիլային սպիրտներ ստանալու համար։

Լաբորատոր պրակտիկայում ալկենների ուղղակի խոնավացումը լայն կիրառություն չի գտել ինչպես կոշտ պայմանների, այնպես էլ զգալի քանակությամբ իզոմերային սպիրտների առաջացման պատճառով։ Ներկայումս հարակից հիդրօքսիմերկուրացիա-դեմերկուրացիոն ռեակցիան սովորաբար օգտագործվում է ալկեններից սպիրտների ռեգիոսելեկտիվ արտադրության համար:
4.3.d. Hydroxymercuration-demercuration
Էլեկտրաֆիլ հարձակումը ալկենի կրկնակի կապի վրա կարող են իրականացվել մետաղական իոնների միջոցով, որոնց մեջ հատուկ դիրք է գրավում սնդիկի (II) կատիոնը։ Սնդիկի ացետատը շատ մեղմ պայմաններում 20 0 C ջերմաստիճանում ավելացնում է ալկեններին ջրային տետրահիդրոֆուրանում (THF) կամ ջրային քացախաթթվի մեջ՝ սնդիկ օրգանական միացություններ առաջացնելու համար: Սնդիկի ացետատի ավելացումը կրկնակի կապին տեղի է ունենում ռեգիոհատուկ կերպով՝ Մարկովնիկովի կանոնին համապատասխան, այսինքն՝ սնդիկի կատիոնը կցվում է ամենաքիչ փոխարինված ածխածնի ատոմին:
Սնդիկ օրգանական միացություններում C-Hg կապը հեշտությամբ կարելի է ճեղքել նատրիումի բորոհիդրիդ NaBH 4-ի միջոցով՝ առաջացնելով սնդիկ և նոր C-H կապ: Ենթադրվում է, որ ալկիլ սնդիկի հիդրիդը ստացվում է որպես անկայուն միջանկյալ նյութ, որը հետագայում քայքայվում է ռադիկալ մեխանիզմով մետաղական սնդիկի արտազատմամբ։

Ընդհանուր առմամբ, այս երկաստիճան հիդրօքսիմերկուրացիան-դեմերկուրացիայի գործընթացը, ի վերջո, ներկայացնում է ռեգիոսպեցիֆիկ ալկենի հիդրացիա՝ համաձայն Մարկովնիկովի կանոնի ծայրահեղ մեղմ պայմաններում, երբ կողմնակի արտադրանքների ձևավորումը կրճատվում է առավելագույն հնարավոր նվազագույնի: Դա կարելի է հստակորեն ցույց տալ հետևյալ օրինակներով, որոնցում ռեակցիայի արտադրանքի ընդհանուր եկամտաբերությունը 90-98% է: Տրված թվային տվյալներն այս դեպքում ցույց են տալիս ոչ թե առաջացած միացությունների ելքը, այլ դրանց հարաբերակցությունը խառնուրդում։




Ինչպես երևում է վերը նշված օրինակներից, ալկենների հիդրօքսիմերկուրացիան-դեմերկուրացիան շատ դեպքերում ապահովում է ալկենների ռեգիոսպեցիֆիկ հիդրացիա երկու իզոմեր սպիրտներից գործնականում միայն մեկի ձևավորմամբ։ Հարկ է նշել, որ սնդիկ օրգանական միացությունը մեկուսացնելու կարիք չկա, և երկու գործընթացներն էլ կարող են իրականացվել անմիջապես մեկը մյուսի հետևից։
Անհամաչափ ալկենների հիդրօքսիմերկուրացիան, ըստ երևույթին, սկսվում է AcOHg + կատիոնի հարձակմամբ և անհամաչափ ցիկլային սնդիկի կատիոնի ձևավորմամբ (անհամաչափ հալոնիումի իոնի անալոգը) որպես միջանկյալ նյութ, որն այնուհետև բացվում է ջրի ամենանուկլեոֆիլ հարձակման արդյունքում: փոխարինված ածխածնի ատոմ, որը կրում է ավելի մեծ դրական լիցք:

Կամրջող սնդիկի իոնը կարող է ամրագրվել ոչ նուկլեոֆիլ խիստ թթվային միջավայրում նույնիսկ 20 0 C ջերմաստիճանում` ավելացնելով ավելի ուժեղ էլեկտրոֆիլ նյութ` սնդիկի տրիֆտորացետատը ֆտորոսուլֆոնաթթվի և անտիմոնի պենտաֆտորիդի խառնուրդում:

Սնդիկի կատիոնը կարող է տրոհվել ոչ միայն ջրի ազդեցությամբ, այլ նաև էլեկտրոն նվիրաբերող այլ լուծիչներով՝ սպիրտներ, քացախաթթու, ացետոնիտրիլ և այլն: Այս դեպքում ռեակցիայի վերջնական արդյունքը կլինի եթերները, ացետատները կամ N-փոխարինված ամիդները: քացախաթթու, համապատասխանաբար, օրինակ.


Երբ օգտագործվում են ճյուղավորված երկրորդային կամ երրորդական սպիրտներ ալկօքսիմերկուրացիա-դեմերկուրացիա ռեակցիայում, Hg(OCOCF 3) 2 trifluoroacetate կամ Hg (OSO 2 CF 3) 2 trifluoroacetate ավելի արդյունավետ են, քան սնդիկի ացետատը:

Այսպիսով, հիդրօքսի- և ալկօքսիմերկուրացիան-դեմերկուրացիան ճյուղավորված ալկիլ ռադիկալներով սպիրտների և եթերների սինթեզի լավագույն նախապատրաստական մեթոդներից մեկն է։
Սնդիկի աղերի ավելացումը ալկեններին կրկնակի կապի հետ կապված հավելման ռեակցիայի ամենավառ օրինակն է, որտեղ արտաքին նուկլեոֆիլ նյութի դերը խաղում է լուծիչը։ Կրկնակի հիդրօքսիմերկուրացիա-դեմերկուրացիա գործընթացի ստերեոքիմիան կախված է յուրաքանչյուր առանձին քայլի ստերեոքիմիական արդյունքից: Հիդրօքսիմերկուրացիան բնութագրվում է հակա- հավելում, ինչպես ցիկլային կատիոն ներառող այլ ռեակցիաների դեպքում: Այնուամենայնիվ, արմատական դեմերկուրացիան չի բնութագրվում բարձր ստերեոսելեկտիվությամբ: Հետևաբար, ամբողջ գործընթացը որպես ամբողջություն նույնպես ոչ ստերեոսպեցիֆիկ է:
4.3.f. Ալկենների ավելացում (կատիոնային դիմերացում և ալկենների պոլիմերացում)
Այս տեսակի ռեակցիայի ամենահետաքրքիր օրինակը ծծմբաթթվի առկայության դեպքում իզոբուտիլենի դիմերիացումն ու պոլիմերացումն է։

Ալկենների այս խառնուրդի տեխնիկական անվանումն է «դիիզոբուտիլեն»։ Այս ռեակցիան ընթանում է կատիոնային մեխանիզմի համաձայն, որը նման է ալկենների կրկնակի կապին հանքային թթուների ավելացման մեխանիզմին։ Առաջին քայլում պրոտոնը կցվում է իզոբուտիլենի մոլեկուլին՝ համեմատաբար կայուն թերթ- բուտիլկացիա. Հետագա ձևավորված թերթ-բութիլկացիան (Լյուիս թթու) փոխազդում է իզոբուտիլենի մոլեկուլի հետ (Լյուիսի հիմք)՝ ձևավորելով նոր կայուն երրորդական օկտիլային կատիոն:

Այս պայմաններում, հիմքերի (H 2 O, HSO 4 - իոնների) ազդեցության տակ օկտիլային կարբոկացիան արագորեն կորցնում է պրոտոնը և վերածվում իզոմերային պենտենների խառնուրդի, քանի որ պրոտոնի անջատումը տեղի է ունենում երկու տարբեր դիրքերից.

Թերմոդինամիկորեն պակաս կայուն ալկենի՝ 2,4,4-տրիմեթիլպենտեն-1-ի նախընտրելի ձևավորումը (80% ռեակցիոն խառնուրդում) կապված է ավելի մեծ տարածական հասանելիության հետ մեթիլ խմբերի ջրածնի ատոմների հարձակման համար՝ համեմատած ջրածնի ատոմների հետ։ մեթիլենի խմբից: Արդյունաբերության մեջ «դիիզոբուտիլենը» հիդրոգենացվում է Ni-Raney-ի վրա՝ արտադրելու «իզոկտան» (ածխաջրածին 2,2,4-տրիմեթիլպենտանի տեխնիկական անվանումը), որն օգտագործվում է որպես բարձր օկտանային վառելիք ներքին այրման շարժիչների համար։
Ծծմբաթթվի բարձր կոնցենտրացիաների դեպքում (ավելի քան 80%), իզոբուտիլենի կատիոնային պոլիմերացումը տեղի է ունենում՝ առաջացնելով պոլիիզոբուտիլեն կոչվող պոլիմեր (-CH 2 C(CH 3) 2 -) n: Այս ռետինանման պոլիմերն օգտագործվում է հակակոռոզիոն և ջրամեկուսիչ ծածկույթներ, հերմետիկ նյութեր և այլն ստանալու համար։
Ի լրումն իզոբուտիլենից, կատիոնային մեխանիզմի համաձայն պոլիմերացվում են 3-մեթիլբութեն-1-ը, վինիլային եթերները և ստիրոլի որոշ ածանցյալներ, որոնք կարող են ձևավորել համեմատաբար կայուն կարբոկացիաներ։ Ջրածնի ֆտորիդը և Լյուիս թթուները նույնպես օգտագործվում են որպես կատիոնային պոլիմերացման կատալիզատորներ՝ BF 3 , AlCl 3 , AlBr 3 և այլն շատ փոքր քանակությամբ ջրի առկայության դեպքում։
4.3.g. Ալկանների ավելացում (ալկենների ալկիլացում)
«Իզօկտանի» սինթեզի մեկ այլ արդյունաբերական մեթոդ հիմնված է իզոբուտիլենի փոխազդեցության վրա իզոբութանի ավելցուկի հետ՝ խտացված ծծմբաթթվի կամ անջուր ջրածնի ֆտորիում 0 10 0 C ջերմաստիճանում:

Այս ռեակցիան նույնպես ընթանում է կատիոնային մեխանիզմի միջոցով և, ինչն առանձնահատուկ հետաքրքրություն է ներկայացնում, կատիոնային շղթայի գործընթացի օրինակ է: Նախ, իզոբուտիլենը դիմերիզացվում է ռեակցիայի պայմաններում՝ ձևավորելով երրորդական օկտիլային կատիոն (CH 3) 3 CCH 2 C + (CH 3) 2: Դրա ձևավորման մեխանիզմը մանրամասն նկարագրված է նախորդ բաժնում: Այնուհետև տեղի է ունենում ջրածնի արագ փոխանցում (հիդրիդ իոնի տեսքով) իզոբութանից դեպի օկտիլ կատիոն՝ «իզոկտան» մոլեկուլի և նոր տերտ-բուտիլ կատիոնի ձևավորմամբ, որն իր հերթին արագ արձագանքում է իզոբուտիլենի հետ՝ ձևավորելով: նոր օկտիլային կատիոն և այլն:

Ի հավելումն «իզոկտանի» սինթեզին, այս ալկիլացման մեթոդը կիրառվում է նավթաքիմիական արդյունաբերության մեջ՝ ճյուղավորված ալկեններից և ցածր եռացող ալկաններից բարձր եռացող ճյուղավորված ածխաջրածինների սինթեզման համար՝ ջերմային ճեղքող ֆրակցիայով։
ԱԼԿԵՆՆԵՐ
Ածխաջրածինները, որոնց մոլեկուլում, բացի պարզ ածխածին-ածխածին և ածխածին-ջրածին σ-կապերից, կան ածխածին-ածխածին π-կապեր, կոչվում են. անսահմանափակ.Քանի որ π կապի ձևավորումը ձևականորեն համարժեք է մոլեկուլի կողմից ջրածնի երկու ատոմների կորստին, չհագեցած ածխաջրածինները պարունակում են. 2pավելի քիչ ջրածնի ատոմներ, քան սահմանը, որտեղ Պ -π-կապերի քանակը.
Այն շարքը, որի անդամները միմյանցից տարբերվում են (2H) n-ով, կոչվում է իզոլոգիական կողմը.Այսպիսով, վերը նշված սխեմայում իզոլոգներն են՝ հեքսանները, հեքսենները, հեքսադիենները, հեքսինները, հեքսատրիենները և այլն։
Մեկ π-կապ (այսինքն՝ կրկնակի կապ) պարունակող ածխաջրածինները կոչվում են ալկեններ (օլեֆիններ)կամ, ըստ շարքի առաջին անդամի՝ էթիլենի, էթիլենային ածխաջրածիններ.Նրանց հոմոլոգ շարքի ընդհանուր բանաձևը C p H 2n.
1. Անվանակարգ
Համաձայն IUPAC-ի կանոնների՝ ալկենների անվանումները կառուցելիս կրկնակի կապ պարունակող ամենաերկար ածխածնային շղթան ստանում է համապատասխան ալկանի անվանումը, որում վերջավորությունը. -enփոխվել է -en.Այս շղթան համարակալված է այնպես, որ ածխածնի ատոմները, որոնք ներգրավված են կրկնակի կապի ձևավորման մեջ, ստանում են հնարավոր ամենափոքր թիվը.

Ռադիկալները անվանվում և համարակալվում են ինչպես ալկանների դեպքում։
Համեմատաբար պարզ կառուցվածք ունեցող ալկենների համար թույլատրվում են ավելի պարզ անվանումներ։ Այսպիսով, ամենատարածված ալկեններից մի քանիսը կոչվում են վերջածանց ավելացնելով -enնույն ածխածնային կմախքով ածխաջրածնային ռադիկալի անվանումը.
Ալկեններից գոյացած ածխաջրածնային ռադիկալները ստանում են վերջածանց - էնիլ.Ռադիկալում համարակալումը սկսվում է ածխածնի ատոմից, որն ունի ազատ վալենտություն։ Այնուամենայնիվ, ամենապարզ ալկենիլ ռադիկալների համար, համակարգված անունների փոխարեն, թույլատրվում է օգտագործել չնչինները.

Ջրածնի ատոմները, որոնք ուղղակիորեն կապված են չհագեցած ածխածնի ատոմների հետ, որոնք կազմում են կրկնակի կապ, հաճախ կոչվում են. վինիլային ջրածնի ատոմներ,
2. Իզոմերիզմ
Բացի ածխածնային կմախքի իզոմերիզմից, ալկենների շարքում կա նաև կրկնակի կապի դիրքի իզոմերիա։ Ընդհանուր առմամբ, այս տեսակի իզոմերիզմը. փոխարինող դիրքի իզոմերիզմ (գործառույթներ)- նկատվում է բոլոր այն դեպքերում, երբ մոլեկուլում առկա են ֆունկցիոնալ խմբեր: C 4 H 10 ալկանի համար հնարավոր է երկու կառուցվածքային իզոմեր.
Ալկենի C 4 H 8 (բութեն) համար հնարավոր է երեք իզոմեր.

Բուտեն-1-ը և բութեն-2-ը ֆունկցիայի դիրքի իզոմերներ են (այս դեպքում նրա դերը խաղում է կրկնակի կապով):
Տարածական իզոմերները տարբերվում են միմյանց նկատմամբ փոխարինողների տարածական դասավորությամբ և կոչվում են. cis իզոմերներ,եթե փոխարինողները գտնվում են կրկնակի կապի նույն կողմում, և տրանս իզոմերներ,եթե հակառակ կողմերում.

3. Կրկնակի կապի կառուցվածքը
C=C կրկնակի կապում մոլեկուլի ջարդման էներգիան 611 կՋ/մոլ է; քանի որ σ-կապ C-C-ի էներգիան 339 կՋ/մոլ է, π կապի խզման էներգիան ընդամենը 611-339 = 272 կՋ/մոլ է։ π-էլեկտրոնների վրա շատ ավելի հեշտ է ազդել, քան σ-էլեկտրոնների վրա, օրինակ՝ բևեռացնող լուծիչների կամ որևէ գրոհող ռեակտիվների ազդեցության տակ: Դա բացատրվում է σ- և π-էլեկտրոնների էլեկտրոնային ամպի բաշխման համաչափության տարբերությամբ։ p-օրբիտալների առավելագույն համընկնումը և, հետևաբար, մոլեկուլի նվազագույն ազատ էներգիան իրականացվում է միայն վինիլային բեկորի հարթ կառուցվածքով և 0,134 նմ հավասար C-C հեռավորությամբ, այսինքն. շատ ավելի փոքր է, քան մեկ կապով միացված ածխածնի ատոմների միջև հեռավորությունը (0,154 նմ): Կրկնակի կապի առանցքի երկայնքով մոլեկուլի «կեսերի» միմյանց նկատմամբ պտտվելիս նվազում է ուղեծրերի համընկնման աստիճանը, ինչը կապված է էներգիայի ծախսման հետ։ Դրա հետևանքն է կրկնակի կապի առանցքի երկայնքով ազատ պտույտի բացակայությունը և ածխածնի ատոմներում համապատասխան փոխարինմամբ երկրաչափական իզոմերների առկայությունը։
Ալկեններ- չհագեցած ածխաջրածիններ, որոնք պարունակում են մեկ կրկնակի կապ. Ալկենների օրինակներ.

Ալկենների ստացման մեթոդներ.
1. Ալկանների ճեղքումը 400-700°C-ում: Ռեակցիան ընթանում է ազատ ռադիկալների մեխանիզմի համաձայն.

2. Ալկանների ջրազրկում.
3. Վերացման ռեակցիա (կտրվածք). 2 ատոմ կամ ատոմների 2 խումբ կտրվում են հարևան ածխածնի ատոմներից և առաջանում է կրկնակի կապ։ Այս ռեակցիաները ներառում են.
Ա) սպիրտների ջրազրկում (150 ° C-ից բարձր տաքացում, ծծմբաթթվի մասնակցությամբ՝ որպես ջրահեռացնող ռեագենտ).
Բ) Ջրածնի հալոգենիդների ճեղքումը, երբ ենթարկվում է ալկալիի ալկոհոլային լուծույթին.

Ջրածնի ատոմը բաժանվում է հիմնականում ածխածնի ատոմից, որը կապված է ավելի փոքր թվով ջրածնի ատոմների հետ (ամենաքիչ հիդրոգենացված ատոմ). Զայցեւի իշխանությունը.
Բ) Դեհալոգենացում.

Ալկենների քիմիական հատկությունները.
Ալկենների հատկությունները որոշվում են բազմակի կապի առկայությամբ, հետևաբար ալկենները մտնում են էլեկտրոֆիլ հավելման ռեակցիաների մեջ, որոնք ընթանում են մի քանի փուլով (H-X - ռեագենտ).
1-ին փուլ.

2-րդ փուլ.
 .
.
Այս տեսակի ռեակցիայի մեջ ջրածնի իոնը պատկանում է ավելի բացասական լիցք ունեցող ածխածնի ատոմին։ Խտության բաշխումը հետևյալն է.

Եթե որպես փոխարինող կա դոնոր, որն արտահայտվում է որպես +I- էֆեկտ, ապա էլեկտրոնի խտությունը տեղափոխվում է դեպի ամենաջրածնային ածխածնի ատոմը՝ դրա վրա ստեղծելով մասամբ բացասական լիցք։ Արձագանքները շարունակվում են Մարկովնիկովի կանոնըտիպի բևեռային մոլեկուլներ միացնելիս HX (HCl, HCN, ՀՈՀև այլն) անհամաչափ ալկենների դեպքում ջրածինը նախընտրելիորեն ավելացվում է ավելի հիդրոգենացված ածխածնի ատոմին կրկնակի կապում:
Ա) ավելացման ռեակցիաներ.
1) հիդրոհալոգենացում.
Ռեակցիան ընթանում է Մարկովնիկովի կանոնով։ Բայց եթե ռեակցիայի մեջ առկա է պերօքսիդ, ապա կանոնը հաշվի չի առնվում.
2) խոնավացում. Ֆոսֆորի կամ ծծմբաթթվի առկայության դեպքում ռեակցիան ընթանում է Մարկովնիկովի կանոնի համաձայն.

3) հալոգենացում. Արդյունքում, բրոմի ջուրը գունազրկվում է. սա որակական ռեակցիա է բազմակի կապի նկատմամբ.
4) հիդրոգենացում. Ռեակցիան ընթանում է կատալիզատորների առկայության դեպքում։



