جذب در رابط صورت می گیرد. بنابراین منطقی است که توصیف ترمودینامیکی پدیده های سطحی را به عنوان یک مورد خاص از ترمودینامیک سیستم های ناهمگن در نظر بگیریم.
برنج. 3.4. جذب گیبس: 1- سیستم مقایسه دو فاز، 2- سیستم دو فاز واقعی با ناحیه غیر یکنواخت
در ترمودینامیک سیستم های ناهمگن از آن استفاده می شود اصل افزایشیکه به شرح زیر است: تمام خواص گسترده یک سیستم ناهمگن برابر است با مجموع خواص گسترده متناظر که فازها قبل از تماس با یکدیگر داشتند.اجازه دهید فازها را با α و β نشان دهیم (شکل 4). سپس برای یک سیستم ایده آل، به گونه ای که خواص فازهای نزدیک به فصل مشترک با خواص توده ای آنها منطبق باشد، روابط زیر برای انرژی داخلی U، حجم V، جرم (تعداد مول) n، آنتروپی S پس از برقراری تعادل معتبر است. سیستم ناهمگن:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
فرض بر این است که دما و فشار در هر دو فاز یکسان است.
برای سیستمهای ناهمگن واقعی، ناحیه انتقال در مرز دو فاز سهم بیشتری در خواص گسترده سیستم دارد. اگر پدیده های سطحی رخ دهند، باید تفاوت بین خواص گسترده یک سیستم ناهمگن واقعی و ویژگی های گسترده یک سیستم مدل که در آن پدیده های سطحی وجود ندارند را در نظر گرفت. به چنین سیستمی سیستم مقایسه می گویند. سیستم مقایسه دارای همان پارامترهای فشرده (T, P, C i ...) و همان حجم V با سیستم واقعی است (شکل 4).
از نقطه نظر ترمودینامیکی، مقدار جذب G به عنوان مقدار اضافی ماده n s، بیان شده بر حسب مول یا گرم، که یک سیستم ناهمگن واقعی در مقایسه با سیستم مرجع، مربوط به سطح مشترک یا سطح سطح دارد، درک می شود. از جاذب A. فرض بر این است که سیستم مقایسه دارای پارامترهای فشرده (T, P, C i) و همان حجم (V = V α + V β) با سیستم واقعی است (شکل 4) .
Г = (n - n α - n β)/A = n s /A 3.11
توابع ترمودینامیکی اضافی ناحیه گذار یک سیستم واقعی (آنها را با شاخص s نشان می دهیم) را می توان به صورت زیر نوشت:
U s = U - U α - U β ، n s = n - n α - n β ، S s = S - S α - S βو غیره.
اندازهگیریهای تجربی جذب همیشه جذب را دقیقاً به عنوان مازاد مؤلفه در سیستم واقعی در مقایسه با سیستم مرجع انتخابی نشان میدهند. به عنوان مثال، هنگام جذب گاز بر روی یک جاذب جامد یا هنگام جذب اجزاء در فاز جامد، برای یافتن مقادیر جذب، تغییر غلظت اولیه ماده جاذب را پس از تماس فازهای α و β تعیین کنید.
n i s = V(C i o - C i)،
جایی که C i o- غلظت اولیه مولفه i C i- غلظت مولفه i پس از برقراری تعادل بین فازهای تماس. اعتقاد بر این است که حجم Vتغییر نمی کند. با این حال، غلظت منجزء ام C i، به دست آمده تجربی، در حجم تعیین می شود V'بالای سطح مشترک فاز بدون در نظر گرفتن حجم ناحیه ناهمگن لایه انتقال V αدر سطح مشترکی که غلظت آن است C i α. بنابراین، به دلیل وجود یک منطقه غیر یکنواخت در یک سیستم واقعی، حجم کل سیستم را می توان به صورت V = V’ + V α. تمام مقدار منجزء -ام C i oبین این دو جلد توزیع خواهد شد:
V C i o = V’ C i + V α C i α،
و تعداد مول های جزء من، جذب شده در رابط، برابر خواهد بود
n i s = (V'C i + V α C i α) - (V' + V α)C i = V α (C i α - C i) 3.12
آن ها جذب تجربی تعیین شده، مازاد مولفه i در حجم V α در مقایسه با مقدار این جزء در همان حجم دور از فصل مشترک است. به این نوع جذب، جذب گیبس می گویند. .
V α C i αمحتوای کامل نامیده می شود من-جزء ام در لایه جذب در منطقه با غلظت بسیار پایین C iدر حجم V'اصلاحیه V α C iمعادله (3.2) را می توان نادیده گرفت و مقدار اندازه گیری شده را می توان در نظر گرفت V α C i αمحتوای کامل من-به عنوان مثال، در هنگام جذب گاز روی یک جاذب جامد در فشارهای پایین، جزء جزء لایه جذب است.
ترمودینامیک فرآیندهای جذب
| نام پارامتر | معنی |
| موضوع مقاله: | ترمودینامیک فرآیندهای جذب |
| روبریک (دسته موضوعی) | تحصیلات |
تعاریف اساسی و روش های طبقه بندی فرآیندهای جذب.
جذب به پدیده هایی اطلاق می شود که به دلیل کاهش خود به خود در انرژی سطح رخ می دهد.
جذب- فرآیند توزیع مجدد برگشت پذیر یا غیرقابل برگشت خود به خودی اجزای یک سیستم ناهمگن بین لایه سطحی و حجم فاز همگن.
در سیستم های چند جزئی، جزء که به شدت کشش سطحی را کاهش می دهد ترجیحاً به لایه سطحی منتقل می شود. در سیستم های تک جزئی، در حین تشکیل لایه سطحی، تغییری در ساختار آن رخ می دهد (جهت گیری معینی از اتم ها و مولکول ها، قطبش)، به نام جذب خودکار.
فاز متراکم تری که برهمکنش های جذب بر روی آن موضعی می شود نامیده می شود جاذب. ماده ای که بین حجم فاز همگن و لایه سطحی توزیع می شود با عبارت ʼʼ مشخص می شود. جذبʼʼ.
در برخی موارد، فرآیند جذب برگشت پذیر است. در این حالت، تحت شرایط خاصی، بخشی از مولکول های جذب شده در نتیجه پدیده های جنبشی مولکولی می توانند از لایه سطحی به فاز توده ای حرکت کنند. فرآیند معکوس جذب نامیده می شود دفع.
روش های طبقه بندی فرآیندهای جذب
طبقه بندی فرآیندهای جذب بر اساس وضعیت تجمع فازهای متقابل.با در نظر گرفتن وابستگی به حالت کل فازهای مجاور، انواع فرآیندهای جذب زیر متمایز می شوند:
جذب گازها روی جاذب جامد؛
جذب مواد محلول در سطح مشترک «جامد-مایع» و «مایع-مایع»؛
جذب سطحی فعال در سطح مشترک مایع و گاز
طبقه بندی فرآیندهای جذب بر اساس مکانیسم برهمکنش بین جاذب و جاذب.جذب را می توان به عنوان برهمکنش مولکول های جاذب با مراکز فعال جاذب در نظر گرفت. با توجه به مکانیسم اثر متقابل آنها، انواع زیر تقسیم می شوند:
1) جذب فیزیکی (مولکولی).- برهمکنش بین مولکول های جاذب و جاذب به دلیل نیروهای واندروالس، پیوندهای هیدروژنی (بدون واکنش های شیمیایی) انجام می شود.
2) جذب شیمیایی (شیمیایی جذب)- اتصال مولکول های جاذب به مراکز فعال جاذب در نتیجه واکنش های شیمیایی انواع مختلف (به استثنای واکنش های تبادل یونی) رخ می دهد.
3) جذب تبادل یونی (تبادل یونی) - توزیع مجدد ماده جاذب بین محلول و فاز جامد (مبدل کننده یون) با توجه به مکانیسم واکنش های تبادل یونی.
برای توصیف کمی فرآیندهای جذب، از دو کمیت استفاده می شود.
1) جذب مطلق- مقدار (مول) یا جرم (کیلوگرم) جاذب در واحد سطح یا جرم جاذب. تعیین - A; ابعاد: mol/m2، mol/kg، kg/m2، kg/kᴦ.
2) جذب گیبس (زیاد).- مازاد ماده جاذب در یک لایه سطحی با ضخامت معین نسبت به مقدار آن در حجم فاز همگن، در واحد سطح یا جرم جاذب. تعیین - G; ابعاد: mol/m 2، mol/kᴦ.
رابطه بین جذب مطلق و اضافی را می توان با استفاده از معادله نشان داد:
Г = А – с * h (3.1)
که در آن c غلظت تعادلی ماده در حجم فاز، mol/m3 است.
h ضخامت لایه سطحی است که به طور معمول 9-10 متر در نظر گرفته می شود.
در سیستم های ناهمگن چند جزئی، هنگامی که یک یا آن جزء بین حجم فاز همگن و لایه سطحی توزیع می شود، معادله انرژی داخلی اضافی سطح معتبر است:
U = T * S + s * s + Sm i * n i (3.2)
با کاهش تمام عبارات معادله به واحد سطح سطح بین فاز، به دست می آوریم:
U s = T * S s + s + Sm i * Г i (3.3)
که در آن Г i = n i / s مازاد مولفه i در لایه سطحی است، یعنی جذب گیبس.
برای یک سیستم تک جزئی، معادله (3.3) به شکل زیر خواهد بود:
G s = s + m * G (3.4)
که در آن G s = U s - T * S s - انرژی گیبس سطح یا کار ایجاد یک واحد سطح.
m * G - متراکم شدن ماده ماده جذب شده در لایه سطحی.
بر اساس رابطه (3.4) می توان نتیجه گرفت که در حین جذب، کار ایجاد سطح بین فازی شامل کار تشکیل سطح (شکستن پیوندهای چسبنده در حجم فاز جاذب) و تراکم ماده در لایه سطحی است.
در حالت تعادل دینامیکی بین جاذب و جاذب، تغییر در انرژی گیبس سیستم ناهمگن ΔG = 0، ترمودینامیک فرآیند جذب با معادله ای به نام توصیف می شود. معادله جذب بنیادی گیبس:
Ds = SГ i * dm i (3.5)
این معادله جهانی است، زیرا برای همه انواع فرآیندهای جذب معتبر است
موارد خاص معادله جذب گیبس.
1) جذب از محلول ها.
برای پتانسیل شیمیایی جزء یکم سیستم در حین جذب در سطح مشترک "جاذب مایع - جامد" و "مایع - گاز" معادلات زیر معتبر است:
m i = m i 0 + R*T*ln a i (3.6)
dm i = R*T* d ln a i (3.7)
که در آن m i 0 پتانسیل شیمیایی جزء i ام سیستم در شرایط استاندارد است.
a i فعالیت جزء i ام سیستم در شرایط استاندارد است.
بر این اساس، معادله جذب گیبس به شکل زیر است:
Г i = - a i / R*T * (ds / da i) (3.8)
برای محلول های غیر الکترولیت ها یک i = c i می گیریم، سپس:
Г i = - с / R*T * (ds / dс) (3.9)
برای محلول های الکترولیت:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
که در آن ± میانگین غلظت یونی محلول است.
n ضریب استوکیومتری است.
2) جذب مواد از فاز گاز.
مطابق با معادله مندلیف-کلیپرون:
Р = с * R*T (3.11)
در این رابطه معادله گیبس برای جذب گازها روی جاذب جامد به شکل زیر نوشته شده است:
Г i = - Р / R*T * (ds / dР) (3.12)
در عمل، معادله جذب گیبس، بر اساس اندازهگیریهای کشش سطحی در مقادیر مختلف غلظت مایع یا فشار گاز تعادلی، امکان محاسبه میزان جذب مواد در لایه سطحی را که کشش سطحی برای آن تعیین میشود، میدهد.
ترمودینامیک فرآیندهای جذب - مفهوم و انواع طبقه بندی و ویژگی های رده "ترمودینامیک فرآیندهای جذب". 2017، 2018.
جذب به عنوان غلظت خود به خودی مولکول ها روی یک سطح با کاهش آنتروپی سیستم همراه است. از آنجایی که ملاک خودانگیختگی فرآیند است
∆H - T · ∆S = ∆G< 0,
سپس جذب فقط در ΔH امکان پذیر است< 0 (экзотермический процесс). Равновесие определяется условием ∆Н = T· ∆S. با افزایش دما، تعادل به سمت فرآیند گرماگیر، یعنی دفع تغییر میکند.
جذب سطحی جامد
1. جذب تک مولکولی
طبق نظریه لانگمویر، مولکول های جاذب با سطح جاذب برهم کنش می کنند و در نهایت یک لایه تک مولکولی تشکیل می دهند. در این حالت، درجه پر شدن () سطح با ماده جذب شده در حین جذب از فاز گاز
از مایع
که در آن K ثابت تعادل (ثابت جذب) است.
p فشار جزئی گاز جذب شده است.
c غلظت ماده جذب شده است.
وابستگی β به p (یا c) توسط نمودار (ایزوترم جذب، T = const) در شکل نشان داده شده است. 1.3.

برنج. 1.3. درجه پر شدن سطح با ماده جذب شده
در غلظت های کم و فشار جزئی، جذب متناسب با غلظت یا فشار جزئی است:
آر<< 1, β ≈ К· r ilis<< 1, β ≈ К· اس، یعنی بخش اولیه ایزوترم تقریباً خطی است و tan α = K (tg α با شیب منحنی در p (یا c) → 0: یا 0 تعیین می شود).
اگر تعداد مول های ماده جذب شده در هر 1 گرم جاذب باشد. - حداکثر تعداد ممکن مول ماده جذب شده در هر 1 گرم جاذب ("ظرفیت تک لایه")، سپس
جایگزینی β به معادله (1.3) (برای مورد جذب از فاز گاز، غلظت بادر معادلات باید با فشار جایگزین شود آر)، ما گرفتیم:
 (1.6)
(1.6)
از آنجایی که و K در یک جفت جاذب-جاذب معین ثابت هستند (در تی=const)، سپس با وابستگی می توان پیدا کرد به(شکل 1.4).

برنج. 1.4. حل گرافیکی معادله جذب
به دست آمده با برونیابی وابستگی خطی تجربی به () = 0. و، از آن زمان، پس از آن، .
از این مقدار می توان برای تعیین سطح ویژه جاذب استفاده کرد UD (بر حسب متر مربع به ازای هر 1 گرم جاذب)، اگر مساحت ω که توسط یک مولکول جاذب در سطح اشغال می شود مشخص باشد (از اندازه مولکول تعیین می شود):
UD = · ω · Na، (1.7)
که در آن Na عدد آووگادرو است (Na = 6.02 10 23).
به نوبه خود، مقدار شناخته شده UD را می توان برای محاسبه ω هر ماده بر اساس جذب آن روی یک جاذب معین استفاده کرد.
2. جذب پلی مولکولی
معادله (1.5) یک منحنی با اشباع را توصیف می کند. در
p (یا c) → ∞ به مقدار حدی برابر با (شکل 1.5، a) تمایل دارد.

شکل 1.5. ایزوترم های جذب:
الف - جذب با اشباع؛ ب – جذب پلی مولکولی
با این حال، در برخی موارد، ایزوترم های جذب مانند آنچه در شکل 1 نشان داده شده است، به نظر می رسد. 1.5، b، i.e. حتی در p (یا c) بالا به حد مجاز نمی رسد.
وابستگی هایی از نوع نشان داده شده در شکل. 1.5،b مربوط به جذب پلی مولکولی است. به عنوان یک قاعده، چنین ایزوترم ها مشخصه مواد با فعل و انفعالات بین مولکولی قوی (به عنوان مثال، آب) است. هنگامی که مراکز جذب روی سطح جاذب اشغال می شوند (لایه تک مولکولی اشباع شده است)، "فرود" مولکول های جاذب بعدی به دلیل برهمکنش های بین مولکولی با مولکول های از قبل جذب شده رخ می دهد (شکل 1.6). گرمای چنین جذبی از نظر مقدار مطلق نزدیک است، اما در مقابل گرمای تبخیر مایع مربوطه است (به این فکر کنید که چرا).

شکل 1.6. طرح جذب:
الف - جذب تک مولکولی؛ ب - جذب پلی مولکولی
هر چه نزدیک تر می شویم آردر برابر فشار بخار اشباع ماده جذب شده، شروع به متراکم شدن روی سطح جاذب می کند، در نتیجه با افزایش به سرعت رشد می کند. آر.
در مورد برهمکنش بین دو اتم:
U – انرژی تعامل؛
U = U PRIOR. + U بازگشت
 - معادله لنارد جونز
, c, b, m = const
- معادله لنارد جونز
, c, b, m = const
در موارد برهمکنش اتم ها با سطح جامد، لازم است همه برهمکنش ها جمع شوند.
x – فاصله تا سطح
r - شعاع عمل نیروهای جاذبه
dV - حجم
n - تعداد مولکول های سطحی
U ADS. – انرژی برهمکنش جذب



در مورد جذب، جاذبه افزایش می یابد. و در مورد برهمکنش غیرقطبی-غیر قطبی، جذب عمدتاً در فرورفتگیها موضعی میشود.
برهم کنش الکترواستاتیکی
جاذب قطبی - جاذب غیر قطبی
جاذب غیر قطبی - جاذب قطبی
جاذب قطبی - جاذب قطبی.
م  مولکول جاذب به عنوان یک دوقطبی و جاذب به عنوان یک رسانا نشان داده می شود که در آن مولکول جاذب یک آینه دوقطبی را به طور متقارن نسبت به آینه داده شده القا می کند.
مولکول جاذب به عنوان یک دوقطبی و جاذب به عنوان یک رسانا نشان داده می شود که در آن مولکول جاذب یک آینه دوقطبی را به طور متقارن نسبت به آینه داده شده القا می کند.
X - فاصله تا وسط
هنگام تعامل، پتانسیل به وجود می آید:
 ,
,
 - لحظه دوقطبی
- لحظه دوقطبی
پتانسیل تمایل به گرفتن حداکثر مقدار دارد، یعنی. دوقطبی ها تمایل دارند عمود بر سطح جهت گیری کنند.
از آنجایی که افزایش دما باعث رشد حرکت براونی می شود، منجر به مهار فرآیند جذب می شود.
در مورد برهمکنش الکترواستاتیکی، جذب عمدتاً روی برآمدگی ها قرار می گیرد.
معادله جذب بنیادی
در مورد جذب، توزیع مجدد جزء رخ می دهد، که به معنای تغییر پتانسیل شیمیایی است. فرآیند جذب را می توان به عنوان انتقال انرژی سطحی به انرژی شیمیایی در نظر گرفت.
حجم لایه = 0، سپس معادله تعمیم یافته قوانین I و II ترمودینامیک:
T = const; (1) = (2) => 

برای یک سیستم دو جزئی:
,
 ,
,
 =>
=>
=>
 - معادله جذب گیبس
.
- معادله جذب گیبس
.
برای مورد جذب تلویزیون. بدن - گاز: 
 ,
,

 - ایزوترم
- ایزوترم
 - ایزوبار
- ایزوبار
 - ایزوپیکنال
- ایزوپیکنال
 - ایزوستر
- ایزوستر
ایزوترم، ایزوپیکن، ایزوستر به یکدیگر مرتبط هستند.
زیرا تابع جذب 



ایزوترم هنری ایزوترم لانگمویر



ترمودینامیک. جذب
برای ماده متراکم:
 ,
,
 ,
,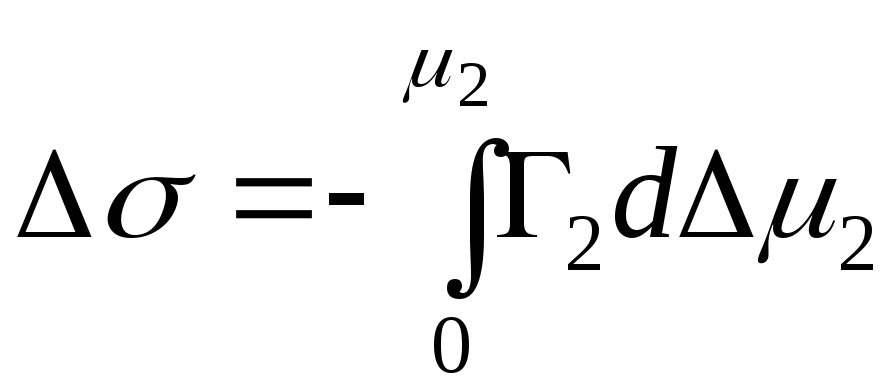
 - تغییر کامل در انرژی گیبس
.
- تغییر کامل در انرژی گیبس
.

P - فشار روی یک سطح منحنی، Р S - فشار روی یک سطح صاف
 - پتانسیل جذب
- پتانسیل جذب
تغییر دیفرانسیل در دام 
 ، Г = ثابت
، Г = ثابت
- تغییر آنتروپی دیفرانسیل
- آنتالپی دیفرانسیل جذب
 - گرمای ایزوستریک جذب
- گرمای ایزوستریک جذب
 - گرمای تراکم
- گرمای تراکم
 - گرمای خالص جذب
- گرمای خالص جذب

 ,
,




Qa - گرمای یکپارچه جذب، 
Qra - گرمای خالص یکپارچه جذب،

معادله هانری
مطالعه جذب به دلیل ناهمگنی سطح پیچیده است، بنابراین ساده ترین قوانین برای سطوح همگن به دست می آید.
اجازه دهید تعامل گازها با یک سطح جامد را در نظر بگیریم، زمانی که گاز از حالت تعادل در حجم به حالت تعادل روی سطح تبدیل می شود. این حالت مشابه تعادل گازها در میدان گرانشی است.
 ,
,
 ,
=>
,
=> -معادله هانری
-معادله هانری
 - ضریب توزیع
- ضریب توزیع
در طول فرآیند جذب، تغییر در پتانسیل های شیمیایی رخ می دهد.
برای فاز انبوه: 
برای گاز روی سطح: 
در حالت تعادل  ، یعنی
، یعنی

در معادله هنری، ثابت به غلظت بستگی ندارد
معادله هانری در ناحیه فشارها و غلظت های پایین معتبر است. با افزایش تمرکز، 2 نوع انحراف از قانون هنری ممکن است:
1- انحرافات مثبت، D کاهش می یابد، A کاهش می یابد
2 - انحرافات منفی، D - افزایش می یابد، A - افزایش می یابد.
نوع انحراف با غلبه یک یا نوع دیگری از تعامل جاذب-جاذب تعیین می شود.
با تعامل چسب قوی، ضرایب فعالیت افزایش می یابد - یک انحراف مثبت. در مورد تعاملات منسجم، انحرافات منفی مشاهده می شود.
جذب تک مولکولی
ایزوترم لانگمویر
ساده ترین الگوها در نظریه هنری به دست آمد. لانگمویر نظریه ای ارائه کرد که بر اساس آن جذب به عنوان یک واکنش شبه شیمیایی در نظر گرفته می شود. که در آن:
سطح از نظر انرژی همگن است.
جذب موضعی است، هر مرکز جذب با یک مولکول جذب کننده تعامل دارد.
مولکول های جذب شده با یکدیگر برهمکنش ندارند.
جذب تک لایه

 - سطح،
- سطح،  - جذب،
- جذب،  - مجتمع جذب
- مجتمع جذب
 سپس غلظت محل های جذب:
سپس غلظت محل های جذب:  ,
, - محدود کردن جذب
- محدود کردن جذب
 ، سپس ثابت واکنش برابر است با:
، سپس ثابت واکنش برابر است با: 

 - معادله لانگمویر
- معادله لانگمویر
وابستگی جذب به غلظت
1 )
)
 ,
,

2) منطقه با غلظت بالا
 - محدود کردن جذب، تشکیل یک لایه تک مولکولی
- محدود کردن جذب، تشکیل یک لایه تک مولکولی
برای انرژی گیبس: .
g ضریب آنتروپی است.
در مورد ایزوترم هنری، انرژی گیبس انتقال ماده جاذب از حالت استاندارد در حالت عمده به حالت استاندارد روی سطح را مشخص می کند. در مورد ایزوترم لانگمویر  درجه میل ترکیبی بین جاذب و ماده جاذب را مشخص می کند.
درجه میل ترکیبی بین جاذب و ماده جاذب را مشخص می کند.
 از وانت هاف ایزوبار پیدا شد.
از وانت هاف ایزوبار پیدا شد.

 ، سپس
، سپس  ، از اینجا
، از اینجا  .
.

 - درجه پر شدن سطح
- درجه پر شدن سطح




 - تعداد صندلی های رایگان،
- تعداد صندلی های رایگان،  - تعداد مکان های اشغال شده
- تعداد مکان های اشغال شده
 ,
,

آن ها در منطقه با غلظت های بالا، تعداد سایت های آزاد با مقدار جاذب نسبت معکوس دارد.
جذب مخلوطی از گازها در یک سطح همگن.
در این حالت فرآیند جذب به عنوان دو واکنش موازی در نظر گرفته می شود.
 (1)
(1)

 (2)
(2)


جذب مخلوطی از گازها در سطحی غیر یکنواخت.
در مورد سطح غیر یکنواخت، نمی توان خود را به پرکردگی های متوسط محدود کرد.
در نتیجه رقابت، بومی سازی جاذب های مختلف در مناطق با انواع مختلف امکان پذیر است.
در این مورد رابطه  .
.
 ,
,
 - فشار بخار اشباع ماده جاذب
- فشار بخار اشباع ماده جاذب
 ,
,
 - گرمای جذب
- گرمای جذب
"+" - وابستگی به همبستگی، "-" - وابستگی آنتیبیت، "N" - هیچ همبستگی.
"+" - جذب طبق همان مکانیسم انجام می شود. در مناطقی که از نظر انرژی مطلوب هستند، گاز با میل ترکیبی بالا به سطح عمدتاً جذب می شود.
"-" - جذب از طریق مکانیسم های مختلف اتفاق می افتد و تا یک نقطه خاص از زمان رقابت برای سطح وجود ندارد.
جذب تک مولکولی عمدتاً در طول جذب فیزیکی گازها در مقادیر کم انجام می شود. پو همچنین در رابط مایع/گاز.
جذب پلی مولکولی
نظریه BET(برونائر، امت، تلر).
در مواردی که تشکیل تک لایه برای جبران انرژی سطحی کافی نباشد، جذب پلی مولکولی است و می توان آن را به عنوان نتیجه تراکم اجباری تحت تأثیر نیروهای سطحی در نظر گرفت.
امتیاز کلیدی:
هنگامی که یک مولکول جذب شده به یک مکان اشغال شده برخورد می کند، یک مجموعه چندگانه تشکیل می شود.
هر چه نزدیک تر می شویم پبه پ ستعداد سایت های جذب رایگان کاهش می یابد. در ابتدا تعداد مکان های اشغال شده توسط یک نفره، دو نفره و ... افزایش و سپس کاهش می یابد. در مجموعه ها
در پ =پ س جذب به تراکم تبدیل می شود.
هیچ تعامل افقی وجود ندارد.
برای لایه اول، ایزوترم لانگمویر برآورده شده است.
سطح به عنوان مجموعه ای از مکان های جذب در نظر گرفته می شود. شرط تعادل دینامیکی معتبر است: میزان تراکم در مکان های آزاد برابر است با نرخ تبخیر از مکان های اشغال شده.
a ضریب تراکم (کسری از مولکول های متراکم شده روی سطح) است.
 ,
,
Zm - حداکثر تعداد صندلی رایگان.
 - فرکانس ارتعاشات اتمی در جهت عمود بر سطح.
- فرکانس ارتعاشات اتمی در جهت عمود بر سطح.
برای لایه اول، شرایط تعادل دینامیکی:



 ، سپس
، سپس
 - معادله لانگمویر
- معادله لانگمویر
برای لایه دوم درست خواهد بود: 
برای لایه i : 
برای سادگی، فرض می شود که a و ν برای همه لایه ها به جز لایه اول یکسان هستند. برای همه لایه ها به جز لایه اول، گرمای جذب ثابت است. برای لایه آخر، گرمای جذب برابر با گرمای تراکم است. در نتیجه معادله به دست آمد
 (*)
(*)
سی- ثابت،
در مورد نظریه BET، ثابت است باانرژی گیبس جذب خالص را مشخص می کند. معادله فقط شامل یک ثابت است و این معادله برای تعیین سطح ویژه جاذب نیز بسیار مهم است.
از آنجایی که گرما در نتیجه جذب آزاد می شود، مناطق سطح خاصی در دماهای پایین تعیین می شوند.
 ????????????
????????????


اشکال اصلی نظریه- غفلت از تعاملات افقی به نفع تعاملات عمودی.
معادله در محدوده برقرار است  از 0.05 تا 0.3.
از 0.05 تا 0.3.
جایی که  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0.3 - برهمکنش جذب - جذب تحت تأثیر قرار می گیرد.
> 0.3 - برهمکنش جذب - جذب تحت تأثیر قرار می گیرد.
حسابداری برای تعاملات جذب-جذب.
فعل و انفعالات زمانی رخ می دهد که مولکول ها یا مولکول های شاخه دار بر روی یک سطح غیر قطبی جذب شوند. قادر به تشکیل همکاران. در این حالت شکل ایزوترم های جذب تغییر می کند.
آ  جاذب قطبی نیست
جاذب قطبی نیست
نمودار 1 مربوط به برهمکنش های ضعیف جاذب-جاذب و برهمکنش های قوی جاذب-جاذب است.
نمودار 2 مربوط به برهمکنش های قوی جاذب-جاذب و برهمکنش های قوی جاذب-جاذب است.
نمودار 3 مربوط به برهمکنش قوی جاذب-جاذب و برهمکنش ضعیف جاذب-جاذب است.
 ,
,

در مورد برهمکنش بین مولکول های جاذب، لازم است تغییرات در ضرایب فعالیت در نظر گرفته شود. و این معادله به صورت زیر نوشته می شود:
 - معادله فرونکین، فاولر، گوگنهایم.
- معادله فرونکین، فاولر، گوگنهایم.
ک- ثابت جاذبه
نظریه بالقوه پلیانی
این نظریه هیچ نوع ایزوترم جذب را استخراج نمی کند، اما امکان محاسبه ایزوترم ها را در دمای متفاوت فراهم می کند.
جذب- این نتیجه جذب ماده جاذب به سطح جاذب به دلیل عمل پتانسیل جذب است که به حضور مولکول های دیگر بستگی ندارد و به فاصله بین سطح و مولکول جاذب بستگی دارد.
 ,
,
 - پتانسیل جذب
- پتانسیل جذب
از آنجایی که سطح غیر یکنواخت است، فاصله با حجم جذب جایگزین می شود  .حجم جذبحجم محصور شده بین سطح و نقطه مربوط به مقدار معین است
.حجم جذبحجم محصور شده بین سطح و نقطه مربوط به مقدار معین است  .
.
پتانسیل جذبکار انتقال 1 مول جاذب خارج از یک حجم جذب معین به یک نقطه معین از حجم جذب است (یا کار انتقال 1 مول بخار اشباع از یک ماده جاذب که در صورت عدم وجود جاذب در تعادل با یک ماده جاذب مایع است. وارد فاز بخار در حالت تعادل با جاذب).

منحنی مشخصه
 - پتانسیل جذب،
- پتانسیل جذب، 
برای یک جاذب معین و جاذب های مختلف، موارد زیر صادق است: 
برای انواع مختلف جاذب ها  ,
,
جایی که  پتانسیل برای ایزوترم های جذب در فشارهای نسبی
پتانسیل برای ایزوترم های جذب در فشارهای نسبی  برای جذب 1 و برای جذب 2. این نسبت یک مقدار ثابت است.
برای جذب 1 و برای جذب 2. این نسبت یک مقدار ثابت است.
 - ضریب میل ترکیبی
- ضریب میل ترکیبی
تئوری تراکم مویرگی.
سیر فرآیند جذب تا حد زیادی به ساختار جسم متخلخل بستگی دارد.
|
میکرو متخلخل | |
|
متخلخل انتقالی | |
|
درشت متخلخل |
در مورد جاذب های ریز متخلخل، میدان های نیروهای جذب با هم همپوشانی دارند. در مورد جاذب های ماکرو متخلخل، منافذ به عنوان کانال های انتقال عمل می کنند. فرآیندهای تراکم در اجسام متخلخل انتقالی بسیار مهم هستند. تراکم مویرگی در مقادیر مشخصی شروع می شود پو  ، زمانی که بخشی از انرژی سطح قبلاً جبران شده باشد. شرط لازم این است که سطح باید خود خیس شود. روند شرح داده شده است معادله تامپسون-کلوین.
، زمانی که بخشی از انرژی سطح قبلاً جبران شده باشد. شرط لازم این است که سطح باید خود خیس شود. روند شرح داده شده است معادله تامپسون-کلوین.

 - در مورد خیس شدن، مرکز انحنا در فاز گاز است.
- در مورد خیس شدن، مرکز انحنا در فاز گاز است.
در مورد تراکم مویرگی، ایزوترم جذب شکل هیسترتیک دارد. شاخه پایین مربوط به فرآیند جذب و شاخه بالایی مربوط به فرآیند دفع است.
همه انواع منافذ را می توان به سه نوع کاهش داد:
|
مخروطی |
استوانه ای با یک انتهای بسته |
استوانه ای با دو سر باز |
|
پر کردن فرآیند از پایین منافذ انجام می شود. ایزوترم جذب و ایزوترم دفع در این مورد منطبق هستند، زیرا فرآیند جذب از یک کره شروع می شود و فرآیند دفع نیز با ناپدید شدن برخی از کره ها آغاز می شود.
↓ |
هیسترزیس وجود ندارد. حرکت رو به جلو و معکوس با معادله توصیف می شود:
|
ته هیچ کجا وجود ندارد، پر شدن منافذ در امتداد دیواره های سیلندر می رود.
سیلندر: ایزوترم ظاهری هیستراتیک خواهد داشت.
↓ |
که در  در شرایط خیس شدن، تراکم در فشارهای پایینتر اتفاق میافتد که از نظر انرژی مطلوب است. از شاخه دفع، منحنی های توزیع اندازه منافذ به دست می آید.
در شرایط خیس شدن، تراکم در فشارهای پایینتر اتفاق میافتد که از نظر انرژی مطلوب است. از شاخه دفع، منحنی های توزیع اندازه منافذ به دست می آید.
حداکثر منحنی دیفرانسیل نسبت به نقطه عطف منحنی انتگرال به سمت چپ منتقل می شود. حجم کل منافذ کوچک کوچک است، اما دارای سطح وسیعی است. با افزایش اندازه منافذ، حجم آنها افزایش می یابد  ، و منطقه مانند است
، و منطقه مانند است  به همین دلیل یک جابجایی در حداکثر منحنی دیفرانسیل مشاهده می شود.
به همین دلیل یک جابجایی در حداکثر منحنی دیفرانسیل مشاهده می شود.
جذب در رابط جامد-مایع.
در مورد جذب در سطح مشترک گاز جامد، ما یک جزء را نادیده گرفتیم. در مورد جذب در سطح مشترک جامد و مایع، ماده جاذب مولکول های حلال را از سطح جاذب جابجا می کند.
 ,
,
معادله درست است:

 ,
,
N 1، N 2 - کسر مولی حلال و جزء، N 1 + N 2 = 1، سپس
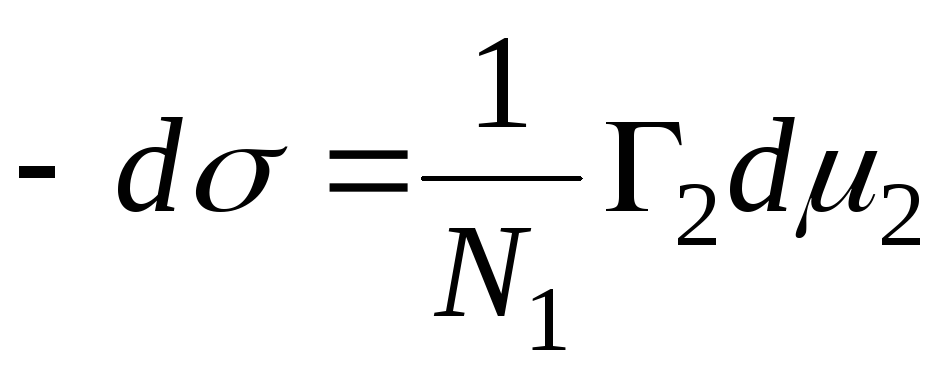 ,
=>
,
=>
 سپس معادله جذب برای رابط جامد-مایع است.
سپس معادله جذب برای رابط جامد-مایع است.
جذب (G) > 0 در  <
0
<
0
اگر مقادیر  برای جزء و حلال بسیار متفاوت است، در این مورد وابستگی جیاز جانب ندارای افراطی در ارزش است ن
~ 0,5.
برای جزء و حلال بسیار متفاوت است، در این مورد وابستگی جیاز جانب ندارای افراطی در ارزش است ن
~ 0,5.
E  اگر
اگر  مقادیر نزدیک دارند، در این حالت ممکن است علامت جذب تغییر کند. اعتیاد جیاز جانب ناز محور x عبور می کند
مقادیر نزدیک دارند، در این حالت ممکن است علامت جذب تغییر کند. اعتیاد جیاز جانب ناز محور x عبور می کند
تابع نقطه تقاطع جی(ن) با محور x نامیده می شود آزئوتروپ جذب. این بدان معنی است که این دو جزء نمی توانند روی یک جاذب معین از هم جدا شوند.
معادله ایزوترم جذب با ثابت مبادله.
در طول جذب در سطح مشترک جامد و مایع، توزیع مجدد ثابت اجزاء بین سطح جاذب و حجم محلول رخ می دهد.
 - اجزاء (- - به سطح مراجعه کنید)
- اجزاء (- - به سطح مراجعه کنید)

 ,
,
 ,
, .
.
 ,
,


جذب در سطح مشترک مایع و گاز
آر  اجازه دهید تغییر در پروفایل غلظت را با عبور از سطح مشترک مایع و گاز در نظر بگیریم. بگذارید جزء 2 فرار باشد.
اجازه دهید تغییر در پروفایل غلظت را با عبور از سطح مشترک مایع و گاز در نظر بگیریم. بگذارید جزء 2 فرار باشد.
Cs - غلظت در لایه سطحی.
بر اساس تعریف جذب اضافی

اگر جزء فرار نباشد، مقدار جذب به صورت زیر نوشته می شود:
پ  ری
ری 

در معادله  ماهیت یک ماده با مشتقات آن توصیف می شود
ماهیت یک ماده با مشتقات آن توصیف می شود  .
.
ایزوترم کشش سطحی می تواند به شکل 1 یا 2 باشد:
1- سورفکتانت ها
2- سورفکتانت ها
فعالیت سطحی g توانایی مواد برای کاهش کشش سطحی در یک سیستم است.

 - ضخامت لایه سطحی
- ضخامت لایه سطحی
سی س- غلظت جزء در لایه سطحی
با– غلظت حجمی
برای سریال های همولوگ یک قانون وجود دارد:
 - قانون ترابو دوکلوس
- قانون ترابو دوکلوس
برای یک سری همولوگ، ایزوترم جذب به شکل زیر است:
به جای A می نویسیم G، زیرا جذب در لایه سطحی بیش از حد است.
ایزوترم کشش سطحی:

 - کشش سطحی یک حلال خالص.
- کشش سطحی یک حلال خالص.
 - معادله اساسی جذب
- معادله اساسی جذب
 - معادله لانگمویر
- معادله لانگمویر
بیایید با هم آنها را حل کنیم:

- معادله شیشکوفسکی
ب- ثابت برای سری همولوگ.
آ- هنگام حرکت از یک همولوگ به دیگری 3-3.5 برابر افزایش می یابد 
![]()
1 - منطقه با غلظت کم
![]()
2- غلظت متوسط
3- لایه تک مولکولی
سورفکتانت ها مولکول های دودوست هستند، به عنوان مثال. شامل یک گروه قطبی و یک رادیکال هیدروکربنی غیر قطبی است.
o قسمت قطبی مولکول است.
| - بخش غیر قطبی مولکول.
در یک حلال قطبی، جهت گیری مولکول های سورفکتانت به گونه ای است که قسمت قطبی مولکول رو به حلال باشد و قسمت غیر قطبی به سمت فاز گاز رانده شود.
در معادله شیشکوفسکی  ، برای سری همسانی ثابت است.
، برای سری همسانی ثابت است.
اثر سورفکتانت با شروع ظاهر می شود n> 5. در غلظت های بالاتر از غلظت لایه تک مولکولی، میسل شدن در محلول های سورفکتانت رخ می دهد.
میسل- به مجموعه ای از مولکول های سورفکتانت آمفیفیلیک گفته می شود که رادیکال های هیدروکربنی آن هسته تشکیل می دهند و گروه های قطبی به فاز آبی تبدیل می شوند.
توده میسلی – توده میسلی.
اچ  تعداد مولکول ها - تعداد تجمع.
تعداد مولکول ها - تعداد تجمع.
میسل های کروی
در مورد میسلی شدن، تعادل در محلول برقرار می شود
CMC - غلظت بحرانی تشکیل میسل.
از آنجایی که ما میسل را یک فاز جداگانه در نظر می گیریم:
برای یک سری همسانی یک معادله تجربی وجود دارد:
آ- انرژی انحلال گروه عاملی.
ب - افزایش پتانسیل جذب، کار جذب در واحد متیلن.
- افزایش پتانسیل جذب، کار جذب در واحد متیلن.
وجود یک هسته هیدروکربنی در میسل ها این فرصت را ایجاد می کند که ترکیباتی که در آب نامحلول هستند در محلول های آبی سورفکتانت ها حل شوند؛ این پدیده حل شدن نامیده می شود (آنچه حل می شود محلول است، سورفکتانت حل کننده است).
گل ممکن است کاملاً غیر قطبی باشد، ممکن است شامل هر دو بخش قطبی و غیر قطبی باشد و مانند یک مولکول سورفکتانت جهت گیری شود.
در هر صورت، در حین حل شدن، جرم میسلی و تعداد تجمع افزایش می یابد نه تنها به دلیل گنجاندن محلول، بلکه به دلیل افزایش تعداد مولکول های سورفکتانت لازم برای حفظ حالت تعادل.
انحلال موثرتر است، هر چه وزن مولکولی محلول کمتر باشد.

 ~ 72 mN\m.
~ 72 mN\m.
 ~ 33 mN\m.
~ 33 mN\m.
اثربخشی سورفکتانت ها به مقدار CMC بستگی دارد.
فشار لایه سطحی دو بعدی

→ -نیروهای کشش سطحی.
- فشار دو بعدی
لایه سطحی نیرویی است برابر با اختلاف کشش سطحی یک محلول سورفکتانت و یک حلال خالص که به سمت یک سطح تمیز هدایت می شود.
بین محلول و لایه سطحی تعادل برقرار می شود



در  منطقه ای وجود دارد که در آن
منطقه ای وجود دارد که در آن  به طور خطی به غلظت بستگی دارد.
به طور خطی به غلظت بستگی دارد.
G [mol/m2].
 -منطقه ای که توسط یک مول از یک ماده اشغال شده است
-منطقه ای که توسط یک مول از یک ماده اشغال شده است
سپس ایزوترم فشار دو بعدی شکل خواهد گرفت 
 - ایزوترم فشار دو بعدی.
- ایزوترم فشار دو بعدی.
اعتیاد  از S M:
از S M:

در  - فشار دو بعدی به شدت افزایش می یابد. در
- فشار دو بعدی به شدت افزایش می یابد. در  دو بعدی تغییر شکل داده و باعث رشد ناگهانی می شود
دو بعدی تغییر شکل داده و باعث رشد ناگهانی می شود  .
.
فیلمی که در هر دو طرف با فازهای یکسان محدود شده باشد، دو طرفه نامیده می شود. در این گونه فیلم ها حرکت دائمی مشروب مادر مشاهده می شود.
به فیلم هایی با ضخامت کمتر از 5 نانومتر، فیلم سیاه می گویند.

لایه های جذب باید دو ویژگی داشته باشند: ویسکوزیته و قابلیت حرکت آسان، سیالیت و کشسانی.
اثر Marangoni خود درمانی است.
مثلث گیبس،  - فشار بیش از حد
- فشار بیش از حد
فیلم کشیده شده است و با توجه به اینکه بخشی از مایع خارج شده است، سورفکتانت ها به سمت فضای آزاد هجوم می آورند. مثلث گیبس
اثر قدرت جذب اجسام.
همیشه یک لایه جذب روی سطح فیلم وجود دارد که پس از آن
معادله لانگمویر:


 به فشار دو بعدی
به فشار دو بعدی
 - آنالوگ معادله شیشکوفسکی
- آنالوگ معادله شیشکوفسکی
پدیده های الکتروکینتیکی دو لایه الکتریکی (EDL).
مدل گلمهولتز. نظریه گوی-چپمن.
1808 پرواز

U – لوله شکل، 2 الکترود را در آن فرو کنید. قانون رگ های ارتباطی نقض می شود و تغییر در سطح مایع در لوله رخ می دهد - پدیده های الکتروکینتیک.
پدیده های جنبشی:
الکتروفورز
الکترواسموز
جریان (جریان) پتانسیل
پتانسیل رسوب گذاری
1 و 2 زمانی بوجود می آیند که اختلاف پتانسیل اعمال شود؛ 3 و 4، پانچ و ته نشین شدن ذرات کلوئیدی باعث ایجاد اختلاف پتانسیل می شود.
الکترواسموز حرکت یک محیط پراکندگی نسبت به یک فاز پراکنده ثابت تحت تأثیر جریان الکتریکی است.
الکتروفورز - این حرکت ذرات فاز پراکنده نسبت به یک محیط پخش ثابت تحت تأثیر جریان الکتریکی است.
پ  علت بروز پدیده های الکتروکینتیکی جدا شدن فضایی بارها و پیدایش یک لایه الکتریکی دوتایی است.
علت بروز پدیده های الکتروکینتیکی جدا شدن فضایی بارها و پیدایش یک لایه الکتریکی دوتایی است.
لایه دوگانه الکتریکی یک خازن مسطح است، یک صفحه توسط یون های تعیین کننده پتانسیل و دیگری توسط یون های مخالف تشکیل می شود. یون ها به همان روشی آلوده می شوند که یون های تعیین کننده پتانسیل به حجم محلول فشار داده می شوند. فاصله بین صفحات  . پتانسیل به صورت خطی کاهش می یابد، اختلاف پتانسیل
. پتانسیل به صورت خطی کاهش می یابد، اختلاف پتانسیل  .
.
اختلاف پتانسیل خارجی باعث پیدایش مدول برشی می شود  یک جفت نیرو در واحد سطح است که در امتداد سطح جسم جامد اعمال می شود.
یک جفت نیرو در واحد سطح است که در امتداد سطح جسم جامد اعمال می شود.

در حالت تعادل، مدول برشی برابر با مدول اصطکاک ویسکوز است (  ).
).

در شرایط ما  ,
,

 - معادله گلمهولتز- اسمالوکوفسکی
- معادله گلمهولتز- اسمالوکوفسکی
 - سرعت خطی جابجایی فاز.
- سرعت خطی جابجایی فاز.
E- قدرت میدان الکتریکی
 - اختلاف پتانسیل بین صفحات
- اختلاف پتانسیل بین صفحات
 - تحرک الکتروفورتیک [m2 /(V*s)].
- تحرک الکتروفورتیک [m2 /(V*s)].
مدل هلمهولتز حرکت حرارتی مولکول ها را در نظر نمی گیرد. در واقع، توزیع یون ها در لایه دوگانه پیچیده تر است.
Gui و Chapman علل زیر را برای DES شناسایی کردند:
انتقال یک یون از یک فاز به فاز دیگر در صورت برقراری تعادل.
یونیزاسیون ماده فاز جامد
تکمیل سطح با یون های موجود در محیط پراکندگی.
قطبش از منبع جریان خارجی
لایه دوگانه الکتریکی ساختاری فازی یا پراکنده دارد. یون ها تمایل دارند به طور مساوی در سراسر لایه منتشر توزیع شوند.
لایه پراکنده متشکل از کنتراینون هاست که طول لایه با انرژی جنبشی آنها تعیین می شود. در دماهای نزدیک به صفر مطلق، یون های ضد تا حد ممکن به یون های تعیین کننده پتانسیل نزدیک هستند.
نظریه دانیا بر اساس دو معادله است:
معادله بولتزمن

 - در برابر نیروهای برهمکنش الکترواستاتیکی کار کنید.
- در برابر نیروهای برهمکنش الکترواستاتیکی کار کنید.
 - چگالی بار حجمی
- چگالی بار حجمی

معادله پواسون 
از آنجایی که ضخامت EDL بسیار کوچکتر از اندازه ذرات است و برای یک EDL مسطح مشتق با توجه به مختصات است.  و
و  لغو می شود.
لغو می شود. 
برای e y در y<<1 функцию можно разложить в ряд Маклорена:

اجازه دهید خودمان را به دو دوره از سریال محدود کنیم، سپس:


 - ضخامت DEL فاصله ای است که پتانسیل DEL در آن کاهش می یابد هیک بار.
- ضخامت DEL فاصله ای است که پتانسیل DEL در آن کاهش می یابد هیک بار.
هر چه دما کمتر باشد، کمتر است  . در T→0 - DEL مسطح. هر چه غلظت بیشتر باشد، من بیشتر، کمتر
. در T→0 - DEL مسطح. هر چه غلظت بیشتر باشد، من بیشتر، کمتر  .
.





 "-" به این معنی است که پتانسیل با فاصله کاهش می یابد. =>
"-" به این معنی است که پتانسیل با فاصله کاهش می یابد. =>
=>

 ,
,
 - پتانسیل به صورت تصاعدی کاهش می یابد.
- پتانسیل به صورت تصاعدی کاهش می یابد.
پتانسیل برای چگالی بار سطحی: 
شارژ سطحی یک شارژ حجمی با علامت مخالف است که در فاصله یکپارچه شده است.




=>


جایی که پتانسیل 2.7 برابر کاهش می یابد - 
ظرفیت دو لایه 
عیب تئوری این است که وجود لایه هلمهولتز در نظر گرفته نمی شود، یعنی. را در نظر نمی گیرد  از این رو خطاها در تعیین پارامترهای اصلی. همچنین تأثیر یونهای ماهیت متفاوت بر ضخامت لایه دوگانه الکتریکی را توضیح نمی دهد.
از این رو خطاها در تعیین پارامترهای اصلی. همچنین تأثیر یونهای ماهیت متفاوت بر ضخامت لایه دوگانه الکتریکی را توضیح نمی دهد.
نظریه استرن. ساختار یک میسل کلوئیدی
لایه دوگانه الکتریکی از دو قسمت متراکم و پراکنده تشکیل شده است. یک لایه متراکم در نتیجه تعامل یون های پتانسیل تشکیل با یون های جذب شده خاص تشکیل می شود. این یونها معمولاً تا حدی یا کاملاً کم آب هستند و میتوانند بار مشابه یا مخالف یونهای تعیینکننده پتانسیل داشته باشند. بستگی به نسبت انرژی برهمکنش الکترواستاتیک دارد  و پتانسیل جذب خاص
و پتانسیل جذب خاص  . یون های لایه متراکم ثابت هستند. قسمت دیگر یون ها در لایه انتشار قرار دارد، این یون ها آزاد هستند و می توانند به عمق محلول حرکت کنند، یعنی. از ناحیه ای با غلظت بیشتر به ناحیه ای با غلظت کمتر. چگالی بار کل از دو قسمت تشکیل شده است.
. یون های لایه متراکم ثابت هستند. قسمت دیگر یون ها در لایه انتشار قرار دارد، این یون ها آزاد هستند و می توانند به عمق محلول حرکت کنند، یعنی. از ناحیه ای با غلظت بیشتر به ناحیه ای با غلظت کمتر. چگالی بار کل از دو قسمت تشکیل شده است.

 - شارژ لایه هلمهولتز
- شارژ لایه هلمهولتز
 -شارژ لایه پراکنده
-شارژ لایه پراکنده
سطح دارای تعداد معینی از مراکز جذب است که هر یک با یک ضد یون برهم کنش دارند. ثابت چنین واکنش شبه شیمیایی برابر است با:

 ، جایی که
، جایی که  - کسر مولی از یون های ضد در محلول
- کسر مولی از یون های ضد در محلول
توزیع هلمهولتز
پتانسیل به صورت خطی کاهش می یابد
توزیع پتانسیل گوی. هیچ لایه متراکمی وجود ندارد، پتانسیل به صورت تصاعدی از مقدار کاهش می یابد 
توزیع استرن.
در ابتدا کاهش پتانسیل خطی و سپس نمایی است.
هنگامی که یک میدان الکتریکی در مورد الکتروفورز اعمال می شود، این ذره فاز جامد نیست که مستقیما حرکت می کند، بلکه ذره فاز جامد با لایه ای از یون ها آن را احاطه کرده است. DES شکل ذره فاز پراکنده را تکرار می کند. هنگامی که یک پتانسیل اعمال می شود، بخشی از لایه پراکنده کنده می شود. خط شکست نامیده می شود مرز لغزشی.
پتانسیل ایجاد شده در مرز لغزش در نتیجه جدا شدن بخشی از لایه منتشر نامیده می شود. پتانسیل الکتروکینتیکی(پتانسیل زتا  ).
).
یک ذره فاز پراکنده با یک لایه احاطه کننده از یون های ضد و یک لایه الکتریکی دوگانه نامیده می شود میسل.
قوانین نوشتن میسل های کلوئیدی:


1-1 الکترولیت شارژ
T - ذره فاز پراکنده.
AA مرز بین قطعات متراکم و پراکنده است.
BB - مرز لغزشی.
مرز لغزشی ممکن است با خط AA منطبق باشد یا نباشد.
مقدار pH که در آن پتانسیل زتا صفر است نامیده می شود نقطه ایزوالکتریک.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2 NaCl
1. CaCl اضافی 2
CaCl 2 ↔ Ca 2 + + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n - x)Cl - ) 2 ایکس + ایکس Cl - - نماد میسلی.
CaSO 4 متر - سنگدانه.
CaSO 4 m∙nCa 2+ – هسته.
CaSO 4 m∙nCa 2 + 2 ( n - x)Cl - - ذره.
2. Na 2 SO 4 اضافی
Na 2 SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - میسل
CaSO 4 متر - سنگدانه.
هسته CaSO 4 m∙nSO 4 2 + –.
CaSO 4 m∙nSO 4 2- 2 (n-x) Na + - ذره
معادله گلمهولتز - اسمولوچوفسکی

 - سرعت خطی جابجایی مرزی (در الکترواسموز).
- سرعت خطی جابجایی مرزی (در الکترواسموز).
 - اختلاف پتانسیل بین صفحات خازن (در الکترواسموز).
- اختلاف پتانسیل بین صفحات خازن (در الکترواسموز).


 - سرعت جریان حجمی محلول، اس- سطح مقطع سلول.
- سرعت جریان حجمی محلول، اس- سطح مقطع سلول.

E- قدرت میدان الکتریکی


 (برای الکترواسموز).
(برای الکترواسموز).
برای پتانسیل جریان:

 - پتانسیل
- پتانسیل
 - فشار روی غشا
- فشار روی غشا
به عنوان یک قاعده، مقادیر تحرک الکتروفورتیک و تحرک الکترواسموتیک کمتر از مقادیر محاسبه شده است. این اتفاق می افتد به دلیل:
اثر آرامش (هنگامی که یک ذره فاز پراکنده حرکت می کند، تقارن جو یونی شکسته می شود).
مهار الکتروفورتیک (ظهور اصطکاک اضافی در نتیجه حرکت یون های متقابل).
اعوجاج خطوط جریان در مورد ذرات رسانای الکتریکی.
رابطه کشش سطحی و پتانسیل. معادله لیپمن
تشکیل EDL به دلیل تمایل سیستم به کاهش انرژی سطحی خود به طور خود به خود اتفاق می افتد. در شرایط ثابت تیو پمعادله تعمیم یافته قانون اول و دوم ترمودینامیک به صورت زیر است:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1 معادله لیپمن.
- 1 معادله لیپمن.
 - چگالی بار سطحی
- چگالی بار سطحی
 - ظرفیت دیفرانسیل
- ظرفیت دیفرانسیل
 - معادله 2 لیپمن.
- معادله 2 لیپمن.
با- ظرفیت.
بیایید معادله 1 لیپمن و معادله اساسی جذب را حل کنیم:
 ,
,


 ، سپس
، سپس
 - معادله نرنست
- معادله نرنست
 ,
,
 ,
,




 - معادله منحنی الکتروکاپیلاری (ECC).
- معادله منحنی الکتروکاپیلاری (ECC).
که در  :
: ، ولی
، ولی 
سورفکتانت های کاتیونی (CPAS) شاخه کاتدی EKC را کاهش می دهند.
سورفکتانت های آنیونی (APS) شاخه آندی EKC را کاهش می دهند.
سورفکتانت های غیر یونی (NSAS) قسمت میانی ECC را کاهش می دهند.
پایداری سیستم های پراکنده فشار از هم گسسته
سیستم های پراکنده را می توان تقسیم کرد:
سیستم هایی که از نظر ترمودینامیکی ناپایدار هستند به دلیل انتقال به حالت فراپایدار می توانند از نظر جنبشی پایدار باشند.
دو نوع ثبات وجود دارد:
پایداری رسوب (نسبت به گرانش).
ثبات تجمعی (نسبت به چسبندگی)
انعقادفرآیند چسبندگی ذرات است که منجر به از دست دادن پایداری تجمع می شود. انعقاد می تواند در اثر تغییرات دما، pH، هم زدن و اولتراسوند ایجاد شود.
انعقاد متمایز می شود:
برگشت پذیر.
برگشت ناپذیر.
انعقاد با ورود الکترولیت ها اتفاق می افتد.
قوانین انعقاد:

فیلم- این بخشی از سیستم است که بین دو سطح سطحی قرار دارد.
فشار از هم گسستهزمانی اتفاق میافتد که ضخامت فیلم در نتیجه تعامل لایههای سطحی به شدت کاهش مییابد.

"-" - با کاهش ضخامت فیلم، فشار جدایی افزایش می یابد.
P 0 فشار در فاز حجیم است که ادامه لایه میانی است.
P 1 - فشار در فیلم.
تئوری ثبات. DLFO (Deryagin، Landau، Fairway، Overbeck).
بر اساس تئوری DLFO، فشار از هم گسسته دو جزء دارد:
الکترواستاتیک P E (مثبت، به دلیل نیروهای دافعه الکترواستاتیکی است). مربوط به کاهش انرژی گیبس با افزایش ضخامت لایه است.
مولکولی P M (منفی، به دلیل عمل نیروهای جاذبه). این ناشی از فشرده سازی فیلم در اثر نیروهای سطحی شیمیایی است، شعاع اثر نیروها دهم نانومتر با انرژی حدود 400 کیلوژول بر مول است.
کل انرژی تعامل:

 - سیستم به طور کلی پایدار است
- سیستم به طور کلی پایدار است
 - سیستم ناپایدار
- سیستم ناپایدار
پ  جزء مثبت
جزء مثبت
این افزایش به دلیل افزایش انرژی پتانسیل در هنگام فشرده شدن لایه های نازک است. برای فیلم هایی با ضخامت زیاد، انرژی یون اضافی جبران می شود و برابر است با اندرکنش انرژی در حجم محیط پراکندگی.
اگر  (
( - ضخامت فیلم،
- ضخامت فیلم،  - شعاع یونی) نازک شدن لایه منجر به ناپدید شدن و کاهش مولکول ها و یون ها با حداقل انرژی سطحی در آن می شود. تعداد ذرات مجاور کاهش می یابد، در نتیجه انرژی پتانسیل ذرات باقی مانده در فیلم افزایش می یابد.
- شعاع یونی) نازک شدن لایه منجر به ناپدید شدن و کاهش مولکول ها و یون ها با حداقل انرژی سطحی در آن می شود. تعداد ذرات مجاور کاهش می یابد، در نتیجه انرژی پتانسیل ذرات باقی مانده در فیلم افزایش می یابد.


نظریه DLVO برهمکنش ذرات را برهمکنش صفحات می داند.

ذرات برهم کنش ندارند



 - معادله لاپلاس،
- معادله لاپلاس،  ,
,


برای سطوح با بار ضعیف
برای سطوح با شارژ زیاد:

جزء مولکولی برهمکنش دو اتم است:
 ~
~
برهمکنش اتم با سطح:

بیایید دو رکورد بگیریم:
D  برای به دست آوردن جزء مولکولی، لازم است تمام انرژی های برهمکنش اتم های صفحه راست و چپ جمع شود.
برای به دست آوردن جزء مولکولی، لازم است تمام انرژی های برهمکنش اتم های صفحه راست و چپ جمع شود.
جایی که  - ثابت Hamaker (ماهیت اجسام متقابل را در نظر می گیرد).
- ثابت Hamaker (ماهیت اجسام متقابل را در نظر می گیرد).
که انرژی برهمکنش ذرات در یک سیستم را می توان با استفاده از منحنی های پتانسیل بیان کرد.
I - حداقل پتانسیل اولیه. این منطقه انعقاد برگشت ناپذیر است، نیروهای جذب غالب هستند.
II - منطقه پایداری تجمعی، نیروهای دافعه غالب هستند.
III - حداقل پتانسیل ثانویه (یا منطقه لخته سازی). یک لایه الکترولیت بین ذرات فاز پراکنده وجود دارد و ذرات را می توان جدا کرد و به منطقه پایداری تجمع منتقل کرد.

منحنی 1 - سیستم به طور کلی پایدار است.
منحنی 2 - پایدار در منطقه I، ناپایدار در منطقه II.
منحنی 3 - انعقاد در سیستم رخ داده است.
منحنی 4 - در نقطه 4 کل انرژی اندرکنش U=0،  ، این نقطه افراطی مربوط به آغاز انعقاد سریع است.
، این نقطه افراطی مربوط به آغاز انعقاد سریع است.
دو مورد وجود دارد:
1. سطوح کمی شارژ شده:
U = U E + U M = 0
 (1)
(1)
2)

 (2)
(2)



 - این ضخامت لایه مربوط به آغاز فرآیند انعقاد است.
- این ضخامت لایه مربوط به آغاز فرآیند انعقاد است.






 - برای سطوح با بار ضعیف
- برای سطوح با بار ضعیف
 سپس
سپس 
2. برای سطوح با شارژ بالا:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
بیایید مربع (3)

انعقاد:
در جذب خاص، یونها را میتوان در مقادیر فوقالعادهای جذب کرد تا سطح بتواند بار خود را تغییر دهد. سطح شارژ می شود.
در مورد جذب خاص، نه تنها یون های دارای علائم مخالف، بلکه از همان علامت نیز می توانند جذب شوند.
اگر یون هایی با همان علامت سطح جذب شوند، در لایه سطحی نه افت پتانسیل، بلکه افزایش آن وجود خواهد داشت.

انعقاد خنثی سازی (با مشارکت ذرات با بار ضعیف اتفاق می افتد و نه تنها به بار الکترولیت منعقد کننده، بلکه به پتانسیل در مرز لایه های متراکم و پراکنده نیز بستگی دارد).
نظریه اسمولوچوفسکی در مورد انعقاد سریع.

وابستگی سرعت انعقاد به غلظت الکترولیت.
I - میزان انعقاد پایین است،
II - سرعت انعقاد تقریباً متناسب با غلظت الکترولیت است.
III - منطقه انعقاد سریع، سرعت عملا مستقل از غلظت است.
مقررات اساسی:
سل اولیه تک پراکنده است، ذرات مشابه شکل کروی دارند.
همه برخوردهای ذرات موثر هستند.
وقتی دو ذره اولیه با هم برخورد می کنند، یک ذره ثانویه تشکیل می شود. ثانویه + اولیه = درجه سوم. اولیه، ثانویه، ثالثی - کثرت.
از نظر سینتیک شیمیایی، فرآیند انعقاد را می توان با این معادله توصیف کرد:
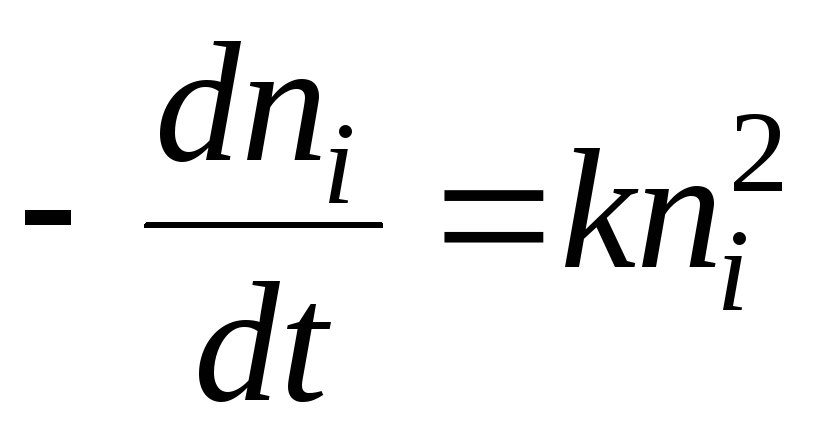
راه حل معادله خواهد بود: 
 - نیمی از زمان انعقاد این زمانی است که در طی آن تعداد ذرات سل 2 برابر کاهش می یابد.
- نیمی از زمان انعقاد این زمانی است که در طی آن تعداد ذرات سل 2 برابر کاهش می یابد.

 ,
,
 ,
,
 ,
,


با افزایش تعدد، حداکثر منحنی های انعقاد به سمت مقادیر بزرگتر تغییر می کند  .
.
ایرادات:
فرض تک پراکندگی.
فرض در مورد اثربخشی همه برخوردها.




 - کره،
- کره، ,
,





