آلکن ها از نظر شیمیایی فعال هستند. خواص شیمیایی آنها تا حد زیادی با حضور یک پیوند دوگانه تعیین می شود. متداولترین واکنشها برای آلکنها، واکنشهای افزودن الکتروفیلی و افزودن رادیکال هستند. واکنش های افزودن هسته دوست معمولاً نیاز به حضور یک هسته دوست قوی دارد و برای آلکن ها معمول نیست. آلکن ها به راحتی تحت واکنش های اکسیداسیون و افزودن قرار می گیرند و همچنین قادر به جایگزینی رادیکال آلیل هستند.
واکنش های اضافه
هیدروژناسیون افزودن هیدروژن (واکنش هیدروژناسیون) به آلکن ها در حضور کاتالیزورها انجام می شود. اغلب از فلزات خرد شده استفاده می شود - پلاتین، نیکل، پالادیوم و غیره. در نتیجه آلکان های مربوطه (هیدروکربن های اشباع شده) تشکیل می شوند.
$CH_2=CH_2 + H2 → CH_3–CH_3$
افزودن هالوژن ها آلکن ها به راحتی و در شرایط عادی با کلر و برم واکنش می دهند و دی هالوآلکان های مربوطه را تشکیل می دهند که در آن اتم های هالوژن در اتم های کربن مجاور قرار دارند.
یادداشت 1
هنگامی که آلکن ها با برم برهم کنش می کنند، برم تغییر رنگ داده و به رنگ زرد مایل به قهوه ای تبدیل می شود. این یکی از قدیمیترین و سادهترین واکنشهای کیفی برای هیدروکربنهای غیراشباع است، زیرا آلکینها و آلکادینها نیز به طور مشابه واکنش نشان میدهند.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
افزودن هالیدهای هیدروژن هنگامی که هیدروکربن های اتیلن با هالیدهای هیدروژن ($HCl$, $HBr$) واکنش می دهند، هالوآلکان ها تشکیل می شوند؛ جهت واکنش به ساختار آلکن ها بستگی دارد.
در مورد اتیلن یا آلکن های متقارن، واکنش افزودن به طور واضح رخ می دهد و منجر به تشکیل تنها یک محصول می شود:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
در مورد آلکن های نامتقارن، تشکیل دو محصول مختلف واکنش افزودن ممکن است:
تبصره 2
در واقع، به طور عمده تنها یک محصول واکنش تشکیل می شود. الگویی در جهت چنین واکنش هایی توسط شیمیدان روسی V.V. مارکونیکوف در سال 1869 به آن حکومت مارکوفنیکوف می گویند. هنگامی که هالیدهای هیدروژن با آلکنهای نامتقارن واکنش میدهند، یک اتم هیدروژن در محل شکاف پیوند دوگانه روی هیدروژنهترین اتم کربن، یعنی قبل از اتصال به تعداد زیادی اتم هیدروژن، اضافه میشود.
مارکوفنیکوف این قاعده را بر اساس داده های تجربی فرموله کرد و تنها بعداً توجیه نظری دریافت کرد. واکنش پروپیلن با کلرید هیدروژن را در نظر بگیرید.
یکی از ویژگی های باند $p$ توانایی آن در قطبی شدن آسان است. تحت تأثیر گروه متیل (اثر القایی مثبت + $I$) در مولکول پروپن، چگالی الکترونی پیوند $p$ به یکی از اتمهای کربن (= $CH_2$) تغییر میکند. در نتیجه یک بار منفی جزئی ($\delta -$) روی آن ظاهر می شود. یک بار مثبت جزئی ($\delta +$) روی اتم کربن دیگر پیوند دوگانه ظاهر می شود.
این توزیع چگالی الکترون در مولکول پروپیلن محل حمله پروتونی آینده را تعیین می کند. این اتم کربن گروه متیلن (= $CH_2$) است که دارای بار منفی جزئی $\delta-$ است. و بر این اساس، کلر به اتم کربن با بار مثبت جزئی $\delta+$ حمله می کند.
در نتیجه محصول اصلی واکنش پروپیلن با کلرید هیدروژن 2-کلروپروپان است.
هیدراتاسیون
هیدراتاسیون آلکن ها در حضور اسیدهای معدنی رخ می دهد و از قانون مارکوفنیکوف پیروی می کند. محصولات واکنش الکل ها هستند
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
آلکیلاسیون
افزودن آلکان ها به آلکن ها در حضور یک کاتالیزور اسیدی ($HF$ یا $H_2SO_4$) در دماهای پایین منجر به تشکیل هیدروکربن هایی با وزن مولکولی بالاتر می شود و اغلب در صنعت برای تولید سوخت موتور استفاده می شود.
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
واکنش های اکسیداسیون
اکسیداسیون آلکن ها، بسته به شرایط و انواع معرف های اکسید کننده، هم با جدا شدن پیوند دوگانه و هم با حفظ اسکلت کربن می تواند رخ دهد:
واکنش های پلیمریزاسیون
مولکول های آلکن قادرند تحت شرایط خاصی با باز شدن پیوندهای $\pi$ و تشکیل دایمرها، تریمرها یا ترکیبات با وزن مولکولی بالا - پلیمرها به یکدیگر اضافه شوند. پلیمریزاسیون آلکن ها می تواند توسط یک رادیکال آزاد یا یک مکانیسم کاتیون-آنیون رخ دهد. از اسیدها، پراکسیدها، فلزات و غیره به عنوان آغازگر پلیمریزاسیون استفاده می شود، واکنش پلیمریزاسیون نیز تحت تأثیر دما، تابش و فشار انجام می شود. یک مثال معمولی پلیمریزاسیون اتیلن برای تشکیل پلی اتیلن است
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
واکنش های جایگزینی
واکنش های جایگزینی برای آلکن ها معمولی نیست. با این حال، در دماهای بالا (بیش از 400 درجه سانتی گراد)، واکنش های افزودن رادیکال، که برگشت پذیر هستند، سرکوب می شوند. در این حالت، جایگزینی اتم هیدروژن واقع در موقعیت آللیک با حفظ پیوند دوگانه امکان پذیر می شود.
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$
هایپر مارکت دانش >> شیمی >> شیمی پایه دهم >> شیمی: آلکن
غیراشباع شامل هیدروکربن های حاوی پیوندهای متعدد بین اتم های کربن در مولکول های آنها می شود. غیر اشباع آلکن ها، آلکین ها، آلکادین ها (پلین ها) هستند. هیدروکربن های حلقوی حاوی پیوند مضاعف در حلقه (سیکلوآلکن ها) و همچنین سیکلوآلکان هایی با تعداد کمی اتم کربن در حلقه (سه یا چهار اتم) نیز دارای ویژگی غیر اشباع هستند. خاصیت "غیر اشباع" با توانایی این مواد برای ورود به واکنش های افزودنی، در درجه اول هیدروژن، با تشکیل هیدروکربن های اشباع یا اشباع - آلکان ها مرتبط است.
ساختار
آلکنها غیرحلقهای هستند که در مولکول علاوه بر پیوندهای منفرد، یک پیوند دوگانه بین اتمهای کربن و مطابق با فرمول کلی CnH2n دارند.
آلکن ها نام دوم خود را - "الفین ها" با قیاس با اسیدهای چرب غیر اشباع (اولئیک، لینولئیک) دریافت کردند که بقایای آن بخشی از چربی های مایع - روغن ها (از روغن انگلیسی - روغن) است.
همانطور که می دانید اتم های کربنی که بین خود پیوند دوگانه دارند، در حالت هیبریداسیون sp 2 هستند. این بدان معنی است که یک اوربیتال s و دو p در هیبریداسیون دخیل هستند و یک اوربیتال p بدون هیبرید باقی می ماند. همپوشانی اوربیتال های هیبریدی منجر به تشکیل یک پیوند a می شود و به دلیل اوربیتال های هیبرید نشده اتم های کربن همسایه مولکول اتیلن، پیوند دوم تشکیل می شود. پ-ارتباط. بنابراین، یک پیوند دوگانه از یک پیوند Þ و یک پیوند p تشکیل شده است.
اوربیتال های ترکیبی اتم هایی که یک پیوند دوگانه تشکیل می دهند در یک صفحه قرار دارند و اوربیتال های تشکیل دهنده یک پیوند n عمود بر صفحه مولکول قرار دارند (شکل 5 را ببینید).
پیوند دوگانه (0.132 نانومتر) کوتاهتر از پیوند منفرد است و انرژی آن بالاتر است، یعنی قویتر است. با این وجود، وجود یک پیوند 7 گرمی متحرک و به راحتی قابل پلاریزه شدن منجر به این واقعیت می شود که آلکن ها از نظر شیمیایی فعال تر از آلکان ها هستند و قادر به انجام واکنش های افزودن هستند.
سری همولوگ اتن
آلکن های زنجیره مستقیم سری همولوگ اتن (اتیلن) را تشکیل می دهند.
C2H4 - اتن، C3H6 - پروپن، C4H8 - بوتن، C5H10 - پنتن، C6H12 - هگزن، و غیره.
ایزومریسم و نامگذاری
آلکن ها مانند آلکان ها با ایزومری ساختاری مشخص می شوند. همانطور که به یاد دارید ایزومرهای ساختاری در ساختار اسکلت کربنی با یکدیگر تفاوت دارند. ساده ترین آلکن که با ایزومرهای ساختاری مشخص می شود، بوتن است.
CH3-CH2-CH=CH2 CH3-C=CH2
ل
CH3
بوتن-1 متیل پروپن
نوع خاصی از ایزومری ساختاری ایزومری موقعیت پیوند دوگانه است:
CH3-CH2-CH=CH2 CH3-CH=CH-CH3
بوتن-1 بوتن-2
چرخش تقریباً آزاد اتمهای کربن حول یک پیوند کربن-کربن امکانپذیر است، بنابراین مولکولهای آلکان میتوانند شکلهای متنوعی به خود بگیرند. چرخش در اطراف پیوند دوگانه غیرممکن است، که منجر به ظهور نوع دیگری از ایزومریسم در آلکن ها - هندسی، یا ایزومریسم سیس ترانس
ایزومرهای سیس با ایزومرهای قفسه سینه در آرایش فضایی قطعات مولکولی (در این مورد، گروههای متیل) نسبت به صفحه متفاوت هستند. پ-اتصالات و در نتیجه خواص.
آلکن ها به سیکلوآلکان ها ایزومر هستند (ایزومر بین طبقاتی) به عنوان مثال:
CH2 = CH-CH2-CH2-CH2-CH3
هگزن-1 سیکلوهگزان
نامگذاری آلکن هاکه توسط IUPAC ساخته شده است، مشابه نامگذاری آلکان ها است.
1. انتخاب مدار اصلی
شکل گیری نام هیدروکربن با تعریف زنجیره اصلی - طولانی ترین زنجیره اتم های کربن در مولکول آغاز می شود. در مورد آلکن ها، زنجیره اصلی باید دارای یک پیوند دوگانه باشد.
2. شماره گذاری اتم های زنجیره اصلی
شماره گذاری اتم های زنجیره اصلی از انتهایی که پیوند دوگانه به آن نزدیک است شروع می شود. به عنوان مثال، نام اتصال صحیح است
dn3-dn-dn2-dn=dn-dn3 dn3
5-متیل هگزن-2، نه 2-متیل هگزن-4، همانطور که انتظار می رود.
اگر موقعیت پیوند دوگانه نتواند شروع شماره گذاری اتم ها را در زنجیره تعیین کند، آنگاه با موقعیت جانشین ها به همان روشی که برای هیدروکربن های اشباع شده تعیین می شود.
CH3- CH2-CH=CH-CH-CH3
ل
CH3
2-متیل هگزن-3
3. تشکیل نام
نام آلکن ها نیز مانند نام آلکان ها شکل می گیرد. در انتهای نام، تعداد اتم کربنی که پیوند دوگانه با آن شروع می شود و پسوندی که نشان می دهد این ترکیب از کلاس آلکن ها، -ene است را مشخص کنید.
اعلام وصول
1. ترک خوردگی فرآورده های نفتی. در فرآیند ترک خوردگی حرارتی هیدروکربن های اشباع، همراه با تشکیل آلکان ها، تشکیل آلکن ها نیز رخ می دهد.
2. هیدروژن زدایی هیدروکربن های اشباع. هنگامی که آلکان ها در دمای بالا (400-600 درجه سانتیگراد) از روی یک کاتالیزور عبور می کنند، یک مولکول هیدروژن حذف می شود و یک آلکن تشکیل می شود: 
3. کم آبی الکل ها (حذف آب). اثر عوامل حذف کننده آب (H2804، Al203) بر روی الکل های تک هیدریک در دماهای بالا منجر به حذف یک مولکول آب و تشکیل یک پیوند دوگانه می شود:
این واکنش کم آبی درون مولکولی نامیده می شود (برخلاف کم آبی بین مولکولی که منجر به تشکیل اترها می شود و در § 16 "الکل ها" مورد بررسی قرار خواهد گرفت).
4. Dehydrohalogenation (حذف هیدروژن هالید).
هنگامی که یک هالوآلکان با یک قلیایی در محلول الکل واکنش می دهد، در نتیجه از بین بردن یک مولکول هیدروژن هالید یک پیوند دوگانه تشکیل می شود.
توجه داشته باشید که این واکنش عمدتا بوتن-2 را به جای بوتن-1 تولید می کند که مربوط به قانون زایتسف:
هنگامی که یک هالید هیدروژن از هالوآلکان های ثانویه و سوم حذف می شود، یک اتم هیدروژن از حداقل اتم کربن هیدروژنه حذف می شود.
5. هالوژن زدایی. هنگامی که روی بر روی مشتق دی بروم یک آلکان اثر می کند، اتم های هالوژن واقع در اتم های کربن همسایه حذف می شوند و یک پیوند دوگانه تشکیل می شود: 
مشخصات فیزیکی
سه نماینده اول سری همولوگ آلکن ها گازها هستند، مواد با ترکیب C5H10-C16H32 مایع هستند و آلکن های بالاتر جامد هستند.
نقطه جوش و ذوب به طور طبیعی با افزایش وزن مولکولی ترکیبات افزایش می یابد.
خواص شیمیایی
واکنش های اضافه
به یاد بیاوریم که یکی از ویژگی های متمایز نمایندگان هیدروکربن های غیر اشباع - آلکن ها توانایی وارد شدن به واکنش های افزودنی است. بیشتر این واکنش ها با مکانیسم افزودن الکتروفیلیک انجام می شود.
1. هیدروژنه شدن آلکن ها. آلکن ها قادر به افزودن هیدروژن در حضور کاتالیزورهای هیدروژناسیون - فلزات - پلاتین، پالادیوم، نیکل هستند:
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
این واکنش هم در فشار اتمسفر و هم در فشار بالا رخ می دهد و به دمای بالا نیاز ندارد، زیرا گرمازا است. هنگامی که دما افزایش می یابد، همان کاتالیزورها می توانند یک واکنش معکوس ایجاد کنند - هیدروژن زدایی.
2. هالوژناسیون (افزودن هالوژن ها). برهمکنش یک آلکن با آب برم یا محلول برم در یک حلال آلی (CCl4) منجر به تغییر رنگ سریع این محلول ها در نتیجه افزودن یک مولکول هالوژن به آلکن و تشکیل دی هالوآلکان می شود.
مارکونیکوف ولادیمیر واسیلیویچ
(1837-1904)
شیمیدان آلی روسی. (1869) قوانینی را در مورد جهت جایگزینی، حذف، افزودن در پیوند دوگانه و واکنش های ایزومریزاسیون بسته به ساختار شیمیایی فرموله کرد. او (از 1880) ترکیب نفت را مطالعه کرد و پایه های پتروشیمی را به عنوان یک علم مستقل پی ریزی کرد. (1883) دسته جدیدی از مواد آلی - سیکلو پارافین ها (نفتن ها) را کشف کرد.
3. هیدروهالوژناسیون (افزودن هالید هیدروژن).
واکنش افزودن هالید هیدروژن در زیر با جزئیات بیشتری مورد بحث قرار خواهد گرفت. این واکنش از قانون مارکوفنیکف پیروی می کند:
هنگامی که هالید هیدروژن به یک آلکن میچسبد، هیدروژن به اتم کربن هیدروژنهتر، یعنی اتمی که در آن اتمهای هیدروژن بیشتری وجود دارد، و هالوژن به اتم کمتر هیدروژنه میچسبد.
4. هیدراتاسیون (افزودن آب). هیدراتاسیون آلکن ها منجر به تشکیل الکل می شود. به عنوان مثال، افزودن آب به اتن زمینه ساز یکی از روش های صنعتی برای تولید الکل اتیلیک است:
CH2=CH2 + H2O -> CH3-CH2OH
اتان اتانول
توجه داشته باشید که یک الکل اولیه (با یک گروه هیدروکسی روی کربن اولیه) تنها زمانی تشکیل می شود که اتن هیدراته شود. هنگامی که پروپن یا سایر آلکن ها هیدراته می شوند، الکل های ثانویه تشکیل می شوند. 
این واکنش همچنین مطابق با قانون مارکوفنیکوف ادامه می یابد - یک کاتیون هیدروژن به یک اتم کربن هیدروژنه تر و یک گروه هیدروکسی به یک اتم هیدروژنه کمتر متصل می شود.
5. پلیمریزاسیون. یک مورد خاص از افزودن، واکنش پلیمریزاسیون آلکن ها است:
این واکنش اضافه از طریق مکانیسم رادیکال آزاد رخ می دهد.
واکنش های اکسیداسیون
مانند هر ترکیب آلی، آلکن ها در اکسیژن می سوزند و CO2 و H20 را تشکیل می دهند.
بر خلاف آلکان ها که در برابر اکسیداسیون در محلول ها مقاوم هستند، آلکن ها به راحتی توسط محلول های آبی پرمنگنات پتاسیم اکسید می شوند. در محلولهای خنثی یا کمی قلیایی، آلکنها به دیولها (الکلهای دیهیدریک) اکسید میشوند و گروههای هیدروکسیل به آن اتمهایی اضافه میشوند که قبل از اکسیداسیون بین آنها پیوند دوگانه وجود داشت.
همانطور که قبلاً می دانید ، هیدروکربن های غیر اشباع - آلکن ها می توانند وارد واکنش های اضافه شوند. بیشتر این واکنش ها با مکانیسم افزودن الکتروفیلیک انجام می شود.
اتصال الکتروفیلیک
واکنشهای الکتروفیل واکنشهایی هستند که تحت تأثیر الکتروفیلها رخ میدهند - ذراتی که فاقد چگالی الکترون هستند، به عنوان مثال، یک اوربیتال پر نشده. ساده ترین ذره الکتروفیل کاتیون هیدروژن است. مشخص است که اتم هیدروژن دارای یک الکترون در مدار سوم است. کاتیون هیدروژن زمانی تشکیل می شود که یک اتم این الکترون را از دست بدهد، بنابراین کاتیون هیدروژن اصلاً الکترونی ندارد:
Н· - 1е - -> Н +
در این مورد، کاتیون دارای میل الکترونی نسبتاً بالایی است. ترکیب این عوامل کاتیون هیدروژن را به یک ذره الکتروفیل نسبتا قوی تبدیل می کند.
تشکیل کاتیون هیدروژن در حین تفکیک الکترولیتی اسیدها امکان پذیر است:
НВr -> Н + + Вr -
به همین دلیل است که بسیاری از واکنش های الکتروفیل در حضور و مشارکت اسیدها رخ می دهد.
ذرات الکتروفیل، همانطور که قبلا ذکر شد، بر روی سیستم های حاوی مناطق با چگالی الکترون افزایش یافته عمل می کنند. نمونه ای از چنین سیستمی پیوند کربن-کربن چندگانه (دو یا سه گانه) است.
قبلاً می دانید که اتم های کربنی که بین آنها پیوند دوگانه تشکیل می شود در حالت هیبریداسیون sp 2 قرار دارند. اوربیتالهای p غیر هیبرید شده اتمهای کربن همسایه که در یک صفحه قرار دارند، همپوشانی دارند و تشکیل میدهند. پ-پیوند، که از استحکام کمتری نسبت به پیوند Þ برخوردار است و مهمتر از همه، به راحتی تحت تأثیر میدان الکتریکی خارجی قطبی می شود. این بدان معنی است که وقتی یک ذره با بار مثبت نزدیک می شود، الکترون های پیوند CS به سمت آن جابه جا می شوند و به اصطلاح پ-مجتمع
معلوم می شود پ- پیچیده و با افزودن یک کاتیون هیدروژن به پ- اتصالات به نظر می رسد کاتیون هیدروژن به چگالی الکترونی بیرون زده از صفحه مولکول برخورد می کند. پ-اتصال و به آن می پیوندد. ![]()
در مرحله بعد، جابجایی کامل جفت الکترون رخ می دهد پ- پیوند به یکی از اتم های کربن که منجر به ظهور یک جفت الکترون تنها روی آن می شود. اوربیتال اتم کربنی که این جفت روی آن قرار دارد و اوربیتال خالی کاتیون هیدروژن همپوشانی دارند که از طریق مکانیسم دهنده-گیرنده منجر به تشکیل پیوند کووالانسی می شود. اتم کربن دوم هنوز یک اوربیتال پر نشده دارد، یعنی یک بار مثبت.
ذره به دست آمده را کربوکاتیون می نامند زیرا دارای بار مثبت روی اتم کربن است. این ذره می تواند با هر آنیونی ترکیب شود، ذره ای که دارای یک جفت الکترون تنها، یعنی یک هسته دوست است.
اجازه دهید مکانیسم واکنش افزودن الکتروفیل را با استفاده از مثال هیدروبرومیناسیون (افزودن برمید هیدروژن) اتن در نظر بگیریم:
СН2= СН2 + НВг --> СНВr-СН3
واکنش با تشکیل یک ذره الکتروفیل - یک کاتیون هیدروژن، که در نتیجه تفکیک یک مولکول هیدروژن برومید رخ می دهد، آغاز می شود.
حملات کاتیون های هیدروژن پ- اتصال، تشکیل پ- مجموعه ای که به سرعت به کربوکاتیون تبدیل می شود: 
حال بیایید به یک مورد پیچیده تر نگاه کنیم.
واکنش افزودن هیدروژن برومید به اتن بدون ابهام ادامه دارد و برهمکنش هیدروژن برومید با پروپن از نظر تئوری می تواند دو محصول ایجاد کند: 1-بروموپروپان و 2-برومپروپان. داده های تجربی نشان می دهد که 2-بروموپروپان عمدتا تولید می شود.
برای توضیح این موضوع، باید ذره میانی - کربوکاتیون را در نظر بگیریم.
افزودن یک کاتیون هیدروژن به پروپن می تواند منجر به تشکیل دو کربوکاتیون شود: اگر یک کاتیون هیدروژن به اتم کربن اول، اتم واقع در انتهای زنجیره بپیوندد، آنگاه کاتیون دوم دارای بار مثبت خواهد بود، به عنوان مثال، در مرکز مولکول (1)؛ اگر به اتم دوم بپیوندد، اتم اول دارای بار مثبت خواهد بود (2). 
جهت ترجیحی واکنش به این بستگی دارد که کدام کربوکاتیون در محیط واکنش فراوانتر است، که به نوبه خود توسط پایداری کربوکاتیون تعیین می شود. این آزمایش تشکیل غالب 2-بروموپروپان را نشان می دهد. این بدان معنی است که تشکیل کربوکاتیون (1) با بار مثبت روی اتم مرکزی به میزان بیشتری رخ می دهد.
پایداری بیشتر این کربوکاتیون با این واقعیت توضیح داده می شود که بار مثبت روی اتم کربن مرکزی با اثر القایی مثبت دو گروه متیل جبران می شود، که اثر کل آنها از اثر +/- یک گروه اتیل بیشتر است:
قوانین واکنش های هیدروهالوژناسیون آلکن ها توسط شیمیدان مشهور روسی V.V. Markovnikov، شاگرد A.M. Butlerov مورد مطالعه قرار گرفت، که همانطور که در بالا ذکر شد، قاعده ای را تنظیم کرد که نام او را دارد.
این قاعده به صورت تجربی، یعنی تجربی ایجاد شد. در حال حاضر می توان توضیحی کاملا قانع کننده برای آن ارائه داد.
جالب توجه است که سایر واکنشهای افزودن الکتروفیل نیز از قانون مارکوفنیکوف پیروی میکنند، بنابراین درست است که آن را به شکل کلیتر فرموله کنیم.
در واکنشهای افزودن الکتروفیلیک، یک الکتروفیل (ذرهای با اوربیتال پر نشده) به اتم کربن هیدروژنهتر و یک هسته دوست (ذرهای با یک جفت الکترون تنها) به یک اتم هیدروژنهتر اضافه میکند.
بسپارش
یک مورد خاص از واکنش افزودن، واکنش پلیمریزاسیون آلکن ها و مشتقات آنها است. این واکنش با مکانیسم افزودن رادیکال آزاد انجام می شود:
پلیمریزاسیون در حضور آغازگرها - ترکیبات پراکسید، که منبع رادیکال های آزاد هستند، انجام می شود. ترکیبات پراکسید موادی هستند که مولکول های آنها شامل گروه -O-O- است. ساده ترین ترکیب پراکسید، پراکسید هیدروژن HOOH است.
در دمای 100 درجه سانتی گراد و فشار 100 مگاپاسکال، همولیز پیوند ناپایدار اکسیژن-اکسیژن و تشکیل رادیکال ها - آغازگرهای پلیمریزاسیون - رخ می دهد. تحت تأثیر رادیکال های KO، پلیمریزاسیون آغاز می شود که به عنوان یک واکنش افزودن رادیکال آزاد ایجاد می شود. رشد زنجیره زمانی متوقف می شود که نوترکیبی رادیکال ها در مخلوط واکنش رخ می دهد - زنجیره پلیمر و رادیکال ها یا COCH2CH2-.
با استفاده از واکنش پلیمریزاسیون رادیکال آزاد مواد حاوی پیوند دوگانه، تعداد زیادی ترکیب با وزن مولکولی بالا بدست می آید: 
استفاده از آلکن ها با جایگزین های مختلف، سنتز طیف وسیعی از مواد پلیمری با طیف وسیعی از خواص را ممکن می سازد. 
همه این ترکیبات پلیمری به طور گسترده در زمینه های مختلفی از فعالیت های انسانی استفاده می شود - صنعت، پزشکی، برای ساخت تجهیزات آزمایشگاه های بیوشیمیایی استفاده می شود، برخی از آنها واسطه برای سنتز سایر ترکیبات مولکولی بالا هستند.
اکسیداسیون
قبلاً می دانید که در محلول های خنثی یا کمی قلیایی، اکسیداسیون آلکن ها به دیول ها (الکل های دی هیدریک) رخ می دهد. در یک محیط اسیدی (محلول اسیدی شده با اسید سولفوریک)، پیوند دوگانه به طور کامل از بین می رود و اتم های کربنی که پیوند دوگانه بین آنها وجود داشت به اتم های کربن گروه کربوکسیل تبدیل می شوند: 
برای تعیین ساختار آنها می توان از اکسیداسیون مخرب آلکن ها استفاده کرد. به عنوان مثال، اگر اسیدهای استیک و پروپیونیک در طی اکسیداسیون یک آلکن خاص به دست آید، این بدان معنی است که پنتن-2 تحت اکسیداسیون قرار گرفته است و اگر اسید بوتیریک و دی اکسید کربن به دست آید، هیدروکربن اصلی پنتن-1 است. .
کاربرد
آلکن ها به طور گسترده در صنایع شیمیایی به عنوان مواد اولیه برای تولید انواع مواد و مواد آلی استفاده می شوند.
به عنوان مثال، اتن ماده اولیه برای تولید اتانول، اتیلن گلیکول، اپوکسیدها و دی کلرواتان است.
مقدار زیادی اتن به پلی اتیلن تبدیل می شود که برای ساخت فیلم بسته بندی، ظروف غذاخوری، لوله ها و مواد عایق الکتریکی استفاده می شود.
گلیسیرین، استون، ایزوپروپانول و حلال ها از پروپن به دست می آیند. با پلیمریزاسیون پروپن، پلی پروپیلن به دست می آید که از بسیاری جهات بر پلی اتیلن برتری دارد: نقطه ذوب و مقاومت شیمیایی بالاتری دارد.
در حال حاضر، الیاف با خواص منحصر به فرد از پلیمرها - آنالوگ های پلی اتیلن تولید می شود. به عنوان مثال، الیاف پلی پروپیلن قوی تر از تمام الیاف مصنوعی شناخته شده است.
مواد ساخته شده از این الیاف امیدوار کننده هستند و به طور فزاینده ای در زمینه های مختلف فعالیت های انسانی مورد استفاده قرار می گیرند.

1. چه نوع ایزومری مشخصه آلکن هاست؟ فرمول ایزومرهای احتمالی پنتن-1 را بنویسید.
2. از چه ترکیباتی می توان به دست آورد: الف) ایزوبوتن (2-متیل پروپن). ب) بوتن-2؛ ج) بوتن-1؟ معادلات واکنش های مربوطه را بنویسید.
3. زنجیره تبدیل زیر را رمزگشایی کنید. ترکیبات A، B، C را نام ببرید. 4. روشی برای بدست آوردن 2-کلروپروپان از 1-کلروپروپان پیشنهاد کنید. معادلات واکنش های مربوطه را بنویسید.
5. روشی برای تصفیه اتان از ناخالصی های اتیلن پیشنهاد دهید. معادلات واکنش های مربوطه را بنویسید.
6- نمونه هایی از واکنش هایی که می توان برای تشخیص هیدروکربن های اشباع و غیر اشباع استفاده کرد، ذکر کنید.
7. برای هیدروژناسیون کامل 2.8 گرم آلکن، 0.896 لیتر هیدروژن (n.e.) مصرف شد. وزن مولکولی و فرمول ساختاری این ترکیب که دارای یک زنجیره معمولی از اتم های کربن است چیست؟
8. اگر معلوم شود که احتراق کامل 20 سانتی متر مکعب از این گاز به 90 سانتی متر مکعب (n.s.) اکسیژن نیاز دارد، چه گازی در سیلندر (اتن یا پروپن) وجود دارد؟
9*. هنگامی که یک آلکن با کلر در تاریکی واکنش می دهد، 25.4 گرم دی کلرید تشکیل می شود و هنگامی که این آلکن با همان جرم با برم در تتراکلرید کربن واکنش می دهد، 43.2 گرم دی برومید تشکیل می شود. تمام فرمول های ساختاری ممکن آلکن شروع را تعیین کنید.
تاریخچه کشف
از مواد فوق قبلاً فهمیدیم که اتیلن جد سری همولوگ هیدروکربن های غیراشباع است که دارای یک پیوند دوگانه است. فرمول آنها C n H 2n است و آلکن نامیده می شوند.
در سال 1669، پزشک و شیمیدان آلمانی بچر اولین کسی بود که اتیلن را از واکنش اسید سولفوریک با الکل اتیلیک بدست آورد. بچر دریافت که اتیلن از نظر شیمیایی فعال تر از متان است. اما متأسفانه در آن زمان دانشمند نتوانست گاز حاصل را شناسایی کند و به همین دلیل هیچ نامی برای آن قائل نشد.
کمی بعد شیمیدانان هلندی از همین روش برای تولید اتیلن استفاده کردند. و از آنجایی که هنگام تعامل با کلر، تمایل به تشکیل مایع روغنی داشت، بر این اساس نام "گاز نفت" را دریافت کرد. بعدها مشخص شد که این مایع دی کلرو اتان است.
در زبان فرانسه اصطلاح «روغن» oléfiant است. و پس از کشف هیدروکربن های دیگر از این نوع، Antoine Fourcroix، شیمیدان و دانشمند فرانسوی، اصطلاح جدیدی را معرفی کرد که در کل کلاس اولفین ها یا آلکن ها رایج شد.
اما قبلاً در آغاز قرن نوزدهم، شیمیدان فرانسوی J. Gay-Lussac کشف کرد که اتانول نه تنها از گاز "نفت" بلکه از آب نیز تشکیل شده است. علاوه بر این، همان گاز در اتیل کلرید کشف شد.
و اگرچه شیمیدانان تشخیص دادند که اتیلن از هیدروژن و کربن تشکیل شده است و از قبل ترکیب مواد را می دانستند، اما برای مدت طولانی نتوانستند فرمول واقعی آن را پیدا کنند. و تنها در سال 1862 E. Erlenmeyer موفق به اثبات وجود پیوند دوگانه در مولکول اتیلن شد. این را دانشمند روسی A.M. Butlerov نیز تشخیص داد و صحت این دیدگاه را به طور تجربی تأیید کرد.
وقوع در طبیعت و نقش فیزیولوژیکی آلکن ها
بسیاری از مردم به این سوال علاقه مند هستند که آلکن ها را در کجا می توان در طبیعت یافت. بنابراین، معلوم می شود که آنها عملا در طبیعت وجود ندارند، زیرا ساده ترین نماینده آن، اتیلن، هورمونی برای گیاهان است و فقط در مقادیر کم در آنها سنتز می شود.
درست است که در طبیعت چنین آلکنی مانند muskalur وجود دارد. این یکی از آلکن های طبیعی یک جاذبه جنسی مگس خانگی ماده است.
شایان ذکر است که با داشتن غلظت بالا، آلکن های پایین دارای اثر مخدر هستند که می توانند باعث تشنج و تحریک غشاهای مخاطی شوند.
کاربردهای آلکن ها
تصور زندگی جامعه مدرن امروزی بدون استفاده از مواد پلیمری دشوار است. از آنجایی که بر خلاف مواد طبیعی، پلیمرها خواص متفاوتی دارند، پردازش آنها آسان است و اگر به قیمت نگاه کنید، نسبتاً ارزان هستند. یکی دیگر از جنبه های مهم به نفع پلیمرها این است که بسیاری از آنها قابل بازیافت هستند.
آلکن ها کاربرد خود را در تولید پلاستیک، لاستیک، فیلم، تفلون، اتیل الکل، استالدئید و سایر ترکیبات آلی یافته اند.

در کشاورزی از آن به عنوان وسیله ای برای تسریع فرآیند رسیدن میوه ها استفاده می شود. از پروپیلن و بوتیلن برای تولید پلیمرها و الکل های مختلف استفاده می شود. اما در تولید لاستیک مصنوعی از ایزوبوتیلن استفاده می شود. بنابراین، می توان نتیجه گرفت که بدون آلکن ها غیرممکن است، زیرا آنها مهمترین مواد خام شیمیایی هستند.
مصارف صنعتی اتیلن
در مقیاس صنعتی، پروپیلن معمولاً برای سنتز پلی پروپیلن و برای تولید ایزوپروپانول، گلیسرول، بوتیرآلدئیدها و غیره استفاده می شود. هر سال تقاضا برای پروپیلن افزایش می یابد.

4.3.b. افزودن هالیدهای هیدروژن (هیدروهالوژناسیون)
یکی دیگر از واکنشهای افزودن الکتروفیلیک مهم به آلکنها، هیدروهالوژناسیون شناخته شده آلکنها است.
در زیر نمونه های معمولی از افزودن HCl، HBr و HI به آلکن های مختلف آورده شده است.


اثر جانشینهای آلکیل بر روی پیوند دوگانه بر سرعت افزودن با دنباله زیر توصیف میشود:
R 2 C=CHR > RCH=CHR > RCH=CH 2
این با مکانیزمی سازگار است که در آن مرحله تعیین کننده سرعت واکنش شامل تشکیل یک کربوکاتیون می شود زیرا پایداری کاتیون های آلکیل به ترتیب سوم > ثانویه > اولیه کاهش می یابد. بنابراین، مکانیسم افزودن باید شامل تشکیل یک واسطه کربوکاتیونی آزاد، که به ندرت مشاهده می شود، یا یک واسطه با ویژگی کربوکاتیونی باشد. مورد آخر معمول ترین است.
اگر افزودن از طریق یک "کربوکاتیون آزاد" اتفاق بیفتد، آنگاه واکنش کاملا غیر استریوانتخابی خواهد بود، زیرا کاتیون های آلکیل ساختاری مسطح دارند. با این حال، هیدروهالوژناسیون، به عنوان یک قاعده، به صورت استریو انتخابی پیش می رود، و بسته به نوع آلکن، انتخابی است. ضد-پیوست، انتخابی syn- یا مخلوط syn-ضد- الحاق
برای آلکن هایی که در آنها پیوند دوگانه به یک حلقه آروماتیک مزدوج نشده است، مشخصه ضد-افزودن هالید هیدروژن ضد-افزودن کلرید هیدروژن و برمید، کلرید دوتریوم و برمید برای سیکلوهگزن، سیکلوپنتن، 1،2-دی متیل هگزن، 1،2-دی متیل پنتن مشاهده شد. سیس- و ترنس-بوتن-2، هگزن-3 و بسیاری از آلکن ها و سیکلوآلکن های ساده دیگر.

در محصول اضافی، جایگزین های یکسان (گروه های متیل) در طرف های مختلف صفحه میانی حلقه سیکلوهگزان قرار دارند، بنابراین متعلق به ترنس-ردیف ضدسازگاری افزودن با مکانیزمی که در آن تشکیل یک کربوکاتیون گسسته فرض می شود دشوار است. برای یک کربوکاتیون مسطح، حمله هسته دوست توسط یون هالید به یک اندازه در هر دو طرف هواپیما محتمل است، که باید منجر به تشکیل مخلوطی از محصولات شود. syn- و ضد- الحاقات سینتیک هیدروهالوژناسیون آلکن نیز مکانیسم پیچیده تری را نشان می دهد. برای آلکن های غیر مزدوج، سرعت واکنش با یک معادله مرتبه سوم با مرتبه دوم در هالید هیدروژن توصیف می شود، به عنوان مثال، با مکانیسم Ad E 3 مطابقت دارد.
v = k [آلکن] 2
واکنش ضد افزودن و مرتبه دوم روی هالید هیدروژن به خوبی با مکانیسم Ad E 3 مطابقت دارد که در آن یک آلکن با دو مولکول هیدروژن هالید واکنش می دهد که یکی از آنها به عنوان یک عامل الکتروفیل و دیگری به عنوان یک عامل هسته دوست عمل می کند.

این مکانیسم سه مولکولی فرض می کند که در ابتدا کمپلکسی از یک مولکول آلکن و یک مولکول هیدروژن هالید تشکیل می شود و به دنبال آن مولکول HX دوم به این کمپلکس حمله می کند. ضد- اضلاع بدون تشکیل کربوکاتیون گسسته. به ویژه باید توجه داشت که هر مکانیسم سه مولکولی باید از دو مرحله متوالی تشکیل شود، زیرا برخورد سه مولکول به طور همزمان بسیار بعید است.

ضدافزودن نشان دهنده یک حمله هسته دوست ترجیحی توسط هالید هیدروژن از سمت مقابل به محل پروتونه شدن آلکن است. به جای یک هالید هیدروژن، عملکرد یک عامل هسته دوست در مرحله نهایی نیز می تواند توسط یک یون هالید انجام شود. در واقع، سرعت واکنش معمولاً به نسبت مستقیم با غلظت یون هالید وارد شده به مخلوط واکنش به شکل هالیدهای تترا آلکیلامونیوم NR 4 + X افزایش می یابد. - یا لیتیوم LiX در این مورد، stereospecific ضد- الحاق
برای آلکان هایی که در آنها پیوند دوگانه به یک حلقه معطر کونژوگه شده است، مشخصه است syn- الحاق یا مخلوط syn-ضد-افزودن هالید هیدروژن، به عنوان مثال:

Syn افزودن فرآیند غالب برای است سیس- و ترنسایزومرهای 1-فنیل پروپن، 1-فنیل-4-آلکیل سیکلوهگزن ها، آسنفتیلن، ایندن. هنگامی که چنین آلکنهایی پروتونه میشوند، کربوکاتیونهای نوع بنزیلی تشکیل میشوند که پایدارتر از کاتیونهای آلکیل خالص هستند که در طی پروتونه شدن آلکنها و سیکلوآلکنهای معمولی به وجود میآیند. سینتیک واکنش در این مورد معمولاً با یک معادله مرتبه دوم سادهتر v = k[alkene] توصیف میشود، یعنی با مکانیسم دو مولکولی Ad E 2 مطابقت دارد. Ad E 2-مکانیسم شامل تشکیل یک جفت یونی شامل یک کربوکاتیون و یک یون هالید است.

نمی توان انتظار داشت که مکانیسم افزودن شامل جفت یون بسیار انتخابی باشد. اگر یک جفت یون سریعتر از آن که بتواند حول یک پیوند کربن-کربن بچرخد به محصول نهایی تبدیل شود، نتیجه نهایی خواهد بود. syn-افزودن، که در آن یک پروتون و یک یون هالید در همان سمت پیوند دوگانه اضافه می شوند. در غیر این صورت تشکیل محصولاتی مانند syn- بنابراین ضد- اتصال NH. این مورد در طول هیدروهالوژناسیون رخ می دهد جفت-استایرن جایگزین Z-C 6 H 4 -CH=CH2. الگوی مشاهده شده در اینجا این است syn-افزودن فقط برای آن دسته از الفینهایی است که وقتی پروتونه میشوند، کربوکاتیون نسبتاً پایداری ایجاد میکنند، به عنوان مثال در مورد جایگزینهای دهنده Z.
واکنشهای هیدروهالوژناسیون که توسط مکانیسم Ad E 2 انجام میشوند، با رقابت بین فرآیندهای اضافه کردن مزدوج و بازآرایی مشخص میشوند، زیرا یک جفت کربوکاتیون یا یون به عنوان یک واسطه تشکیل میشود.

به عنوان نمونه ای از بازآرایی با مهاجرت 1،2 یک گروه آلکیل و یک یون هیدرید، ما به ترتیب واکنش های هیدروهالوژناسیون ترت-بوتیل اتیلن و ایزوپروپی اتیلن را ارائه می کنیم.

هنگامی که همان واکنش بدون حلال در سرما (0-78 درجه سانتیگراد) انجام می شود، مخلوطی از 33٪ محصولات طبیعی و 67٪ غیر طبیعی (باز گروه بندی شده) محصولات افزودنی تشکیل می شود.

4.3.c. گرایش. قانون مارکوفنیکف
بر خلاف الکتروفیل های متقارن (Hal 2)، هالیدهای هیدروژن معرف های الکتروفیل نامتقارن هستند. افزودن هر الکتروفیل نامتقارن (HBr، ICl، H2O، Hg(OAc)2، و غیره) به یک آلکن نامتقارن در اصل می تواند مخلوطی از دو محصول جایگزین ایجاد کند، اما در عمل تنها یکی از آنها معمولاً تشکیل می شود. به عنوان مثال، افزودن برومید هیدروژن به پروپیلن را در نظر بگیرید.

در سال 1870 V.V. مارکوفنیکوف یک قانون تجربی را فرموله کرد که بر اساس آن آلکن های نامتقارن HX را به گونه ای اضافه می کنند که محصولی ترجیحاً تشکیل می شود که در آن هیدروژن به انتهای کمترین جانشینی و X به انتهای پیوند دوگانه با بیشترین جانشینی اضافه می شود.
قاعده مارکوفنیکوف معمولاً با تفاوت در پایداری دو کربوکاتیون جایگزین توضیح داده می شود. به عنوان مثال، در مثال بالا، نرمال nپایداری کاتیون پروپیل بسیار کمتر از کاتیون ایزوپروپیل است و بنابراین واکنش در مسیر دوم ادامه می یابد.
قانون مارکوفنیکوف در اصل فقط برای موارد افزودن HX به بسترهای هیدروکربنی استفاده می شد، اما در اصل می توان آن را به واکنش های دیگر آلکن های جایگزین تعمیم داد. بنابراین، افزودن HCl به CF 3 CH=CH 2 می دهد ضد-Markovnikov" محصول CF 3 CH 2 CH 2 CL. این قابل انتظار بود، زیرا کاتیون CF 3 CH + CH 3 به دلیل اثر قوی (-I) از کاتیون CF 3 CH 2 CH 2 + پایداری کمتری دارد. گروه CF 3 کاتیون CF 3 CH 2 CH 2 + عمدتاً تشکیل می شود ، اما همچنین ، اگرچه به میزان کمتری ، توسط اثر القایی گروه CF 3 بی ثبات می شود ، در نتیجه افزودن HCl به تری فلوروماتیلن بسیار کندتر از افزودن به اتیلن جایگزین نشده است.
به یک دلیل مشابه، کاتیون های وینیل تری آلکیلامونیوم HBr را نیز بر خلاف قانون مارکونیکوف اضافه می کنند:
افزودن HX به آلکنهایی که دارای جانشینهای قوی (-I) و (-M) هستند، به عنوان مثال، به اکریلونیتریل یا نیترواتیلن، باید برخلاف قانون مارکوفنیکوف باشد. با این حال، در این مورد، پیوند دوگانه با توجه به معرف های الکتروفیل به شدت غیرفعال می شود که این واکنش ها فقط در شرایط بسیار سخت رخ می دهد. وینیل کلرید CH 2 =CHCl همیشه به طور انحصاری "افزونه های مارکوفنیکوف" می دهد. به عنوان مثال، هنگامی که با HCl واکنش می دهد، تنها 1،1-دی کلرواتان (دی کلرید جمینال) CH 3 CHCl 2 تشکیل می شود. کلر، مشابه گروه CF 3، دارای اثر (-I) قوی است و در نگاه اول به نظر می رسد که به همین دلیل افزودنی باید جهت گیری ضد مارکوونیکوف داشته باشد، زیرا کاتیون + CH 2 CH 2 Cl باید باشد. پایدارتر از کاتیون CH 3 CH + Cl. با این حال، بر خلاف گروه CF 3، کلر علاوه بر اثر (-I) دارای اثر متقابل (+M) نیز می باشد (زیرا دارای جفت های تنها است). تجربه نشان میدهد که بزرگی اثر مزومری برای کاهش انرژی کاتیون ۱-کلرواتیل به زیر سطح انرژی کاتیون ۲-کلرواتیل، که در آن اثر +M خود را نشان نمیدهد، کاملاً کافی است.
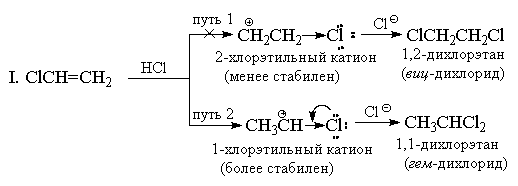
II. از دیدگاه تئوری رزونانس، ساختار کاتیون 1-کلرواتیل را می توان به صورت زیر نشان داد:
با این حال، افزودن به وینیل کلرید در شرایط یکسان آهستهتر از اتیلن اتفاق میافتد، به عنوان مثال، با توجه به اثر کلی (-I > + M)، کلر در مقایسه با هیدروژن و کاتیون 1-کلرواتیل، یک جایگزین الکترونکشنده باقی میماند. پایدارتر از C 2 H 5 + است. سایر وینیل هالیدها به روشی مشابه با HX واکنش می دهند.
وینیل اترها CH 2 = CHOR HX (X=Hal) را طبق قانون مارکوفنیکوف با نرخ بسیار بالاتری نسبت به همه آلکن های جایگزین ذکر شده در بالا اضافه می کنند. این به دلیل اثر +M قابل توجه گروه RO است. بر خلاف اتم کلر، گروه RO، از نظر اثر الکترونیکی کل (+M> -I)، یک جایگزین قوی الکترون دهنده است که به طور موثر مرکز کربوکاتیون همسایه را تثبیت می کند. ساختار کربوکاتیون در این مورد نیز می تواند به عنوان مجموعه ای از دو ساختار تشدید نشان داده شود
حمله کاتیون اکسونیوم توسط آنیون هالید منجر به تشکیل اترهای آلفا هالوژن از نوع CH3 CH(Hal)OR می شود.
4.3.g. هیدراتاسیون آلکن ها
هیدراتاسیون اسیدی آلکن ها منجر به تشکیل الکل می شود. جهت هیدراتاسیون آلکن ها با قانون مارکوفنیکف تعیین می شود، بنابراین فرض می شود که در این واکنش یک کربوکاتیون به عنوان ذره واسط تشکیل می شود.
تمایل کربوکاتیون های آلکیل ثانویه به ترتیب مجدد از استفاده از هیدراتاسیون آلکن ها برای تولید الکل های ثانویه جلوگیری می کند.

این روش فقط برای تهیه الکل های سوم کاربرد محدودی در آزمایشگاه پیدا کرده است. واکنش هیدراتاسیون در این مورد تا حد زیادی برگشت پذیر است و الکل های ثالثی در بازده کم (40-45٪) تشکیل می شوند.


هیدراتاسیون ساده ترین آلکن ها - اتیلن و پروپیلن - یک روش صنعتی مهم برای تولید الکل های اتیل و ایزوپروپیل است.

در عمل آزمایشگاهی، هیدراتاسیون مستقیم آلکن ها، هم به دلیل شرایط سخت و هم به دلیل تشکیل مقدار قابل توجهی از الکل های ایزومر، کاربرد گسترده ای پیدا نکرده است. در حال حاضر، واکنش مربوط به هیدروکسی مرکوراسیون - demercuration - معمولاً برای تولید انتخابی منطقه ای الکل ها از آلکن ها استفاده می شود.
4.3.d. هیدروکسی مرکوراسیون - عرق زدایی
حمله الکتروفیلیک به پیوند دوگانه یک آلکن می تواند توسط یون های فلزی انجام شود که در میان آنها کاتیون جیوه (II) موقعیت خاصی را اشغال می کند. استات جیوه در شرایط بسیار ملایم در دمای 20 درجه سانتیگراد به آلکنهای موجود در تتراهیدروفوران آبی (THF) یا اسید استیک آبی اضافه می کند تا ترکیبات ارگانومرکوری را تشکیل دهد. افزودن استات جیوه به پیوند دوگانه به طور خاص مطابق با قانون مارکوفنیکف انجام می شود، یعنی کاتیون جیوه به کمترین اتم کربن جایگزین می چسبد.
پیوند C-Hg در ترکیبات ارگانومرکوری را می توان به راحتی با اثر سدیم بوروهیدرید NaBH 4 جدا کرد و جیوه و یک پیوند C-H جدید را تشکیل داد. فرض بر این است که هیدرید آلکیل جیوه به عنوان یک واسطه ناپایدار به دست می آید، که بیشتر تجزیه می شود تا جیوه فلزی را با یک مکانیسم رادیکال آزاد کند.

در مجموع، این فرآیند دو مرحلهای از هیدروکسی مرکوراسیون-دمکوراسیون در نهایت نشاندهنده هیدراتاسیون منطقهای خاص یک آلکن بر اساس قانون مارکوفنیکوف در شرایط بسیار ملایم است، زمانی که تشکیل محصولات جانبی به حداکثر ممکن کاهش مییابد. این را می توان با استفاده از مثال های زیر به وضوح نشان داد که در آن بازده کل محصولات واکنش 90-98٪ است. داده های دیجیتالی داده شده در این مورد، بازده ترکیبات حاصل را نشان نمی دهد، بلکه نسبت آنها را در مخلوط نشان می دهد.




همانطور که از مثالهای بالا مشاهده میشود، هیدروکسی مرکوراسیون-دمرکوراسیون آلکنها در اکثر موارد هیدراتاسیون منطقهای خاص آلکنها را با تشکیل تقریباً تنها یکی از دو الکل ایزومر فراهم میکند. لازم به ذکر است که نیازی به جداسازی ترکیب ارگانومرکوری نیست و هر دو فرآیند را می توان مستقیماً یکی پس از دیگری انجام داد.
هیدروکسی مرکوراسیون آلکن های نامتقارن ظاهراً با حمله کاتیون AcOHg + و تشکیل به عنوان واسطه یک کاتیون جیوه حلقوی نامتقارن (آنالوگ یون هالوژنیوم نامتقارن) آغاز می شود که سپس در نتیجه حمله هسته دوست توسط آب در قسمت های مختلف باز می شود. اتم کربن جایگزین، که حامل بار مثبت بیشتری است.

یون جیوه پل زدن را می توان در یک محیط اسیدی غیر هسته دوست حتی در دمای 20 درجه سانتیگراد با افزودن یک عامل الکتروفیل قوی تر - تری فلورواستات جیوه در مخلوطی از اسید فلوروسولفونیک و پنتا فلوراید آنتیموان تثبیت کرد.

کاتیون جیوه را میتوان نه تنها با اثر آب، بلکه توسط دیگر حلالهای اهداکننده الکترون تجزیه کرد: الکلها، اسید استیک، استونیتریل و غیره. اسید استیک، به ترتیب، به عنوان مثال:


وقتی از الکلهای ثانویه یا سوم شاخهدار در واکنش آلکوکسی مرکوراسیون استفاده میشود، تری فلوئورواستات جیوه (OCOCF 3) 2 یا جیوه تریفلات جیوه (OSO 2 CF 3) 2 موثرتر از استات جیوه هستند.

بنابراین، هیدروکسی و آلکوکسی مرکوراسیون- demercuration یکی از بهترین روش های آماده سازی برای سنتز الکل ها و اترها با رادیکال های آلکیل شاخه ای است.
افزودن نمک های جیوه به آلکن ها بارزترین مثال از واکنش افزودن مزدوج به یک پیوند دوگانه است که در آن نقش یک عامل هسته دوست خارجی توسط یک حلال ایفا می شود. استریوشیمی فرآیند هیدروکسی مرکوراسیون دوگانه-دمکوراسیون به نتیجه استریوشیمیایی هر مرحله جداگانه بستگی دارد. هیدروکسی مرکوراسیون با ضد-افزودن، مانند واکنش های دیگر که شامل یک کاتیون حلقوی است. با این حال، حذف عصب رادیکال به شدت انتخابی نیست. بنابراین، کل فرآیند به عنوان یک کل نیز غیر استریو اختصاصی است.
4.3.e. افزودن آلکن ها (دیمرسازی کاتیونی و پلیمریزاسیون آلکن ها)
جالب ترین مثال از این نوع واکنش، دیمر شدن و پلیمریزاسیون ایزوبوتیلن در حضور اسید سولفوریک است.

نام فنی این مخلوط از آلکن ها "دی ایزوبوتیلن" است. این واکنش با مکانیسم کاتیونی مشابه مکانیسم افزودن اسیدهای معدنی به پیوند دوگانه آلکن ها انجام می شود. در مرحله اول، یک پروتون به یک مولکول ایزوبوتیلن متصل می شود تا یک مولکول نسبتاً پایدار تشکیل دهد. مالش-کاتیون بوتیل بیشتر شکل گرفت مالشکاتیون بوتیل (اسید لوئیس) با یک مولکول ایزوبوتیلن (باز لوئیس) واکنش می دهد تا یک کاتیون اکتیل سوم پایدار جدید را تشکیل دهد.

در این شرایط، تحت عمل بازها (یونهای H2O، HSO4 -)، کربوکاتیون اکتیل به سرعت یک پروتون را از دست میدهد و به مخلوطی از پنتنهای ایزومر تبدیل میشود، زیرا انتزاع پروتون از دو موقعیت مختلف اتفاق میافتد:

تشکیل ترجیحی یک آلکن با ثبات ترمودینامیکی کمتر - 2،4،4-تری متیل پنتن-1 (80٪ در مخلوط واکنش) با دسترسی فضایی بیشتر برای حمله توسط پایه اتم های هیدروژن گروه های متیل، در مقایسه با هیدروژن همراه است. اتم های گروه متیلن در صنعت، "دی ایزوبوتیلن" با Ni-Raney هیدروژنه می شود تا "ایزواکتان" (نام فنی هیدروکربن 2،2،4-تری متیل پنتان) تولید شود که به عنوان سوخت با اکتان بالا برای موتورهای احتراق داخلی استفاده می شود.
در غلظت های بالای اسید سولفوریک (بیش از 80%)، پلیمریزاسیون کاتیونی ایزوبوتیلن برای تشکیل پلیمری به نام پلی ایزوبوتیلن (-CH 2 C(CH 3) 2 -) n رخ می دهد. از این پلیمر لاستیک مانند برای تولید پوشش های ضد خوردگی و ضد آب، درزگیرها و ... استفاده می شود.
علاوه بر ایزوبوتیلن، 3-متیل بوتن-1، وینیل اترها و برخی از مشتقات استایرن که قادر به تشکیل کربوکاتیون های نسبتاً پایدار هستند، توسط مکانیسم کاتیونی پلیمریزه می شوند. هیدروژن فلوراید و اسیدهای لوئیس نیز به عنوان کاتالیزور برای پلیمریزاسیون کاتیونی استفاده می شوند: BF 3، AlCl 3، AlBr 3 و غیره در حضور مقادیر بسیار کمی آب.
4.3.g. افزودن آلکان ها (آلکیلاسیون آلکن ها)
روش صنعتی دیگر برای سنتز ایزواکتان مبتنی بر واکنش ایزوبوتیلن با ایزوبوتان اضافی در حضور اسید سولفوریک غلیظ یا در هیدروژن فلوراید بی آب در دمای 0 10 0 C است.

این واکنش همچنین توسط یک مکانیسم کاتیونی انجام می شود و آنچه به ویژه جالب است، نمونه ای از فرآیند کاتیونی زنجیره ای است. ابتدا ایزوبوتیلن تحت شرایط واکنش دیمر می شود و یک کاتیون اکتیل سوم (CH 3) 3 CCH 2 C + (CH 3) 2 را تشکیل می دهد. مکانیسم تشکیل آن به طور مفصل در بخش قبل توضیح داده شده است. سپس، انتقال سریع هیدروژن (به شکل یون هیدرید) از ایزوبوتان به کاتیون اکتیل برای تشکیل یک مولکول "ایزواکتان" و یک کاتیون ترت بوتیل جدید وجود دارد که به نوبه خود به سرعت با ایزوبوتیلن واکنش می دهد و یک ماده جدید تشکیل می دهد. کاتیون اکتیل و غیره

این روش آلکیلاسیون علاوه بر سنتز "ایزواکتان" در صنعت پتروشیمی برای سنتز هیدروکربن های شاخه دار با جوش بالا از آلکن های شاخه دار و آلکان های کم جوش با استفاده از کسر ترک حرارتی استفاده می شود.
آلکن ها
هیدروکربن هایی که در مولکول آنها علاوه بر پیوندهای σ ساده کربن-کربن و کربن-هیدروژن، پیوند π-کربن-کربن نیز وجود دارد. نامحدوداز آنجایی که تشکیل پیوند π به طور رسمی معادل از دست دادن دو اتم هیدروژن توسط مولکول است، هیدروکربن های غیر اشباع حاوی 2pاتم های هیدروژن کمتری نسبت به اتم های محدود کننده وجود دارد پ -تعداد پیوندهای π:
سری هایی که اعضای آن با (2H) n با یکدیگر تفاوت دارند نامیده می شود سریال ایزولوژیکبنابراین، در طرح فوق، ایزولوگ ها هگزان ها، هگزن ها، هگزادین ها، هگزین ها، هگزاترین ها و غیره هستند.
هیدروکربن های حاوی یک پیوند π (یعنی پیوند دوگانه) نامیده می شوند آلکن ها (الفین ها)یا به گفته اولین عضو سری - اتیلن، هیدروکربن های اتیلنفرمول کلی سری همولوگ آنها C p H 2l است.
1. نامگذاری
مطابق با قوانین IUPAC، هنگام ساخت نام آلکنها، طولانیترین زنجیره کربنی حاوی پیوند دوگانه، نام آلکان مربوطه را که در انتهای آن -anجایگزین توسط -en.شماره گذاری این زنجیره به گونه ای است که اتم های کربنی که در تشکیل پیوند دوگانه نقش دارند کمترین اعداد ممکن را دریافت می کنند:

رادیکال ها مانند آلکان ها نامگذاری و شماره گذاری می شوند.
برای آلکنهایی با ساختار نسبتاً ساده، نامهای سادهتر مجاز است. بنابراین، برخی از متداولترین آلکنها با افزودن پسوند نامگذاری میشوند -enبه نام یک رادیکال هیدروکربنی با اسکلت کربنی مشابه:
رادیکال های هیدروکربنی تشکیل شده از آلکن ها پسوند را دریافت می کنند -انیل.شماره گذاری در رادیکال از اتم کربن با ظرفیت آزاد شروع می شود. با این حال، برای ساده ترین رادیکال های آلکنیل، به جای نام های سیستماتیک، مجاز به استفاده از نام های بی اهمیت است:

اتم های هیدروژن که مستقیماً به اتم های کربن غیراشباع پیوند می خورند و یک پیوند دوگانه تشکیل می دهند اغلب نامیده می شوند اتم های هیدروژن وینیل،
2. ایزومریسم
علاوه بر ایزومر اسکلت کربن، ایزومری موقعیت پیوند دوگانه نیز در سری آلکن ها ظاهر می شود. به طور کلی این نوع ایزومریسم است ایزومری موقعیت جانشین (تابع)- در تمام مواردی که مولکول حاوی هر گروه عاملی است مشاهده می شود. برای آلکان C4H10، دو ایزومر ساختاری ممکن است:
برای آلکن C4H8 (بوتن)، سه ایزومر ممکن است:

بوتن-1 و بوتن-2 ایزومرهای موقعیت تابع هستند (در این مورد، نقش آن توسط یک پیوند دوگانه ایفا می شود).
ایزومرهای فضایی در آرایش فضایی جانشین ها نسبت به یکدیگر متفاوت هستند و نامیده می شوند. ایزومرهای سیس،اگر جانشین ها در همان سمت پیوند دوگانه قرار گیرند، و ایزومرهای ترانس،اگر در طرف مقابل:

3. ساختار یک پیوند دوگانه
انرژی برش یک مولکول در پیوند دوگانه C=C 611 کیلوژول بر مول است. از آنجایی که انرژی پیوند σ C-C 339 کیلوژول بر مول است، انرژی شکستن پیوند π تنها 611-339 = 272 کیلوژول بر مول است. الکترونهای π بسیار سبکتر از الکترونهای σ هستند و بهعنوان مثال، به تأثیر حلالهای قطبیکننده یا تأثیر هر معرف مهاجم حساس هستند. این با تفاوت در تقارن توزیع ابر الکترونی الکترونهای σ و π توضیح داده میشود. حداکثر همپوشانی اوربیتالهای p و بنابراین، حداقل انرژی آزاد مولکول تنها با ساختار مسطح قطعه وینیل و با فاصله کوتاهشده C-C برابر با 0.134 نانومتر، یعنی. به طور قابل توجهی کوچکتر از فاصله بین اتم های کربن متصل شده توسط یک پیوند واحد (0.154 نانومتر). با چرخش «نیمههای» مولکول نسبت به یکدیگر در امتداد محور پیوند دوگانه، درجه همپوشانی مداری کاهش مییابد که با مصرف انرژی مرتبط است. پیامد این امر عدم وجود چرخش آزاد در امتداد محور پیوند دوگانه و وجود ایزومرهای هندسی با جایگزینی مناسب در اتمهای کربن است.
آلکن ها- هیدروکربن های غیر اشباع که حاوی یک پیوند دوگانه هستند. نمونه هایی از آلکن ها:

روش های بدست آوردن آلکن ها
1. ترک خوردگی آلکان ها در 400-700 درجه سانتی گراد. واکنش از طریق مکانیسم رادیکال آزاد رخ می دهد:

2. هیدروژن زدایی آلکان ها:
3. واکنش حذف (حذف): 2 اتم یا 2 گروه اتم از اتم های کربن همسایه حذف می شوند و یک پیوند دوگانه ایجاد می شود. چنین واکنش هایی عبارتند از:
الف) آبگیری الکل ها (گرمایش بالای 150 درجه سانتیگراد با مشارکت اسید سولفوریک به عنوان معرف حذف کننده آب):
ب) حذف هالیدهای هیدروژن در مواجهه با محلول قلیایی الکلی:

اتم هیدروژن ترجیحاً از اتم کربنی که به اتم های هیدروژن کمتری (کمترین اتم هیدروژنه شده) پیوند دارد، جدا می شود - حکومت زایتسف.
ب) هالوژن زدایی:

خواص شیمیایی آلکن ها
خواص آلکن ها با حضور یک پیوند چندگانه تعیین می شود، بنابراین آلکن ها وارد واکنش های افزودن الکتروفیلی می شوند که در چندین مرحله رخ می دهد (H-X - معرف):
مرحله 1:

مرحله دوم:
 .
.
یون هیدروژن در این نوع واکنش متعلق به اتم کربنی است که بار منفی بیشتری دارد. توزیع چگالی:

اگر جانشین دهنده یک دهنده باشد که اثر +I- را نشان می دهد، چگالی الکترون به سمت هیدروژنه ترین اتم کربن تغییر می کند و یک بار تا حدی منفی روی آن ایجاد می کند. واکنش ها بر اساس قانون مارکوفنیکف: هنگام اتصال مولکول های قطبی مانند NH (HCl, HCN, HOHو غیره) به آلکن های نامتقارن، هیدروژن ترجیحاً به اتم کربن هیدروژنه تر در پیوند دوگانه متصل می شود.
الف) واکنش های افزایشی:
1) هیدروهالوژناسیون:
واکنش از قانون مارکوفنیکف پیروی می کند. اما اگر پراکسید در واکنش وجود داشته باشد، این قانون در نظر گرفته نمی شود:
2) آبرسانی واکنش از قانون مارکوفنیکوف در حضور اسید فسفریک یا سولفوریک پیروی می کند:

3) هالوژناسیون. در نتیجه، آب برم تغییر رنگ می دهد - این یک واکنش کیفی به یک پیوند چندگانه است:
4) هیدروژناسیون. واکنش در حضور کاتالیزورها انجام می شود.



