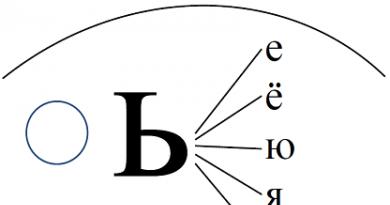عکس. 1. نمودارهای کانتور چگالی الکترون در H 2 +
سخنرانی شماره 4. مفهوم روش اوربیتال مولکولی. نمودارهای انرژی اوربیتال های مولکولی برای مولکول های هم هسته ای دوتایی. اوربیتال های مولکولی σ - و π-. مولکول های دی و پارامغناطیس پیوند یونی.
فعل و انفعالات بین مولکولی پیوند هیدروژنی.
روش پیوندهای ظرفیتی کاملاً به وضوح تشکیل و ساختار بسیاری از مولکول ها را توضیح می دهد، اما نمی تواند بسیاری از واقعیت ها را توضیح دهد، به عنوان مثال، وجود یون های مولکولی (H2 +، He2+) یا رادیکال ها (CH3، NH2)، پارامغناطیس مولکول ها با یک تعداد زوج الکترون ها (O2، NO)، که در چارچوب روش اوربیتال مولکولی (MMO) توضیح داده شده است.
روش اوربیتال مولکولی
روش مداری مولکولی که توسط مولیکن و هوند توسعه یافته است، بر این فرض استوار است که هر الکترون در یک مولکول در میدان تمام هستهها و الکترونهای اتمهایی است که مولکول را تشکیل میدهند و حالت آن با تابع موج Ψ مشخص میشود. ، اوربیتال مولکولی نامیده می شود. هر MO مربوط به یک تابع موج است که منطقه محتمل ترین باقی ماندن الکترون های یک انرژی خاص در یک مولکول را مشخص می کند. اوربیتال های s-، p-، d-، f اتمی مربوط به اوربیتال های مولکولی σ-، π-، δ-، ... هستند که مطابق با اصل پائولی، قانون هوند، اصل حداقل انرژی پر شده اند.
ساده ترین راه برای تشکیل یک اوربیتال مولکولی (MO) است
ترکیب خطی اوربیتال های اتمی (AO) (روش LCAO-MO).
اگر یک الکترون در میدان دو هسته اتمی A و B وجود داشته باشد، می توان آن را یا در یک هسته یا در هسته دیگر قرار داد و حالت آن را می توان با دو اوربیتال مولکولی Ψ و Ψ * که توسط یک خطی تشکیل شده اند توصیف کرد. ترکیبی از اوربیتال های اتمی:
Ψ = Ψ A + Ψ B و Ψ * = Ψ A - Ψ B
یک اوربیتال مولکولی، اگر مربوط به افزایش چگالی الکترون در ناحیه بین هستهها و در نتیجه افزایش جاذبه آنها باشد، Ψ پیوند نامیده میشود، و اگر چگالی الکترون بین هستهها کاهش یابد و در پشت هستهها افزایش پیدا کند، Ψ * شل میشود. ، که معادل افزایش دافعه هسته ها است. انرژی MO اتصال کمتر از انرژی AO اولیه است، انرژی MO در حال شل شدن بیشتر از انرژی اوربیتال اتمی اولیه است.
روی انجیر 1 نمودارهای کانتور چگالی الکترونی پیوند Ψ را نشان می دهد
(الف) و شل شدن Ψ * (ب) اوربیتال های مولکولی در ذره +H2.
همانطور که در MVS، تقارن اوربیتال های مولکولی در مورد خط پیوند منجر به تشکیل σ - MO، در جهت عمود بر خط پیوند، - π - MO می شود.
هنگامی که اوربیتال های d همپوشانی دارند، δ-
روی انجیر شکل 2 شکل گیری MOs - پیوند و σ - سست را با ترکیبی از اوربیتال های اتمی مختلف نشان می دهد. 3 به ترتیب π -MO و π* - MO.
همپوشانی اوربیتال های s منجر به تشکیل دو اوربیتال مولکولی می شود: پیوند σs و شل شدن σ*s.
همپوشانی اوربیتال های p منجر به تشکیل شش اوربیتال مولکولی با تقارن های مختلف می شود. از دو اوربیتال p از اتم های برهم کنش، که در امتداد خط ارتباطی هدایت می شوند، به عنوان مثال، محور X، اوربیتال های پیوند σ p z - و سست شدن σ * p z - در امتداد محورهای Z و Y - πρ z - و πp y تشکیل می شوند. - اتصال و π * р z - و π* p y - شل شدن MO.

جمعیت MO با الکترون ها مطابق با اصل پائولی، اصل کمترین انرژی و قانون هوند اتفاق می افتد.
برنج. 2. تشکیل اوربیتال های مولکولی σ - پیوند و σ - سست کننده
با توجه به این واقعیت که برای اوربیتال های یک نوع، اندازه ناحیه همپوشانی اوربیتال ها در سری σ > π > δ کاهش می یابد، سپس تقسیم سطوح انرژی در طول تشکیل MO از AO به همان ترتیب کاهش می یابد (شکل . 4)، که منجر به تغییر در ترتیب پر شدن σр - و π - MO در مولکول ها می شود.
الکترون های جفت نشدهبا چرخش های یکسان، به عنوان مثال B، C، N و همتایان الکترونیکی آنها، دنباله پر کردن MO به شرح زیر است:
σ(1s)< σ* (1s) < σ(2s) < σ* (2s) < π (2pz )= π (2py ) < σ(2px ) < π* (2pz )= π* (2py ) < σ* (2px )....

برنج. 3. تشکیل اوربیتال های مولکولی π - پیوند و π - سست کننده
برنج. 4. کاهش درجه تقسیم سطوح انرژی در سری σ > π > δ
برای مولکولهای دواتمی همهستهای دورههای دوم و بعدی، که در آن سطوح فرعی p از اتمها پر میشوند. الکترون های جفت شدهبا اسپین های ضد موازی، به عنوان مثال (O - Ne) و همتایان الکترونیکی آنها، دنباله پر کردن MO تا حدودی تغییر می کند:
σ(1s)< σ* (1s) < σ(2s) < σ* (2s) < σ(2px ) < π (2pz )= π (2py ) < π* (2pz )= π* (2py ) < σ* (2px )....
پیکربندی الکترونیکی یک مولکول را می توان به صورت نمودار انرژی یا فرمول الکترونیکی نشان داد.
روی انجیر شکل 5 نمودار انرژی اوربیتال های مولکولی را برای مولکول هیدروژن H2 نشان می دهد که فرمول الکترونیکی آن به صورت زیر نوشته شده است: [σ(1s)]2 یا (σ 1s )2.

برنج. 5. نمودار انرژی مولکول H 2
پر شدن σ 1s اوربیتال مولکولی پیوندی منجر به افزایش چگالی الکترون بین هسته ها می شود و وجود مولکول H2 را تعیین می کند.
روش MO احتمال وجود یون هیدروژن مولکولی H2 + و عدم امکان وجود مولکول He2 را اثبات می کند، زیرا در مورد دوم، پر شدن اوربیتال های پیوندی σ 1s با دو الکترون منجر به این نمی شود. تغییر در انرژی اتم های جدا شده: [(σ 1s )2 (σ * 1s )2 ] (شکل 6). بنابراین، مولکول He2 وجود ندارد.
برنج. 6. نمودار انرژی تایید کننده عدم امکان وجود مولکول He2
روی انجیر شکل 7 نمودار انرژی اوربیتالهای مولکولی را نشان میدهد که از همپوشانی اوربیتالهای s و p سطح انرژی دوم برای مولکولهای هم هستهای دواتمی از نوع A2 تشکیل شدهاند.
فلشها تغییر ترتیب اشغال MO مولکولهای تشکیلشده توسط اتمها را نشان میدهند، که در آن سطح فرعی 2p با الکترونهای جفتنشده (B2، C2، N2) پر شده است، که پیوند π st (2py ) و π st ( 2pz در زیر σst (2px) و الکترون های زوجی (O2 , F2 , Ne2 ) قرار دارند که پیوند π st (2py ) و π st (2pz ) بالای σst (2px ) قرار دارند.

برنج. شکل 7. نمودار انرژی MO برای مولکول های هم هسته دوره دوم (فلش ها تغییر در ترتیب پر شدن پیوند σ- و π-MO را نشان می دهد)
در MMO از مفهوم استفاده می شود - ترتیب پیوند، که به عنوان تفاوت بین تعداد الکترون ها در MO پیوند و تعداد الکترون ها در MO در حال شل شدن، تقسیم بر تعداد اتم های تشکیل دهنده پیوند تعریف می شود.
N − N* |
||||||||
برای مولکول های دو اتمی، ترتیب پیوند n برابر است با: n = |
جایی که N عدد است |
|||||||
الکترونهای روی MO باند، N* تعداد الکترونهایی است که روی MOهای در حال شل شدن هستند. |
||||||||
برای مولکول H2، ترتیب پیوند به ترتیب، |
2− 0 |
1، برای He2 |
||||||
2− 2 |
که عدم امکان وجود دیاتومیک را تایید می کند |
|||||||
مولکول ها. مشخص است که گازهای بی اثر به شکل مولکول های تک اتمی وجود دارند. استفاده از قوانین مشابه برای پر کردن اوربیتالهای مولکولی با الکترون
هنگام پر کردن اوربیتال های اتمی در اتم های جدا شده (اصل پائولی، اصل حداقل انرژی و قانون هوند))، می توان ساختار الکترونیکی مولکول های دو اتمی را تعیین کرد، به عنوان مثال N2 و O2.
اجازه دهید پیکربندی الکترونیکی اتم ها را در حالت پایه بنویسیم:
یا . |
|||
یا . |
|||
پیکربندی الکترونیکی مولکول های N2 و O2 را می توان به صورت زیر نوشت |
|||
N + N → N2 |
|||
O2: O+O → O2

روی انجیر شکل 8 نمودار انرژی تشکیل یک مولکول اکسیژن را نشان می دهد.
شکل 8. نمودار انرژی یک مولکول اکسیژن
در مولکول O2، دو الکترون با اسپین های موازی به دو الکترون ختم می شوند
انحطاط (با همان انرژی) * اوربیتال های مولکولی شل. وجود الکترونهای جفتنشده، خواص پارامغناطیس مولکول اکسیژن را تعیین میکند که اگر اکسیژن به حالت مایع خنک شود، بهویژه قابل توجه میشود.
مولکول های پارامغناطیس به دلیل حرکت درونی بارها دارای گشتاور مغناطیسی خاص خود هستند. در غیاب میدان مغناطیسی خارجی، گشتاورهای مغناطیسی مولکول ها به طور تصادفی جهت گیری می شوند، بنابراین میدان مغناطیسی حاصل از آنها صفر است. گشتاور مغناطیسی کل ماده نیز برابر با صفر است.
اگر ماده در یک میدان مغناطیسی خارجی قرار گیرد، تحت تأثیر آن، گشتاورهای مغناطیسی مولکول ها جهت گیری غالب در یک جهت را به دست می آورند و ماده مغناطیسی می شود - کل گشتاور مغناطیسی آن با صفر متفاوت می شود.
مولکولهای دیامغناطیس گشتاورهای مغناطیسی خاص خود را ندارند و هنگامی که وارد میدان مغناطیسی می شوند ضعیف مغناطیسی می شوند.
پارامغناطیس ها همه موادی هستند که از ذرات شیمیایی با تعداد فرد الکترون تشکیل شده اند، به عنوان مثال، مولکول NO، یون های مولکولی N2 +، N2 - و غیره.
اکثر موادی که مولکول های آنها دارای تعداد زوج الکترون هستند، دارند خواص دیامغناطیسی(N2، CO).
توضیحی در مورد خواص پارامغناطیس مولکول های اکسیژن و بور حاوی تعداد زوج الکترون بر اساس MMO ارائه شده است. مولکول O2 دارای دو الکترون جفت نشده در اوربیتال های مولکولی شل شده * است و مولکول B2 دارای دو الکترون جفت نشده در اوربیتال های مولکولی پیوند * است (جدول 1 را ببینید).
ذرات شیمیایی که دارای الکترون های جفت نشده در اوربیتال های بیرونی خود هستند رادیکال های آزاد نامیده می شوند. آنها پارامغناطیس و بسیار واکنش پذیر هستند. رادیکال های معدنی با الکترون های جفت نشده موضعی، به عنوان مثال (.H)، (.NH2)، معمولاً کوتاه مدت هستند. آنها در طول فتولیز تشکیل می شوند،

رادیولیز، پیرولیز، الکترولیز. برای تثبیت آنها از دمای پایین استفاده می شود. رادیکال های کوتاه مدت ذرات میانی در بسیاری از واکنش ها، به ویژه واکنش های زنجیره ای و کاتالیزوری هستند.
ترتیب پیوند در مولکول N2، که دارای بیش از شش الکترون در هر است
مفهوم ترتیب پیوند شیمیایی در روش MO با مفهوم تعدد پیوندها در روش BC مطابقت دارد (O2 یک پیوند دوگانه است، N2 یک پیوند سه گانه است). بزرگی ترتیب پیوند بر استحکام پیوند تأثیر می گذارد. هر چه ترتیب پیوند بالاتر باشد، انرژی پیوند بیشتر و طول پیوند کوتاهتر می شود.
روی میز. شکل 1 پیکربندی های الکترونیکی و ویژگی های پیوند مولکول های هم هسته ای دوره اول و دوم را نشان می دهد. همانطور که از جدول مشخص است، با افزایش ترتیب پیوند در سری B2 - C2 - N2، انرژی افزایش و طول پیوند کاهش می یابد.
جدول 1. پیکربندی های الکترونیکی و برخی از خواص مولکول های دوره اول و دوم
مغناطیسی |
|||||||
مولکول |
پیکربندی الکترونیکی |
قطع ارتباط، |
|||||
خواص |
|||||||
[(σ1s )2 ] |
دیامغناطیسی |
||||||
[(σ1s )2 (σ*1s )2 ] |
مولکول وجود ندارد |
||||||
دیامغناطیسی |
|||||||
مولکول وجود ندارد |
|||||||
پارامغناطیس |
|||||||
دیامغناطیسی |
|||||||
دیامغناطیسی |
|||||||
روش MO مقادیر غیر صحیح ترتیب پیوند را امکان پذیر می کند. این در یون های مولکولی رخ می دهد، به عنوان مثال، در یون مولکولی H2+، که n = 0.5 است.
نظم در تغییرات در ترتیب، انرژی و طول پیوند را می توان در مثال های مولکول و یون های مولکولی اکسیژن ردیابی کرد.
پیکربندی الکترونیکی و ترتیب پیوند مولکول اکسیژن در جدول آورده شده است. 1. پیکربندی های الکترونیکی و ترتیب پیوند یون های اکسیژن مولکولی
به شرح زیر: |
|||||||
O2 - - |
n = 1.5. |
||||||
کاهش ترتیب پیوند در سری ذرات O2 + , O2 , O2 - کاهش را تعیین می کند. |
|||||||
استحکام پیوند و تایید تجربی: |
|||||||
O2+: |
n \u003d 2.5، E sv \u003d 629 کیلوژول / مول، |
d sv = 112 pm; |
|||||
n \u003d 2.0، E sv \u003d 494 کیلوژول / مول، |
d sv = 121 pm; |
||||||
O2 - : |
n \u003d 1.5، E sv \u003d 397 کیلوژول / مول، |
d sv \u003d 126 بعد از ظهر. |
|||||
همه ذرات دارای الکترون های جفت نشده هستند و خواص پارامغناطیس از خود نشان می دهند. مولکول هایی که تعداد الکترون های ظرفیت یکسانی دارند نامیده می شوند
ایزوالکترونیکذرات. اینها شامل مولکولهای CO و N2 هستند که در مجموع 14 الکترون دارند. یون مولکولی N2 + و مولکول CN با 13 الکترون. IMO همان ترتیب پر شدن را به ذرات ایزوالکترونیک اختصاص می دهد

الکترونهای اوربیتالهای مولکولی، همان ترتیب پیوند، که توضیح نزدیکی خواص فیزیکی مولکولها را ممکن میسازد.
هنگامی که یک مولکول هترونهسته ای از نوع AB تشکیل می شود، ترکیب اوربیتال های دو اتم مختلف، که منجر به تشکیل یک مولکول می شود، تنها در صورتی امکان پذیر است که انرژی های الکترون نزدیک باشند، در حالی که اوربیتال های اتمی با الکترونگاتیوی بالاتر در انرژی. نمودارها همیشه پایین تر قرار دارند.
روی انجیر شکل 9 طرح انرژی برای تشکیل یک مولکول CO را نشان می دهد.
چهار الکترون 2p از اتم اکسیژن و دو الکترون 2p از اتم کربن به π - و σ - MO متصل می شوند. انرژی الکترونهای 2p اتمهای اتصال یکسان نیست: اتم اکسیژن بار هستهای و الکترونگاتیوی بالاتری نسبت به اتم کربن دارد، بنابراین الکترونهای 2p در اتم اکسیژن با شدت بیشتری توسط هسته و موقعیت آنها جذب میشوند. نمودار انرژی مربوط به انرژی کمتری در مقایسه با اوربیتال های 2p اتم کربن است. هر شش الکترون درگیر در تشکیل پیوند روی سه MO پیوندی قرار دارند؛ بنابراین، تعدد پیوند سه است، که شباهت قابل توجهی را در خواص نیتروژن آزاد و مونوکسید کربن (II) توضیح میدهد (جدول 2).
برنج. 9. طرح انرژی برای تشکیل مولکول CO
جدول 2. برخی از خواص فیزیکی مولکول های CO و N2
مولکول |
T pl، K |
تی بیل، ک |
E St، kJ/mol |
d sv , pm |
انواع پیوندهای شیمیایی غیر ظرفیتی
پیوند یونی.
هنگامی که تفاوت در الکترونگاتیوی اتم های برهم کنش بیش از دو واحد باشد، جابجایی الکترون های ظرفیت آنقدر زیاد است که می توان در مورد انتقال آنها از یک اتم به اتم دیگر با تشکیل ذرات باردار - کاتیون ها و آنیون ها صحبت کرد. این ذرات بر اساس قوانین الکترواستاتیک با یکدیگر تعامل دارند. پیوند حاصل را یونی می نامند. ترکیبات با پیوندهای یونی به طور قابل توجهی هستند
کمتر از ترکیبات با پیوند کووالانسی، مشخصه موادی است که در شرایط عادی در حالت کریستالی وجود دارند و در حالت مذاب یا محلول هدایت یونی دارند. ترکیبات یونی در درجه اول شامل نمک های معمولی هستند - هالیدهای فلز قلیایی که دارای شبکه کریستالی یونی هستند. مولکول های یونی فقط در دماهای بالا در بخارات ترکیبات یونی وجود دارند.
پیوند یونی، بر خلاف پیوند کووالانسی، غیر جهت دار است، زیرا یون ها میدان های نیروی متقارن کروی را تشکیل می دهند. اشباع ندارداز آنجایی که برهمکنش یونهای علامت مخالف در جهات مختلف رخ میدهد، غیرمحلی میشود، زیرا در ناحیه اتصال افزایش چگالی الکترونی مشاهده نمیشود.
مدل الکترواستاتیک پیوند یونی تشکیل آن را به عنوان برهمکنش یونهای دارای بار مخالف می داند که هر کدام مشخص می شود
انرژی تشکیل یک مولکول AB را می توان به عنوان مجموع جبری چندین انرژی تعریف کرد: انرژی جاذبه یون های Az+ و Bz-، انرژی دافعه یون ها، انرژی میل ترکیبی الکترون اتم B و انرژی یونیزاسیون اتم A.
یون های موجود در یک مولکول، n - سهم انرژی دافعه را که معمولاً 10٪ انرژی جاذبه است، در نظر می گیرد، E B - انرژی میل الکترونی اتم B، I A - انرژی یونیزاسیون اتم A.
برای یک مولکول گازی KCl، انرژی E AB بدون در نظر گرفتن قطبش محاسبه شد.
یونها: d \u003d 2.67 10-10 eV، E Cl \u003d 3.61 eV، I K \u003d 4.34 eV و انرژی اتصال E bond \u003d -E AB \u003d 4.06 eV ~ 391 kJ است.
انرژی یونیزاسیون مولکول KCl به صورت تجربی تعیین شده 422 کیلوژول بر مول است.
در گازها، مایعات و بلورها، هر یون تمایل دارد خود را با بیشترین تعداد یون های بار مخالف احاطه کند.
مکان یون ها در فضا با نسبت شعاع آنها تعیین می شود. اگر نسبت شعاع کاتیون به شعاع آنیون در داخل باشد
r + /r - = 0.41-0.73، سپس شش یون بار مخالف در اطراف اتم مرکزی هماهنگ می شوند - یک کاتیون یا آنیون. این هماهنگی هشت وجهی نامیده می شود و نوع شبکه کریستالی به عنوان نوع NaCl تعیین می شود.
اگر نسبت شعاع کاتیون به شعاع آنیون در داخل باشد
r + /r - = 0.73-1.37، سپس هشت یون بار مخالف در اطراف اتم مرکزی هماهنگ می شوند - یک کاتیون یا آنیون. چنین هماهنگی مکعبی نامیده می شود و نوع شبکه کریستالی به عنوان نوع CsCl تعیین می شود.
هنگامی که یون ها به یکدیگر نزدیک می شوند، پوسته های الکترونی کروی آنها تغییر شکل می دهند، که منجر به جابجایی بار الکتریکی و ظهور یک گشتاور الکتریکی القایی در ذره می شود. این پدیده نامیده می شود پلاریزاسیون یونی. پلاریزاسیون یونی یک فرآیند دو طرفه است که قطبش پذیری یون ها و اثر پلاریزهبسته به ساختار الکترونیکی، بار و اندازه یون. قطبش پذیری برای یون هایی با پیکربندی گاز بی اثر (ns 2 np 6 ) که در عین حال بیشترین اثر پلاریزه را دارند حداقل است. قطبش پذیری قابل توجه یون های عناصر d با حضور تعداد زیادی الکترون ظرفیت توضیح داده می شود، در نتیجه، جزء کووالانسی پیوند افزایش می یابد.
اثر پلاریزاسیون تفاوت های زیادی را در خواص مواد توضیح می دهد، به عنوان مثال، حلالیت ضعیف کلرید نقره در آب در مقایسه با کلریدهای قلیایی.

فلزات، تفاوت در دمای ذوب، به عنوان مثال، T pl، AgCl = 4550 C، T pl، NaCl = 8010 C. تنظیمات الکترونیکی یون ها: Ag + - 4d 10 5s 0. Na+ - 3s 0 .
پیکربندی الکترونیکی کمتر متقارن یون Ag + به دلیل وجود الکترون های 4d 10 باعث قطبش قوی تر آن می شود که منجر به ظاهر شدن می شود.
جزء کووالانسی جهتی پیوند در مقایسه با NaCl که در آن درجه یونیته پیوند بالاتر است.
اتصال فلزی.
مهمترین خاصیت فلزات رسانایی الکتریکی بالا است که با افزایش دما کاهش می یابد. اتمهای فلز با اتمهای سایر عناصر تفاوت دارند زیرا الکترونهای بیرونی خود را نسبتاً ضعیف حفظ میکنند. بنابراین، در شبکه کریستالی یک فلز، این الکترون ها اتم های خود را ترک می کنند و آنها را به یون های دارای بار مثبت تبدیل می کنند. الکترون های "مشترک" در فضای بین کاتیون ها حرکت می کنند و آنها را در کنار هم نگه می دارند. فواصل بین اتمی در فلزات بیشتر از ترکیبات آنها با پیوند کووالانسی است. چنین پیوندی نه تنها در بلورهای فلزی، بلکه در مذاب آنها و در حالت آمورف نیز وجود دارد. نامیده می شود
فلزی، هدایت الکترونیکی فلزات را تعیین می کند.
الکترون های یک فلز به طور تصادفی حرکت می کنند و از یک اتم به اتم دیگر عبور می کنند و یک گاز الکترونی تشکیل می دهند. یون های فلزی با بار مثبت فقط اندکی در اطراف موقعیت خود در شبکه کریستالی نوسان می کنند، هنگامی که فلز گرم می شود، ارتعاشات کاتیون ها افزایش می یابد و مقاومت الکتریکی فلز افزایش می یابد. به دلیل وجود الکترون های آزاد که با اتم های خاصی مرتبط نیستند، فلزات جریان الکتریسیته و گرما را به خوبی هدایت می کنند.
خواص فیزیکی فلزات مانند رسانایی حرارتی و الکتریکی بالا، شکل پذیری و شکل پذیری، درخشش فلزی را می توان بر اساس مفهوم گاز الکترونی توضیح داد.پیوند فلزی بسیار قوی است، زیرا اکثر فلزات نقطه ذوب بالایی دارند.
تفسیر دقیقتری از پیوند فلزی به ما اجازه میدهد که ارائه دهیم روش اوربیتال مولکولی. به یاد بیاورید که وقتی دو اوربیتال اتمی برهم کنش می کنند، دو اوربیتال مولکولی تشکیل می شود: یک اوربیتال پیوندی و یک اوربیتال ضد پیوند. سطح انرژی به دو بخش تقسیم می شود. اگر چهار اتم فلز به طور همزمان برهم کنش کنند، چهار اوربیتال مولکولی تشکیل می شود. با برهمکنش همزمان ذرات N موجود در یک کریستال، N اوربیتال مولکولی تشکیل میشود و مقدار N میتواند به مقادیر عظیمی برسد که قابل مقایسه با تعداد است.
آووگادرو (6 1023). اوربیتال های مولکولی تشکیل شده توسط اوربیتال های اتمی هم سطح به قدری نزدیک هستند که عملاً ادغام می شوند و یک اوربیتال مشخص را تشکیل می دهند.
منطقه انرژی (شکل 10).
برنج. 10. تشکیل نوار انرژی در کریستال
شکل گیری نوارهای انرژی را در مثال سدیم فلزی در نظر بگیرید،
ما قبلاً می دانیم که الکترون ها در اتم ها در حالت های انرژی مجاز هستند - اوربیتال های اتمی (AO). به طور مشابه، الکترونها در مولکولها در حالتهای انرژی مجاز وجود دارند - اوربیتال های مولکولی (MO).
اوربیتال مولکولیبسیار پیچیده تر از اوربیتال اتمی. در اینجا چند قانون وجود دارد که هنگام ساخت MO از AO ما را راهنمایی می کند:
- هنگام کامپایل MO از مجموعه ای از اوربیتال های اتمی، همان تعداد MO به دست می آید که AO در این مجموعه وجود دارد.
- میانگین انرژی MO به دست آمده از چندین AO تقریبا برابر است (اما ممکن است بیشتر یا کمتر از) میانگین انرژی AO های گرفته شده باشد.
- MO ها از اصل طرد پائولی پیروی می کنند: هر MO نمی تواند بیش از دو الکترون داشته باشد که باید اسپین های مخالف داشته باشند.
- AO هایی که دارای انرژی های قابل مقایسه هستند به بهترین شکل ترکیب می شوند.
- بازده ترکیب دو اوربیتال اتمی با همپوشانی آنها با یکدیگر متناسب است.
- هنگامی که یک MO با همپوشانی دو AO غیر معادل تشکیل می شود، MO پیوندی شامل سهم بیشتری از AO با کمترین انرژی است، در حالی که اوربیتال ضد پیوند حاوی سهم AO با انرژی بالاتر است.
ما مفهوم را معرفی می کنیم سفارش ارتباطی. در مولکول های دو اتمی، ترتیب پیوند نشان می دهد که تعداد جفت الکترون های پیوندی چقدر از تعداد جفت الکترون های ضد پیوند بیشتر است:
حال بیایید به مثالی از نحوه اعمال این قوانین نگاه کنیم.
نمودارهای مداری مولکولی عناصر دوره اول
بیا شروع کنیم با تشکیل یک مولکول هیدروژناز دو اتم هیدروژن
در نتیجه تعامل اوربیتال های 1sهر یک از اتم های هیدروژن دو اوربیتال مولکولی را تشکیل می دهند. در طول برهمکنش، زمانی که چگالی الکترون در فضای بین هسته ها متمرکز می شود، الف پیوند سیگما - اوربیتال(σ). این ترکیب انرژی کمتری نسبت به اتم های اصلی دارد. در برهمکنش، زمانی که چگالی الکترون در خارج از ناحیه بین هسته ای متمرکز می شود، یک آنتی باند سیگما - اوربیتال(σ*). این ترکیب انرژی بالاتری نسبت به اتم های اصلی دارد.
 نمودارهای MO مولکول های هیدروژن و هلیوم
نمودارهای MO مولکول های هیدروژن و هلیوم الکترون ها، با توجه به اصل پائولی، ابتدا اوربیتال با کمترین انرژی σ-اوربیتال را اشغال می کند.
حال در نظر بگیرید تشکیل مولکول He 2، هنگامی که دو اتم هلیوم به یکدیگر نزدیک می شوند. در این حالت، برهمکنش اوربیتال های 1s نیز رخ می دهد و اوربیتال های σ * - تشکیل می شود، در حالی که دو الکترون اوربیتال پیوندی را اشغال می کنند و دو الکترون دیگر اوربیتال شل کننده را اشغال می کنند. اوربیتال - - به همان میزانی که اوربیتال - - تثبیت شده است، بیثبات میشود، بنابراین دو الکترون که اوربیتال σ * - را اشغال میکنند، مولکول He2 را بیثبات میکنند. در واقع، به طور تجربی ثابت شده است که مولکول He 2 بسیار ناپایدار است.
بعد، در نظر بگیرید تشکیل مولکول Li 2با در نظر گرفتن این که اوربیتال های 1s و 2s از نظر انرژی بسیار متفاوت هستند و بنابراین برهمکنش قوی بین آنها وجود ندارد. نمودار سطح انرژی مولکول Li 2 در زیر نشان داده شده است، که در آن الکترون های موجود در اوربیتال های 1s-bonding و 1s-antibonding سهم قابل توجهی در پیوند ندارند. بنابراین، تشکیل یک پیوند شیمیایی در مولکول Li 2 انجام می شود الکترون های 2s. این عمل به تشکیل مولکولهای دیگر گسترش مییابد که در آنها زیر پوستههای اتمی پر شده (s, p, d) به پیوند شیمیایی. بنابراین، تنها الکترون های ظرفیت .
در نتیجه برای فلزات قلیایی، نمودار مداری مولکولی شکلی شبیه به نمودار مولکول Li 2 در نظر گرفته شده توسط ما خواهد داشت.
 نمودار MO یک مولکول لیتیوم
نمودار MO یک مولکول لیتیوم سفارش ارتباط nدر مولکول Li 2 1 است
نمودارهای مداری مولکولی عناصر دوره دوم
بیایید در نظر بگیریم که چگونه دو اتم یکسان دوره دوم با مجموعه ای از اوربیتال های s و p با یکدیگر برهم کنش می کنند. باید انتظار داشت که اوربیتال های 2s فقط با یکدیگر و اوربیتال های 2p فقط با اوربیتال های 2p متصل شوند. زیرا اوربیتال های 2p می توانند به دو روش مختلف با یکدیگر تعامل داشته باشند، آنها اوربیتال های مولکولی σ و π را تشکیل می دهند. با استفاده از نمودار خلاصه زیر می توانید تنظیم کنید پیکربندی الکترونیکی مولکول های دو اتمی دوره دوم که در جدول آورده شده است.

بنابراین، تشکیل یک مولکول، برای مثال، فلوئور F2اتم ها در نماد نظریه اوربیتال مولکولیمی توان اینگونه نوشت:
2F =F 2 [(σ 1s) 2 (σ * 1s) 2 (σ 2s) 2 (σ * 2 s) 2 (σ 2px) 2 (π 2py) 2 (π 2pz) 2 (π * 2py) 2 ( π * 2 pz) 2 ].
زیرا از آنجایی که همپوشانی ابرهای 1s ناچیز است، مشارکت الکترونها در این اوربیتالها را میتوان نادیده گرفت. سپس پیکربندی الکترونیکی مولکول فلوئور به صورت زیر خواهد بود:
F2،
که در آن K پیکربندی الکترونیکی لایه K است.
 نمودارهای MO مولکول های دو اتمی عناصر 2 دوره
نمودارهای MO مولکول های دو اتمی عناصر 2 دوره اوربیتال های مولکولی مولکول های دو اتمی قطبی
دکترین MOبه شما امکان توضیح و آموزش را می دهد مولکول های هترونهسته ای دو اتمی. اگر اتم های موجود در مولکول خیلی متفاوت از یکدیگر نیستند (به عنوان مثال، NO، CO، CN)، می توانید از نمودار بالا برای عناصر دوره دوم استفاده کنید.
با تفاوت های قابل توجه بین اتم های سازنده مولکول، نمودار تغییر می کند. در نظر گرفتن مولکول HF، که در آن اتم ها از نظر الکترونگاتیوی بسیار متفاوت هستند.
انرژی اوربیتال 1s اتم هیدروژن بالاتر از انرژی بالاترین اوربیتال ظرفیت فلوئور، اوربیتال 2p است. برهمکنش اوربیتال 1s اتم هیدروژن و اوربیتال 2p فلوئور منجر به تشکیل اوربیتال های باندینگ و آنتی باند، همانطور که در تصویر نشان داده شده است. یک جفت الکترون واقع در اوربیتال پیوند مولکول HF تشکیل می شود پیوند کووالانسی قطبی.
برای اوربیتال پیوندمولکول های HF اوربیتال 2p اتم فلوئور نقش مهم تری نسبت به اوربیتال 1s اتم هیدروژن ایفا می کند.
برای یک اوربیتال آنتی باندمولکول های HF برعکس: اوربیتال 1s اتم هیدروژن نقش مهم تری نسبت به اوربیتال 2p اتم فلوئور ایفا می کند.
 دسته بندی ها ،
دسته بندی ها ، 3.4. روش اوربیتال مولکولی
روش اوربیتال مولکولی (MO) در مدل گرافیکی آن از ترکیب خطی اوربیتال های اتمی (LCAO) بیشتر قابل مشاهده است. روش MO LCAO بر اساس قوانین زیر است.
1. هنگامی که اتم ها به فاصله های پیوندهای شیمیایی به یکدیگر نزدیک می شوند، اوربیتال های مولکولی (AO) از اوربیتال های اتمی تشکیل می شوند.
2. تعداد اوربیتال های مولکولی به دست آمده برابر با تعداد اتمی های اولیه است.
3. اوربیتال های اتمی که از نظر انرژی نزدیک هستند همپوشانی دارند. در نتیجه همپوشانی دو اوربیتال اتمی، دو اوربیتال مولکولی تشکیل می شود. یکی از آنها نسبت به اتمی های اصلی انرژی کمتری دارد و نامیده می شود الزام آور و اوربیتال مولکولی دوم انرژی بیشتری نسبت به اوربیتال های اتمی اولیه دارد و نامیده می شود شل شدن .
4. هنگامی که اوربیتال های اتمی همپوشانی دارند، تشکیل هر دو پیوند - (همپوشانی در امتداد محور پیوند شیمیایی) و - پیوند (همپوشانی در دو طرف محور پیوند شیمیایی) امکان پذیر است.
5. اوربیتال مولکولی که در تشکیل پیوند شیمیایی دخالتی نداشته باشد نامیده می شود غیر الزام آور . انرژی آن برابر با انرژی AO اصلی است.
6. در یک اوربیتال مولکولی (و همچنین اوربیتال اتمی) نمی توان بیش از دو الکترون پیدا کرد.
7. الکترون ها اوربیتال مولکولی را با کمترین انرژی اشغال می کنند (اصل کمترین انرژی).
8. پر شدن اوربیتال های منحط (با همان انرژی) به صورت متوالی با یک الکترون برای هر یک از آنها اتفاق می افتد.
اجازه دهید روش MO LCAO را اعمال کنیم و ساختار مولکول هیدروژن را تجزیه و تحلیل کنیم. اجازه دهید سطوح انرژی اوربیتال های اتمی اتم های هیدروژن اولیه را در دو نمودار موازی به تصویر بکشیم (شکل 3.5).
مشاهده می شود که افزایش انرژی در مقایسه با اتم های غیر محدود وجود دارد. هر دو الکترون انرژی خود را کاهش دادند که مطابق با واحد ظرفیت در روش پیوندهای ظرفیتی است (پیوندی توسط یک جفت الکترون تشکیل می شود).
روش MO LCAO توضیح بصری تشکیل یونها و یونها را ممکن میسازد، که باعث ایجاد مشکلاتی در روش پیوندهای ظرفیتی میشود. یک الکترون از اتم H با افزایش انرژی به اوربیتال مولکولی پیوند کاتیون می رود (شکل 3.7).
در یک آنیون، سه الکترون باید قبلاً در دو اوربیتال مولکولی قرار گیرند (شکل 3.8).
اگر دو الکترون که به اوربیتال پیوندی نزول کرده اند، انرژی افزایش دهند، الکترون سوم باید انرژی خود را افزایش دهد. با این حال، انرژی به دست آمده توسط دو الکترون بیشتر از انرژی از دست رفته توسط یک الکترون است. چنین ذره ای ممکن است وجود داشته باشد.
مشخص است که فلزات قلیایی در حالت گازی به شکل مولکول های دو اتمی وجود دارند. بیایید سعی کنیم امکان وجود یک مولکول Li 2 دو اتمی را با استفاده از روش MO LCAO بررسی کنیم. اتم لیتیوم اصلی حاوی الکترون هایی در دو سطح انرژی است - اول و دوم (1 سو 2 س) (شکل 3.9).
همپوشانی یکسان 1 س-اوربیتال های اتم های لیتیوم دو اوربیتال مولکولی (پیوند و شل شدن) به دست می دهند که طبق اصل حداقل انرژی، چهار الکترون کاملاً پر می شوند. افزایش انرژی حاصل از انتقال دو الکترون به اوربیتال مولکولی پیوندی قادر به جبران تلفات آن در هنگام انتقال دو الکترون دیگر به اوربیتال مولکولی ضد پیوند نیست. به همین دلیل است که فقط الکترون های لایه الکترونی خارجی (ظرفیت) در تشکیل پیوند شیمیایی بین اتم های لیتیوم کمک می کنند.
ظرفیت همپوشانی 2 س-اوربیتال های اتم های لیتیوم نیز منجر به تشکیل یکی می شود
- پیوند و یک اوربیتال مولکولی سست کننده. دو الکترون بیرونی اوربیتال پیوندی را اشغال میکنند و یک افزایش کلی در انرژی ایجاد میکنند (تکثر پیوند 1 است).
با استفاده از روش MO LCAO، اجازه دهید امکان تشکیل مولکول He 2 را در نظر بگیریم (شکل 3.10).
در این حالت، دو الکترون اوربیتال مولکولی پیوند و دو الکترون دیگر اوربیتال سست را اشغال خواهند کرد. چنین جمعیتی از دو اوربیتال با الکترون، افزایش انرژی به همراه نخواهد داشت. بنابراین، مولکول He 2 وجود ندارد.
با استفاده از روش MO LCAO، به راحتی می توان خواص پارامغناطیس مولکول اکسیژن را نشان داد. برای اینکه شکل را به هم نریزیم، همپوشانی 1 را در نظر نخواهیم گرفت س-اوربیتال های اتم های اکسیژن اولین لایه الکترونی (داخلی). ما آن را در نظر می گیریم پ-اوربیتال های لایه الکترونی دوم (خارجی) می توانند به دو صورت همپوشانی داشته باشند. یکی از آنها با یک مشابه با تشکیل یک پیوند همپوشانی خواهد داشت (شکل 3.11).
دو نفر دیگر پ-همپوشانی AO در دو طرف محور ایکسبا تشکیل دو پیوند (شکل 3.12).
انرژی اوربیتال های مولکولی ساخته شده را می توان از داده های طیف جذب مواد در ناحیه فرابنفش تعیین کرد. بنابراین، در میان اوربیتال های مولکولی مولکول اکسیژن که در نتیجه همپوشانی تشکیل شده است. پ-AO، اوربیتالهای دژنره شده دو پیوندی (با انرژی یکسان) انرژی کمتری نسبت به پیوند دارند، با این حال، مانند اوربیتالهای شلکننده *، انرژی کمتری نسبت به اوربیتال شلکننده * دارند (شکل 3.13).
در مولکول O 2، دو الکترون با اسپین های موازی به دو اوربیتال مولکولی انحطاط (با انرژی یکسان) *-شست شونده ختم شدند. وجود الکترون های جفت نشده است که خواص پارامغناطیسی مولکول اکسیژن را تعیین می کند، که اگر اکسیژن به حالت مایع خنک شود، قابل توجه خواهد بود.
در بین مولکول های دو اتمی، یکی از قوی ترین مولکول های CO است. روش MO LCAO به راحتی توضیح این واقعیت را ممکن می سازد (شکل 3.14، ص را ببینید. 18).
نتیجه همپوشانی پ-اوربیتال های اتم های O و C تشکیل دو انحطاط است
اوربیتال پیوندی و یک پیوندی. این اوربیتال های مولکولی شش الکترون را اشغال خواهند کرد. بنابراین تعدد پیوند سه است.
روش MO LCAO نه تنها برای مولکول های دو اتمی، بلکه برای مولکول های چند اتمی نیز قابل استفاده است. اجازه دهید به عنوان مثال، ساختار مولکول آمونیاک را در چارچوب این روش تحلیل کنیم (شکل 3.15).
از آنجایی که سه اتم هیدروژن فقط سه 1 دارند س-اوربیتال ها، سپس تعداد کل اوربیتال های مولکولی تشکیل شده برابر با شش خواهد بود (سه پیوند و سه شل شدن). دو الکترون از اتم نیتروژن در یک اوربیتال مولکولی غیر پیوندی (جفت الکترون تک) قرار خواهند گرفت.
3.5. اشکال هندسی مولکول ها
وقتی صحبت از شکل مولکول ها می شود، قبل از هر چیز به معنای موقعیت نسبی هسته اتم ها در فضا است. وقتی مولکول از سه یا چند اتم تشکیل شده باشد (دو هسته همیشه در یک خط مستقیم قرار دارند) منطقی است که در مورد شکل یک مولکول صحبت کنیم. شکل مولکول ها بر اساس تئوری دفع جفت الکترون ظرفیتی (خارجی) تعیین می شود. طبق این نظریه، مولکول همیشه به شکلی خواهد بود که در آن دافعه جفت الکترون خارجی حداقل است (اصل حداقل انرژی). در انجام این کار، اظهارات زیر در مورد نظریه دافعه باید در نظر گرفته شود.
1. جفت الکترون های تنها بیشترین دافعه را متحمل می شوند.
2. دافعه بین جفت مشترک نشده و جفتی که در تشکیل پیوند نقش دارند تا حدودی کمتر است.
3. کمترین دافعه بین جفت الکترون های دخیل در تشکیل پیوند. اما حتی این برای جداسازی هسته اتم های دخیل در تشکیل پیوندهای شیمیایی تا حداکثر زاویه کافی نیست.
به عنوان مثال، اشکال ترکیبات هیدروژنی عناصر دوره دوم را در نظر بگیرید: BeH 2، BH 3، CH 4، C 2 H 4، C 2 H 2، NH 3، H 2 O.
بیایید با تعیین شکل مولکول BeH 2 شروع کنیم. بیایید فرمول الکترونیکی آن را به تصویر بکشیم:
که از آن مشخص است که هیچ جفت الکترونی مشترکی در مولکول وجود ندارد. بنابراین، برای جفتهای الکترونی که اتمها را به هم متصل میکنند، میتوان تا حداکثر فاصلهای که در آن هر سه اتم در یک خط مستقیم قرار دارند، دفع کرد، یعنی. زاویه HBeH 180 درجه است.
مولکول BH 3 از چهار اتم تشکیل شده است. طبق فرمول الکترونیکی آن، هیچ جفت الکترونی تنها در آن وجود ندارد:
مولکول چنین شکلی به دست می آورد که در آن فاصله بین همه پیوندها حداکثر و زاویه بین آنها 120 درجه است. هر چهار اتم در یک صفحه خواهند بود - مولکول صاف است:
فرمول الکترونیکی مولکول متان به شرح زیر است:
همه اتم های یک مولکول معین نمی توانند در یک صفحه باشند. در این حالت، زاویه بین پیوندها 90 درجه خواهد بود. آرایش بهینه تر (از نقطه نظر انرژی) اتم ها - چهار وجهی وجود دارد. زاویه بین پیوندها در این حالت 109 درجه 28 اینچ است.
فرمول الکترونیکی اتن به صورت زیر است:
به طور طبیعی، تمام زوایای بین پیوندهای شیمیایی حداکثر مقدار 120 درجه را می گیرند.
بدیهی است که در یک مولکول استیلن، همه اتم ها باید در یک خط مستقیم قرار گیرند:
H:C:::C:H.
تفاوت بین مولکول آمونیاک NH 3 و تمام مولکول های قبلی وجود یک جفت الکترون تنها در اتم نیتروژن در آن است:
همانطور که قبلاً ذکر شد، جفت الکترونهای دخیل در تشکیل پیوند با شدت بیشتری از جفت الکترون تنها دفع میشوند. جفت تنها با توجه به اتم های هیدروژن در مولکول آمونیاک به طور متقارن قرار دارد:
زاویه HNH کوچکتر از زاویه HCH در مولکول متان است (به دلیل دافعه الکترون قویتر).
در حال حاضر دو جفت تنها در یک مولکول آب وجود دارد:
این به دلیل شکل زاویه ای مولکول است:
در نتیجه دافعه قویتر جفتهای الکترون تنها، زاویه HOH حتی از زاویه HNH در مولکول آمونیاک کوچکتر است.
مثال های ارائه شده کاملاً به وضوح احتمالات تئوری دفع جفت الکترون ظرفیت را نشان می دهد. پیش بینی شکل بسیاری از مولکول های معدنی و آلی را نسبتاً آسان می کند.
3.6. تمرینات
1
. چه نوع پیوندهایی را می توان به عنوان مواد شیمیایی طبقه بندی کرد؟
2.
آیا می دانید دو رویکرد اصلی برای در نظر گرفتن پیوندهای شیمیایی چیست؟ تفاوت آنها چیست؟
3.
ظرفیت و حالت اکسیداسیون را تعریف کنید.
4.
تفاوت بین پیوندهای کووالانسی ساده، دهنده-پذیرنده، داتیو، فلزی، یونی چیست؟
5.
پیوندهای بین مولکولی چگونه طبقه بندی می شوند؟
6.
الکترونگاتیوی چیست؟ الکترونگاتیوی از چه داده هایی محاسبه می شود؟ الکترونگاتیوی اتم هایی که یک پیوند شیمیایی را تشکیل می دهند به ما اجازه قضاوت می دهد؟ الکترونگاتیوی اتم های عناصر هنگام حرکت در جدول تناوبی D.I. مندلیف از بالا به پایین و از چپ به راست چگونه تغییر می کند؟
7.
هنگام در نظر گرفتن ساختار مولکول ها با روش MO LCAO چه قوانینی باید رعایت شود؟
8.
با استفاده از روش پیوندهای ظرفیتی، ساختار ترکیبات هیدروژنی عناصر را توضیح دهید
دوره 2.
9.
انرژی تفکیک در سری مولکول های Cl 2، Br 2، I 2 کاهش می یابد (به ترتیب 239 kJ/mol، 192 kJ/mol، 149 kJ/mol)، اما انرژی تفکیک مولکول F 2 (151 kJ/mol) ) بسیار کمتر از انرژی تفکیک مولکول های Cl 2 است و از الگوی عمومی خارج می شود. حقایق داده شده را توضیح دهید.
10.
چرا در شرایط عادی، CO 2 یک گاز است، و SiO 2 یک جامد، H 2 O یک مایع است،
و H 2 S یک گاز است؟ سعی کنید وضعیت تجمع مواد را توضیح دهید.
11.
با استفاده از روش MO LCAO، وقوع و ویژگی های پیوند شیمیایی در مولکول های B 2 , C 2 , N 2 , F 2 , LiH, CH 4 را توضیح دهید.
12.
با استفاده از تئوری دافعه جفت الکترون ظرفیت، شکل مولکول های ترکیبات اکسیژن عناصر دوره 2 را تعیین کنید.
روش اوربیتال مولکولی بر اساس این فرض که الکترون های یک مولکول در اوربیتال های مولکولی قرار دارند، مشابه اوربیتال های اتمی در یک اتم جدا شده. هر اوربیتال مولکولی مربوط به مجموعه خاصی از اعداد کوانتومی مولکولی است. برای اوربیتال های مولکولی، اصل پائولی همچنان معتبر است، یعنی. هر اوربیتال مولکولی نمی تواند بیش از دو الکترون با اسپین های ضد موازی داشته باشد.
در حالت کلی، در یک مولکول چند اتمی، ابر الکترونی به طور همزمان به همه اتم ها تعلق دارد، یعنی. در تشکیل یک پیوند شیمیایی چند مرکزی شرکت می کند. بدین ترتیب، تمام الکترون های یک مولکول به طور همزمان به کل مولکول تعلق دارند و خاصیت دو اتم پیوندی نیستند.. از این رو، مولکول به عنوان یک کل در نظر گرفته می شود، نه به عنوان مجموعه ای از اتم های منفرد.
در یک مولکول، مانند هر سیستمی از هسته ها و الکترون ها، وضعیت یک الکترون در اوربیتال های مولکولی باید با تابع موج مربوطه توصیف شود. در رایجترین نسخه روش مداری مولکولی، توابع موجی الکترونها با نشان دادن یافت میشوند. اوربیتال مولکولی به عنوان ترکیبی خطی از اوربیتال های اتمی(خود نوع نام اختصاری "MOLCAO" را دریافت کرد).
در روش MOLCAO فرض بر این است که تابع موج y ، مربوط به اوربیتال مولکولی، می تواند به صورت مجموع نشان داده شود:
y = c 1 y 1 + c 2 y 2 + ¼ + c n y n
که در آن y توابع موجی هستند که اوربیتال های اتم های برهم کنش را مشخص می کنند.
c i ضرایب عددی هستند که معرفی آنها ضروری است زیرا سهم اوربیتال های اتمی مختلف در کل اوربیتال مولکولی می تواند متفاوت باشد.
از آنجایی که مربع تابع موج احتمال یافتن یک الکترون را در نقطهای از فضای بین اتمهای برهم کنش نشان میدهد، جالب است که بفهمیم تابع موج مولکولی باید چه شکلی داشته باشد. ساده ترین راه برای حل این مشکل در مورد ترکیبی از توابع موج اوربیتال های 1s از دو اتم یکسان است:
y = c 1 y 1 + c 2 y 2
از آنجایی که برای اتم های یکسان با 1 \u003d c 2 \u003d c ، باید مجموع را در نظر گرفت
y = c 1 (y 1 + y 2)
ثابت با فقط مقدار دامنه تابع را تحت تأثیر قرار می دهد، بنابراین، برای پیدا کردن شکل اوربیتال، کافی است بفهمیم که مجموع آن چقدر خواهد بود. y 1 و y2 .
با قرار دادن هسته های دو اتم برهم کنش در فاصله ای برابر با طول پیوند، و با به تصویر کشیدن توابع موج اوربیتال های 1s، آنها را اضافه می کنیم. معلوم می شود که بسته به نشانه های توابع موج، جمع آنها نتایج متفاوتی به دست می دهد. در مورد اضافه کردن توابع با علائم مشابه (شکل 4.15، a)، مقادیر y در فضای بین هسته ای بیشتر از مقادیر است y 1 و y2 . در حالت مخالف (شکل 4.15، b)، کل اوربیتال مولکولی با کاهش قدر مطلق تابع موج در فضای بین هسته ای در مقایسه با توابع موج اتم های اصلی مشخص می شود.
|
|



برنج. 4.15. طرح افزودن اوربیتال های اتمی در طول تشکیل
اتصال (الف) و شل شدن (ب) MO
از آنجایی که مجذور تابع موج، احتمال یافتن یک الکترون در ناحیه مربوطه فضا را مشخص می کند، یعنی. چگالی ابر الکترونی، به این معنی که در نسخه اول اضافه شدن توابع موج، چگالی ابر الکترونی در فضای بین هسته ای افزایش می یابد و در نسخه دوم کاهش می یابد.
بنابراین، افزودن توابع موج با علائم یکسان منجر به ظهور نیروهای جاذبه هستههای با بار مثبت به ناحیه بین هستهای با بار منفی و تشکیل پیوند شیمیایی میشود. این اوربیتال مولکولی نامیده می شود الزام آور و الکترون های واقع روی آن - پیوند الکترون ها .
در صورت اضافه شدن توابع موجی از علائم مختلف، جاذبه هر هسته در جهت ناحیه بین هسته ای ضعیف می شود و نیروهای دافعه غالب می شوند - پیوند شیمیایی تقویت نمی شود و اوربیتال مولکولی حاصل نامیده می شود. شل شدن (الکترون های واقع بر روی آن - شل شدن الکترون ها ).
مشابه اوربیتال های اتمی s-, p-, d-, f- نشان دهنده MO s- , پ- , د- , اوربیتال های j . اوربیتال های مولکولی ناشی از برهمکنش دو اوربیتال 1s نشان دهنده: s-linking و س (با ستاره) - شل شدن . هنگامی که دو اوربیتال اتمی برهم کنش می کنند، دو اوربیتال مولکولی همیشه تشکیل می شود - یک پیوند و یک شل شدن.
انتقال یک الکترون از اوربیتال 1s اتمی به اوربیتال s که منجر به تشکیل پیوند شیمیایی می شود، با آزاد شدن انرژی همراه است. انتقال الکترون از اوربیتال 1 به اوربیتال s نیاز به انرژی دارد. در نتیجه، انرژی اوربیتال پیوند s کمتر است و اوربیتال بازشونده s بالاتر از انرژی اوربیتال های 1s اتمی اصلی است که معمولاً در قالب نمودارهای مربوطه نشان داده می شود (شکل 4.16).
 JSC MO JSC
JSC MO JSC
برنج. 4.16. نمودار انرژی تشکیل MO مولکول هیدروژن
همراه با نمودارهای انرژی تشکیل اوربیتال های مولکولی، ظاهر ابرهای مولکولی که از همپوشانی یا دفع اوربیتال های اتم های برهم کنش به دست می آیند، مورد توجه است.
در اینجا باید در نظر گرفت که هیچ اوربیتالی نمی تواند تعامل داشته باشد، بلکه فقط آنهایی که الزامات خاصی را برآورده می کنند.
1. انرژی اوربیتال های اتمی اولیه نباید تفاوت زیادی با یکدیگر داشته باشند - آنها باید از نظر قدر قابل مقایسه باشند.
2. اوربیتال های اتمی باید خواص تقارن یکسانی در مورد محور مولکول داشته باشند.
آخرین نیاز به این واقعیت منجر می شود که آنها می توانند با یکدیگر ترکیب شوند، به عنوان مثال، s - s (شکل 4.17، a)، s - p x (شکل 4.17، b)، p x - p x، اما آنها نمی توانند s - p y باشند. ، s - p z (شکل 4.17، ج)، زیرا در سه مورد اول، هر دو اوربیتال هنگام چرخش حول محور بین هسته ای تغییر نمی کنند (شکل 3.17 a, b) و در آخرین موارد علامت تغییر می کنند (شکل 4.17، c). این امر در موارد اخیر منجر به تفریق متقابل نواحی تشکیلشده همپوشانی میشود و این اتفاق نمیافتد.
3. ابرهای الکترونی اتم های برهم کنش باید تا حد امکان همپوشانی داشته باشند. به عنوان مثال، این به این معنی است که ترکیب اوربیتالهای p x – p y، p x – p z یا p y – p z که دارای مناطق همپوشانی نیستند، غیرممکن است.

(a B C)
برنج. 4.17. تأثیر تقارن اوربیتال های اتمی بر احتمال
تشکیل اوربیتال های مولکولی: MO ها تشکیل می شوند (a, b)
تشکیل نشده (در)
در مورد برهمکنش دو اوربیتال s، اوربیتال های s و s حاصل به این شکل هستند (شکل 3.18)
|
|
|
![]()
|

![]()
برنج. 4.18. طرحی برای ترکیب دو اوربیتال 1s
برهمکنش دو اوربیتال px نیز یک پیوند s ایجاد می کند، زیرا پیوند حاصل در امتداد یک خط مستقیم که مراکز اتم ها را به هم متصل می کند هدایت می شود. اوربیتال های مولکولی در حال ظهور به ترتیب s و s تعیین می شوند، طرح تشکیل آنها در شکل نشان داده شده است. 4.19.
 |
برنج. 4.19. طرحی برای ترکیب دو اوربیتال p x
با ترکیبی از اوربیتال های p y - p y یا p z - p z - (شکل 4.20)، اوربیتال های s نمی توانند تشکیل شوند، زیرا نواحی اوربیتال های همپوشانی احتمالی روی خط مستقیمی که مراکز اتم ها را به هم متصل می کند قرار ندارند. در این موارد، اوربیتال های دژنراته p y - و p z - و همچنین p - و p - تشکیل می شوند (اصطلاح "دژنراته" در این مورد به معنای "یکسان در شکل و انرژی" است).


برنج. 4.20. طرحی برای ترکیب دو اوربیتال p z
هنگام محاسبه اوربیتال های مولکولی سیستم های چند اتمی، علاوه بر این، ممکن است ظاهر شود سطوح انرژی در میانه راه بین پیوند و شل شدن اوربیتال های مولکولی. چنین مو تماس گرفت غیر الزام آور .
همانند اتمها، الکترونها در مولکولها تمایل دارند اوربیتالهای مولکولی مربوط به حداقل انرژی را اشغال کنند. بنابراین، در یک مولکول هیدروژن، هر دو الکترون از اوربیتال 1s به اوربیتال پیوندی s 1 s منتقل می شوند (شکل 4.14)، که می تواند با فرمول نمایش داده شود:
مانند اوربیتال های اتمی، اوربیتال های مولکولی حداکثر می توانند دو الکترون را در خود نگه دارند.
روش MO LCAO با مفهوم ظرفیت عمل نمی کند، بلکه اصطلاح «نظم» یا «تعدد پیوند» را معرفی می کند.
سفارش ارتباط (P)برابر است با ضریب تقسیم تفاوت بین تعداد الکترون های پیوند دهنده و شل کننده بر تعداد اتم های برهم کنش، یعنی. در مورد مولکول های دو اتمی، نیمی از این تفاوت. ترتیب پیوند می تواند مقادیر صحیح و کسری از جمله صفر داشته باشد (اگر ترتیب پیوند صفر باشد، سیستم ناپایدار است و پیوند شیمیایی رخ نمی دهد).
بنابراین، از نقطه نظر روش MO، پیوند شیمیایی در مولکول H 2 که توسط دو الکترون پیوندی تشکیل شده است، باید به عنوان یک پیوند واحد در نظر گرفته شود که با روش پیوندهای ظرفیتی نیز مطابقت دارد.
از نقطه نظر روش MO و وجود یک یون مولکولی پایدار H مشخص است. در این حالت تنها الکترون از اوربیتال 1s اتمی به اوربیتال s 1 S مولکولی می گذرد که با آزاد شدن انرژی و تشکیل پیوند شیمیایی با تعدد 0.5 همراه است.
در مورد یون های مولکولی H و He (شامل سه الکترون)، الکترون سوم از قبل روی اوربیتال ضد پیوند s قرار گرفته است (مثلا He (s 1 S 2 (s) 1) و ترتیب پیوند به این صورت است. یون ها طبق تعریف 0.5 است. چنین یون هایی وجود دارند، اما پیوند در آنها ضعیف تر از مولکول هیدروژن است.
از آنجایی که در یک مولکول فرضی He 2 باید 4 الکترون وجود داشته باشد، آنها فقط می توانند 2 در s 1 S قرار گیرند - اوربیتال های پیوند و s - سست، یعنی. ترتیب پیوند صفر است و مولکول های دو اتمی هلیوم، مانند سایر گازهای نجیب، وجود ندارند. به طور مشابه، مولکول های Be 2، Ca 2، Mg 2، Ba 2 و غیره نمی توانند تشکیل شوند.
بنابراین، از دیدگاه روش اوربیتال مولکولی، دو اوربیتال اتمی برهم کنش، دو اوربیتال مولکولی را تشکیل می دهند: پیوند و شل شدن. برای AO با اعداد کوانتومی اصلی 1 و 2، تشکیل MO ارائه شده در جدول 1 امکان پذیر است. 4.4.
از نظر زمانی، روش MO دیرتر از روش VS ظاهر شد، زیرا سوالاتی در تئوری پیوندهای کووالانسی وجود داشت که با روش VS قابل توضیح نبودند. اجازه دهید به برخی از آنها اشاره کنیم.
همانطور که مشخص است، موقعیت اصلی روش VS این است که پیوند بین اتم ها به دلیل جفت الکترون (ابرهای دو الکترونی اتصال) انجام می شود. اما همیشه اینطور نیست. در برخی موارد، تک تک الکترون ها در تشکیل یک پیوند شیمیایی نقش دارند. بنابراین، در یون مولکولی H 2 + پیوند یک الکترونی. روش VS نمی تواند تشکیل یک پیوند تک الکترونی را توضیح دهد، این با موقعیت اصلی آن در تضاد است.
روش VS همچنین نقش الکترون های جفت نشده در یک مولکول را توضیح نمی دهد. مولکول هایی با الکترون های جفت نشده پارامغناطیس، به عنوان مثال، آنها به میدان مغناطیسی کشیده می شوند، زیرا الکترون جفت نشده یک گشتاور مغناطیسی ثابت ایجاد می کند. اگر هیچ الکترون جفت نشده در مولکول ها وجود نداشته باشد، آنها دیامغناطیسیاز میدان مغناطیسی رانده می شوند. مولکول اکسیژن پارامغناطیس است، دارای دو الکترون با اسپین های موازی است که با روش VS در تضاد است. همچنین لازم به ذکر است که روش VS نمی تواند تعدادی از خواص ترکیبات پیچیده - رنگ آنها و غیره را توضیح دهد.
برای توضیح این حقایق، روش مداری مولکولی (MMO) پیشنهاد شد.
4.5.1. مفاد اصلی mmo، mo.
1. در یک مولکول، همه الکترون ها مشترک هستند. خود مولکول یک کل واحد است، مجموعه ای از هسته ها و الکترون ها.
2. در یک مولکول، هر الکترون با یک اوربیتال مولکولی مطابقت دارد، همانطور که هر الکترون در یک اتم با یک اوربیتال اتمی مطابقت دارد. و نامگذاری اوربیتال ها مشابه است:
AO s، p، d، f
MO σ، π، δ، φ
3. به عنوان اولین تقریب، اوربیتال مولکولی ترکیب خطی (جمع و تفریق) اوربیتال های اتمی است. بنابراین، آنها از روش MO LCAO صحبت می کنند (اوربیتال مولکولی ترکیبی خطی از اوربیتال های اتمی است) که در آن از ن AO تشکیل می شود ن MO (این شرط اصلی روش است).
برنج. 12. انرژی
طرح تشکیل خال
هیدروژن H 2 را خنک می کند
در نظر گرفتن پیوندهای شیمیایی در روش MO شامل توزیع الکترون ها در یک مولکول در امتداد اوربیتال های آن است. دومی ها به ترتیب صعودی انرژی و با در نظر گرفتن اصل پائولی پر می شوند. این روش افزایش چگالی الکترون بین هسته ها را در طول تشکیل یک پیوند کووالانسی فرض می کند.با استفاده از مفاد 1-3، تشکیل مولکول H 2 را از نقطه نظر روش MO توضیح می دهیم. با همگرایی کافی اتم های هیدروژن، اوربیتال های الکترونی آنها همپوشانی دارند. طبق بند 3، از دو اوربیتال ls یکسان، دو اوربیتال مولکولی تشکیل می شود: یکی از آنها از جمع اوربیتال های اتمی، دیگری از تفریق آنها (شکل 12). انرژی اولین E 1< E 2 , а энергия второй E 2 < E 3 .
اوربیتال مولکولی که انرژی آن کمتر از انرژی اوربیتال اتمی یک اتم جدا شده باشد نامیده می شود. الزام آور(با نماد مشخص می شود  sv)، و الکترون های واقع روی آن - پیوند الکترون ها
sv)، و الکترون های واقع روی آن - پیوند الکترون ها
اوربیتال مولکولی که انرژی آن از اوربیتال اتمی بیشتر باشد نامیده می شود ضد اتصالیا شل شدن(با نماد مشخص می شود  razr)، و الکترون های واقع بر روی آن - شل شدن الکترون ها
razr)، و الکترون های واقع بر روی آن - شل شدن الکترون ها
اگر اسپین های الکترون اتم های هیدروژن متصل کننده ضد موازی باشند، آنگاه آنها MO اتصال را اشغال می کنند، یک پیوند شیمیایی ایجاد می شود (شکل 12)، همراه با آزاد شدن انرژی E 1 (435 کیلوژول در مول). اگر اسپین های الکترون اتم های هیدروژن موازی باشند، مطابق با اصل پائولی، آنها را نمی توان روی یک اوربیتال مولکولی قرار داد: یکی از آنها روی پیوند و دیگری روی اوربیتال شل کننده قرار می گیرد، به این معنی که پیوند شیمیایی نمی تواند تشکیل شود.
بر اساس روش MO، تشکیل مولکول ها در صورتی امکان پذیر است که تعداد الکترون های موجود در اوربیتال های پیوندی بیشتر از تعداد الکترون های موجود در اوربیتال های شل شونده باشد. اگر تعداد الکترونهای موجود در اوربیتالهای پیوند و شلکننده یکسان باشد، چنین مولکولهایی نمیتوانند تشکیل شوند. بنابراین، این نظریه وجود مولکول He 2 را مجاز نمیداند، زیرا در آن دو الکترون در اوربیتال پیوند و دو الکترون در اوربیتال شلشونده قرار دارند. الکترون همیشه در حال شل شدن اثر الکترون پیوند را نفی می کند.
در علامت گذاری روش MO، واکنش تشکیل یک مولکول هیدروژن از اتم ها به صورت زیر نوشته می شود:
2H = H 2 [(σ CB 1s) 2 ]،
آن ها از نمادها برای بیان قرارگیری الکترون ها در اوربیتال های اتمی و مولکولی استفاده می شود. در این حالت نماد هر MO داخل پرانتز قرار می گیرد و بالای براکت های سمت راست تعداد الکترون های این اوربیتال است.
تعداد پیوندهای ظرفیت با فرمول تعیین می شود:

جایی که: B تعداد اتصالات است.
N CB N RAS - به ترتیب، تعداد الکترون های اتصال و شل شدن در مولکول.
در یک مولکول هیدروژن B \u003d (2-0): 2 \u003d 1، هیدروژن تک ظرفیتی است. مولکول H 2 دیا مغناطیسی است (الکترون ها جفت می شوند).
اکنون پیوند تک الکترونی در یون مولکولی H 2 + به راحتی توضیح داده می شود (شکل 13). تنها الکترون این یون از نظر انرژی مطلوب ترین اوربیتال را اشغال می کند  St. 1s. معادله فرآیند:
St. 1s. معادله فرآیند:
H + H + = H 2 + [(σ St 1s) 1]، ∆H = - 259.4 کیلوژول


برنج. 13. طرح انرژی 14. طرح انرژی
تشکیل تشکیل مولکولی یون دی هلیوم He 2
یون هیدروژن H2
تعداد پیوندهای موجود در یون H 2 + ½ (پیوند با یک الکترون) است. یون H 2 + پارامغناطیس است (یک الکترون جفت نشده دارد).
وجود یون دی هلیوم مولکولی He 2 + امکان پذیر است (شکل 14). معادله تشکیل آن
He + He + = He 2 + [(σ CB 1s) 2 (σ res 1s) 1]، ∆H = - 292.8 kJ
این یون به صورت تجربی کشف شده است. تعداد لینک های موجود در آن
برنج. 15 . طرح انرژی برای تشکیل مولکولهای هم هسته دواتمی عناصر دوره دوم
4.5.2. مولکولهای اصلی هم هسته دواتمی عناصر دوره دوم.اصل در نظر گرفته شده ساخت MO از دو AOs یکسان در ساخت مولکول های هم هسته ای عناصر دوره دوم D.I حفظ می شود. مندلیف. آنها در نتیجه تعامل 2s- و 2p x -، 2p y تشکیل می شوند. - و اوربیتال 2p z.
مشارکت الکترون های داخلی اوربیتال های 1s را می توان نادیده گرفت (آنها در طرح های انرژی بعدی در نظر گرفته نمی شوند). اوربیتال 2s یک اتم فقط با اوربیتال 2s اتم دیگر برهمکنش میکند (انرژیهای اوربیتالهای برهم کنش باید نزدیک باشد) و MO σ2 s نور و σ2 s res را تشکیل میدهند. هنگامی که اوربیتال های 2p هر دو اتم با هم همپوشانی دارند (برهم کنش) MO تشکیل می شود:
(
برنج. 16. طرح انرژی تشکیل مولکول Li 2
 ، و از r y - و r z - - با حرف
، و از r y - و r z - - با حرف  . با کمک انجیر. 15 به راحتی می توان پیکربندی های الکترونیکی این مولکول ها را در علامت گذاری روش MO نشان داد.
. با کمک انجیر. 15 به راحتی می توان پیکربندی های الکترونیکی این مولکول ها را در علامت گذاری روش MO نشان داد.
مثال 1 مولکول لیتیوم Li 2 . طرح شکل گیری آن در شکل 16 نشان داده شده است. دارای دو الکترون اتصال دهنده است، مولکول دیامغناطیس است (الکترون ها جفت شده اند). نوشتن معادله و فرمول را می توان با نشان دادن سطح داخلی به عنوان K ساده کرد:
2Li = Li2
تعداد لینک ها 1 می باشد.
مثال 2 مولکول بریلیم بی 2. هشت الکترون مولکول به صورت زیر روی MO قرار می گیرند:
2 باش
همانطور که مشاهده می شود، تعداد پیوندهای موجود در مولکول صفر است: دو الکترون شل شونده عمل دو پیوند پیوندی را از بین می برند. چنین مولکولی نمی تواند وجود داشته باشد و هنوز کشف نشده است. لازم به ذکر است که مولکول های دو اتمی برای همه عناصر گروه IIA، پالادیوم و عناصر بی اثر غیرممکن است، زیرا اتم های آنها دارای ساختار الکترونیکی بسته هستند.
مثال 3 مولکول نیتروژن N 2 (شکل 17). توزیع 14 الکترون توسط MO به صورت زیر نوشته شده است:
N 2 [(σ CB 1s) 2 (σ CB 1s) 2 (σ CB 2s) 2 (σ cut 2s) 2 (π CB 2p y) 2 (π CB 2p z) 2 (σ CB 2p x) 2 ]
یا به اختصار:
N 2 [CC (σ s CB)2 (σ s resp) 2 (π y CB) 2 (π z CB) 2 (σ x CB)2]
1 -1 +1 +1 +1=3

برنج. 17. طرح انرژی برای تشکیل مولکول N 2
تحت فرمول، تعداد پیوندهای موجود در یک مولکول نشان داده شده است، بر اساس این محاسبه که دو الکترون واقع در یک MO یک پیوند ظرفیتی را تشکیل می دهند. علامت مثبت نشان دهنده اوربیتال های پیوندی است، علامت منفی نشان دهنده اوربیتال های ضد پیوند است. تعداد پیوندهای موجود در مولکول 3 است. هیچ الکترون جفت نشده ای وجود ندارد - مولکول دیامغناطیس است.
مثال 4 مولکول O 2 (شکل 18). الکترون ها در امتداد MO به ترتیب زیر قرار می گیرند:
O 2 [CC(σ s CB) 2 (σ s res) 2 (π y CB) 2 (π z CB) 2 (σ x CB) 2 (π y res) 1 (π z res) 1]
1 -1 +1 +1 +1 - 1 / 2 - 1 / 2 =2

برنج. 18. طرح انرژی برای تشکیل مولکول O 2
در یک مولکول دو پیوند ظرفیتی وجود دارد. دو الکترون آخر مطابق با قاعده هوند در اوربیتال های سست کننده π مختلف قرار گرفتند. دو الکترون جفت نشده پارامغناطیس مولکول اکسیژن را تعیین می کنند.4.5.3. مولکول های هترونهسته ای دو اتمی عناصر دوره دوم.طرح انرژی برای تشکیل MO از مولکول های دو اتمی ناهم هسته ای، متشکل از اتم های عناصر دوره دوم، در شکل نشان داده شده است. 19. شبیه طرح تشکیل MO مولکولهای هم هسته است.
تفاوت اصلی این است که مقادیر انرژی اوربیتال های همنام اتم های عناصر مختلف با یکدیگر برابر نیستند، زیرا بارهای هسته اتم ها متفاوت است. به عنوان مثال، پیکربندی الکترونیکی ظرفیت مولکول های CO و NO را در نظر بگیرید.
برنج. 19 . طرح انرژی برای تشکیل دو مولکول هترو هسته ای اتمی عناصر دوره دوم
CO[CC(σs CB)2 (σ s resp)2(π y CB)2(π z CB)2 (σ x CB)2]
1 -1 +1 +1 +1=3
همانطور که توسط نظریه VS پیش بینی شده است، سه پیوند ظرفیتی در مولکول CO وجود دارد (مقایسه با N2). مولکول دیا مغناطیسی است - همه الکترون ها جفت هستند.
مثال 6 بدون مولکول مولکول های MO اکسید نیتریک (II) باید 11 الکترون را در خود جای دهند: پنج نیتروژن - 2s 2 2p 3 و شش اکسیژن - 2s 2 2p 4. ده مورد از آنها به همان شکلی قرار می گیرند که الکترون های مولکول مونوکسید کربن (II) (مثال 5) و یازدهم روی یکی از اوربیتال های شل کننده قرار می گیرد - π y res یا π Z res (این اوربیتال ها از نظر انرژی هستند. معادل یکدیگر). سپس
NО[КК(σs CB)2(σ s res)2(π y CB)2(π z CB)2(σ x CB)2(π y res)1]
1 -1 +1 +1 +1 - 1 / 2 =2 1 / 2
این بدان معنی است که مولکول NO دارای پیوند دو و نیم ظرفیتی است، انرژی اتصال بزرگ است - 677.8 کیلوژول در مول. پارامغناطیس است زیرا حاوی یک الکترون جفت نشده است.
مثال های ارائه شده برای نشان دادن امکانات روش MO در توضیح ساختار و خواص مولکول ها خدمت می کنند.
مثال 7 فسفر به دلیل الکترون های جفت نشده (اسپیوالانس) چه ظرفیتی می تواند در حالت عادی و برانگیخته از خود نشان دهد؟
راه حل.توزیع الکترون ها در سطح انرژی بیرونی فسفر 3s 2 3p 3 (با در نظر گرفتن قانون هوند،  )
برای سلول های کوانتومی به شکل زیر است:
)
برای سلول های کوانتومی به شکل زیر است:
3s 3px 3py 3pz
اتم های فسفر دارای اوربیتال های d آزاد هستند، بنابراین انتقال یک الکترون 3s به حالت 3 بعدی امکان پذیر است:
3s 3px 3py 3pz 3dxy
از این رو، ظرفیت (اسپینوالانس) فسفر در حالت عادی سه و در حالت برانگیخته پنج است.
مثال 8 . هیبریداسیون مداری ظرفیتی چیست؟ مولکول های نوع AB n چه ساختاری دارند اگر پیوند در آنها به دلیل ایجاد شده باشد sp-, sp 2 -, sp 3 -هیبریداسیون اوربیتال های اتم A؟
راه حل.تئوری پیوندهای ظرفیتی (VS) مشارکت در تشکیل پیوندهای کووالانسی را نه تنها از AOs خالص، بلکه همچنین ترکیبی، به اصطلاح ترکیبی، AOs را فرض میکند. در طول هیبریداسیون، شکل و انرژی اولیه اوربیتال ها (ابرهای الکترونی) متقابلاً تغییر می کند و اوربیتال ها (ابرها) به شکل یکسان جدید و با همان انرژی تشکیل می شوند. تعداد اوربیتال های هیبریدی (ق)برابر تعداد نسخه های اصلی پاسخ را در جدول ببینید. 13.