ადსორბცია ხდება ინტერფეისში. აქედან გამომდინარე, მიზანშეწონილია განიხილოს ზედაპირის ფენომენების თერმოდინამიკური აღწერა, როგორც ჰეტეროგენული სისტემების თერმოდინამიკის განსაკუთრებული შემთხვევა.
ბრინჯი. 3.4. გიბსის ადსორბცია: 1- ორფაზიანი შედარების სისტემა, 2- რეალური ორფაზიანი სისტემა არაერთგვაროვანი რეგიონით
ჰეტეროგენული სისტემების თერმოდინამიკაში გამოიყენება დანამატების პრინციპირომელიც არის შემდეგი: ჰეტეროგენული სისტემის ყველა ვრცელი თვისება უდრის შესაბამისი ვრცელი თვისებების ჯამს, რაც ექნებოდა ფაზებს კონტაქტამდე.ფაზები ავღნიშნოთ α და β-ით (სურ. 4). შემდეგ იდეალური სისტემისთვის, ისეთი, რომ ინტერფეისის მახლობლად მდებარე ფაზების თვისებები ემთხვევა მათ ნაყარ თვისებებს, შემდეგი მიმართებები მოქმედებს შიდა ენერგიის U, მოცულობა V, მასა (მოლების რაოდენობა) n, ენტროპია S წონასწორობის დამყარების შემდეგ. ჰეტეროგენული სისტემა:
U = U α + U β , V = V α + V β , n = n α + n β , S = S α + S β
ეს ვარაუდობს, რომ ტემპერატურა და წნევა ორივე ფაზაში ერთნაირია.
რეალური ჰეტეროგენული სისტემებისთვის, გარდამავალი რეგიონი ორი ფაზის საზღვარზე დამატებით წვლილს შეიტანს სისტემის ვრცელ თვისებებში. თუ ზედაპირული ფენომენი ხდება, უნდა გავითვალისწინოთ განსხვავება რეალური ჰეტეროგენული სისტემის ვრცელ თვისებებსა და მოდელის სისტემის ფართო თვისებებს შორის, რომელშიც ზედაპირული ფენომენები არ არის. ასეთ სისტემას შედარების სისტემას უწოდებენ. შედარების სისტემას აქვს იგივე ინტენსიური პარამეტრები (T, P, C i ...) და იგივე მოცულობა V, რაც რეალურ სისტემას (ნახ. 4).
თერმოდინამიკური თვალსაზრისით, ადსორბციული მნიშვნელობა G გაგებულია, როგორც ნივთიერების ჭარბი რაოდენობა n s, გამოხატული მოლებით ან გრამებით, რომელიც რეალურ ჰეტეროგენულ სისტემას აქვს საცნობარო სისტემასთან შედარებით, რომელიც დაკავშირებულია ინტერფეისის არეალთან ან ზედაპირის ფართობთან. ადსორბენტის A. ვარაუდობენ, რომ შედარების სისტემას აქვს იგივე ინტენსიური პარამეტრები (T, P, C i) და იგივე მოცულობა (V = V α + V β), როგორც რეალურ სისტემას (ნახ. 4). .
Г = (n - n α - n β)/A = n s /A 3.11
რეალური სისტემის გარდამავალი რეგიონის ჭარბი თერმოდინამიკური ფუნქციები (მათ აღვნიშნავთ s ინდექსით) შეიძლება დაიწეროს როგორც
U s = U - U α - U β , n s = n - n α - n β , S s = S - S α - S βდა ა.შ.
ადსორბციის ექსპერიმენტული გაზომვები ყოველთვის იძლევა ადსორბციას, როგორც კომპონენტის სიჭარბეს რეალურ სისტემაში არჩეულ საცნობარო სისტემასთან შედარებით. მაგალითად, მყარ ადსორბენტზე აირის ადსორბციისას ან მყარ ფაზაზე კომპონენტების ადსორბციისას, ადსორბციის მნიშვნელობების საპოვნელად, განსაზღვრეთ ადსორბატის საწყისი კონცენტრაციების ცვლილება α და β ფაზების შეხების შემდეგ.
n i s = V(C i o - C i),
სად C i o- i-ე კომპონენტის საწყისი კონცენტრაცია, C i– i-ე კომპონენტის კონცენტრაცია კონტაქტურ ფაზებს შორის წონასწორობის დამყარების შემდეგ. ითვლება, რომ მოცულობა ვარ იცვლება. თუმცა კონცენტრაცია მეე კომპონენტი C iექსპერიმენტულად მიღებული, განისაზღვრება მოცულობით V'ფაზის ინტერფეისის ზემოთ გარდამავალი ფენის არაჰომოგენური რეგიონის მოცულობის გათვალისწინების გარეშე V αინტერფეისზე, სადაც არის კონცენტრაცია C i α. ამრიგად, რეალურ სისტემაში არაერთგვაროვანი რეგიონის არსებობის გამო, სისტემის მთლიანი მოცულობა შეიძლება წარმოდგენილი იყოს როგორც V = V' + Va. ყველა რაოდენობით მე-ე კომპონენტი C i oგანაწილდება ამ ორ ტომს შორის:
V C i o = V' C i + V α C i α,
და კომპონენტის მოლების რაოდენობა მეინტერფეისზე ადსორბირებული იქნება ტოლი
n i s = (V’C i + V α C i α) – (V’ + V α)C i = V α (C i α – C i) 3.12
იმათ. ექსპერიმენტულად განსაზღვრული ადსორბცია არის i-ე კომპონენტის სიჭარბე V α მოცულობაში ამ კომპონენტის რაოდენობასთან შედარებით იმავე მოცულობაში ფაზის ინტერფეისიდან შორს. ამ ტიპის ადსორბციას უწოდებენ გიბსის ადსორბციას. .
V α C i αსრული შინაარსი ეწოდება მე-ადსორბციული ფენის ნაწილი. ძალიან დაბალი კონცენტრაციის რეგიონში C iმოცულობაში V'შესწორება V α C iგანტოლება (3.2) შეიძლება იყოს უგულებელყოფილი და გაზომილი მნიშვნელობა შეიძლება ჩაითვალოს V α C i αსრული შინაარსი მე-ადსორბციული ფენის th კომპონენტი, მაგალითად, გაზის ადსორბციის დროს მყარ ადსორბენტზე დაბალი წნევის დროს.
ადსორბციული პროცესების თერმოდინამიკა.
| პარამეტრის სახელი | მნიშვნელობა |
| სტატიის თემა: | ადსორბციული პროცესების თერმოდინამიკა. |
| რუბრიკა (თემატური კატეგორია) | Განათლება |
ადსორბციული პროცესების კლასიფიკაციის ძირითადი განმარტებები და მეთოდები.
ადსორბცია ეხება ფენომენებს, რომლებიც წარმოიქმნება ზედაპირის ენერგიის სპონტანური შემცირების გამო.
ადსორბცია– ჰეტეროგენული სისტემის კომპონენტების სპონტანური შექცევადი ან შეუქცევადი გადანაწილების პროცესი ზედაპირულ ფენასა და ერთგვაროვანი ფაზის მოცულობას შორის.
მრავალკომპონენტიან სისტემებში, კომპონენტი, რომელიც უფრო ძლიერად ამცირებს ინტერფეისურ დაძაბულობას, სასურველია გადავიდეს ზედაპირულ ფენაზე. ერთკომპონენტიან სისტემებში, ზედაპირული ფენის ფორმირებისას, ხდება მისი სტრუქტურის ცვლილება (ატომებისა და მოლეკულების გარკვეული ორიენტაცია, პოლარიზაცია), ე.წ. ავტოადსორბცია.
უფრო მკვრივ ფაზას, რომელზედაც ლოკალიზებულია ადსორბციული ურთიერთქმედებები, ეწოდება ადსორბენტი. ნივთიერება, რომელიც გადანაწილებულია ერთგვაროვანი ფაზის მოცულობასა და ზედაპირულ ფენას შორის, აღინიშნება ტერმინით ʼʼ. ადსორბირებასʼʼ.
ზოგიერთ შემთხვევაში, ადსორბციის პროცესი შექცევადია. ამ შემთხვევაში, გარკვეულ პირობებში, მოლეკულური კინეტიკური ფენომენების შედეგად ადსორბირებული მოლეკულების ნაწილი შეიძლება გადავიდეს ზედაპირის ფენიდან ნაყარ ფაზაში. ადსორბციის საპირისპირო პროცესს უწოდებენ დეზორბცია.
ადსორბციული პროცესების კლასიფიკაციის მეთოდები.
ადსორბციული პროცესების კლასიფიკაცია ურთიერთქმედების ფაზების აგრეგაციის მდგომარეობის მიხედვით.მიმდებარე ფაზების საერთო მდგომარეობაზე დამოკიდებულების გათვალისწინებით, განასხვავებენ ადსორბციის პროცესების შემდეგ ტიპებს:
აირების ადსორბცია მყარ ადსორბენტებზე;
გახსნილი ნივთიერებების ადსორბცია „მყარი-თხევადი“ და „თხევადი-თხევადი“ ინტერფეისებზე;
ზედაპირული აქტიური ნივთიერებების ადსორბცია თხევადი აირის ინტერფეისზე.
ადსორბციული პროცესების კლასიფიკაცია ადსორბენტსა და ადსორბატს შორის ურთიერთქმედების მექანიზმის მიხედვით.ადსორბცია შეიძლება ჩაითვალოს, როგორც ადსორბირებული მოლეკულების ურთიერთქმედება ადსორბენტის აქტიურ ცენტრებთან. მათი ურთიერთქმედების მექანიზმის მიხედვით იყოფა ადსორბციის შემდეგი ტიპები:
1) ფიზიკური (მოლეკულური) ადსორბცია– ადსორბატისა და ადსორბენტის მოლეკულებს შორის ურთიერთქმედება ხორციელდება ვან დერ ვაალის ძალების, წყალბადის ბმების გამო (ქიმიური რეაქციების გარეშე);
2) ქიმიური ადსორბცია (ქიმისორბცია)– ადსორბატის მოლეკულების მიმაგრება ადსორბენტის აქტიურ ცენტრებთან ხდება სხვადასხვა ტიპის ქიმიური რეაქციების შედეგად (გარდა იონური გაცვლის რეაქციებისა);
3) იონგაცვლის ადსორბცია (იონური გაცვლა) – ადსორბირებული ნივთიერების გადანაწილება ხსნარსა და მყარ ფაზას (იონგამცვლელს) შორის იონგაცვლის რეაქციების მექანიზმის მიხედვით.
ადსორბციის პროცესების რაოდენობრივად აღსაწერად გამოიყენება ორი რაოდენობა.
1) აბსოლუტური ადსორბცია– ადსორბატის რაოდენობა (მოლი) ან მასა (კგ) ზედაპირის ერთეულზე ან ადსორბენტის მასაზე. აღნიშვნა – A; განზომილება: მოლ/მ2, მოლ/კგ, კგ/მ2, კგ/კᴦ.
2) გიბსის (ჭარბი) ადსორბცია- ადსორბირებული ნივთიერების სიჭარბე გარკვეული სისქის ზედაპირულ ფენაში მის რაოდენობასთან შედარებით ერთგვაროვანი ფაზის მოცულობაში, ადსორბენტის ზედაპირის ფართობის ერთეულზე ან მასაზე. აღნიშვნა – G; განზომილება: mol/m 2, mol/kᴦ.
კავშირი აბსოლუტურ და ჭარბ ადსორბციას შორის შეიძლება ილუსტრირებული იყოს განტოლების გამოყენებით:
Г = А – с * სთ (3.1)
სადაც c არის ნივთიერების წონასწორული კონცენტრაცია ფაზის მოცულობაში, მოლ/მ3;
h არის ზედაპირის ფენის სისქე, პირობითად 10 -9 მ.
მრავალკომპონენტიან ჰეტეროგენულ სისტემებში, როდესაც ერთი ან სხვა კომპონენტი გადანაწილებულია ერთგვაროვანი ფაზის მოცულობასა და ზედაპირულ ფენას შორის, მოქმედებს ზედაპირის ჭარბი შიდა ენერგიის განტოლება:
U = T * S + s * s + Sm i * n i (3.2)
განტოლების ყველა ტერმინის შემცირება ინტერფაზური ზედაპირის ერთეულ ფართობზე, მივიღებთ:
U s = T * S s + s + Sm i * Г i (3.3)
სადაც Г i = n i/s არის i-ე კომპონენტის სიჭარბე ზედაპირულ ფენაში, ანუ გიბსის ადსორბცია.
ერთკომპონენტიანი სისტემისთვის განტოლება (3.3) მიიღებს ფორმას:
G s = s + m * G (3.4)
სადაც G s = U s - T * S s – ზედაპირის გიბსის ენერგია ან ერთეული ზედაპირის ფართობის შექმნის სამუშაო;
m *G – ადსორბირებული ნივთიერების დატკეპნა ზედაპირულ შრეში.
განტოლების (3.4) საფუძველზე შეგვიძლია დავასკვნათ, რომ ადსორბციის დროს ინტერფაზური ზედაპირის შექმნის სამუშაო შედგება ზედაპირის ფორმირების (ადსორბირებული ფაზის მოცულობაში შეკრული ბმების გაწყვეტა) და ზედაპირის ფენაში ნივთიერების დატკეპნისაგან.
ადსორბენტსა და ადსორბატს შორის დინამიური წონასწორობის მდგომარეობაში, ჰეტეროგენული სისტემის გიბსის ენერგიის ცვლილება ΔG = 0, ადსორბციის პროცესის თერმოდინამიკა აღწერილია განტოლებით ე.წ. გიბსის ფუნდამენტური ადსორბციის განტოლება:
Ds = SГ i * dm i (3.5)
ეს განტოლება უნივერსალურია, რადგან ის მოქმედებს ყველა სახის ადსორბციული პროცესისთვის
გიბსის ადსორბციის განტოლების განსაკუთრებული შემთხვევები.
1) ადსორბცია ხსნარებიდან.
სისტემის მეათე კომპონენტის ქიმიური პოტენციალისათვის ადსორბციის დროს „თხევადი-მყარი ადსორბენტი“ და „თხევად-გაზი“ ინტერფეისებზე მოქმედებს შემდეგი განტოლებები:
m i = m i 0 + R*T*ln a i (3.6)
dm i = R*T* d ln a i (3.7)
სადაც m i 0 არის სისტემის i-ე კომპონენტის ქიმიური პოტენციალი სტანდარტულ პირობებში;
a i არის სისტემის i-ე კომპონენტის აქტივობა სტანდარტულ პირობებში.
ამის საფუძველზე გიბსის ადსორბციის განტოლება იღებს ფორმას:
Г i = - a i / R*T * (ds / da i) (3.8)
არაელექტროლიტების ხსნარებისთვის ვიღებთ i = c i, შემდეგ:
Г i = - с / R*T * (ds / dс) (3.9)
ელექტროლიტური ხსნარებისთვის:
Г i = - с ± n / R*T * (ds / dс ± n) (3.10)
სადაც с ± არის ხსნარის საშუალო იონური კონცენტრაცია;
n არის სტოქიომეტრიული კოეფიციენტი.
2) ნივთიერებების ადსორბცია აირის ფაზიდან.
მენდელეევ-კლეიპერონის განტოლების შესაბამისად:
Р = с * R*T (3.11)
ამასთან დაკავშირებით, გიბსის განტოლება აირების ადსორბციისთვის მყარ ადსორბენტებზე იწერება შემდეგი ფორმით:
Г i = - Р / R*T * (ds / dР) (3.12)
პრაქტიკაში, გიბსის ადსორბციის განტოლება საშუალებას იძლევა, ზედაპირული დაძაბულობის გაზომვების საფუძველზე თხევადი კონცენტრაციის ან წონასწორული აირის წნევის სხვადასხვა მნიშვნელობებზე, გამოვთვალოთ ნივთიერებების ადსორბციის რაოდენობა ინტერფეისურ ფენაში, რომლისთვისაც განისაზღვრება ზედაპირული დაძაბულობა.
ადსორბციული პროცესების თერმოდინამიკა. - კონცეფცია და ტიპები. კატეგორიის კლასიფიკაცია და მახასიათებლები "ადსორბციული პროცესების თერმოდინამიკა". 2017, 2018 წ.
ადსორბციას, როგორც ზედაპირზე მოლეკულების სპონტანურ კონცენტრაციას, თან ახლავს სისტემის ენტროპიის დაქვეითება. ვინაიდან პროცესის სპონტანურობის კრიტერიუმია
∆H - T · ∆S = ∆G< 0,
მაშინ ადსორბცია შესაძლებელია მხოლოდ ∆H-ზე< 0 (экзотермический процесс). Равновесие определяется условием ∆Н = T· ∆S. ტემპერატურის მატებასთან ერთად წონასწორობა გადადის ენდოთერმული პროცესისკენ, ანუ დეზორბციისკენ.
ადსორბცია მყარ ზედაპირზე
1. მონომოლეკულური ადსორბცია.
ლანგმუირის თეორიის მიხედვით, ადსორბენტის მოლეკულები ურთიერთქმედებენ ადსორბენტის ზედაპირთან და საბოლოოდ ქმნიან მონომოლეკულურ ფენას. ამ შემთხვევაში, ზედაპირის შევსების ხარისხი () ადსორბირებული ნივთიერებით გაზის ფაზიდან ადსორბციის დროს.
სითხიდან
სადაც K არის წონასწორობის მუდმივი (ადსორბციის მუდმივი);
p არის ადსორბირებული აირის ნაწილობრივი წნევა;
c არის ადსორბირებული ნივთიერების კონცენტრაცია.
β-ის დამოკიდებულება p (ან c)-ზე წარმოდგენილია გრაფიკით (ადსორბციის იზოთერმი, T = const) ნახ. 1.3.

ბრინჯი. 1.3. ზედაპირის შევსების ხარისხი ადსორბირებული ნივთიერებით
დაბალი კონცენტრაციისა და ნაწილობრივი წნევის დროს, ადსორბცია პროპორციულია კონცენტრაციის ან ნაწილობრივი წნევისა:
რ<< 1, β ≈ К· რ ილისი<< 1, β ≈ К· ს, ე.ი. იზოთერმის საწყისი მონაკვეთი არის დაახლოებით წრფივი და tan α = K (tg α განისაზღვრება მრუდის დახრილობით p (ან c) → 0: ან ).
თუ არის ადსორბირებული ნივთიერების მოლების რაოდენობა 1 გ ადსორბენტზე; - ადსორბირებული ნივთიერების მოლების მაქსიმალური რაოდენობა 1 გ ადსორბენტზე („ერთფენოვანი სიმძლავრე“), შემდეგ
β ჩანაცვლება განტოლებაში (1.3) (გაზის ფაზიდან ადსორბციის შემთხვევაში, კონცენტრაცია თანგანტოლებებში უნდა შეიცვალოს წნევით რ), ვიღებთ:
 (1.6)
(1.6)
ვინაიდან და K მოცემული ადსორბენტი-ადსორბენტი წყვილში არის მუდმივები (at თ=const), შემდეგ დამოკიდებულების მიხედვით შეიძლება იპოვოთ TO(ნახ. 1.4).

ბრინჯი. 1.4. ადსორბციის განტოლების გრაფიკული ამოხსნა
მიღებული ექსპერიმენტული წრფივი დამოკიდებულების ექსტრაპოლაციით () = 0-მდე; და მას შემდეგ, რაც , .
მნიშვნელობა შეიძლება გამოყენებულ იქნას ადსორბენტის კონკრეტული ზედაპირის ფართობის დასადგენად UD (მ 2-ში 1 გ ადსორბენტზე), თუ ცნობილია ω ფართობი, რომელსაც ზედაპირზე იკავებს ადსორბენტის ერთი მოლეკულა (განსაზღვრულია მოლეკულის ზომიდან):
UD = · ω · Na, (1.7)
სადაც Na არის ავოგადროს რიცხვი (Na = 6.02 10 23).
თავის მხრივ, UD-ის ცნობილი მნიშვნელობა შეიძლება გამოყენებულ იქნას ნებისმიერი ნივთიერების ω-ს გამოსათვლელად, მოცემულ ადსორბენტზე მისი ადსორბციის საფუძველზე.
2. პოლიმოლეკულური ადსორბცია.
განტოლება (1.5) აღწერს მრუდს გაჯერებით, ე.ი. ზე
p (ან c) → ∞ მიდრეკილია ზღვრული მნიშვნელობისკენ (ნახ. 1.5,a).

სურ.1.5. ადსორბციის იზოთერმები:
ა – ადსორბცია გაჯერებით; ბ – პოლიმოლეკულური ადსორბცია
თუმცა, ზოგიერთ შემთხვევაში, ადსორბციის იზოთერმები ჰგავს ნახ. 1.5, ბ, ე.ი. არ აღწევს ზღვარს მაღალ p (ან c) დროსაც კი.
ნახაზზე ნაჩვენები ტიპის დამოკიდებულებები. 1.5,b შეესაბამება პოლიმოლეკულურ ადსორბციას. როგორც წესი, ასეთი იზოთერმები დამახასიათებელია ძლიერი ინტერმოლეკულური ურთიერთქმედების მქონე ნივთიერებებისთვის (მაგალითად, წყალი). როდესაც ადსორბციული ცენტრები ადსორბენტის ზედაპირზე არის დაკავებული (მონომოლეკულური ფენა გაჯერებულია), შემდეგი ადსორბირებული მოლეკულების „დაშვება“ ხდება უკვე შეწოვილ მოლეკულებთან ინტერმოლეკულური ურთიერთქმედების გამო (ნახ. 1.6). ასეთი ადსორბციის სითბო აბსოლუტური სიდიდით ახლოს არის, მაგრამ შესაბამისი სითხის აორთქლების სითბოს საპირისპირო ნიშნით (დაფიქრდით რატომ).

სურ.1.6. ადსორბციის სქემა:
a - მონომოლეკულური ადსორბცია; ბ - პოლიმოლეკულური ადსორბცია
რაც უფრო ვუახლოვდებით რადსორბირებული ნივთიერების გაჯერებული ორთქლის წნევამდე იგი იწყებს კონდენსაციას ადსორბენტის ზედაპირზე, რის შედეგადაც ის სწრაფად იზრდება მატებასთან ერთად. რ.
ორ ატომს შორის ურთიერთქმედების შემთხვევაში:
U – ურთიერთქმედების ენერგია;
U = U PRIOR. + U დაბრუნება
 - ლენარდ-ჯონსის განტოლება
, c, b, m = const
- ლენარდ-ჯონსის განტოლება
, c, b, m = const
ატომების მყარ ზედაპირთან ურთიერთქმედების შემთხვევაში აუცილებელია ყველა ურთიერთქმედების შეჯამება.
x - მანძილი ზედაპირამდე
r – მიზიდულობის ძალების მოქმედების რადიუსი
dV - მოცულობა
n – ზედაპირული მოლეკულების რაოდენობა
U ADS. - ადსორბციული ურთიერთქმედების ენერგია



ადსორბციის შემთხვევაში, მიზიდულობა იზრდება. ხოლო არაპოლარული-არაპოლარული ურთიერთქმედების შემთხვევაში, ადსორბცია ძირითადად ლოკალიზებულია ჩაღრმავებში.
ელექტროსტატიკური ურთიერთქმედება.
პოლარული ადსორბენტი - არაპოლარული ადსორბატი
არაპოლარული ადსორბენტი - პოლარული ადსორბატი
პოლარული ადსორბენტი - პოლარული ადსორბატი.
მ  ადსორბატის მოლეკულა წარმოდგენილია დიპოლის სახით, ხოლო ადსორბენტი წარმოდგენილია როგორც გამტარი, რომელშიც ადსორბატის მოლეკულა იწვევს დიპოლურ სარკეს სიმეტრიულად მოცემულთან მიმართებაში.
ადსორბატის მოლეკულა წარმოდგენილია დიპოლის სახით, ხოლო ადსორბენტი წარმოდგენილია როგორც გამტარი, რომელშიც ადსორბატის მოლეკულა იწვევს დიპოლურ სარკეს სიმეტრიულად მოცემულთან მიმართებაში.
X - მანძილი შუამდე
ურთიერთქმედებისას პოტენციალი ჩნდება:
 ,
,
 - დიპოლური მომენტი.
- დიპოლური მომენტი.
პოტენციალი მიდრეკილია მიიღოს მაქსიმალური მნიშვნელობა, ე.ი. დიპოლები მიდრეკილნი არიან ორიენტირდნენ ზედაპირზე პერპენდიკულურად.
ვინაიდან ტემპერატურის მატება ხელს უწყობს ბრაუნის მოძრაობის ზრდას, ეს იწვევს ადსორბციის პროცესის დათრგუნვას.
ელექტროსტატიკური ურთიერთქმედების შემთხვევაში, ადსორბატი უპირატესად ლოკალიზებულია პროტრუზიებზე.
ფუნდამენტური ადსორბციის განტოლება.
ადსორბციის შემთხვევაში ხდება კომპონენტის გადანაწილება, რაც ნიშნავს ქიმიური პოტენციალის ცვლილებას. ადსორბციის პროცესი შეიძლება ჩაითვალოს, როგორც ზედაპირის ენერგიის ქიმიურ ენერგიად გადასვლა.
ფენის მოცულობა = 0, შემდეგ თერმოდინამიკის I და II კანონების განზოგადებული განტოლება:
T = const; (1) = (2) => 

ორკომპონენტიანი სისტემისთვის:
,
 ,
,
 =>
=>
=>
 - გიბსის ადსორბციის განტოლება
.
- გიბსის ადსორბციის განტოლება
.
ტელევიზორის ადსორბციის შემთხვევისთვის. სხეული - გაზი: , 
 ,
,

 - იზოთერმი
- იზოთერმი
 - იზობარი
- იზობარი
 - იზოპინალური
- იზოპინალური
 - იზოსტერი
- იზოსტერი
იზოთერმი, იზოპიკნი, იზოსტერე დაკავშირებულია ერთმანეთთან.
იმიტომ რომ ადსორბციის ფუნქცია 



ჰენრი იზოთერმი Langmuir იზოთერმი



თერმოდინამიკა. ადსორბცია.
შედედებული ნივთიერებისთვის:
 ,
,
 ,
,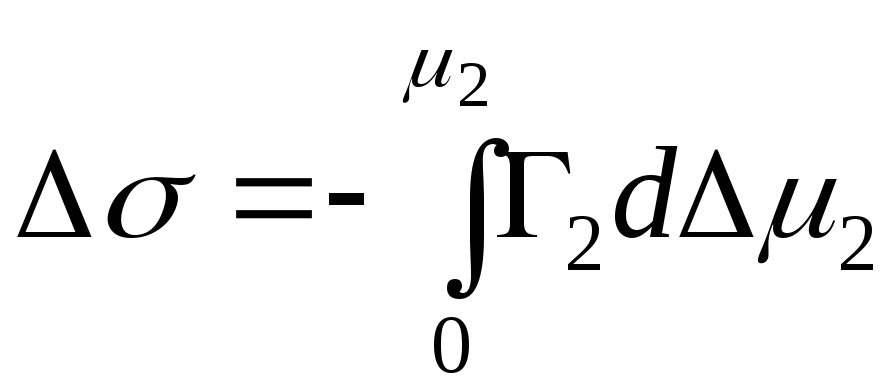
 - გიბსის ენერგიის განუყოფელი ცვლილება
.
- გიბსის ენერგიის განუყოფელი ცვლილება
.

P – წნევა მოსახვევ ზედაპირზე, Р S – წნევა ბრტყელ ზედაპირზე
 - ადსორბციის პოტენციალი
- ადსორბციის პოტენციალი
დიფერენციალური ცვლილება ტრაპიაში 
 , Г = კონსტ
, Г = კონსტ
- დიფერენციალური ენტროპიის ცვლილება
- ადსორბციის დიფერენციალური ენთალპია
 - ადსორბციის იზოტერული სითბო
- ადსორბციის იზოტერული სითბო
 - კონდენსაციის სითბო
- კონდენსაციის სითბო
 - ადსორბციის წმინდა სითბო
- ადსორბციის წმინდა სითბო

 ,
,




Qa - ადსორბციის ინტეგრალური სითბო, 
Qra - ადსორბციის ინტეგრალური წმინდა სითბო,

ჰენრის განტოლება
ადსორბციის შესწავლა გართულებულია ზედაპირის ჰეტეროგენურობით, ამიტომ უმარტივესი კანონები მიიღება ერთგვაროვანი ზედაპირებისთვის.
განვიხილოთ აირების ურთიერთქმედება მყარ ზედაპირთან, როდესაც გაზი გადადის წონასწორული მდგომარეობიდან მოცულობით წონასწორულ მდგომარეობაში ზედაპირზე. ეს შემთხვევა სიმძიმის ველში აირების წონასწორობის ანალოგია.
 ,
,
 ,
=>
,
=> -ჰენრის განტოლება
-ჰენრის განტოლება
 - განაწილების კოეფიციენტი
- განაწილების კოეფიციენტი
ადსორბციის პროცესის დროს ხდება ქიმიური პოტენციალის ცვლილება.
ნაყარი ფაზისთვის: 
ზედაპირზე გაზისთვის: 
წონასწორობის მდგომარეობაში  , ე.ი.
, ე.ი.

ჰენრის განტოლებაში მუდმივი არ არის დამოკიდებული კონცენტრაციაზე
ჰენრის განტოლება მოქმედებს დაბალი წნევისა და კონცენტრაციის რეგიონში. კონცენტრაციის მატებასთან ერთად შესაძლებელია ჰენრის კანონის 2 ტიპის გადახრები:
1 - დადებითი გადახრები, D მცირდება, A მცირდება
2 - უარყოფითი გადახრები, D - იზრდება, A - იზრდება.
გადახრის ტიპი განისაზღვრება ადსორბენტ-ადსორბატის ურთიერთქმედების ამა თუ იმ ტიპის უპირატესობით.
ძლიერი წებოვანი ურთიერთქმედებით, აქტივობის კოეფიციენტები იზრდება - დადებითი გადახრა. შეკრული ურთიერთქმედების შემთხვევაში შეინიშნება უარყოფითი გადახრები.
მონომოლეკულური ადსორბცია.
ლანგმუირის იზოთერმი.
უმარტივესი ნიმუშები იქნა მიღებული ჰენრის თეორიაში. ლანგმუირმა შემოგვთავაზა თეორია, რომლის მიხედვითაც ადსორბცია განიხილება, როგორც კვაზიქიმიური რეაქცია. სადაც:
ზედაპირი ენერგიულად ერთგვაროვანია.
ადსორბცია ლოკალიზებულია, თითოეული ადსორბციის ცენტრი ურთიერთქმედებს ერთ ადსორბატულ მოლეკულასთან.
ადსორბატის მოლეკულები არ ურთიერთქმედებენ ერთმანეთთან.
მონოფენის ადსორბცია.

 - ზედაპირი,
- ზედაპირი,  - ადსორბირება,
- ადსორბირება,  - ადსორბციული კომპლექსი.
- ადსორბციული კომპლექსი.
 შემდეგ ადსორბციის ადგილების კონცენტრაცია:
შემდეგ ადსორბციის ადგილების კონცენტრაცია:  ,
, - ადსორბციის შეზღუდვა.
- ადსორბციის შეზღუდვა.
 , მაშინ რეაქციის მუდმივია:
, მაშინ რეაქციის მუდმივია: 

 - ლანგმუირის განტოლება.
- ლანგმუირის განტოლება.
ადსორბციის დამოკიდებულება კონცენტრაციაზე
1 )
)
 ,
,

2) მაღალი კონცენტრაციის ფართობი
 - ადსორბციის შეზღუდვა, მონომოლეკულური შრის წარმოქმნა
- ადსორბციის შეზღუდვა, მონომოლეკულური შრის წარმოქმნა
გიბსის ენერგიისთვის: .
g არის ენტროპიის ფაქტორი.
ჰენრის იზოთერმის შემთხვევაში, გიბსის ენერგია ახასიათებს ადსორბატის გადასვლას სტანდარტული მდგომარეობიდან ზედაპირის სტანდარტულ მდგომარეობაში. ლანგმუირის იზოთერმის შემთხვევაში  ახასიათებს ადსორბენტსა და ადსორბატს შორის კავშირის ხარისხს.
ახასიათებს ადსორბენტსა და ადსორბატს შორის კავშირის ხარისხს.
 ნაპოვნია van't Hoff isobar-დან.
ნაპოვნია van't Hoff isobar-დან.

 , მაშინ
, მაშინ  , აქედან
, აქედან  .
.

 - ზედაპირის შევსების ხარისხი.
- ზედაპირის შევსების ხარისხი.




 - თავისუფალი ადგილების რაოდენობა,
- თავისუფალი ადგილების რაოდენობა,  - დაკავებული ადგილების რაოდენობა.
- დაკავებული ადგილების რაოდენობა.
 ,
,

იმათ. მაღალი კონცენტრაციების რეგიონში, თავისუფალი ადგილების რაოდენობა უკუპროპორციულია ადსორბატის რაოდენობასთან.
აირების ნარევის ადსორბცია ერთგვაროვან ზედაპირზე.
ამ შემთხვევაში, ადსორბციის პროცესი განიხილება, როგორც ორი პარალელური რეაქცია.
 (1)
(1)

 (2)
(2)


აირების ნარევის ადსორბცია არაერთგვაროვან ზედაპირზე.
არაერთგვაროვანი ზედაპირის შემთხვევაში არ შეიძლება შემოიფარგლოთ საშუალო შევსებით.
კონკურენციის შედეგად შესაძლებელია სხვადასხვა ადსორბატების ლოკალიზაცია სხვადასხვა ტიპის ადგილებში.
ამ შემთხვევაში ურთიერთობა  .
.
 ,
,
 - ადსორბატის გაჯერებული ორთქლის წნევა.
- ადსორბატის გაჯერებული ორთქლის წნევა.
 ,
,
 - ადსორბციის სითბო.
- ადსორბციის სითბო.
"+" - სიმბატური დამოკიდებულება, "-" - ანტიბატური დამოკიდებულება, "N" - არანაირი კორელაცია.
"+" - ადსორბცია მიმდინარეობს იმავე მექანიზმის მიხედვით. ენერგიულად ყველაზე ხელსაყრელ ადგილებში, ზედაპირთან მაღალი მიდრეკილების მქონე გაზი უპირატესად ადსორბირდება.
"-" - ადსორბცია ხდება სხვადასხვა მექანიზმით და დროის გარკვეულ მომენტამდე არ არის კონკურენცია ზედაპირისთვის.
მონომოლეკულური ადსორბცია ძირითადად ხორციელდება აირების ფიზიკური ადსორბციის დროს დაბალი მნიშვნელობებით. გვ, ასევე თხევადი/გაზის ინტერფეისზე.
პოლიმოლეკულური ადსორბცია.
BET თეორია(ბრუნაუერი, ემეტი, თელერი).
იმ შემთხვევაში, როდესაც მონოფენის წარმოქმნა არ არის საკმარისი ზედაპირის ენერგიის კომპენსაციისთვის, ადსორბცია პოლიმოლეკულურია და შეიძლება ჩაითვალოს ზედაპირული ძალების მოქმედების ქვეშ იძულებითი კონდენსაციის შედეგად.
ძირითადი პუნქტები:
როდესაც ადსორბატის მოლეკულა ხვდება დაკავებულ ადგილს, წარმოიქმნება მრავალჯერადი ნაკრები.
რაც უფრო ვუახლოვდებით გვრომ გვ სმცირდება უფასო ადსორბციული ადგილების რაოდენობა. თავდაპირველად მატულობს და შემდეგ მცირდება ერთეულების, დუბლის და ა.შ. კომპლექტებში.
ზე გვ =გვ ს ადსორბცია გადაიქცევა კონდენსაციაში.
ჰორიზონტალური ურთიერთქმედება არ არის.
პირველი ფენისთვის შესრულებულია ლანგმუირის იზოთერმი.
ზედაპირი განიხილება როგორც ადსორბციული ადგილების ერთობლიობა. დინამიური წონასწორობის პირობა მოქმედებს: თავისუფალ ადგილებში კონდენსაციის სიჩქარე უდრის დაკავებული ადგილებიდან აორთქლების სიჩქარეს.
a არის კონდენსაციის კოეფიციენტი (ზედაპირზე შედედებული მოლეკულების ფრაქცია);
 ,
,
Zm - უფასო ადგილების მაქსიმალური რაოდენობა.
 - ატომური ვიბრაციების სიხშირე ზედაპირის პერპენდიკულარული მიმართულებით.
- ატომური ვიბრაციების სიხშირე ზედაპირის პერპენდიკულარული მიმართულებით.
პირველი ფენისთვის, დინამიური წონასწორობის პირობები:



 , მაშინ
, მაშინ
 - ლანგმუირის განტოლება.
- ლანგმუირის განტოლება.
მეორე ფენისთვის მართალი იქნება: 
i-ე ფენისთვის: 
სიმარტივისთვის, ვარაუდობენ, რომ a და ν ერთი და იგივეა ყველა ფენისთვის პირველის გარდა. ყველა ფენისთვის, გარდა პირველისა, ადსორბციის სითბო მუდმივია. ბოლო ფენისთვის ადსორბციის სითბო უდრის კონდენსაციის სითბოს. შედეგად მიღებული განტოლება
 (*)
(*)
C- მუდმივი,
BET თეორიის შემთხვევაში, მუდმივი თანახასიათებს გიბსის სუფთა ადსორბციის ენერგიას. განტოლება შეიცავს მხოლოდ ერთ მუდმივობას და ეს განტოლება ასევე ძალიან მნიშვნელოვანია ადსორბენტის კონკრეტული ზედაპირის ფართობის დასადგენად.
ვინაიდან სითბო გამოიყოფა ადსორბციის შედეგად, ზედაპირის სპეციფიკური არეები განისაზღვრება დაბალ ტემპერატურაზე.
 ????????????
????????????


თეორიის მთავარი ნაკლი- ჰორიზონტალური ურთიერთქმედებების უგულებელყოფა ვერტიკალურის სასარგებლოდ.
განტოლება მოქმედებს დიაპაზონში  0.05-დან 0.3-მდე.
0.05-დან 0.3-მდე.
სად  <
0,05 – существенное влияние оказывает
неоднородность поверхности.
<
0,05 – существенное влияние оказывает
неоднородность поверхности.
 > 0.3 – გავლენას ახდენს ადსორბატი-ადსორბატის ურთიერთქმედება.
> 0.3 – გავლენას ახდენს ადსორბატი-ადსორბატის ურთიერთქმედება.
ადსორბატ-ადსორბატის ურთიერთქმედების აღრიცხვა.
ურთიერთქმედება ხდება მაშინ, როდესაც განშტოებული მოლეკულები ან მოლეკულები ადსორბირდება არაპოლარულ ზედაპირზე. შეუძლია თანამოაზრეების ჩამოყალიბება. ამ შემთხვევაში იცვლება ადსორბციული იზოთერმების ფორმა.
ა  ადსორბენტი არ არის პოლარული.
ადსორბენტი არ არის პოლარული.
გრაფიკი 1 შეესაბამება სუსტ ადსორბატ-ადსორბატულ ურთიერთქმედებებს და ძლიერ ადსორბატ-ადსორბენტურ ურთიერთქმედებებს.
გრაფიკი 2 შეესაბამება ძლიერ ადსორბატ-ადსორბატს და ძლიერ ადსორბატ-ადსორბენტურ ურთიერთქმედებებს.
გრაფიკი 3 შეესაბამება ძლიერ ადსორბატ-ადსორბატულ ურთიერთქმედებას და სუსტ ადსორბატ-ადსორბენტურ ურთიერთქმედებას.
 ,
,

ადსორბატულ მოლეკულებს შორის ურთიერთქმედების შემთხვევაში აუცილებელია აქტივობის კოეფიციენტების ცვლილებების გათვალისწინება. და ეს განტოლება იწერება ასე:
 - ფრუნკინის, ფაულერის, გუგენჰაიმის განტოლება.
- ფრუნკინის, ფაულერის, გუგენჰაიმის განტოლება.
კ- მიზიდულობის მუდმივი.
პოლიანის პოტენციური თეორია.
ეს თეორია არ გამოიმუშავებს რაიმე ტიპის ადსორბციის იზოთერმს, მაგრამ შესაძლებელს ხდის იზოთერმების გამოთვლას სხვადასხვა ტემპერატურაზე.
ადსორბცია- ეს არის ადსორბატის მიზიდვის შედეგი ადსორბციის ზედაპირზე ადსორბციის პოტენციალის მოქმედების გამო, რომელიც არ არის დამოკიდებული სხვა მოლეკულების არსებობაზე და დამოკიდებულია ზედაპირსა და ადსორბატულ მოლეკულას შორის მანძილზე.
 ,
,
 - ადსორბციის პოტენციალი.
- ადსორბციის პოტენციალი.
ვინაიდან ზედაპირი არაერთგვაროვანია, მანძილი იცვლება ადსორბციის მოცულობით  .ადსორბციის მოცულობაარის მოცულობა, რომელიც ჩასმულია ზედაპირსა და მოცემულ მნიშვნელობის შესაბამის წერტილს შორის
.ადსორბციის მოცულობაარის მოცულობა, რომელიც ჩასმულია ზედაპირსა და მოცემულ მნიშვნელობის შესაბამის წერტილს შორის  .
.
ადსორბციის პოტენციალიარის 1 მოლი ადსორბატის გადატანის სამუშაო მოცემული ადსორბციული მოცულობის გარეთ ადსორბციის მოცულობის მოცემულ წერტილში (ან ადსორბატის 1 მოლი გაჯერებული ორთქლის გადატანის სამუშაო, რომელიც წონასწორობაშია თხევად ადსორბატთან ადსორბენტის არარსებობის შემთხვევაში. ორთქლის ფაზაში ადსორბენტთან წონასწორობაში).

დამახასიათებელი მრუდი
 - ადსორბციის პოტენციალი,
- ადსორბციის პოტენციალი, 
მოცემული ადსორბენტისთვის და სხვადასხვა ადსორბატებისთვის, მართალია შემდეგი: 
სხვადასხვა ტიპის ადსორბატებისთვის  ,
,
სად  ადსორბციული იზოთერმების პოტენციალი შედარებითი წნევის დროს
ადსორბციული იზოთერმების პოტენციალი შედარებითი წნევის დროს  ადსორბატისთვის 1 და ადსორბატისთვის 2. ეს თანაფარდობა არის მუდმივი მნიშვნელობა.
ადსორბატისთვის 1 და ადსორბატისთვის 2. ეს თანაფარდობა არის მუდმივი მნიშვნელობა.
 - აფინურობის კოეფიციენტი
- აფინურობის კოეფიციენტი
კაპილარული კონდენსაციის თეორია.
ადსორბციის პროცესის მიმდინარეობა დიდწილად დამოკიდებულია ფოროვანი სხეულის სტრუქტურაზე.
|
მიკროფოროვანი | |
|
გარდამავალი ფოროვანი | |
|
მაკროფოროვანი |
მიკროფოროვანი სორბენტების შემთხვევაში ადსორბციული ძალების ველები ერთმანეთს ემთხვევა. მაკროფოროვანი სორბენტების შემთხვევაში ფორები მოქმედებს როგორც სატრანსპორტო არხები. კონდენსაციის პროცესები ყველაზე მნიშვნელოვანია გარდამავალ ფოროვან სხეულებში. კაპილარული კონდენსაცია იწყება გარკვეული მნიშვნელობებით გვდა  , როცა ზედაპირის ენერგიის ნაწილი უკვე კომპენსირებულია. აუცილებელი პირობაა, რომ ზედაპირი თვითდასველებული იყოს. პროცესი აღწერილია ტომპსონ-კელვინის განტოლება.
, როცა ზედაპირის ენერგიის ნაწილი უკვე კომპენსირებულია. აუცილებელი პირობაა, რომ ზედაპირი თვითდასველებული იყოს. პროცესი აღწერილია ტომპსონ-კელვინის განტოლება.

 - დამსველების შემთხვევაში, გამრუდების ცენტრი გაზის ფაზაშია.
- დამსველების შემთხვევაში, გამრუდების ცენტრი გაზის ფაზაშია.
კაპილარული კონდენსაციის შემთხვევაში ადსორბციის იზოთერმას აქვს ისტერიული ფორმა. ქვედა ტოტი შეესაბამება ადსორბციის პროცესს, ხოლო ზედა ტოტი - დეზორბციის პროცესს.
ყველა ტიპის ფორები შეიძლება შემცირდეს სამ ტიპად:
|
კონუსური |
ცილინდრული ერთი დახურული ბოლოთი |
ცილინდრული ორი ღია ბოლოებით |
|
პროცესის შევსება ხორციელდება ფორების ქვედა მხრიდან. ადსორბციის იზოთერმი და დეზორბციის იზოთერმი ამ შემთხვევაში ემთხვევა ერთმანეთს, ვინაიდან ადსორბციის პროცესი იწყება სფეროდან და დეზორბციის პროცესიც იწყება ზოგიერთი სფეროს გაქრობით.
↓ |
არ არის ისტერეზი. წინ და საპირისპირო ინსულტი აღწერილია განტოლებით:
|
ფსკერი არსად არ არის, ფორების შევსება ცილინდრის კედლებზე წავა.
ცილინდრი: იზოთერმს ექნება ისტერიული გარეგნობა.
↓ |
IN  ტენიანობის პირობებში კონდენსაცია ხდება დაბალ წნევაზე, რაც ენერგიულად ხელსაყრელია. დეზორბციის ტოტიდან მიღებულია ფორების ზომის განაწილების მრუდები.
ტენიანობის პირობებში კონდენსაცია ხდება დაბალ წნევაზე, რაც ენერგიულად ხელსაყრელია. დეზორბციის ტოტიდან მიღებულია ფორების ზომის განაწილების მრუდები.
დიფერენციალური მრუდის მაქსიმუმი გადაინაცვლებს მარცხნივ ინტეგრალური მრუდის დახრის წერტილის მიმართ. მცირე ფორების საერთო მოცულობა მცირეა, მაგრამ აქვს დიდი ზედაპირი. პორების ზომის გაზრდით, მათი მოცულობა იზრდება როგორც  , და ტერიტორია მსგავსია
, და ტერიტორია მსგავსია  , ამის გამო შეინიშნება დიფერენციალური მრუდის მაქსიმუმის ცვლა.
, ამის გამო შეინიშნება დიფერენციალური მრუდის მაქსიმუმის ცვლა.
ადსორბცია მყარი-თხევადი ინტერფეისით.
მყარი აირის ინტერფეისზე ადსორბციის შემთხვევაში, ჩვენ უგულებელვყავით ერთი კომპონენტი. მყარი-თხევადი ინტერფეისზე ადსორბციის შემთხვევაში, ადსორბატი ანაცვლებს გამხსნელის მოლეკულებს ადსორბენტის ზედაპირიდან.
 ,
,
განტოლება სწორია:

 ,
,
N 1, N 2 – გამხსნელის და კომპონენტის მოლური ფრაქციები, N 1 + N 2 = 1, შემდეგ
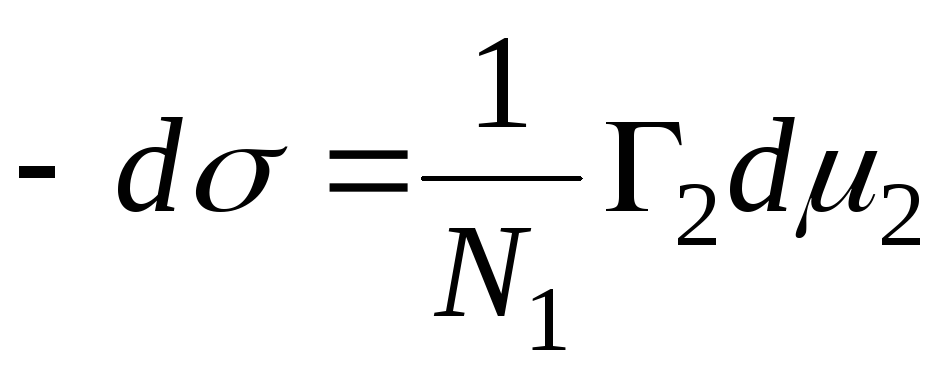 ,
=>
,
=>
 , მაშინ არის ადსორბციის განტოლება მყარი-თხევადი ინტერფეისისთვის.
, მაშინ არის ადსორბციის განტოლება მყარი-თხევადი ინტერფეისისთვის.
ადსორბცია (G) > 0 at  <
0
<
0
თუ ღირებულებები  რადგან კომპონენტი და გამხსნელი ძალიან განსხვავებულია, ამ შემთხვევაში დამოკიდებულება გსაწყისი ნაქვს ექსტრემუმი ღირებულებაზე ნ
~ 0,5.
რადგან კომპონენტი და გამხსნელი ძალიან განსხვავებულია, ამ შემთხვევაში დამოკიდებულება გსაწყისი ნაქვს ექსტრემუმი ღირებულებაზე ნ
~ 0,5.
ე  თუ
თუ  აქვს ახლო მნიშვნელობები, ამ შემთხვევაში შეიძლება შეიცვალოს ადსორბციის ნიშანი. დამოკიდებულება გსაწყისი ნკვეთს x-ღერძს
აქვს ახლო მნიშვნელობები, ამ შემთხვევაში შეიძლება შეიცვალოს ადსორბციის ნიშანი. დამოკიდებულება გსაწყისი ნკვეთს x-ღერძს
ფუნქცია გადაკვეთის წერტილი გ(ნ) x-ღერძით ეწოდება ადსორბციული აზეოტროპი. ეს ნიშნავს, რომ ორი კომპონენტის გამოყოფა შეუძლებელია მოცემულ ადსორბენტზე.
ადსორბციის იზოთერმის განტოლება გაცვლის მუდმივთან.
მყარი-თხევადი ინტერფეისზე ადსორბციის დროს, კომპონენტების მუდმივი გადანაწილება ხდება ადსორბენტის ზედაპირსა და ხსნარის მოცულობას შორის.
 - კომპონენტები (- - ეხება ზედაპირს)
- კომპონენტები (- - ეხება ზედაპირს)

 ,
,
 ,
, .
.
 ,
,


ადსორბცია თხევადი აირის ინტერფეისზე
რ  განვიხილოთ კონცენტრაციის პროფილის ცვლილება თხევადი აირის ინტერფეისის გადაკვეთისას. დაე, კომპონენტი 2 იყოს არასტაბილური.
განვიხილოთ კონცენტრაციის პროფილის ცვლილება თხევადი აირის ინტერფეისის გადაკვეთისას. დაე, კომპონენტი 2 იყოს არასტაბილური.
Cs – კონცენტრაცია ზედაპირულ ფენაში.
ჭარბი ადსორბციის განმარტებაზე დაყრდნობით

თუ კომპონენტი არ არის არასტაბილური, მაშინ ადსორბციის მნიშვნელობა ჩაიწერება შემდეგნაირად:
პ  რი
რი 

ეკვ.  ნივთიერების ბუნება აღწერილია მისი წარმოებულით
ნივთიერების ბუნება აღწერილია მისი წარმოებულით  .
.
ზედაპირული დაძაბულობის იზოთერმი შეიძლება იყოს 1 ან 2 ფორმის:
1 - ზედაპირულად აქტიური ნივთიერებები
2 - ზედაპირულად აქტიური ნივთიერებები
ზედაპირული აქტივობა g არის ნივთიერებების უნარი, შეამცირონ ზედაპირული დაძაბულობა სისტემაში.

 - ზედაპირის ფენის სისქე
- ზედაპირის ფენის სისქე
C ს- კომპონენტის კონცენტრაცია ზედაპირულ ფენაში
თან- მოცულობის კონცენტრაცია
ჰომოლოგიური სერიებისთვის არსებობს წესი:
 - ტრაუბო დუკლოს წესი
- ტრაუბო დუკლოს წესი
ჰომოლოგიური სერიებისთვის, ადსორბციის იზოთერმი ასე გამოიყურება:
A-ს ნაცვლად ვწერთ G, რადგან ადსორბცია გადაჭარბებულია ზედაპირულ ფენაში.
ზედაპირული დაძაბულობის იზოთერმი:

 - სუფთა გამხსნელის ზედაპირული დაძაბულობა.
- სუფთა გამხსნელის ზედაპირული დაძაბულობა.
 - ფუნდამენტური ადსორბციის განტოლება;
- ფუნდამენტური ადსორბციის განტოლება;
 - ლანგმუირის განტოლება.
- ლანგმუირის განტოლება.
ერთად მოვაგვაროთ ისინი:

- შიშკოვსკის განტოლება.
ბ– მუდმივი ჰომოლოგიური სერიებისთვის.
ა- ერთი ჰომოლოგიდან მეორეზე გადასვლისას იზრდება 3-3,5-ჯერ 
![]()
1 - დაბალი კონცენტრაციის ფართობი
![]()
2 – საშუალო კონცენტრაცია
3 – მონომოლეკულური ფენა
სურფაქტანტები დიფილური მოლეკულებია, ე.ი. მოიცავს პოლარულ ჯგუფს და არაპოლარული ნახშირწყალბადის რადიკალს.
o არის მოლეკულის პოლარული ნაწილი.
| - მოლეკულის არაპოლარული ნაწილი.
პოლარულ გამხსნელებში ზედაპირულად აქტიური ნივთიერების მოლეკულები ისეა ორიენტირებული, რომ მოლეკულის პოლარული ნაწილი გამხსნელისკენ არის მიმართული, ხოლო არაპოლარული ნაწილი გადადის გაზის ფაზაში.
შიშკოვსკის განტოლებაში  , ის მუდმივია ჰომოლოგიური სერიებისთვის.
, ის მუდმივია ჰომოლოგიური სერიებისთვის.
სურფაქტანტის ეფექტი იწყება ნ>5. მონომოლეკულური შრის კონცენტრაციაზე მაღალი კონცენტრაციების დროს მიცელიზაცია ხდება ზედაპირულად აქტიური ხსნარებში.
მიცელი– ეწოდება ამფიფილური სურფაქტანტის მოლეკულების აგრეგატს, რომლის ნახშირწყალბადების რადიკალები ქმნიან ბირთვს, ხოლო პოლარული ჯგუფები გადაიქცევა წყალ ფაზაში.
მიცელური მასა – მიცელური მასა.
ჰ  მოლეკულების რაოდენობა – აგრეგაციის ნომერი.
მოლეკულების რაოდენობა – აგრეგაციის ნომერი.
სფერული მიცელები
მიცელიზაციის შემთხვევაში ხსნარში წონასწორობა მყარდება
CMC - მიცელის წარმოქმნის კრიტიკული კონცენტრაცია.
ვინაიდან მიცელას ცალკე ფაზად მივიჩნევთ:
ჰომოლოგიური სერიებისთვის არის ემპირიული განტოლება:
ა- ფუნქციური ჯგუფის დაშლის ენერგია.
ბ – ადსორბციული პოტენციალის ზრდა, ადსორბციული სამუშაო მეთილენის ერთეულზე.
– ადსორბციული პოტენციალის ზრდა, ადსორბციული სამუშაო მეთილენის ერთეულზე.
მიცელებში ნახშირწყალბადის ბირთვის არსებობა ქმნის წყალში უხსნადი ნაერთების დაშლის შესაძლებლობას ზედაპირულად აქტიური ნივთიერებების წყალხსნარებში; ამ ფენომენს ეწოდება ხსნადი (რაც იხსნება არის ხსნადი, ზედაპირულად აქტიური ნივთიერება არის გამხსნელი).
ტალახი შეიძლება იყოს სრულიად არაპოლარული, შეიძლება შეიცავდეს როგორც პოლარულ, ასევე არაპოლარულ ნაწილებს და იყოს ორიენტირებული როგორც ზედაპირულად აქტიური ნივთიერების მოლეკულა.
ნებისმიერ შემთხვევაში, ხსნადიზაციის დროს ხდება მიცელარული მასის და აგრეგაციის რაოდენობის ზრდა არა მხოლოდ ხსნადიზატის შეყვანის გამო, არამედ სურფაქტანტის მოლეკულების რაოდენობის ზრდის გამო, რომელიც აუცილებელია წონასწორული მდგომარეობის შესანარჩუნებლად.
ხსნადიზაცია უფრო ეფექტურია, რაც უფრო დაბალია ხსნარის მოლეკულური წონა.

 ~ 72 მნ\მ.
~ 72 მნ\მ.
 ~ 33 მნ\მ.
~ 33 მნ\მ.
სურფაქტანტების ეფექტურობა დამოკიდებულია CMC მნიშვნელობაზე.
2D ზედაპირული ფენის წნევა

→ -ზედაპირის დაძაბულობის ძალები.
- ორგანზომილებიანი წნევა.
ზედაპირული ფენა არის ძალა, რომელიც ტოლია ზედაპირული დაძაბულობის განსხვავებას ზედაპირული ხსნარისა და სუფთა გამხსნელის მიმართ, მიმართული სუფთა ზედაპირისკენ.
წონასწორობა დამყარებულია ხსნარსა და ზედაპირულ ფენას შორის



ზე  არის ტერიტორია, სადაც
არის ტერიტორია, სადაც  ხაზოვანი დამოკიდებულია კონცენტრაციაზე.
ხაზოვანი დამოკიდებულია კონცენტრაციაზე.
გ [მოლ/მ2].
 - ფართობი, რომელსაც უკავია ნივთიერების ერთი მოლი
- ფართობი, რომელსაც უკავია ნივთიერების ერთი მოლი
მაშინ ორგანზომილებიანი წნევის იზოთერმა ექნება ფორმა 
 - ორგანზომილებიანი წნევის იზოთერმი.
- ორგანზომილებიანი წნევის იზოთერმი.
დამოკიდებულება  S M-დან:
S M-დან:

ზე  - ორგანზომილებიანი წნევა მკვეთრად იზრდება. ზე
- ორგანზომილებიანი წნევა მკვეთრად იზრდება. ზე  ორგანზომილებიანი დეფორმირებულია, რაც იწვევს უეცარ ზრდას
ორგანზომილებიანი დეფორმირებულია, რაც იწვევს უეცარ ზრდას  .
.
ორივე მხრიდან იდენტური ფაზებით შემოსაზღვრულ ფილმს ორმხრივი ეწოდება. ასეთ ფილმებში შეინიშნება დედა ლიქიორის მუდმივი მოძრაობა.
5 ნმ-ზე ნაკლები სისქის ფილმებს შავი ფილმები ეწოდება.

ადსორბციულ ფენებს უნდა ჰქონდეს ორი მახასიათებელი: სიბლანტე და მარტივი მობილურობა, სითხე და ელასტიურობა.
მარანგონის ეფექტი თვითგანკურნებადია.
გიბსის სამკუთხედი,  - ზედმეტი წნევა.
- ზედმეტი წნევა.
ფილმი გადაჭიმულია და იმის გამო, რომ სითხის ნაწილი დარჩა, ზედაპირულად აქტიური ნივთიერებები მიედინება თავისუფალ სივრცეში. გიბსის სამკუთხედი.
სხეულების ადსორბციის სიძლიერის ეფექტი.
ფილმის ზედაპირზე ყოველთვის არის ადსორბციული ფენა, რისთვისაც შემდეგ
ლანგმუირის განტოლება:


 ორგანზომილებიან წნევაში
ორგანზომილებიან წნევაში
 - შიშკოვსკის განტოლების ანალოგი
- შიშკოვსკის განტოლების ანალოგი
ელექტროკინეტიკური ფენომენები. ელექტრო ორმაგი ფენა (EDL).
გელემჰოლცის მოდელი. გუი-ჩეპმენის თეორია.
1808 ფრენა

უ – ფორმის მილი, ჩაყარეთ მასში 2 ელექტროდი. დარღვეულია კომუნიკაციის გემების კანონი და ხდება მილში სითხის დონის ცვლილება - ელექტროკინეტიკური მოვლენები.
კინეტიკური ფენომენები:
ელექტროფორეზი
ელექტროოსმოზი
ნაკადის (ნაკადის) პოტენციალი
დალექვის პოტენციალი
1 და 2 წარმოიქმნება პოტენციური სხვაობის გამოყენებისას; 3 და 4, კოლოიდური ნაწილაკების დარტყმა და დალექვა იწვევს პოტენციური სხვაობის გაჩენას.
ელექტროოსმოზი არის დისპერსიული გარემოს მოძრაობა სტაციონარული დისპერსიული ფაზის მიმართ ელექტრული დენის გავლენის ქვეშ.
ელექტროფორეზი - ეს არის დისპერსიული ფაზის ნაწილაკების მოძრაობა სტაციონარულ დისპერსიულ გარემოსთან მიმართებაში ელექტრული დენის გავლენის ქვეშ.
პ  ელექტროკინეტიკური ფენომენების წარმოქმნის მიზეზი არის მუხტების სივრცითი გამოყოფა და ორმაგი ელექტრული ფენის გამოჩენა.
ელექტროკინეტიკური ფენომენების წარმოქმნის მიზეზი არის მუხტების სივრცითი გამოყოფა და ორმაგი ელექტრული ფენის გამოჩენა.
ელექტრული ორმაგი ფენა არის ბრტყელი კონდენსატორი, ერთი ფირფიტა წარმოიქმნება პოტენციალის განმსაზღვრელი იონებით, მეორე კი კონტრ-იონებით. იონები დაბინძურებულია ისევე, როგორც პოტენციალის განმსაზღვრელი კო-იონები იხსნება ხსნარის მოცულობაში. მანძილი ფირფიტებს შორის  . პოტენციალი წრფივად ეცემა, პოტენციური განსხვავება
. პოტენციალი წრფივად ეცემა, პოტენციური განსხვავება  .
.
გარე პოტენციური განსხვავება იწვევს ათვლის მოდულის გამოჩენას  არის ძალების წყვილი ერთეულ ფართობზე, რომელიც მოქმედებს მყარი სხეულის ზედაპირის გასწვრივ.
არის ძალების წყვილი ერთეულ ფართობზე, რომელიც მოქმედებს მყარი სხეულის ზედაპირის გასწვრივ.

წონასწორობაში ათვლის მოდული უდრის ბლანტი ხახუნის მოდულს (  ).
).

ჩვენს პირობებში  ,
,

 - გელემჰოლც-სმალუკოვსკის განტოლება
- გელემჰოლც-სმალუკოვსკის განტოლება
 - ფაზის გადაადგილების ხაზოვანი სიჩქარე.
- ფაზის გადაადგილების ხაზოვანი სიჩქარე.
ე- ელექტრული ველის სიძლიერე.
 - პოტენციური განსხვავება ფირფიტებს შორის
- პოტენციური განსხვავება ფირფიტებს შორის
 - ელექტროფორეზული მობილურობა [მ 2 /(V*s)].
- ელექტროფორეზული მობილურობა [მ 2 /(V*s)].
ჰელემჰოლცის მოდელი არ ითვალისწინებს მოლეკულების თერმულ მოძრაობას. სინამდვილეში, იონების განაწილება ორ ფენაში უფრო რთულია.
გუიმ და ჩეპმენმა დაადგინეს DES-ის შემდეგი მიზეზები:
იონის გადასვლა ერთი ფაზიდან მეორეზე, როდესაც წონასწორობა დამყარებულია.
მყარი ფაზის ნივთიერების იონიზაცია.
ზედაპირის დასრულება დისპერსიულ გარემოში არსებული იონებით.
პოლარიზაცია გარე დენის წყაროდან.
ელექტრო ორმაგ ფენას აქვს ბუნდოვანი ან დიფუზური სტრუქტურა. იონები, როგორც წესი, თანაბრად ნაწილდება დიფუზურ ფენაში.
დიფუზური ფენა შედგება კონტრინონებისგან, ფენის სიგრძე განისაზღვრება მათი კინეტიკური ენერგიით. ტემპერატურაზე, რომელიც უახლოვდება აბსოლუტურ ნულს, კონტრ-იონები მაქსიმალურად ახლოს არიან პოტენციალის განმსაზღვრელ იოებთან.
დანიას თეორია ემყარება ორ განტოლებას:
ბოლცმანის განტოლება

 - მუშაობა ელექტროსტატიკური ურთიერთქმედების ძალების წინააღმდეგ.
- მუშაობა ელექტროსტატიკური ურთიერთქმედების ძალების წინააღმდეგ.
 - მოცულობითი მუხტის სიმკვრივე.
- მოცულობითი მუხტის სიმკვრივე.

პუასონის განტოლება 
ვინაიდან EDL სისქე გაცილებით მცირეა ვიდრე ნაწილაკების ზომა და ბრტყელი EDL წარმოებული კოორდინატებთან მიმართებაში  და
და  გაუქმებულია.
გაუქმებულია. 
იყიდება e y at y<<1 функцию можно разложить в ряд Маклорена:

მოდით შემოვიფარგლოთ სერიის ორი ტერმინით, შემდეგ:


 - DEL სისქე არის მანძილი, რომლის დროსაც მცირდება DEL პოტენციალი ეერთხელ.
- DEL სისქე არის მანძილი, რომლის დროსაც მცირდება DEL პოტენციალი ეერთხელ.
რაც უფრო დაბალია ტემპერატურა, მით ნაკლებია  . T→0-ზე – ბინა DEL. რაც უფრო მაღალია კონცენტრაცია, მით მეტი მე, მით ნაკლები
. T→0-ზე – ბინა DEL. რაც უფრო მაღალია კონცენტრაცია, მით მეტი მე, მით ნაკლები  .
.





 „–“ ნიშნავს, რომ პოტენციალი მცირდება მანძილის მატებასთან ერთად. =>
„–“ ნიშნავს, რომ პოტენციალი მცირდება მანძილის მატებასთან ერთად. =>
=>

 ,
,
 - პოტენციალი ექსპონენტურად მცირდება.
- პოტენციალი ექსპონენტურად მცირდება.
ზედაპირული მუხტის სიმკვრივის პოტენციალი: 
ზედაპირული მუხტი არის მოცულობითი მუხტი საპირისპირო ნიშნით, ინტეგრირებული მანძილზე.




=>


სადაც პოტენციალი მცირდება 2,7-ჯერ - 
ორმაგი ფენის ტევადობა 
თეორიის მინუსი არის ის, რომ არ არის გათვალისწინებული ჰელემჰოლცის ფენის არსებობა, ე.ი. არ ითვალისწინებს  , აქედან გამომდინარე, შეცდომები ძირითადი პარამეტრების განსაზღვრისას. ის ასევე არ ხსნის სხვადასხვა ხასიათის იონების გავლენას ელექტრული ორმაგი ფენის სისქეზე.
, აქედან გამომდინარე, შეცდომები ძირითადი პარამეტრების განსაზღვრისას. ის ასევე არ ხსნის სხვადასხვა ხასიათის იონების გავლენას ელექტრული ორმაგი ფენის სისქეზე.
შტერნის თეორია. კოლოიდური მიკელის სტრუქტურა.
ელექტრული ორმაგი ფენა შედგება ორი ნაწილისაგან: მკვრივი და დიფუზური. მკვრივი ფენა წარმოიქმნება პოტენციალის წარმომქმნელი იონების სპეციალურად ადსორბირებულებთან ურთიერთქმედების შედეგად. ეს იონები, როგორც წესი, ნაწილობრივ ან მთლიანად დეჰიდრატირებულია და შეიძლება ჰქონდეთ იგივე ან საპირისპირო მუხტი პოტენციალის განმსაზღვრელი იონების მიმართ. ეს დამოკიდებულია ელექტროსტატიკური ურთიერთქმედების ენერგიის თანაფარდობაზე  და სპეციფიკური ადსორბციის პოტენციალი
და სპეციფიკური ადსორბციის პოტენციალი  . მკვრივი ფენის იონები ფიქსირდება. იონების მეორე ნაწილი განლაგებულია დიფუზურ შრეში, ეს იონები თავისუფალია და შეუძლიათ ღრმად გადაადგილება ხსნარში, ე.ი. უფრო მაღალი კონცენტრაციის ზონიდან უფრო დაბალი კონცენტრაციის ზონამდე. დატენვის მთლიანი სიმკვრივე შედგება ორი ნაწილისგან.
. მკვრივი ფენის იონები ფიქსირდება. იონების მეორე ნაწილი განლაგებულია დიფუზურ შრეში, ეს იონები თავისუფალია და შეუძლიათ ღრმად გადაადგილება ხსნარში, ე.ი. უფრო მაღალი კონცენტრაციის ზონიდან უფრო დაბალი კონცენტრაციის ზონამდე. დატენვის მთლიანი სიმკვრივე შედგება ორი ნაწილისგან.

 -ჰელმჰოლცის ფენის მუხტი
-ჰელმჰოლცის ფენის მუხტი
 - დიფუზური ფენის დამუხტვა
- დიფუზური ფენის დამუხტვა
ზედაპირს აქვს ადსორბციული ცენტრების გარკვეული რაოდენობა, რომელთაგან თითოეული ურთიერთქმედებს ერთ კონტრაიონთან. ასეთი კვაზიქიმიური რეაქციის მუდმივი ტოლია:

 , სად
, სად  - კონტრიონების მოლური ფრაქცია ხსნარში
- კონტრიონების მოლური ფრაქცია ხსნარში
ჰელმჰოლცის განაწილება
პოტენციალი წრფივად მცირდება
გუის პოტენციალის განაწილება. არ არის მკვრივი ფენა, პოტენციალი მნიშვნელობიდან ექსპონენციალურად მცირდება 
Stern განაწილება.
თავდაპირველად, პოტენციალის შემცირება არის წრფივი და შემდეგ ექსპონენციალური.
როდესაც ელექტროფორეზის შემთხვევაში გამოიყენება ელექტრული ველი, პირდაპირ მოძრაობს არა მყარი ფაზის ნაწილაკი, არამედ მყარი ფაზის ნაწილაკი მის გარშემო მდებარე იონების ფენით. DES იმეორებს გაფანტული ფაზის ნაწილაკების ფორმას. პოტენციალის გამოყენებისას დიფუზური ფენის ნაწილი იშლება. შესვენების ხაზი ეწოდება მოცურების საზღვარი.
პოტენციალი, რომელიც წარმოიქმნება სრიალის საზღვარზე დიფუზური ფენის ნაწილის გამოყოფის შედეგად, ე.წ. ელექტროკინეტიკური პოტენციალი(ზეტა პოტენციალი  ).
).
დისპერსიული ფაზის ნაწილაკს კონტრიონების მიმდებარე ფენით და ორმაგი ელექტრული ფენით ეწოდება მიცელი.
კოლოიდური მიცელების დაწერის წესები:


1-1 დამტენი ელექტროლიტი
T - დისპერსიული ფაზის ნაწილაკი.
AA არის საზღვარი მკვრივ და დიფუზურ ნაწილებს შორის.
BB - მოცურების საზღვარი.
მოცურების საზღვარი შეიძლება ემთხვეოდეს ან არ ემთხვეოდეს AA ხაზს.
pH მნიშვნელობა, რომლის დროსაც ზეტა პოტენციალი ნულის ტოლია, ეწოდება იზოელექტრული წერტილი.
CaCl 2 + Na 2 SO 4 → CaSO 4 ↓ + 2 NaCl
1. ჭარბი CaCl 2
CaCl 2 ↔ Ca 2+ + 2Cl -
(CaSO 4 m∙nCa 2+ 2( n - x)Cl - ) 2 x + x Cl - - მიცელის აღნიშვნა.
CaSO 4 მ – აგრეგატი.
CaSO 4 m∙nCa 2+ – ბირთვი.
CaSO 4 m∙nCa 2+ 2( n - x)Cl - - ნაწილაკი.
2. ჭარბი Na 2 SO 4
Na 2 SO 4 ↔2Na + + SO 4 2-
(CaSO 4 m∙nSO 4 2- 2(n-x)Na + ) 2x- 2xNa + - მიცელი
CaSO 4 მ – აგრეგატი.
CaSO 4 m∙nSO 4 2 + – ბირთვი.
CaSO 4 m∙nSO 4 2- 2(n-x)Na + - ნაწილაკი
გელემჰოლც-სმოლუჩოვსკის განტოლება

 - საზღვრის გადაადგილების წრფივი სიჩქარე (ელექტროოსმოზში).
- საზღვრის გადაადგილების წრფივი სიჩქარე (ელექტროოსმოზში).
 - პოტენციური განსხვავება კონდენსატორის ფირფიტებს შორის (ელექტროოსმოზში).
- პოტენციური განსხვავება კონდენსატორის ფირფიტებს შორის (ელექტროოსმოზში).


 - ხსნარის მოცულობითი ნაკადის სიჩქარე, ს- უჯრედის განივი ფართობი.
- ხსნარის მოცულობითი ნაკადის სიჩქარე, ს- უჯრედის განივი ფართობი.

ე- ელექტრული ველის სიძლიერე.


 (ელექტროოსმოზისთვის).
(ელექტროოსმოზისთვის).
ნაკადის პოტენციალისათვის:

 - პოტენციალი
- პოტენციალი
 - ზეწოლა მემბრანაზე
- ზეწოლა მემბრანაზე
როგორც წესი, ელექტროფორეზული და ელექტროოსმოსური მობილურობების მნიშვნელობები ნაკლებია, ვიდრე გამოთვლილი. ეს ხდება იმის გამო, რომ:
რელაქსაციის ეფექტი (როდესაც დისპერსიული ფაზის ნაწილაკი მოძრაობს, ირღვევა იონური ატმოსფეროს სიმეტრია).
ელექტროფორეზული დათრგუნვა (დამატებითი ხახუნის წარმოქმნა კონტრიონების მოძრაობის შედეგად).
დენის ხაზების დამახინჯება ელექტროგამტარ ნაწილაკების შემთხვევაში.
ზედაპირულ დაძაბულობასა და პოტენციალს შორის კავშირი. ლიპმანის განტოლება.
EDL-ის წარმოქმნა ხდება სპონტანურად, სისტემის სურვილის გამო, შეამციროს მისი ზედაპირის ენერგია. მუდმივ პირობებში თდა გვთერმოდინამიკის პირველი და მეორე კანონების განზოგადებული განტოლება ასე გამოიყურება:
 (2)
(2)
(3), (1)=(3) =>
=>

 - 1 ლიპმანის განტოლება.
- 1 ლიპმანის განტოლება.
 - ზედაპირული მუხტის სიმკვრივე.
- ზედაპირული მუხტის სიმკვრივე.
 - დიფერენციალური ტევადობა.
- დიფერენციალური ტევადობა.
 - ლიპმანის მე-2 განტოლება.
- ლიპმანის მე-2 განტოლება.
თან- ტევადობა.
მოდით ამოხსნათ ლიპმანის პირველი განტოლება და ფუნდამენტური ადსორბციის განტოლება:
 ,
,


 , მაშინ
, მაშინ
 - ნერნსტის განტოლება
- ნერნსტის განტოლება
 ,
,
 ,
,




 - ელექტროკაპილარული მრუდის განტოლება (ECC).
- ელექტროკაპილარული მრუდის განტოლება (ECC).
IN  :
: , მაგრამ
, მაგრამ 
კათიონური ზედაპირულად აქტიური ნივთიერებები (CPAS) ამცირებენ EKC-ის კათოდური განშტოებას.
ანიონური სურფაქტანტები (APS) ამცირებენ EKC-ის ანოდურ ტოტს.
არაიონური სურფაქტანტები (NSAS) ამცირებენ ECC-ის შუა ნაწილს.
დისპერსიული სისტემების სტაბილურობა. განცალკევებული წნევა.
დისპერსიული სისტემები შეიძლება დაიყოს:
სისტემები, რომლებიც თერმოდინამიკურად არასტაბილურია, შეიძლება იყოს კინეტიკურად სტაბილური მეტასტაბილურ მდგომარეობაში გადასვლის გამო.
სტაბილურობის ორი ტიპი არსებობს:
ნალექის სტაბილურობა (მიზიდულობის მიმართ).
აგრეგატიული სტაბილურობა. (ადჰეზიასთან შედარებით)
კოაგულაციაარის ნაწილაკების ადჰეზიის პროცესი, რაც იწვევს აგრეგაციის სტაბილურობის დაკარგვას. კოაგულაცია შეიძლება გამოწვეული იყოს ტემპერატურის ცვლილებებით, pH-ით, მორევით და ულტრაბგერით.
კოაგულაცია გამოირჩევა:
შექცევადი.
შეუქცევადი.
კოაგულაცია ხდება ელექტროლიტების შეყვანით.
კოაგულაციის წესები:

ფილმი- ეს არის სისტემის ნაწილი, რომელიც მდებარეობს ორ ინტერფეისულ ზედაპირს შორის.
განცალკევებული წნევახდება მაშინ, როდესაც ფირის სისქე მკვეთრად მცირდება ზედაპირული ფენების მიახლოების ურთიერთქმედების შედეგად.

"-" - როგორც ფილმის სისქე მცირდება, დაშლილი წნევა იზრდება.
P 0 არის წნევა ნაყარის ფაზაში, რომელიც წარმოადგენს შუალედური ფენის გაგრძელებას.
P 1 - წნევა ფილმში.
სტაბილურობის თეორია. DLFO (დერიაგინი, ლანდაუ, ფეირვეი, ოვერბეკი).
DLFO თეორიის მიხედვით, დაშლილ წნევას აქვს ორი კომპონენტი:
ელექტროსტატიკური P E (დადებითი, ეს გამოწვეულია ელექტროსტატიკური მოგერიების ძალებით). შეესაბამება გიბის ენერგიის შემცირებას ფირის სისქის გაზრდით.
მოლეკულური P M (უარყოფითი, მიზიდულობის ძალების მოქმედების გამო). ეს გამოწვეულია ფირის შეკუმშვით ქიმიური ზედაპირის ძალების გამო, ძალების მოქმედების რადიუსი არის ნმ მეათედი ენერგიით დაახლოებით 400 კჯ/მოლი.
მთლიანი ურთიერთქმედების ენერგია:

 - სისტემა აგრეგატულად სტაბილურია
- სისტემა აგრეგატულად სტაბილურია
 - არასტაბილური სისტემა
- არასტაბილური სისტემა
პ  დადებითი კომპონენტი.
დადებითი კომპონენტი.
ზრდა გამოწვეულია პოტენციური ენერგიის ზრდით, როდესაც თხელი ფენები შეკუმშულია. დიდი სისქის ფილმებისთვის ჭარბი იონის ენერგია კომპენსირდება და უდრის ენერგიის ურთიერთქმედებას დისპერსიული საშუალების მოცულობაში.
თუ  (
( - ფირის სისქე,
- ფირის სისქე,  - იონის რადიუსი) ფირის გათხელება იწვევს მოლეკულების და იონების გაქრობას და შემცირებას მასში მინიმალური ზედაპირული ენერგიის მქონე. მეზობელი ნაწილაკების რაოდენობა მცირდება, რის შედეგადაც იზრდება ფილმში დარჩენილი ნაწილაკების პოტენციური ენერგია.
- იონის რადიუსი) ფირის გათხელება იწვევს მოლეკულების და იონების გაქრობას და შემცირებას მასში მინიმალური ზედაპირული ენერგიის მქონე. მეზობელი ნაწილაკების რაოდენობა მცირდება, რის შედეგადაც იზრდება ფილმში დარჩენილი ნაწილაკების პოტენციური ენერგია.


DLVO თეორია განიხილავს ნაწილაკების ურთიერთქმედებას, როგორც ფირფიტების ურთიერთქმედებას.

ნაწილაკები არ ურთიერთქმედებენ



 - ლაპლასის განტოლება,
- ლაპლასის განტოლება,  ,
,


სუსტად დამუხტული ზედაპირებისთვის
მაღალ დამუხტულ ზედაპირებზე:

მოლეკულური კომპონენტი არის ორი ატომის ურთიერთქმედება:
 ~
~
ატომის ურთიერთქმედება ზედაპირთან:

ავიღოთ ორი ჩანაწერი:
დ  მოლეკულური კომპონენტის მისაღებად აუცილებელია მარჯვენა და მარცხენა ფირფიტის ატომების ურთიერთქმედების ყველა ენერგიის შეჯამება.
მოლეკულური კომპონენტის მისაღებად აუცილებელია მარჯვენა და მარცხენა ფირფიტის ატომების ურთიერთქმედების ყველა ენერგიის შეჯამება.
სად  - ჰამაკერის მუდმივი (მხედველობაში იღებს ურთიერთმოქმედი სხეულების ბუნებას).
- ჰამაკერის მუდმივი (მხედველობაში იღებს ურთიერთმოქმედი სხეულების ბუნებას).
რომ. სისტემაში ნაწილაკების ურთიერთქმედების ენერგია შეიძლება გამოიხატოს პოტენციური მრუდების გამოყენებით.
I – პირველადი პოტენციური მინიმუმი. ეს არის შეუქცევადი კოაგულაციის ზონა, ჭარბობს მიზიდულობის ძალები.
II – აგრეგატიული მდგრადობის ზონა, ჭარბობს მოგერიების ძალები.
III – მეორადი პოტენციალის მინიმალური (ან ფლოკულაციის ზონა). დისპერსიული ფაზის ნაწილაკებს შორის არის ელექტროლიტური ფენა და შესაძლებელია ნაწილაკების გამოყოფა და გადატანა აგრეგაციის სტაბილურობის ზონაში.

მრუდი 1 - სისტემა აგრეგატულად სტაბილურია.
მრუდი 2 – სტაბილურია I ზონაში, არასტაბილური II ზონაში.
მრუდი 3 - სისტემაში მოხდა კოაგულაცია.
მრუდი 4 – მე-4 წერტილში ჯამური ურთიერთქმედების ენერგია U=0,  , ეს ექსტრემალური წერტილი შეესაბამება სწრაფი კოაგულაციის დასაწყისს.
, ეს ექსტრემალური წერტილი შეესაბამება სწრაფი კოაგულაციის დასაწყისს.
არის ორი შემთხვევა:
1. ოდნავ დამუხტული ზედაპირები:
U = U E + U M = 0
 (1)
(1)
2)

 (2)
(2)



 - ეს არის ფენის სისქე, რომელიც შეესაბამება კოაგულაციის პროცესის დაწყებას.
- ეს არის ფენის სისქე, რომელიც შეესაბამება კოაგულაციის პროცესის დაწყებას.






 - სუსტად დამუხტული ზედაპირებისთვის
- სუსტად დამუხტული ზედაპირებისთვის
 მერე
მერე 
2. ძალიან დამუხტული ზედაპირებისთვის:
 (1)
(1)
2)

 (2)
(2)


 (3)
(3)
 ,
,
მოდით კვადრატში (3)

კოაგულაცია:
სპეციფიკური ადსორბციის დროს, იონები შეიძლება შეიწოვება სუპერ-ექვივალენტური რაოდენობით ისე, რომ ზედაპირს შეუძლია შეცვალოს მისი მუხტი. ზედაპირი დამუხტულია.
სპეციფიური ადსორბციის შემთხვევაში შეიძლება ადსორბირებული იყოს არა მხოლოდ საპირისპირო ნიშნის იონები, არამედ იგივე ნიშნის.
თუ ზედაპირის იგივე ნიშნის იონები შეიწოვება, მაშინ ზედაპირულ ფენაში იქნება არა პოტენციალის ვარდნა, არამედ მისი ზრდა.

ნეიტრალიზაციის კოაგულაცია (წარმოიქმნება სუსტად დამუხტული ნაწილაკების მონაწილეობით და დამოკიდებულია არა მხოლოდ ელექტროლიტ-კოაგულატორის მუხტზე, არამედ მკვრივი და დიფუზური ფენების საზღვარზე არსებულ პოტენციალზე).
სმოლუჩოვსკის სწრაფი კოაგულაციის თეორია.

კოაგულაციის სიჩქარის დამოკიდებულება ელექტროლიტების კონცენტრაციაზე.
I - კოაგულაციის მაჩვენებელი დაბალია,
II - კოაგულაციის სიჩქარე თითქმის პროპორციულია ელექტროლიტების კონცენტრაციისა.
III – სწრაფი კოაგულაციის რეგიონი, სიჩქარე პრაქტიკულად დამოუკიდებელია კონცენტრაციისგან.
ძირითადი დებულებები:
საწყისი სოლი არის მონოდისპერსიული, მსგავს ნაწილაკებს აქვთ სფერული ფორმა.
ნაწილაკების ყველა შეჯახება ეფექტურია.
ორი პირველადი ნაწილაკის შეჯახებისას წარმოიქმნება მეორადი ნაწილაკი. მეორადი + პირველადი = მესამეული. პირველადი, მეორადი, მესამეული - სიმრავლე.
ქიმიური კინეტიკის თვალსაზრისით, კოაგულაციის პროცესი შეიძლება აღწერილი იყოს განტოლებით:
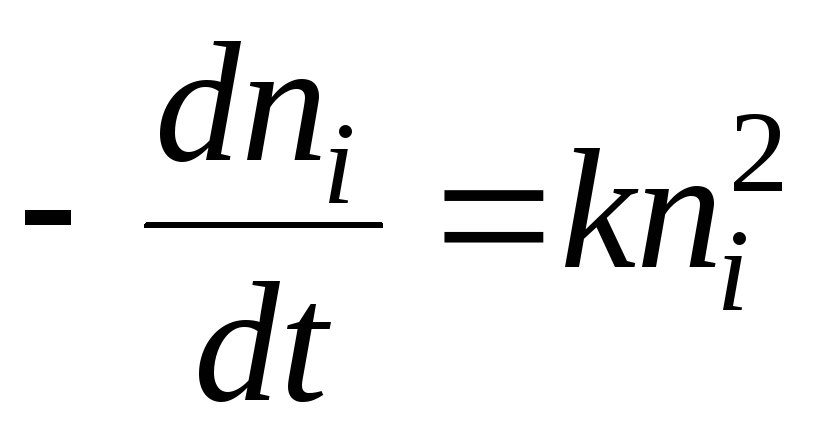
გამოსავალი იქნება განტოლება: 
 - ნახევარი კოაგულაციის დრო. ეს ის დროა, რომლის დროსაც სოლის ნაწილაკების რაოდენობა 2-ჯერ მცირდება.
- ნახევარი კოაგულაციის დრო. ეს ის დროა, რომლის დროსაც სოლის ნაწილაკების რაოდენობა 2-ჯერ მცირდება.

 ,
,
 ,
,
 ,
,


სიმრავლის მატებასთან ერთად, კოაგულაციის მრუდების მაქსიმუმი გადადის უფრო დიდ მნიშვნელობებზე  .
.
ხარვეზები:
მონოდისპერსიულობის დაშვება.
ვარაუდი ყველა შეჯახების ეფექტურობის შესახებ.




 - სფერო,
- სფერო, ,
,





